Антибактериальная терапия респираторных инфекций
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.

Читайте в новом номере
В настоящее время мировая общественность озабочена повсеместным ростом резистентности клинически значимой патогенной микрофлоры и отсутствием революционных открытий в сфере создания новых групп антибактериальных средств. Рост антибиотикорезистентности происходит на фоне дефицита новых системных антибактериальных препаратов. В последние десятилетия разработка антибиотиков существенно замедлилась, многие фармацевтические компании прекратили работу в этой области по причине сложности проведения клинических исследований и ограниченной экономической привлекательности разработки новых антибиотиков.
Несмотря на то, что и в мире, и в России наблюдается рост устойчивости респираторных патогенов к антибиотикам многих фармакологических групп, амоксициллин/клавуланат по-прежнему сохраняет высокую антибактериальную активность в отношении всех основных возбудителей респираторных инфекций. Амоксициллин/клавуланат рекомендован для лечения инфекций нижних дыхательных путей у взрослых и детей, включен в национальные клинические рекомендации по лечению внебольничной пневмонии и хронической обструктивной болезни легких: для приема внутрь на амбулаторном этапе лечения, для парентерального введения в условиях стационара. Одним из факторов успешного применения амоксициллина/клавуланата является наличие различных лекарственных форм для энтерального и парентерального введения, в т. ч. растворимых форм, которые улучшают фармакокинетику и повышают безопасность препарата.
Ключевые слова: респираторные инфекции, лечение, эффективность, безопасность, амоксициллин/клавуланат,
Амоксиклав.
Для цитирования: Визель А.А., Визель И.Ю. Антибактериальная терапия респираторных инфекций сегодня: остались ли надежды?. РМЖ. Медицинское обозрение. 2019;9(I):29-33.
Modern antibacterial therapy of respiratory infections: is there any hope?
A.A. Vizel, I.Yu. Vizel
Kazan State Medical University
Nowadays, the world community is concerned about the widespread increase in the resistance of clinically significant pathogenic microflora and the lack of revolutionary discoveries in creating new groups of antibacterial agents. The increase in antibiotic resistance occurs in the setting of new systemic antibacterial drugs deficiency. In recent decades, antibiotics development has slowed significantly С many pharmaceutical companies have stopped working in this area due to the clinical trials complexity and limited economic attractiveness of developing new antibiotics. Despite the fact that there is an increase in respiratory pathogens resistance to antibiotics of many pharmacological groups (both in the world and in Russia), amoxicillin/clavulanate still retains high antibacterial activity against all the respiratory infections main pathogens. Amoxicillin/clavulanate is recommended for lower respiratory tract infections treatment in adults and children and included in the national clinical guidelines for the treatment of community-acquired pneumonia and chronic obstructive pulmonary disease: for oral administration С at the outpatient treatment stage, for parenteral administration С in a clinical setting. One of the factors for the successful amoxicillin/clavulanate application is the presence of various dosage forms for enteral and parenteral administration, including soluble forms that improve pharmacokinetics and increase drug safety.
Keywords: respiratory infections, treatment, efficacy, safety, amoxicillin/clavulanate, Amoksiklav.
For citation: Vizel A.A., Vizel I.Yu. Modern antibacterial therapy of respiratory infections: is there any hope? RMJ. Medical Review. 2019;9(I):29-33.
Статья посвящена вопросам антибактериальной терапии респираторных инфекций с учетом проблемы антибиотикорезистентности
Представления человечества и медицинской науки о лечении инфекционной патологии нижних дыхательных путей претерпели разительные изменения за последнее столетие: от фатального ожидания "кризиса" в лечении крупозной пневмонии, преодоление которого обеспечивало обоснованную надежду врачу и пациенту на благополучный исход, от ослепляющего оптимизма и надежд на всесилие антибиотиков, которые могли бы даже упразднить гнойную хирургию, до современного состояния озабоченности повсеместным ростом резистентности клинически значимой патогенной микрофлоры и отсутствием революционных открытий в сфере создания новых групп антибактериальных средств. Рост антибиотикорезистентности происходит на фоне дефицита новых системных антибактериальных препаратов: рынок антибиотиков, несмотря на высокую неудовлетворенную потребность, остается непривлекательным для инвестиций. Можно констатировать, что в последние десятилетия разработка антибиотиков существенно замедлилась, многие фармацевтические компании прекратили работу в этой области по причине сложности проведения клинических исследований и ограниченной экономической привлекательности разработки новых антибиотиков. В связи с этим, по данным на 2013 г., в США была поставлена задача разработать 10 новых, безопасных
и эффективных антибиотиков к 2020 г., этот проект Американского общества инфекционных болезней (Infectious Diseases Society of America С IDSA) был назван "Инициатива 10x20" [1]. Возможно, этот проект изменит ситуацию. Пока же основными задачами становятся сохранение эффективности существующих препаратов и замедление развития резистентности к ним патогенной микрофлоры.
Оценка устойчивости респираторной микрофлоры к антибиотикам не может не вызывать тревоги. В международном исследовании D.J. Biedenbach et al., проведенном в пяти странах (Аргентина, Мексика, Венесуэла, Россия, Филиппины), изучалась чувствительность возбудителей внебольничных инфекций к различным классам антибиотиков по критериям EUCAST (European Committee on Antimicrobial Susceptibility Testing - Европейский комитет по определению чувствительности к антимикробным препаратам) и CLSI (Clinical and Laboratory Standards Institution - Институт клинических и лабораторных стандартов) [2].
Результаты исследования подтвердили устойчивую тенденцию последних лет - повсеместное снижение чувствительности пневмококков к макролидам. Так, в России к кларитромицину и по критериям CLSI, и по критериям EUCAST уровень резистентности выделенных штаммов пневмококка составил 43,2%; к азитромицину по критериям CLSI резистентными были 43,2% штаммов пневмококка; по критериям EUCAST С 43,9% штаммов [2].
В этом же исследовании показано, что сохраняется высокая чувствительность к амоксициллину/клавуланату и пневмококков (в Аргентине С 100%, в России С 83,8%), и гемофильной палочки (в Аргентине С 90%, в Мексике, России, на Филиппинах С 100%) (по критериям CLSI).
Эффективность и безопасность амоксициллина/клавуланата подтверждены результатами многих исследований и многолетним практическим опытом использования препарата в клинической практике.
Амоксициллин/клавуланат активен в отношении основных возбудителей пневмонии и хронической обструктивной болезни легких (ХОБЛ): Streptococcus pneumoniae, Haemophilus influenzae, Staphylococcus aureus, Klebsiella pneumoniae [6].
Амоксициллин/клавуланат обладает высокой биодоступностью (90%) при приеме внутрь, создает высокие концентрации в легких и плевральной жидкости, быстро проникает в мокроту и накапливается в слизистой оболочке бронхов, создавая концентрации, значительно превышающие минимальные подавляющие концентрации чувствительных микроорганизмов, включая продуцирующие β-лактамазу штаммы H. influenzae и Moraxella catarrhalis [7].
Амоксициллин/клавуланат имеет хороший профиль безопасности. Согласно результатам многочисленных клинических исследований амоксициллин/клавуланат отличается хорошей переносимостью, нежелательные явления при применении антибиотика развиваются относительно редко, в большинстве случаев являются дозозависимыми, носят транзиторный характер и не требуют отмены препарата [8].
Широкий спектр антимикробной активности, привлекательная фармакокинетика и приемлемый профиль безопасности позволили амоксициллину/клавуланату стать одним из наиболее популярных антибактериальных препаратов, применяемых в лечении большого числа инфекционных заболеваний.
Так, в Испании наиболее часто применяемыми антибиотиками при ВП были амоксициллин/клавуланат (30,7%) и левофлоксацин (30,4%) [9]. В Кабардино-Балкарии был проведен опрос врачей по предпочтениям в назначении препаратов. Наиболее часто назначаемым антибиотиком при лечении ВП был амоксициллин/клавуланат, основными критериями выбора врачей были эффективность и безопасность [10]. Фармакоэкономический анализ продаж антибиотиков для системного применения на фармацевтическом рынке г. Хабаровска показал, что амоксициллин/клавуланат входит в перечень лидирующих препаратов [11].
К числу основных показаний для назначения антибиотика относятся ВП и инфекционное обострение ХОБЛ.
Амоксициллин/клавуланат занимает одно из ведущих мест в лечении ВП [12, 13].
Отечественные авторы показали клинические и экономические преимущества ступенчатой терапии амоксициллином/клавуланатом при пневмонии [14].
Часто начальная терапия проводится препаратами нескольких классов, и предельно важной становится тактика последующего снижения антибактериальной нагрузки. Испанские исследователи показали, что при ВП деэскалация антибиотиков может быть сужена до пенициллина, амоксициллина или амоксициллина/клавуланата в течение первых 72 ч после поступления. Было показано, что переход на эти антибиотики не оказывал негативного влияния на исходы ВП даже у больных с бактериемией, тяжелым течением пневмонии и при клинической нестабильности [15].
При анализе ведения 1290 больных с ВП в Испании в 2000Р2013 гг. было отмечено, что чаще всего в виде стартовой терапии были назначены амоксициллин/клавуланат (30,7%) и левофлоксацин (30,4%). При оказании первичной помощи частота этих назначений была 38% и 26% соответственно, а при оказании неотложной помощи препараты менялись местами: левофлоксацин С 35%, а амоксициллин/клавуланат С 25% [9].
В Университетской больнице Кокоди в Кот-д’Ивуаре было проведено ретроспективное исследование 62 пациентов с ВП, госпитализированных с 1 декабря 2008 г. по 30 ноября 2010 г. Наиболее часто были назначены амоксициллин/клавуланат (42,27%), нетилмицин (34,5%) и ципрофлоксацин (6%). Врачи назначали амоксициллин/клавуланат с нетилмицином в 80,64% случаев, а монотерапия антибиотиками составляла 14,52% назначений. Авторы отметили, что уровень соответствия локальным клиническим рекомендациям составлял всего 3,6% [16].
Исследование, проведенное во Франции, свидетельствует о значимости применения амоксициллина/клавуланата в отделениях интенсивной терапии, где встречаются носители Enterobacteriaceae, которая вырабатывает бета-лактамазы расширенного спектра. Мультивариантный анализ показал, что колонизация Enterobacter spp. или Klebsiella pneumoniae является независимым фактором развития пневмонии, вызванной возбудителями, вырабатывающими бета-лактамазы расширенного спектра, а применение амоксициллина/клавуланата в течение более 2 дней пребывания в отделении интенсивной терапии оказывало достоверное протективное действие [17].
Амоксициллин/клавуланат является препаратом выбора у амбулаторных больных ВП с сопутствующими заболеваниями (ХОБЛ, сахарный диабет, хроническая сердечная недостаточность, хроническая болезнь почек со снижением скорости клубочковой фильтрации, цирроз печени, алкоголизм, наркомания, истощение), и/или принимавших за последние 3 мес. антибиотики в течение і2 последовательных дней, и/или имеющих иные факторы риска инфицирования редкими и/или полирезистентными возбудителями (табл. 1) [12].

Амоксициллин/клавуланат является препаратом выбора у госпитализированных больных с нетяжелой ВП, без сопутствующих заболеваний и факторов риска инфицирования редкими и/или полирезистентными возбудителями, а также у пациентов, имеющих сопутствующие заболевания и факторы риска инфицирования редкими и/или полирезистентными возбудителями (табл. 2) [12].

Амоксициллин/клавуланат является препаратом выбора при лечении больных тяжелой ВП на стационарном этапе без факторов риска инфицирования P. aeruginosa и аспирации и у пациентов с подтвержденной/предполагаемой аспирацией (табл. 3) [12].

Амоксициллин/клавуланат у госпитализированных пациентов с ВП рекомендовано использовать в соответствии с принципами ступенчатой терапии: вначале внутривенное введение, в дальнейшем по мере клинической стабилизации -перевод пациента на пероральные формы.
Хроническая обструктивная болезнь легких
О влиянии амоксициллина/клавуланата на обострения ХОБЛ свидетельствуют многие публикации. Так, в Германии в плацебо-контролируемом исследовании 353 больных ХОБЛ было показано, что при назначении этого антибиотика время до следующего обострения составляло 233 дня, а в группе плацебо - 160 дней [18].
Однако, в отличие от пневмонии, значимость применения амоксициллина/клавуланата при обострении ХОБЛ не столь однозначна, особенно у амбулаторных больных с промежуточной вероятностью бактериальной инфекции. В Нидерландах у ограниченной группы из 35 пациентов с обострениями ХОБЛ без пневмонии у получавших преднизолон в сочетании с амоксициллином/клавуланатом и в сочетании с плацебо не было достоверных различий во времени от начала лечения обострения до его разрешения [19]. Работа была опубликована 5 лет тому назад. В настоящее время для трактовки таких результатов необходимо было бы разделить больных по уровню эозинофилов в крови, а также более строго доказывать бактериальную природу обострений.
Те же авторы год спустя опубликовали результаты обследования 25 пациентов, госпитализированных по поводу обострения ХОБЛ, у которых на 3-й день лечения определяли активность бета-лактамазы в мокроте и амоксициллина как в мокроте, так и в сыворотке. Они отметили, что у получавших амоксициллин/клавуланат при обострении ХОБЛ активность бета-лактамазы в мокроте не различалась у пациентов с концентрацией амоксициллина в мокроте ниже и выше минимальной ингибирующей концентрации (МИК90). Кроме того, у большинства пациентов концентрация амоксициллина в мокроте была ниже МИК90, на основании чего авторы призывали более тщательно изучать и оптимизировать применение антибиотиков при обострениях ХОБЛ [20]. Там же, в Нидерландах, проблему недостаточной концентрации амоксициллина/клавуланата в мокроте у больных ХОБЛ предложили решить посредством небулизации этого препарата в дозе от 50:10 до 300:60 мг амоксициллина/клавулановой кислоты, а безопасность оценивали по спирометрии до и после вдыхания. 17 пациентов прошли в общей сложности 100 ингаляций амоксициллина/клавуланата. Клинически значимых уменьшений объема форсированного выдоха за 1 с (ОФВ1) отмечено не было. Концентрация этого антибиотика в мокроте значительно превысила МИК90, что позволило авторам сделать заключение о перспективности его небулизации как у стабильных пациентов с ХОБЛ, так и у пациентов с тяжелым обострением [21].
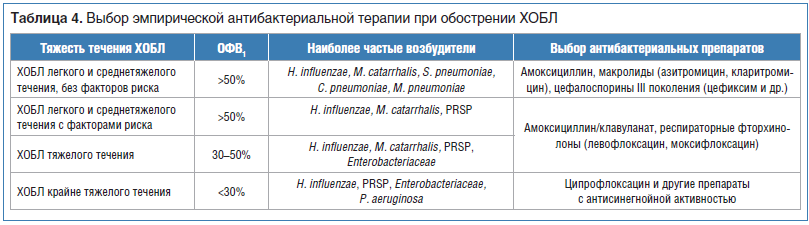
Клинические рекомендации, разработанные экспертами РРО, содержат алгоритм эмпирической антибактериальной терапии инфекционного обострения ХОБЛ с учетом известных факторов риска неблагоприятного исхода и наиболее вероятными возбудителями [22].
В соответствии с национальными клиническими рекомендациями амоксициллин/клавуланат является препаратом выбора при лечении инфекционного обострения у всех пациентов с тяжелым течением ХОБЛ и у пациентов с факторами риска неблагоприятного исхода при легком и среднетяжелом течении ХОБЛ (табл. 4) [22].
Заключение
Амоксициллин/клавуланат (Амоксиклав ® ) С комбинированный бета-лактамный антибиотик, который в условиях роста антибиотикорезистентности сохраняет свою клиническую значимость благодаря доказанной in vitro
и in vivo антибактериальной активности в отношении основных респираторных патогенов, наличию удобных лекарственных форм для амбулаторного и стационарного лечения и хорошей переносимости препарата. .
Только для зарегистрированных пользователей
Н.Д.Сорока 1 , С.П.Гомозова 2 , Е.В.Коршунова 1 , Е.К.Волочугина 1 , Т.Г.Власова 3 , Л.В.Островская 1
В статье представлены данные и обсуждены основные причины заболеваемости детей острыми респираторными вирусными инфекциями в Санкт-Петербурге; приведены результаты применения топического аэрозольного антибиотика фузафунгина (Биопарокс) у 28 детей в возрасте от 3 до 17 лет, страдавших острыми респираторными заболеваниями. Обладающий выраженным противовоспалительным действием и не имеющий побочных эффектов, Биопарокс может быть альтернативой применению системных антибиотиков у часто болеющих детей как при острых респираторных заболеваниях, так и в профилактике активации бактериальной инфекции дыхательных путей.
Ключевые слова: респираторная инфекция, дети, местная антибактериальная терапия, фузафунгин
N.D.Soroka 1 , S.P.Gomozova 2 , E.V.Korshunova 1 , E.K.Volochugina 1 , T.G.Vlasova 3 , L.V.Ostrovskaya 1
The article presents data and discusses main causes of the incidence of acute respiratory viral infections among the pediatric population in St.Petersburg; it describes the results of using the topic antibiotic fusafungin (Bioparox spray) in 28 children aged from 3 to 17 years, who suffered from acute respiratory diseases. Having a strong anti-inflammatory effect and no side effects, Bioparox might be an alternative to using systemic antibiotics in frequently ill children to treat acute respiratory diseases and prevent activation of bacterial infection of the respiratory tract.
Key words: respiratory infection, children, local antibacterial therapy, fusafungin
Острые респираторные заболевания (группа этиологически неоднородных болезней, объединенных общими эпидемиологическими и клиническими характеристиками) ежегодно регистрируются более, чем у 20 млн. детей (по данным Министерства здравоохранения и социального развития Российской Федерации) [1, 2]. Подавляющее большинство респираторных заболеваний имеет вирусную природу. Именно острые респираторные вирусные инфекции (ОРВИ) занимают лидирующее положение в структуре детской заболеваемости, составляя 90% всех болезней респираторного тракта инфекционной природы [1, 2]. Несмотря на широкое внедрение в лечебную практику большого числа профилактических средств и противовирусных препаратов (воздействующих на ключевые звенья патогенеза воспалительного процесса), ОРВИ остаются малоуправляемыми инфекциями. По данным Всемирной организации здравоохранения, каждый ребенок в течение года переносит несколько эпизодов респираторных инфекций, большинство из которых протекают легко и статистикой не фиксируются [1, 3].
Анализ учтенной заболеваемости детей ОРВИ и гриппом в Санкт-Петербурге за последние 10 лет представлен на рис. 1. Как видно из диаграммы, в течение только 2003 г. в Санкт-Петербурге ОРВИ переболели 605 378 детей, или 75% всего детского населения города. К причинам столь стабильно высокой заболеваемости ОРВИ у детей можно отнести: чрезвычайно большое количество (более 200 видов) возбудителей; высокую изменчивость антигенной специфичности вирусов (особенно вирусов гриппа) и тропность вирусов к слизистой оболочке дыхательных путей; отсутствие эндемичности вирусной инфекции; нестойкость противовирусного иммунитета; анатомо-физиологические особенности строения дыхательных путей и адаптивно-защитных механизмов детского организма; высокий уровень промышленных и транспортных загрязнений внешней среды (особенно в крупных городах).

Рис. 1. Заболеваемость детей ОРВИ и гриппом в Санкт-Петербурге (1992-2003 гг.).
ОРВИ в педиатрии тесно связаны с большим количеством проблем. ОРВИ являются причиной значительного экономического ущерба: если прямые расходы (непосредственно на лечение) составляют 25%, то косвенные (связанные с временной нетрудоспособностью или снижением продуктивности труда родителей) превышают 70%. Расчеты, проведенные И.Л.Шахининой в 1998 г., показали, что экономические потери от ОРВИ за 1998 г. в Москве составили 1,5 млрд. руб., а в 1997 г. по Российской Федерации (ОРВИ-Грипп) -16,6 млрд. руб. [4].
Неоспорима синергическая и кондуктивная роль ОРВИ в формировании воспалительных процессов, вызванных бактериальной флорой (бронхитов, пневмоний и др.) как в амбулаторных условиях, так и в стационаре (внутрибольничные ОРВИ значительно повышают опасность заражения госпитальными штаммами резистентных к антибиотикам микроорганизмов) [3, 5].
Основные патогенетические механизмы ОРВИ можно представить следующей схемой (рис. 2). В ней выделены три узловых звена, которые необходимо учитывать при построении программы лечения ОРВИ (сочетание этиотропного, патогенетического и симптоматического лечения).
Этиотропное лечение (противовирусное или антибактериальное - при наличии признаков активности бактериальной инфекции) широкого распространения у детей не получило [6, 7]. Это связано с малым количеством разрешенных в педиатрической практике препаратов, обладающих специфической противовирусной активностью; значительное их число, кроме возрастных ограничений, имеет и серьезные побочные эффекты. Необходимо также учитывать, что основным условием эффективности противовирусных средств является раннее их назначение (с первых симптомов заболевания), что не всегда возможно. Определенную роль играет и высокая стоимость большинства противовирусных средств. Многочисленными исследованиями доказана неэффективность антибиотикотерапии при ОРВИ, протекающих с симптомами поражения как верхних (ринит, фарингит, ларингит, синусит), так и нижних дыхательных путей (трахеит, бронхит). Необоснованное назначение антибактериальной терапии, особенно у детей раннего возраста, способствует формированию бактериальной резистентности, рецидивирующему течению респираторных инфекций; удлинению сроков выздоровления и формированию лекарственной аллергии у предрасположенных детей. Таким образом, педиатр должен взвешивать необходимость и целесообразность назначения системных антибиотиков при острых неосложненных инфекциях верхних дыхательных путей.
В случае такого выбора в ряде случаев альтернативой может служить местная антибактериальная терапия, позволяющая подавить активность бактериальной инфекции и препятствовать ее распространению на дистальные отделы бронхолегочной системы, что особенно важно при лечении инфекции носоглотки у часто и длительно болеющих детей [1, 3, 7, 8].
Попытки ингаляции системных антибиотиков не увенчались успехом из-за низкой эффективности и большого числа побочных эффектов (нарушения в составе микрофлоры носоглотки, в том числе активизация грибковой флоры, высокий риск формирования лекарственной аллергии, местное раздражающее действие и др.) [5].
В этой связи нам представляется, что наиболее рациональным препаратом для проведения местной антибиотикотерапии в настоящее время можно считать Биопарокс (Фузафунгин) - топический аэрозольный антибиотик, обладающий бактериостатическим и противовоспалительным эффектами. Его действующим началом является фузафунгин, полученный из гриба-микомицета Fusarium lateritium WR 437. Подавляя процесс размножения и препятствуя адгезии микробов к слизистой оболочке дыхательных путей, Биопарокс одномоментно оказывает и антимикотическое действие (особенно в отношении Candida albicans), что уменьшает риск развития вторичного кандидоза (см. таблицу). Биопарокс действует на микробную флору в течение 12 ч; оптимальный эффект наблюдается в течение 4 ч после введения препарата [7, 9].
Таблица. Антимикробный спектр действия Биопарокса
| Грамположительные бактерии | Грамотрицательные бактерии | Прочие |
| Staphylococcus aureus Streptococcus A,C,G Streptococcus mutants Streptococcus pneumoniae | Грамотрицательные кокки: Moraxella catarrhalis Грамотрицательные бациллы: Listeria monocytogenes Actinomyces pyogenes Nocardia asteroides Nocardia brasiliensis Pasteurella multocida Haemophilus influenzae | Mycoplasma pneumoniae Анаэробы: Clostridium perfringens Clostridium butyricum Propionibacterium acnes Грибы: Candida albicans |
Противовоспалительные свойства Биопарокса обусловлены подавлением выработки провоспалительных цитокинов (интерлейкинов-1, -6, ФНО, супероксидов), стимуляцией образования интерлейкина-2 и естественных клеток-киллеров, повышением концентрации иммуноглобулинов A и лизоцима в секрете носоглотки; активацией макрофагов и фагоцитарной активности нейтрофилов; повышением неспецифической резистентности слизистой оболочки верхних дыхательных путей и пр. 8.
Препарат выпускается в форме дозированного аэрозоля, содержащего 20 мл (400 доз по 0,125 мг) активного раствора и снабжен двумя насадками (назальной и оральной). Ингаляции детям проводятся (начиная с 2,5-летнего возраста) 4 раза/сут, по 4 дозы через рот и/или по 4 дозы в каждый носовой ход. При необходимости Биопарокс может комбинироваться с системными антибиотиками и другими противовоспалительными средствами. Средняя продолжительность курса лечения составляет 7-10 дней.
Цель настоящего открытого исследования: оценка воздействия Биопарокса на отдельные симптомы ОРВИ и определение возможностей препарата в профилактике вторичных бактериальных осложнений.
Пациенты и методы. Под наблюдением находилось 28 детей в возрасте от 3 до 17 лет с клиническими проявлениями острой респираторной инфекции: в амбулаторных условиях (20 детей) и в условиях специализированного пульмонологического отделения (8 пациентов). 22 ребенка посещали школу и относились к группе часто и длительно болеющих; 8 человек имели неблагоприятный преморбидный фон (атопические заболевания нижних дыхательных путей и хронические заболевания ЛОР-органов). Все пациенты получали комплексное лечение острого респираторного заболевания по единому протоколу; в исследование не были включены дети, которым было показано назначение системных антибиотиков или до начала исследования уже проводилась антибиотикотерапия (местная или системная).
Основные симптомы заболевания у наблюдавшихся больных представлены на рис. 3.

Рис. 3. Основные клинические симптомы ОРЗ.
Острый ларингит или ларинготрахеит был диагностирован у 4 пациентов, острый ринит и ринофаренгит - у 18 детей, острый трахеобронхит и бронхит - у 6 больных. Проявления интоксикации (нарушения самочувствия, недомогание, головная боль, умеренная лихорадка) отмечены у 11 детей.
У 19 детей до начала лечения отмечались умеренно выраженный лейкоцитоз и повышенная СОЭ.
Биопарокс был включен в комплексную терапию ОРЗ в 1-2-й или на 5-10-й дни заболевания в связи с отсутствием эффекта от традиционного лечения. Основным показанием к применению Биопарокса была необходимость профилактики бактериальной инфекции (хроническая носоглоточная инфекция) или признаки ее активности (интоксикация, гнойная мокрота или слизисто-гнойные выделения из носа) а также неэффективность предшествующей симптоматической терапии. Препарат применялся 4 раза в день по 4 ингаляции через рот и в каждый носовой ход; курс лечения в среднем составил 7 дней. Дети, лечившиеся амбулаторно, осматривались педиатром до начала лечения, на 7-й и 10-14-й дни от начала приема Биопарокса; а при необходимости - и в более отдаленные сроки (до полного выздоровления). Результаты лечения оценивались на основании: дневников ежедневного самоконтроля, где учитывались признаки обратного развития симптомов заболевания (улучшения самочувствия, исчезновение интоксикации и др.); данных физикального обследования (исчезновение хрипов, жесткого дыхания); динамики лабораторных показателей.
Симптомы ринита у подавляющего большинства детей значительно уменьшились к 5-му дню лечения и полностью исчезли у 22 детей через 8 дней приема препарата (рис. 4): чихание и зуд в носу исчезли через 6 дней, а выделения из носа - через 7-8 дней применения Биопарокса. У 5 пациентов (со склонностью к атопии и хроническим аденоидитом) длительно (свыше 10 дней) сохранялись заложенность носа и необильные слизистые выделения; однако и у них на фоне лечения препаратом отмечалась существенная положительная динамика (исчезновение гиперемии и уменьшение отека слизистой оболочки при риноскопии).

Рис. 4. Динамика обратного развития клинических проявлений ринита у детей на фоне лечения Биопароксом.
Симптомы острого ларингита и ларинготрахеита у большинства наблюдаемых детей полностью исчезали к 9-му дню лечения; охриплость голоса, боль и першение в горле исчезали в основном к 6-му дню лечения (рис. 5). Дольше всего сохранялась гиперемия зева у детей с хроническим тонзиллитом или гипертрофией небных миндалин; в этой группе дети получали Биопарокс до 10 дней.

Рис. 5. Динамика обратного развития клинических проявлений ларингита/ларинготрахеита у детей на фоне лечения Биопароксом.
При остром бронхите или трахеобронхите (рис. 6), затруднение дыхания, неприятные ощущения в грудной клетке к 6-му дню наблюдения определялись лишь у 1 пациента; кашель, жесткое дыхание и хрипы на 5-й день лечения не определялся у 4 детей, а на 10-й день - у 21 ребенка. Длительный (более 13 дней), непродуктивный кашель на фоне жесткого дыхания был зафиксирован у 6 детей с отягощенным преморбидным фоном, что потребовало дополнительного назначения противокашлевых препаратов.

Рис. 6. Динамика обратного развития клинических проявлений бронхита/трахеобронхита у детей на фоне лечения Биопароксом.
Симптомы интоксикации у всех больных через 5 дней лечения полностью были купированы.
Полное клиническое выздоровление к 13-му дню от начала лечения Биопароксом достигнуто у 24 детей; у 4 пациентов (с неблагоприятным преморбидным фоном) сохранялись нечастый сухой кашель, заложенность носа и жесткий характер дыхания, потребовавшие дополнительной симптоматической терапии. Ни у одного ребенка, получавшего Биопарокс, не возникло показаний к проведению антибактериальной терапии. В ходе наблюдений не были зафиксированы ни побочные явления, ни обострения аллергических заболеваний, ни бактериальные осложнения.
Эффективность и переносимость препарата, как врачами, так и пациентами была оценена как отличная (18 человек) или хорошая (5 пациентов).
Нежелательные явления (умеренно выраженная сухость слизистых полости рта после ингаляций и неприятные ощущения во рту в первые дни приема) были отмечены у 2 пациентов, но не потребовали отмены препарата.
Таким образом, топический аэрозольный антибиотик Биопарокс является эффективным препаратом с выраженным противовоспалительным действием и может быть рекомендован в качестве стартового антибактериального препарата в лечении ОРВИ с признаками активизации бактериального процесса. Для получения оптимального терапевтического эффекта рационально назначение препарата в первые дни ОРЗ.
ЛИТЕРАТУРА
1. Коровина Н.А., Овсянникова Е.М. Вопр. современной педиатрии. 2002; 1(1): 1-4.
2. Крослак М. ОРВИ или грипп? Легкое дыхание. Науч.-практ. изд. для врачей. 2005; 16: 2-3.
3. Зайцева О.В., Щербакова М.Ю. Острые респираторные заболевания у детей: современные аспекты лечения и профилактики. М., 2004, с.4.
4. Шахинина И.Л. Грипп и острые респираторные заболевания - приоритетная социально-экономическая проблема здравоохранения. Информ. сб. М., 1998; 10-17.
5. Овчинников Ю.М., Свистушкин В.М., Никифорова Г.Н. Рациональное местное лечение при воспалительных заболеваниях верхних дыхательных путей. Инфекции и антимикробная терапия, 2000; 6 (2): 190-102.
6. Белоусов Ю.М. Антимикробная терапия. РМЖ; 1998; 12(7): 10-13.
7. Балясинская Г.Л. Биопарокс в лечении заболеваний ЛОР-органов у детей. Практ. рекомендации по материалам VIII Конгресса педиатров России. М., 1998: 20.
8. Barth V. et al. Местная антибактериальная терапия заболеваний верхних дыхательных путей. М., 2000: 12-14.
9. .Pandraud L. Therapeutic Efficacy and Clinical Ecceptability of Fusafungine in Follicular Pharyngitis; Cur. Med. Res. and Opinion. 2002; 7(18): 381-388.
Читайте также:


