Устойчивость микобактерий туберкулеза к изониазиду
Лекарственно устойчивые штаммы туберкулёза возникают естественным путём в ходе спонтанного мутагенеза как ответная реакция на введение антибиотиков. Они, как правило, обладают слабым фитнесом, т.е. они медленнее растут, слабее размножаются, у них нет других преимуществ, за исключением устойчивости к антибиотикам. И, соответственно, первоначальная стратегия при столкновении с лекарственно устойчивыми штаммами заключалась в том, чтобы, во-первых, антибиотики, направленные на лечение туберкулёза, были изъяты из широкой сети обращения и использовались только в специализированных учреждениях и, во-вторых, курс лечения проводился особым образом: сначала больного лечили антибиотиками, потом делали перерыв, за это время оставшиеся лекарственно чувствительные штаммы начинали доминировать, соответственно вытесняя лекарственно устойчивые варианты, затем опять проводили химиотерапию, достигали хороших результатов, что снова приводило к появлению лекарственно устойчивых штаммов, снова делали перерыв и так до полного излечения. Но потом оказалось, и обнаружили это, прежде всего в Африке, что такие проблемы как СПИД, который поражает иммунную систему, приводят к значительному росту числа лекарственно устойчивых штаммов. Причём если раньше эти штаммы были в основном в лечебных учреждениях, то теперь они стали обнаруживаться во всей популяции. И наиболее распространённая на сегодняшний день теория, для которой находится всё больше и больше подтверждений, заключается в том, что для того, чтобы лекарственно устойчивые штаммы вырвались в популяцию, они должны пройти несколько циклов размножения в организме со слабой иммунной системой, а именно такими объектами являются, прежде всего, больные СПИДом. Далее обнаружилось, что в странах, где происходят колоссальные социальные пертурбации, где всё рушится, возникает большая прослойка бедных, социально дезориентированных людей, у которых доходы ниже прожиточного реального минимума и иммунная система ослаблена, и такие люди тоже становятся тем резервуаром, в котором лекарственно устойчивые штаммы могут адаптироваться и приобрести такие преимущества, которые позволяют им конкурировать с лекарственно чувствительными штаммами. Таким образом с появлением и распространением СПИДа в мире, а также с началом таких крупных социальных потрясений, как в бывших странах СНГ, появились две большие зоны, включающие Африку, Азию, страны СНГ, где лекарственно устойчивые штаммы стали стремительно распространяться.
И тогда первыми забеспокоились международные организации, потому что эпидемия любого заболевания, в том числе и туберкулёза, в одной стране, является проблемой многих. В данном случае это было связано и усугублялось миграцией, поскольку открылись все ворота, люди стали эмигрировать из бывшего Советского Союза, и в Западной Европе вдруг стали обнаруживать те генотипы туберкулёза, которые раньше там не регистрировались.
Несмотря на то, что со дня открытия туберкулёза прошло уже больше ста лет, микобактерия хорошо изучена, известен и расшифрован её геном, но, тем не менее, мы пока не имеем надёжных средств вакцинации от туберкулёза. Спектр имеющихся лекарственных препаратов из-за проблемы лекарственной устойчивости приходится постоянно расширять и модифицировать, и ещё одна большая проблема – это проблема ранней диагностики туберкулёза.
Кох, открыватель туберкулёза, получивший за это Нобелевскую премию, был уверен, что можно быстро справиться с этой инфекцией. Но оказалось, что вакцина Коха защиты не даёт. Тогда появилась другая вакцина, БЦЖ, но она защищает только детей, а после 14 лет – что её вводи, что ни вводи – защиты нет. Кроме того, эффективность использования этой вакцины значительно меняется в зависимости от географического региона. В некоторых странах она обеспечивает высокую защиту детей – до 80%, а в других – 0%. К этому могли привести очень многие факторы. БЦЖ отличается от диких штаммов туберкулёза, у неё отсутствует фрагмент генома, и соответственно, несколько десятков генов у БЦЖ нет. В каждой стране штаммы для производства вакцины свои, единого мирового стандарта нет. По утверждениям специалистов-фтизиатров, наблюдается неуклонный рост осложнений при вакцинации БЦЖ. В чём причины? Они могут быть разнообразными. Может быть, сам ребёнок и его состояние, потому что в последнее время возросло число патологий среди новорождённых. Может быть, вакцинный штамм. Вакцинные штаммы строго контролируют по всем стандартным микробиологическим параметрам, но эти параметры не позволяют учитывать генотипические варианты. Так, во Франции на сегодняшний день идентифицировано не менее четырех штаммов БЦЖ, которые используют для вакцинации, в России – около двадцати. Поскольку при производстве штамм контролируется не на генетическом уровне, то не исключено, что на генетическом уровне могут происходить изменения и некоторые из них могут привести к не очень хорошим свойствам, которые, в свою очередь, и приводят к осложнениям. Возможно. Этого никто не проверял. Мы готовы принять участие в таких исследованиях, и мы могли бы найти те нуклеотидные замены, которые не должны присутствовать в исходном штамме, и создать устройство, с помощью которого можно было бы контролировать штаммы в ходе производства. Это позволяло бы проводить более глубокий независимый внутренний производственный контроль. Это в любом случае необходимо делать и, безусловно, это будет сделано, потому что любые живые вакцины требуют такого контроля. Всё в этом мире меняется, хотим мы или нет, это естественный, неизбежный процесс, возникают мутации, приобретаются какие-то селективные преимущества, иногда эти селективные преимущества срабатывают в организме, и это может привести к осложнениям. Такие работы – составление генетических портретов вакцинных штаммов - необходимы для практического здравоохранения и весьма интересны с научной точки зрения.
Следующая проблема – диагностика. Для детей это – реакция Манту, для взрослых – флюорография или томография. В ходе наших исследований и в ходе общения с коллегами, мы поняли, что реакция Манту имеет весьма условное диагностическое значение. Во-первых, реакция Манту не однозначна и существенно зависит от иммунного статуса человека. Во-вторых, она не всегда обладает высокой специфичностью и чувствительностью и не может отличить иммунитет, полученный при вакцинации БЦЖ, от дикой бактерии. Ведь реакция Манту – это суммарные белки от БЦЖ, и если вы вакцинированы БЦЖ, то они пересекаются с белками, полученными при прививке, появляется папула, на основании чего возникает подозрение, и надо проводить исследования дальше, тщательно проверять, что же происходит в организме. Чувствительность реакции Манту очень высока, а специфичность очень низкая, по оценкам некоторых специалистов она составляет всего 8-20%. Если же ещё накладывается коассоциированная инфекция – ВИЧ, или гепатит, или респираторные заболевания, то это вносит ещё большую путаницу. Поэтому в случае положительной реакции Манту необходимо провести подтверждающие диагностические анализы с помощью более совершенных методов. Если же говорить о флюорографии или результатах томографических исследований, то они выдают уже патологию. Т.е. это, безусловно, очень нужная, но уже не ранняя диагностика.
В России Т-клеточные технологии пока не внедрены. А в мире эти технологии уже внедрены в Германии и США, в специализированных крупных центрах, что надо делать и нам. Там не только есть центры, но действует система иммунологического мониторинга и система мониторинга генотипов микобактерии туберкулёза. Это позволяет реально оценивать эффективность всех противотуберкулёзных мероприятий, позволяет изучать процессы, которые реально происходят с микобактерией туберкулёза, вовремя выявлять эпидемические очаги, а не работать, как это делали раньше, по территориям в целом.

Лекарственно-устойчивый туберкулез является одной из ведущих проблем современной фтизиатрии, определяя трудности профилактики, диагностики и лечения данного заболевания. Особое значение приобретает мониторинг распространения множественной лекарственной устойчивости микобактерий туберкулеза (МЛУ МБТ), пред-широкой и широкой лекарственной устойчивости микобактерий туберкулеза (пред-ШЛУ и ШЛУ МБТ) [1]. Под МЛУ МБТ понимают устойчивость возбудителя к сочетанию изониазида и рифампицина независимо от наличия устойчивости к другим противотуберкулезным препаратам. Пред-ШЛУ МБТ – устойчивость микобактерий туберкулеза к изониазиду и рифампицину в сочетании с устойчивостью к фторхинолону или аминогликозиду/полипептиду (канамицину и/или амикацину и/или капреомицину) независимо от наличия устойчивости к другим противотуберкулезным препаратам. ШЛУ МБТ – это вид устойчивости, при которой одновременно определяется устойчивость микобактерий туберкулеза к изониазиду, рифампицину, фторхинолону и аминогликозиду/полипептиду (канамицину и/или амикацину и/или капреомицину) независимо от наличия устойчивости к другим противотуберкулезным препаратам [2]. Большой интерес представляют методы прогнозирования эпидемической ситуации лекарственно-устойчивого туберкулеза [3]. Глобальные отчеты ВОЗ по туберкулезу с данными о распространении МЛУ-ТБ в странах мира публикуются с 2012 г. [4], а начиная с 2016 г. проводится оценка бремени туберкулеза с МЛУ МБТ и устойчивостью к рифампицину (РУ МБТ). В Российской Федерации показатель заболеваемости МЛУ/РУ-ТБ в 2017 г. составил 39 (25–57) на 100 000 населения в год. Обеспечение стандартизации лабораторных подходов к определению лекарственной устойчивости микобактерий туберкулеза (ЛУ МБТ) также играет большую роль в корректной оценке территориальных особенностей ЛУ МБТ [5]. В современных эпидемиологических условиях выбор назначаемой схемы химиотерапии туберкулеза должен основываться на сведениях о распространенности ЛУ МБТ к противотуберкулезным препаратам в конкретном регионе, в том числе на уровне районов и микрорайонов. Непрерывное наблюдение за резистентностью МБТ на территории с помощью IT-технологий позволяет быстро получить информацию о распространении ЛУ МБТ у больных, оценить спектр ЛУ МБТ, изучить территориальные особенности его распространения в динамике пространства и времени, что обеспечивает инновационный подход в реализации противотуберкулезных мероприятий.
Цель исследования. Изучить распространение лекарственно-устойчивого туберкулеза на территории Ярославской области в период 2011–2017 гг. с использованием авторской компьютерной программы.
Результаты исследования и их обсуждение
Массивное выделение микобактерий обнаружено у 399 (23,3%) больных, умеренное бактериовыделение – у 330 (19,3%) больных и скудное бактериовыделение – у 842 (49,1%) больных. С помощью молекулярно-генетических методов микобактерии туберкулеза были обнаружены еще у 8,3% больных без выявления бактериовыделения другими методами. Первичная ЛУ МБТ наблюдалась у 904 (52,8%) больных, в том числе у 279 (16,3%) больных выявлена МЛУ МБТ, у 175 (10,2%) больных – пред-ШЛУ МБТ, у 96 (5,6%) – ШЛУ МБТ, у 354 (20,7%) больных – устойчивость к другим комбинациям препаратов (рис. 1).
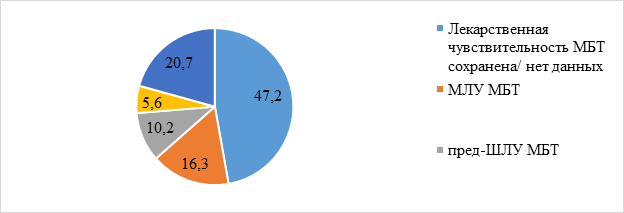
Рис. 1. Структура первичной ЛУ МБТ (%) среди бактериовыделителей 2011–2017 гг. (n=1713)
Среди впервые выявленных больных ЛУ МБТ к одному препарату определена у 180 (10,5%), двум препаратам – у 147 (8,6%), трем препаратам – у 133 (7,8%), к четырем и более препаратам – у 444 (26%) больных. Таким образом, выявляя ЛУ МБТ к изониазиду и рифампицину, мы в 26% случаев имеем устойчивость к 4 и более препаратам, что является фактором высокого риска нарастания устойчивости на фоне эмпирических режимов лечения. При такой ситуации на территории необходимо внедрять ускоренные методы определения ЛУ МБТ к противотуберкулезным препаратам второго ряда (молекулярно-генетические, посевы на жидкую питательную среду). Данный подход позволит проводить индивидуальную коррекцию схемы терапии в максимально короткие сроки и повысить эффективность лечения.
Получена ежегодная динамика структуры первичной ЛУ МБТ в 2011–2017 гг. к отдельным препаратам (таблица).
Динамика структуры первичной ЛУ МБТ к отдельным препаратам среди бактериовыделителей с ЛУ МБТ в 2011–2017 гг.
Департамент ВОЗ "Остановить ТБ"
ШЛУ-ТБ — это сокращенное название туберкулеза (ТБ) с широкой лекарственной устойчивостью. Каждый третий человек в мире инфицирован "дремлющими" бациллами ТБ (то есть бактериями ТБ). Люди заболевают ТБ только тогда, когда бактерии становятся активными. Происходит это при снижении иммунитета по каким-либо причинам, например, в результате ВИЧ, старения или каких-либо заболеваний. Как правило, ТБ можно излечить с помощью четырех стандартных противотуберкулезных препаратов, или препаратов первой линии. При неправильном употреблении или назначении этих лекарств может развиться ТБ с множественной лекарственной устойчивостью (МЛУ-ТБ). Для лечения МЛУ-ТБ требуется более длительная терапия препаратами второй линии, которые стоят дороже и вызывают больше побочных эффектов. ШЛУ-ТБ может развиться в том случае, когда эти препараты второй линии также неправильно применяются или назначаются и, поэтому, становятся неэффективными. В связи с тем, что ШЛУ-ТБ устойчив к препаратам и первой и второй линии, выбор терапии существенно ограничен. Поэтому, жизненно важно проводить борьбу с ТБ надлежащим образом.
МЛУ-ТБ, или ТБ с множественной лекарственной устойчивостью, является особой формой ТБ с лекарственной устойчивостью. Он развивается в случае устойчивости бактерий ТБ, как минимум, к изониазиду и рифампицину — двум самым мощным противотуберкулезным препаратам. ШЛУ-ТБ является ТБ, который в дополнение к лекарственной устойчивости, свойственной для МЛУ-ТБ. устойчив ко всем фторхинолонам и, как минимум, к одному из трех инъекционных лекарств второй линии (капреомицину, канамицину или амикацину). Такое определение ШЛУ-ТБ было принято Глобальной целевой группой ВОЗ по ШЛУ-ТБ в октябре 2006 года.
Люди, больные легочным ТБ (то есть ТБ легких — органа, наиболее подверженного этой болезни), часто являются заразными и могут распространять болезнь при кашле, чихании или просто при разговоре, так как при этом бактерии попадают в воздух. Для инфицирования человеку достаточно вдохнуть лишь небольшое количество этих бактерий (однако только незначительная доля людей заболевает ТБ). Иногда (в случае, когда бактерии передаются человеком, больным ТБ с лекарственной устойчивостью) бактерии уже устойчивы к лекарствам. Вторым путем развития МЛУ-ТБ и ШЛУ-ТБ является непосредственное появление у ТБ пациента лекарственной устойчивости. Это может произойти в случае неправильного применения или назначения лекарств, что случается при плохой организации программ по борьбе с ТБ, например, при ненадлежащей поддержке пациентов в ходе проведения полного курса лечения; в случае назначения неправильного лечения или неправильной дозы лекарства, либо назначения лекарства на слишком короткий период времени; при нерегулярном снабжении лекарствами клиник, распределяющих препараты; или при плохом качестве лекарств.
По всей вероятности, нет разницы между скоростью передачи ШЛУ-ТБ и каких-либо других форм ТБ. Распространение бактерий ТБ зависит от таких факторов, как число и концентрация заразных людей в каком-либо месте, где присутствуют люди, подверженные высокому риску инфицирования (такие, как люди с ВИЧ/СПИДом). Риск инфицирования возрастает по мере увеличения времени пребывания в одном помещении ранее не инфицированного человека и заразного человека. Риск распространения инфекции возрастает там, где наблюдается высокая концентрация бактерий ТБ — в таких закрытых пространствах, как переполненные дома, больницы или тюрьмы. Риск возрастает еще больше при плохой вентиляции. При надлежащем лечении пациентов с инфекционным ТБ риск распространения инфекции снижается и, в конечном счете, сводится к нулю.
Да, в некоторых случаях. Ряд стран с надлежащими программами борьбы против ТБ продемонстрировал, что излечение больных людей возможно в 30% случаев. Но успешные результаты в значительной мере зависят также от степени лекарственной устойчивости, степени тяжести болезни и от состояния иммунной системы пациента. Крайне важно, чтобы врачи, лечащие пациентов с ТБ, знали о возможной лекарственной устойчивости и имели доступ к лабораториям, которые могут поставить своевременный и точный диагноз для того, чтобы как можно раньше начать эффективное лечение. Для эффективного лечения необходимо, чтобы врачи, имеющие особый опыт в лечении таких случаев заболевания, имели доступ ко всем шести классам лекарственных препаратов второй линии.
На данный момент мы не знаем, но ШЛУ-ТБ встречается редко. Тем не менее, по оценкам ВОЗ, в 2004 году во всем мире было зарегистрировано почти полмиллиона случаев МЛУ-ТБ, который, как правило, предшествует появлению ШЛУ-ТБ. Мы также знаем, что результаты единственного проведенного на сегодняшний день глобального исследования свидетельствуют о том, что в некоторых районах, по всей вероятности, до 19% случаев МЛУ-ТБ фактически были случаями ШЛУ-ТБ, но это встречалось редко. Возможность появления ШЛУ-ТБ существует везде, где лекарства второй линии для лечения МЛУ-ТБ применяются неправильно. В срочном порядке проводятся исследования для получения дополнительной информации.
Большинство здоровых людей с нормальным иммунитетом могут никогда не заболеть ТБ, если они не будут иметь тесных контактов с заразными больными, не получающими терапии или получающими терапию в течение менее одной недели. Даже тогда у 90% людей, инфицированных бактериями ТБ, болезнь никогда не разовьется. Это относится как к "обычному" ТБ, так и к ШЛУ-ТБ. Однако ВИЧ-инфицированные люди, имеющие тесные контакты с людьми, больными ТБ, с большей вероятностью могут заразиться и заболеть ТБ. Люди, больные ТБ, которые общаются с ВИЧ-инфицированными лицами, должны соблюдать надлежащую гигиену при кашле, например, закрывать рот платком во время кашля или даже, на ранних стадиях лечения, использовать хирургические маски, особенно, в закрытых помещениях с плохой вентиляцией. Риск инфицирования ТБ на открытом воздухе очень незначительный. В целом, вероятность инфицирования ШЛУ-ТБ еще ниже, чем вероятность инфицирования обычным ТБ, так как случаи ШЛУ-ТБ до сих пор встречаются крайне редко.
Самым важным для пациента является продолжение приема всех лекарственных препаратов в точном соответствии с медицинскими предписаниями. Нельзя пропускать ни одной дозы, и это особенно важно в том случае, когда лекарства необходимо принимать через день (в случае так называемой интермиттирующей терапии). Кроме того, лечение необходимо довести до самого конца. Если пациент страдает от побочных эффектов лекарств (например, плохо переносит принимаемые таблетки), он должен сообщить об этом своему врачу или медицинской сестре, так как часто можно найти простое решение возникшей проблемы. Если же пациент должен уехать по какой-либо причине, он должен убедиться в том, что взятых с собой таблеток ему хватит на все время поездки.
В течение ряда лет мы наблюдали в мире отдельные случаи ТБ с крайне высокой лекарственной устойчивостью, который сегодня мы называем ШЛУ-ТБ. Все лекарства, применяемые против ТБ, существуют уже давно. При их ненадлежащем применении развивается устойчивость. Благодаря регулярным обзорам лекарственной устойчивости, которые мы стали проводить лишь недавно, охватывая все больше и больше стран, а также улучшению лабораторного потенциала поступает все больше сообщений о таких случаях заболевания. Это привело к более тщательному изучению проблемы и появлению этого названия.
Страны могут предотвратить ШЛУ-ТБ, обеспечив работу своих национальных программ борьбы против ТБ и всех врачей, лечащих людей, больных ТБ, в соответствии с "Международными стандартами лечения ТБ". В этом документе особо подчеркивается важность постановки правильного диагноза и проведения надлежащего лечения всех пациентов с ТБ, включая ТБ с лекарственной устойчивостью; обеспечения регулярных, своевременных поставок всех противотуберкулезных препаратов; надлежащего назначения противотуберкулезных препаратов и поддержки пациентов с целью максимально точного выполнения предписанной схемы приема лекарств; ухода за пациентами с ШЛУ-ТБ в центрах с надлежащей вентиляцией и максимального ограничения их контактов с другими пациентами, в частности, с ВИЧ-инфицированными, особенно на ранних стадиях лечения, когда уровень инфекционности еще не снижен в результате лечения.
Вакцина БЦЖ предотвращает тяжелые формы ТБ у детей, такие как туберкулезный менингит. Предположительно БЦЖ может также предотвращать тяжелые формы ТБ у детей даже в случае воздействия на них ШЛУ-ТБ, но она может быть менее эффективна для профилактики легочного ТБ — самой распространенной и инфекционной формы ТБ — у взрослых людей. Поэтому, по всей вероятности, значение БЦЖ в профилактике ШЛУ-ТБ весьма ограничено. Срочно необходимы новые вакцины, над которыми активно работают ВОЗ и члены Партнерства "Остановить ТБ".
ТБ является самой распространенной инфекций людей с ВИЧ/СПИДом, так как очень много людей уже инфицировано бактериями ТБ (см. пункт 1 выше). В тех районах, где наиболее распространен ШЛУ-ТБ, ВИЧ-инфицированные люди из-за своего ослабленного иммунитета подвергаются более высокому риску инфицирования ШЛУ-ТБ по сравнению с людьми, у которых нет ВИЧ. Если в этих районах много ВИЧ-инфицированных людей, то между ШЛУ-ТБ и ВИЧ будет наблюдаться прочная связь. К счастью, в большинстве районов с высокими коэффициентами ВИЧ ШЛУ-ТБ не имеет широкой распространенности. По этой причине у большинства людей с ВИЧ, у которых развивается ТБ, болезнь чувствительна к лекарствам, то есть является обычным ТБ и может лечиться с помощью стандартных противотуберкулезных препаратов первой линии (см. пункт 1 выше). Для людей с ВИЧ-инфекцией лечение антиретровирусными препаратами, по всей вероятности, снизит риск инфицирования ШЛУ-ТБ так же, как такое лечение снижает риск инфицирования обычным ТБ.
Симптомы ШЛУ-ТБ не отличаются от симптомов обычного ТБ, или ТБ с лекарственной чувствительностью: кашель с отделением густой, мутной слизи (или мокроты), иногда с кровью, на протяжении более 2 недель; повышенная температура, озноб и ночной пот; усталость и мышечная слабость; потеря веса; и в некоторых случаях одышка и боль в груди. Если у вас эти симптомы, это не значит, что у вас ШЛУ-ТБ, но это значит, что вы должны обратиться к врачу и пройти обследование. Если вы уже больны ТБ и принимаете лекарства и если через несколько недель лечения, по крайней мере, некоторые из этих симптомов не улучшились, вам следует проинформировать об этом своего врача или медицинскую сестру.
Каждый, кто имел контакт с человеком, который болен или у которого подозревается ШЛУ-ТБ, должен проконсультироваться со своим врачом или в местной ТБ клинике и пройти обследование для выяснения, есть ли у него ТБ. Это особенно важно в случае появления каких-либо симптомов ТБ (см. пункт 13 выше). При кашле необходимо предоставить образец мокроты для тестирования на наличие ТБ. В клинике будут проведены некоторые другие тесты, включая кожные пробы и рентгеновский снимок груди. В случае обнаружения ТБ будет начато лечение лекарствами, которые наиболее подходят для конкретной формы ТБ. Если будет получено какое-либо свидетельство об инфицировании бактериями ТБ, но не о заболевании ТБ, может быть назначено превентивное лечение (выбор лекарств будет основан на известной модели лекарственной устойчивости) или же такого человека могут просто попросить регулярно проходить проверки.
Для защиты работников здравоохранения, которые могут контактировать с пациентами, имеющими инфекционный ТБ, в медицинских учреждениях необходимо постоянно принимать строгие меры по инфекционному контролю. Работникам здравоохранения также рекомендуется убедиться в том, что они знают свой ВИЧ-статус с тем, чтобы не подвергаться риску инфицирования.
Это зависит от доступа пациента к медико-санитарным службам. При обнаружении в мокроте бактерий ТБ диагноз ТБ может быть поставлен через 1-2 дня, но полученный результат не позволит определить, чувствителен ли ТБ к лекарствам или устойчив. Для оценки лекарственной чувствительности необходимо культивировать бактерии и проводить тестирование в соответствующей лаборатории. При этом для постановки окончательного диагноза, особенно в случае ШЛУ-ТБ, может потребоваться от 6 до 16 недель. Для сокращения времени, необходимого для диагностирования, срочно необходимы новые методики для быстрой диагностики ТБ.
Во-первых, ВОЗ обеспечивает получение органами здравоохранения, ответственными за борьбу против ТБ, точной информации в отношении ШЛУ-ТБ. Во-вторых, ВОЗ привлекает внимание к тому факту, что надлежащая борьба с ТБ, прежде всего, предотвращает появление лекарственной устойчивости, а надлежащее лечение МЛУ-ТБ предотвращает появление ШЛУ-ТБ. Это полностью соответствует новой "Стратегии борьбы с ТБ", принятой в марте 2006 года. В-третьих, ВОЗ распространяет руководящие принципы по борьбе с МЛУ-ТБ для руководителей национальных программ по борьбе с ТБ, опубликованные в мае 2006 года, для содействия странам в создании эффективных программ по борьбе против ТБ с лекарственной устойчивостью. В-четвертых, департаменты ВОЗ по борьбе с ТБ и ВИЧ координируют международные ответные меры с помощью Глобальной целевой группы ВОЗ по ШЛУ-ТБ, которая провела свое первое совещание в октябре 2006 года. Последняя информация и регулярно обновляемые данные по ШЛУ-ТБ, а также другие сведения в отношении ТБ будут публиковаться на веб-сайте ВОЗ "Остановить ТБ" и на веб-сайте Партнерства "Остановить ТБ".

Дата публикации: 23.11.2019 2019-11-23
Статья просмотрена: 90 раз
Туберкулез по-прежнему остается одной из глобальных проблем здравоохранения, несмотря на то, что он является излечимым заболеванием. В 2015 г. было зарегистрировано 10,4 млн. новых случаев туберкулеза и 1,4 млн. смертей от этого заболевания. В 2015 г. коэффициент летальности от туберкулеза варьировал в широких пределах — от менее 5 % в некоторых странах до более 20 % в большинстве стран Африканского региона ВОЗ. Эти данные подчеркивают сохранение большого неравенства в доступе к высококачественным услугам диагностики и лечения туберкулеза. Европейский регион ВОЗ имеет самый высокий коэффициент заболеваемости туберкулезом с множественной лекарственной устойчивостью к рифампицину (МЛУ/РР-ТБ) на уровне 14 случаев на 100 000 населения. [1]
Множественная лекарственная устойчивость (МЛУ) микобактерий туберкулеза (МБТ) — это устойчивость возбудителя к сочетанию изониазида и рифампицина независимо от наличия устойчивости к другим противотуберкулезным препаратам (ПТП). Пред-широкая лекарственная устойчивость микобактерий туберкулеза (пред-ШЛУ МБТ) — это вид устойчивости, при которой определяется устойчивость микобактерий туберкулеза к изониазиду и рифампицину в сочетании с устойчивостью к фторхинолону или аминогликозиду/полипептиду (канамицин и/или амикацин и/или капреомицин) независимо от наличия устойчивости к другим противотуберкулезным препаратам. Широкая лекарственная устойчивость микобактерий туберкулеза (ШЛУ МБТ) — это вид устойчивости, при которой определяется устойчивость микобактерий туберкулеза к изониазиду, рифампицину, фторхинолону и аминогликозиду/полипептиду (канамицину и/или амикацину и/или капреомицину) одновременно, независимо от наличия устойчивости к другим противотуберкулезным препаратам. [5]
По классификации А. Г. Хоменко (1980) различают два вида устойчивости МБТ:
– монорезистентность — устойчивость к одному противотуберкулезному препарату;
– полирезистентность — устойчивость к двум и более противотуберкулезным препаратам.
В свою очередь существует истинная полирезистентность, при которой бактериальная клетка одновременно устойчива ко многим противотуберкулезным препаратам, и ложная (или множественная) резистентность, при которой отдельные особи популяции устойчивы к одному, а другие — к другому препарату. [4]
По своей природе лекарственная резистентность МБТ обусловлена одной или нескольких хромосомных мутаций в независимых генах МБТ. В клинической практике причинами возникновения МЛУ-ТБ являются: поздняя диагностика первичной лекарственной устойчивости (ЛУ) возбудителя, неадекватное или незавершенное предыдущее лечение, а также использование некачественных ПТП. Неадекватный или ошибочно выбранный режим химиотерапии приводит к тому, что лекарственно-устойчивый мутант, встречающийся в микобактериальной популяции, становится доминирующим у пациента, болеющего туберкулезом. Но даже при правильно назначенной противотуберкулезной терапии перерывы в лечении, временные отмены того или иного препарата, несоблюдение сроков химиотерапии способствуют формированию приобретенной устойчивости возбудителя. [5] Перед началом лечения больному назначается двукратное микробиологическое исследование используют световую и люминесцентную микроскопию мокроты. Бактериологический (культуральный) метод выявления МБТ состоит в посеве мокроты и другого патологического материала на твердые и жидкие питательные среды. Для выделения культуры МБТ достаточно 20–100 микробных тел в 1 мл мокроты. Рост культуры происходит за 21–90 сут. ПЦР для выявления ДНК возбудителя. Используют систему BACTEC (Приказ МЗ РФ № 19 от 21 марта 2003 г). [5, 4]
Для пациентов с подтвержденным рифампицин-чувствительным и изониазид-устойчивым туберкулезом рекомендуется лечение рифампицином, этамбутолом, пиразинамидом и левофлоксацином в течение 6 месяцев. Не рекомендуется добавлять в режим лечения пациентов с подтвержденным рифампицинчувствительным и изониазид-устойчивым туберкулезом стрептомицин или другие инъекционные препараты. МЛУ/РУ-ТБ, находящихся на длительном режиме лечения, необходимо включить три препарата группы А (левофлоксацин/моксифлоксацин, бедаквилин, линезолид) и один препарат группы В (клофазимин, циклосерин/теризидон), чтобы лечение начиналось как минимум с четырех противотуберкулезных препаратов. При лечении двумя препаратами группы A, то в режим необходимо включить оба препарата группы B. Если режим не может быть составлен только из препаратов групп A и B, их необходимо дополнить препаратами группы C (этамбутол, деламанид, пиразинамид, имипенем-циластатин, меропенем, амикацин (стрептомицин), этионамид/ протионамид, парааминосалициловая кислота). Канамицин и капреомицин, клавулановую кислоту не следует включать в длительные режимы лечения МЛУ/РУ-ТБ. Левофлоксацин или моксифлоксацин, линезолид необходимо включать в длительные режимы лечения МЛУ/РУ-ТБ. Бедаквилин необходимо включать в длительные режимы лечения МЛУ/РУ-ТБ у пациентов в возрасте от 18 лет и 6–17 лет. Клофазимин и циклосерин или теризидон, этамбутол, пиразинамид, имипенем-циластатин или меропенем можно включать в длительные режимы лечения МЛУ/РУ-ТБ. Деламанид можно включать в длительные режимы лечения МЛУ/РУ-ТБ у пациентов в возрасте от 3 лет. Амикацин можно включать в длительные режимы лечения МЛУ/РУ-ТБ у пациентов в возрасте от 18 лет при условии подтверждения чувствительности к нему и принятия достаточных мер для контроля нежелательных реакций. В случае недоступности амикацина его можно заменить стрептомицином при соблюдении тех же условий.
– Этионамид или протионамид можно включать в длительные режимы лечения МЛУ/РУ-ТБ только в том случае, если в них не входят бедаквилин, линезолид, клофазимин или деламанид или если невозможно составить режим из более предпочтительных препаратов.
– Парааминосалициловую кислоту можно включать в длительные режимы лечения МЛУ/РУ-ТБ только в том случае, если в них не входят бедаквилин, линезолид, клофазимин или деламанид или если невозможно составить режим из более предпочтительных препаратов. [6]
Общая продолжительность лечения МЛУ/РУ-ТБ составляет 18–20 месяцев; она может быть изменена в зависимости от ответа пациента на терапию. Предполагаемая продолжительность лечения после достижения конверсии культуры составляет 15–17 месяцев. С использованием амикацина или стрептомицина, предполагается интенсивная фаза продолжительностью 6–7 месяцев. У пациентов с МЛУ/РУ-ТБ, которые ранее на протяжении более 1 месяца не принимали препараты второго ряда, используемые в коротком режиме лечения МЛУ-ТБ, или у которых была исключена устойчивость к фторхинолонам и инъекционным препаратам второго ряда, вместо длительных режимов может использоваться короткий режим лечения МЛУ-ТБ продолжительностью 9–12 месяцев. [6, 5] Для мониторинга ответа на лечение рекомендуется посев мокроты в дополнение к микроскопии мазка мокроты ежемесячно. У пациентов с РУ-ТБ или МЛУ-ТБ одновременно с рекомендуемым режимом лечения МЛУ-ТБ может применяться выборочная частичная резекция легких (лобэктомия или клиновидная резекция). [6, 5]
Пациентам, проходящим лечение от ТБ, может быть предложена помощь в виде отслеживание хода лечения и/или цифровой мониторинг приема препаратов, материальная поддержка, психологическая поддержка. Обучение персонала. Пациенты могут лечиться под непосредственным наблюдением (ЛНН) на дому или с привлечением обученных медицинских работников. Лечение под видеонаблюдением (ЛВН) может заменить. Для пациентов, проходящих лечение от МЛУ-ТБ, более предпочтительной является децентрализованная, а не централизованная модель лечения. [6, 4]
Рост лекарственной устойчивости МБТ у больных туберкулезом легких и отсутствие новых противотуберкулезных препаратов ставит фтизиатрическую службу в трудные условия, что заставляет фтизиатров обратиться к богатому опыту борьбы с туберкулезом в доантибактериальный период, а именно в 20–50-е гг. прошлого столетия. Именно в доантибактериальный период были сформированы основные принципы массовой флюорографии, когда более 50 % всех больных деструктивным туберкулезом легких с бактериовыделением умирали в течение 5–6 лет после установления диагноза. В это время рентгенологический метод стал основным способом выявления начальных форм туберкулеза легких. Еще в 30-х гг. XX в. Бройнинг в Германии, Мальмрос и Хедвалл в Швеции и Г. Р. Рубинштейн и И. Е. Кочнова в СССР показали, что преобладающая форма туберкулеза, наиболее рано возникающая у клинически здоровых взрослых людей, является очаговый туберкулез легких, как правило, выявляют через 6–12 месяцев после получения нормальной рентгенограммы. [4]
Читайте также:


