Пресепсин в ранней диагностике сепсиса
Подпишитесь на рассылку, чтобы получать новости сайта
Пресепсин: новый биомаркер для прогнозирования и диагностики сепсиса
Пресепсин: новый биомаркер
для прогнозирования и диагностики сепсиса
Иошиказу Окамура, Ральф Томэ
Департамент исследований и разработок Митсубиси Кемикл Медиенс Корпорэйшн,
Yoshikazu Okamura, Ralf Thomae, R&D Department, Research and Development Division, Mitsubishi Chemical Medience Corporation,
Сепсис – это крайне серьезное заболевание, характеризующееся синдромом
системного воспалительного ответа (ССВО), связанным с инфекцией. Сепсис
регистрируется у 1-2% всех госпитализированных пациентов и у 25% пациентов
отделений интенсивной терапии (ОИТ). Смертность при сепсисе составляет 20%, при
тяжелом сепсисе – 40%, при септическом шоке – более 60%. Диагностика сепсиса
основана на международных согласованных критериях [1, 2]. Прогнозирование
течения и исходов сепсиса оценивается по шкале MEDS (Mortality in Emergency
Department Sepsis) [3]. 20-35% пациентов с тяжелым сепсисом и септическим шоком
умирают в течение 30 дней после начала его развития. Шкала прогностической
стратификации критических пациентов APACHE II позволяет оценивать риск
смертности при тяжелом сепсисе. Септический шок – сильный предиктор смертности,
как в краткосрочном, так и в долгосрочном масштабе. Лечение сепсиса базируется на
антибиотикотерапии, хирургическом дренировании инфицированных жидкостей и на
мероприятиях по снижению дисфункции органов, которые могут включать гемодиализ
при почечной недостаточности, искусственную вентиляцию при легочной
недостаточности, трансфузию продуктами крови, мероприятия по нормализации
кровообращения и др.
Серьезной проблемой в лечении сепсиса является задержка начала
адекватной антибиотикотерапии. Результаты многочисленных исследований
показывают, что каждый час задержки начала введения адекватных антибиотиков
приводит к повышению смертности на 7% [4, 5].
Биомаркеры сепсиса. Различные методы идентификации микроорганизмов,
связанных с развитием сепсиса (микроскопия мочи, люмбальная пункция,
гемокультуры, высевы мокроты и др.) могут занимать несколько дней, что может
приводить к опасной задержке проведения жизненно важных мероприятий. Для
решения этой проблемы необходимы новые тесты, которые были бы способными
сразу при поступлении пациента с подозрением на сепсис давать врачу точную
информацию о наличии сепсиса, о его тяжести и о текущем прогнозе его развития.
Идеальный маркер сепсиса должен также обеспечивать надежный мониторинг
эффективности терапии и оперативно менять ее тактику.
Традиционные маркеры сепсиса, такие как С-реактивный белок,
прокальцитонин, лактат, эндотоксин и др. не отвечают вышеперечисленным
требованиям. Однако недавние клинические исследования нового биомаркера,
названного пресепсином, показали, что он является многообещающим ранним и
прогностическим маркером сепсиса [6, 7].
Пресепсин (ПСП) – это белок (мол. масса 13 КДа) являющийся N-концевым
фрагментом рецептора макрофагов CD14. CD14 – это белок, существующий в двух
формах: 1) связанной с мембраной (mCD14) и присутствующей на поверхности
макрофагов, моноцитов и гранулоцитов и 2) в растворимой (sCD14, s – soluble,
растворимый), циркулирующей в кровотоке. mCD14 – рецептор, ответственный за
трансдукцию эндотоксинового сигнала внутрь клеток. Выход mCD14 в кровоток и
образование sCD14 связаны с инфекцией и с некоторыми другими патологическими
состояниями. При активации бактериального фагоцитоза sCD14 и mCD14
расщепляются лизосомальными протеиназами с образованием фрагмента, исходно
названного sCD14-subtype (sCD14-ST), а потом переименованного в пресепсин [6, 7].
Один из механизмов образования ПСП связан с бактериальным фагоцитозом и
расщеплением mCD14 лизосомальными ферментам (рис. 1) [8].
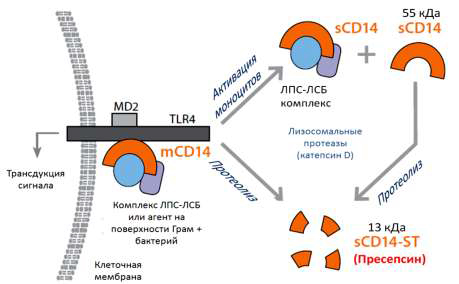
Рис. 1. Механизм образования ПСП.
mCD14 – СD14, связанный с мембраной, sCD14 – растворимый CD14, sCD14-ST – пресепсин, ЛПС –
липополисахарид, ЛСБ – липополисахарид связывающий белок, TLR4 – толл-подобный рецептор 4; MD2 – белок,
связанный с TLR4. Подробности в тексте.
Показано, что ПСП повышается в связи с инфекцией и специфически
продуцируется при сепсисе, связанном с грамотрицательными и
грамположительными бактериями, с грибками, при вирусных инфекция ПСП не
продуцируется [9, 10]. Недавно был разработан новый диагностический инструмент –
хемилюминесцентный иммуноферментный анализатор PATHFAST, который _______за 17
мин проводит полностью автоматические измерения важнейших биомаркеров
различных критических состояний и в особенности – пресепсина.
Эффективность ПСП для диагностики сепсиса. Измерения уровней ПСП при
разных патологических состояниях помощью экспресс-анализатора PATHFAST
показали, что этот маркер является высоко специфическим по отношении к сепсису
[7]. Анализ чувствительности и специфичности ПСП, проведенный в различных
исследованиях, продемонстрировал, что он обеспечивает: 1) раннюю диагностику
сепсиса непосредственно при поступлении пациента, 2) прогнозирование течения
заболевания и 3) оценку риска неблагоприятных исходов. Согласно результатам
клинических исследований уровни ПСП имеют сильную связь со степенью тяжести
сепсиса и 30-дневной смертностью.
В недавнем проспективном исследовании 859 пациентов с ССВО, поступивших
в отделения неотложной терапии (ОНТ) подтверждено, что ПСП – высоко
эффективный биомаркер, действительно пригодный для ранней диагностики сепсиса,
стратификации риска, мониторинга терапии и прогнозирования исходов у септических
пациентов [11]. Данное исследование показало, что одновременное измерение
уровней ПСП и оценка тяжести пациентов с помощью шкал MEDS и APACHE II
значительно улучшает точность прогнозирования развития тяжелого сепсиса.
Предварительные исследования показали также, что ПСП – весьма
перспективный маркер неонатального и педиатрического сепсиса [12].
К сожалению, несмотря на широкое применение современных антибиотиков и
высокотехнологичных методов реанимации, сепсис все еще является главной
причиной смертности пациентов в ОНТ и в ОРИТ, поэтому ранняя диагностика
сепсиса сразу при поступлении пациентов – ключевой момент для повышения
выживаемости таких больных. ПСП - многообещающий маркер для решения этой
Эффективность ПСП для прогнозирования сепсиса. При сепсисе
повышение ПСП сильно связано с повышением риска неблагоприятного исхода, а
снижение – с повышением шансов выживания. Более того, как показано в
специальном исследовании, именно ПСП, по сравнению с другими маркерами
сепсиса, наилучшим образом отражает динамику тяжести сепсиса (рис. 2) [13].
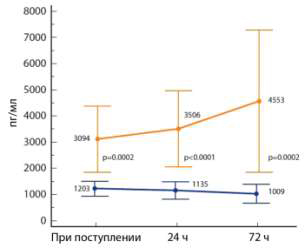
Рис. 2. Динамика ПСП у септических пациентов
с благоприятным исходом (внизу) и у не выживших (вверху).
Недавнее многоцентровое ретроспективное рандомизированное исследование,
в котором наблюдались пациенты, поступившие в ОИТ с сепсисом и септическим
шоком, показало, что уровни ПСП адекватно отражают изменение тяжести патологии
у впоследствии выживших и не выживших пациентов [14].
1.Согласно существующей практике, измерение широко используемых
маркеров сепсиса проводится в центральной лаборатории, что ведет к существенной
задержке получения срочной и жизненно важной диагностической информации.
2. Ни один из ныне широко используемых маркеров сепсиса не сочетает в себе
возможности для ранней диагностики сепсиса, стратификации рисков, с ним
связанных, прогнозирования и мониторинга течения сепсиса.
3. Пресепсин – новый, многообещающий маркер, который позволяет через 17
минут после взятия крови проводить:
а) раннюю и точную дифференциальную диагностику ССВО и сепсиса,
б) оценку тяжести сепсиса,
в) оперативный мониторинг эффективности его терапии,
г) прогнозирование его исхода, особенно эффективное при параллельной
оценке тяжести пациента согласно шкалам APACHEII, SOFA и MEDS.
4. Измерение уровней ПСП возможно оперативно проводить непосредственно
при поступлении пациента в ОНТ, ОИТ, ОРИТ и в операционном блоке (тестирование
Point-of-Care), что обеспечит своевременное принятие обоснованных клинических
Диагностические уровни пресепсина, пг/мл
| Уровень ПСП, пг/мл | Клинический диагноз | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сепсис может быть исключен. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ≥300 | Системная инфекция (сепсис) возможны. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ≥500 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ≥1000 | Высокий риск развития системной инфекции (тяжелого
сепсиса / септического шока). Высокий риск 30-дневной смертности, сравнимый с таковым 1. Levy MM, Fink MP, Marshall JC, et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference. Crit Care Med. 2003;31(4):1250-6. 2. Bone RC, Balk RA, Cerra FB, et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine. Chest. 1992;101(6):1644-55. 3. Shapiro NI, Wolfe RE, Moore RB, et al. Mortality in Emergency Department Sepsis (MEDS) score: A prospectively derived and validated clinical prediction rule. Crit Care Med. 2003;31(3):670-5. 4. Kumar A, Roberts D, Wood KE, et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit Care Med. 2006;34(6):1589-96. 5. Dellinger RP, Levy MM, Rhodes A, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med. 2013;41(2):580-637. 6. Shozushima T, Takahashi G, Matsumoto N, et al. Usefulness of presepsin (sCD14-ST) measurements as a marker for the diagnosis and severity of sepsis that satisfied diagnostic criteria of systemic inflammatory response syndrome. J Infect Chemother. 2011;17(6):764-9. 7. Spanuth E, Wilhelm J, Loppnow H, et al. Diagnostic and Prognostic Value of Presepsin (Soluble CD14 Subtype) in Emergency Patients with Early Sepsis Using the New Assay PATHFAST Pesepsin. IFCC World Lab/EuroMedLab. 2011 May. 8. Naitoh K, Shirakawa K, Hirose J, et al. The new sepsis marker, sCD14-ST (PRESEPSIN), induction mechanism in the rabbit sepsis models. SEPSIS 2010; poster:P-19. 9. Yaegashi Y, Shirakawa K, Sato N, et al. Evaluation of a newly identified soluble CD14 subtype as a marker for sepsis. J Infect Chemother. 2005;11(5):234-8. 10. Kojika M, Takahashi G, Matsumoto N, et al. Serum levels of soluble CD14 subtype reflect the APACHE II and SOFA Scores. Medical Postgraduates 2010;48(1):46-50. 11. Liu B, Chen YX, Yin Q, et al. Diagnostic value and prognostic evaluation of Presepsin for sepsis in an emergency department. Crit Care. 2013;17(5):R244. 12. Mussap M, Puxeddu E, Burrai P et al. Soluble CD14 subtype (sCD14-ST) presepsin in critically ill preterm newborns: preliminary reference ranges. J Matern Fetal Neonatal Med. 2012;25(Suppl 5):51-3. 13. Endo S, Suzuki Y, Takahashi G, et al. Presepsin as a powerful monitoring tool for the prognosis and treatment of sepsis: A multicenter prospective study. J Infect Chemother. 2013, 14. Masson S, Caironi P, Spanuth E, et al. Presepsin (soluble CD14 subtype) and procalcitonin levels for mortality prediction in sepsis: data from the Albumin Italian Outcome Sepsis trial. Crit Care. 2014;18(1):R6. Гординская Наталья Александровна – e-mail: nniito@rambler.ru Цель настоящей работы: изучение прогностической значимости различных лабораторных данных в диагностике септических осложнений при ожоговой болезни. Показано, что определение sCD14-ST (пресепсина) в крови позволяет в самые ранние сроки развития системной воспалительной реакции диагностировать активацию CD14-клеток, опережая другие показатели. Конкретные цифровые значения уровня пресепсина дают возможность дифференцировать генерализацию инфекции на фоне системного воспалительного ответа при ожоговой болезни. Ключевые слова: пресепсин; прогностическая значимость лабораторных данных; ожоговая болезнь; септические осложнения. ВВЕДЕНИЕ Сепсис является наиболее частой причиной летальных исходов в отделениях реанимации и интенсивной терапии и самой распространен- ной причиной шока [1]. По данным американских и европейских обзоров частота развития сепсиса колеблется от 2% у всех госпитализированных больных до 11% у больных, находившихся в палатах интенсивной терапии. Cовременный взгляд на патогенез сепсиса привел к появлению новой терминологии и диагностических крите- риев [2]. Вместе с тем проблема ранней диагностики сепсиса остается нерешенной, так как при сепсисе отсутствуют специфические симптомы и признаки. Это касается прежде всего пациентов, у которых системная воспалительная реакция развивается в силу основного заболевания, как при ожоговой болезни. Диагностика сепсиса у таких больных является особенно сложной. ЦЕЛЬЮ НАСТОЯЩЕЙ РАБОТЫ было изучение прогностической значимости различных лабораторных данных в диагностике септических осложнений при ожоговой болезни. МАТЕРИАЛЫ И МЕТОДЫ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ Бактериологическое исследование крови при положительном результате анализа дает воз- можность выбора адекватных режимов антибактериальной терапии и является классиче- ским. Однако этот метод не лишен недостатков. По нашим данным у пациентов с термиче- ской травмой при подозрении на сепсис рост микроорганизмов наблюдался во второй-третьей пробе на вторые-третьи сутки от начала исследования, то есть положительная гемо- культура регистрировалась не ранее четвёртых суток от момента забора крови. Кроме того, на фоне системной антибактериальной терапииожоговой болезни рост микробов на питательных средах нередко отсутствует, что, однако, не дает права исключить инфекцию кровяного русла. Молекулярные методы детекции ДНК микроорганизмов позволяют получить результат в день исследования, но в настоящее время нет возможности обнаружения всего спектра возбудителей госпитальной инфекции. В нашем распоряжении были наборы для определения ДНК стафилококка и синегнойной палочки, при этом выявление ДНК ацинетобактерий и энтеробактерий оста- валось невозможным. Молекулярно-генетические методы нами использовались в экспериментальной части работы при моделировании генерализованной стафилококковой инфекции у крыс. Подтверждение инфекции кровяного русла проводили ПЦР-исследованием внутрисердечной крови, забранной асептически при выведении животных из опыта. У всех опытных животных в крови обнаружена ДНК стафилококка, у контрольных – не обнаружена. Многие исследователи рекомендуют для диагностики сепсиса использовать определение в крови количества С-реактивного белка (СРБ). СРБ – острофазный белок, самый быстрый и чувствительный индикатор повреж- дения тканей при воспалении, некрозе, травме. В сыворотке здоровых людей С-реактивный белок практически не определяется. При термической травме уровень СРБ повы- шается до нескольких сотен мг/мл [3]. В дальнейшем регистрируется снижение количества СРБ с возможными подъемами в разные пери- оды ожоговой болезни. По литературным дан- ным у пациентов с термической травмой и подозрением на генерализацию инфекционно- го процесса в остром периоде ожоговой болезни концентрация СРБ составляет от 102 до 261 мг/мл, в среднем 153±56 мг/мл. Нами получены идентичные результаты, уровень СРБ составил 150±67 мг/мл, однако цифровые значения количества СРБ для прогноза развития сепсиса на фоне термической травмы определить не удалось. В последнее десятилетие, с учетом новых данных о патогенезе многих заболеваний и состояний, сопровождающихся системной вос- палительной реакцией, широко обсуждаетсяопределение уровня про- и противовоспали- тельных цитокинов. Цитокины играют ведущую роль в развитии системного воспаления любой этиологии, выступая индукторами и регуляторами иммунного ответа. Они обладают широким спектром биологического действия, проявляющегося в многообразных изменениях метаболизма, гемопоэза, свойствах сосудистой стенки и функции регулятор- ных систем. Вне воспалительной реакции и иммунного реагирования цитокины в крови содержатся в очень малом количестве, усиление их синтеза начинается в ответ на проникно- вение микроорганизмов или повреждение тканей. Как показали результаты наших исследова- ний, наиболее важным для пациентов с тяжелой термической травмой является определение фактора некроза опухолей-a (ФНО-a), так как наблюдается многократное увеличение содержания цитокина в плазме крови соответственно тяжести травмы и развитию осложне- ний. Через сутки после травмы уровень ФНО-a в периферической крови достоверно разли- чался в зависимости от площади ожога и при развитии инфекции: в I группе (ожог до 45% п.т.) уровень составил 354,7±60,6 пкг/мл, во II группе (ожог свыше 45% п.т.) – 752,6±40,7, в III группе (ожог+сепсис) – 938,6±57,1 пкг/мл. На третьи сутки после травмы у пациентов без инфекции регистрировалось снижение концентрации цитокина, а при развитии сепсиса уровень ФНО-a продолжал нарастать и составил 12936,4±2140,1 пкг/мл. Таким образом, уровень ФНО-a в плазме крови отражает тяжесть термического поражения и позволяет диагностировать развитие сепсиса на фоне термической травмы. Вслед за провоспалительными цитокинами при системной воспалительной реакции и сеп- сисе в кровотоке появляется прокальцитонин. Прокальцитонин (РСТ) представляет собой полипептид с м.м. 14,5 кДа, который является неактивным предшественником кальцитонина. В норме РСТ образуется из препрокальцитонина в С-клетках щитовидной железы под действием кальций-зависимых факторов. У здоровых людей весь образующийся РСТ преобразуется в кальцитонин и практически отсут- ствует в кровотоке. При генерализованных бактериальных инфекциях, тяжелых травмах,ожогах, кардиогенном шоке, продолжительных нарушениях микроциркуляции, то есть при системной воспалительной реакции орга- низма происходит повышение РСТ в крови. При этом имеет место экстратиреоидный синтез РСТ в лейкоцитах, нейроэндокринных клетках легких, кишечника и печени [4]. Основными индукторами синтеза прокальцитонина явля- ются бактериальные эндотоксины и провоспа- лительные цитокины. Полученные нами результаты полуколиче- ственного определения прокальцитонина у пациентов с термической травмой и подозрением на генерализацию инфекции показали, что в 40% случаев развития сепсиса содержа- ние РСТ в крови оценено как ложноотрица- тельный результат. Значения РСТ при этом не превышали 0,5 нг/мл. В настоящее время появилась возможность определения уровня гуморального белка пре- сепсиса, выделяющегося при активации фаго- цитирующих клеток. РИС. Уровень пресепсина в опытной группе животных.
У 17 больных из числа обследованных содержание пресепсина было выше 500 пкг/мл (от522 до 2285 пкг/мл), что по инструкции к тесту является значимым для диагностики сепсиса. При этом уровень прокальцитонина был выше 10 нг/мл только у 5 человек, положительная гемокультура зарегистрирована у 11 (таблица). Таким образом, определение sCD14-ST (пресепсина) в крови пациентов с тяжелой терми- ческой травмой и подозрением на септический процесс в 100% случаев позволило подтвер- дить клинический диагноз. ЗАКЛЮЧЕНИЕ ТАБЛИЦА. Уровень ПСП и ПКТ
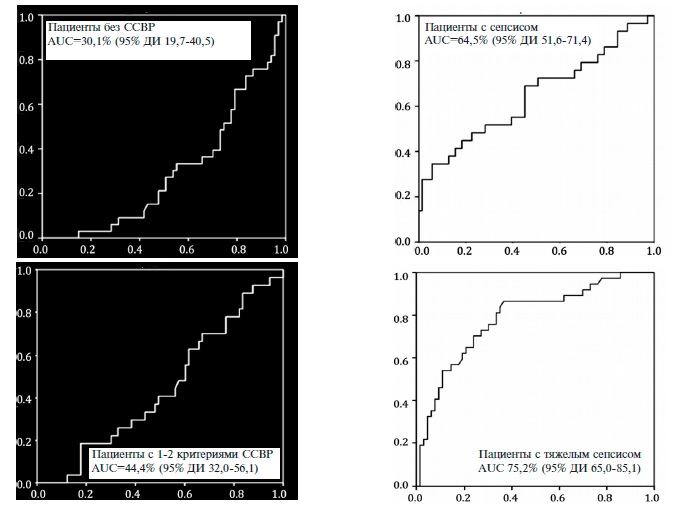
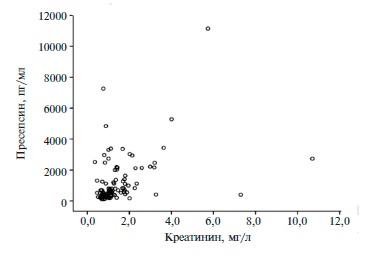
требует значительных затрат времени, а отрицательные результаты при этом не исключают сепсис. Динамическое наблюдение за содержанием СРБ у тяжелообожженных дает возможность оценивать тяжесть состояния пациентов, одна- ко количественные критерии, позволяющие улавливать изменения в условиях системной воспалительной реакции основного заболевания, отсутствуют. Недостатком при изучении уровня цитокинов является невозможность быстрого определе- ния показателя у одного больного, т. к. использование наборов для иммуноферментного метода требует накопления проб крови для целого планшета. Литературные данные сравнительных исследований показывают, что полуколичественный экспресс-тест РСТ, используемый чаще всего в клиниках, не всегда показывает результаты, идентичные полученным, с помощью высоко- чувствительных, но, к сожалению, малодоступ- ных количественных методов. Определение sCD14-ST (пресепсина) в крови позволяет в самые ранние сроки развития системной воспалительной реакции диагностировать активацию CD14-клеток, опережая другие показатели. Конкретные цифровые значения уровня пресепсина дают возможность дифференцировать генерализацию инфекции на фоне системного воспалительного ответа при ожоговой болезни. Оценить диагностическое значение референсных показателей маркера сепсиса в диагностике синдрома системной воспалительной реакции (ССВР) и сепсиса у пациентов с нозокомиальной пневмонией (НП). Материалы и методы В исследование были включены 100 пациентов (68 мужчин; средний возраст 62,1±7,2 лет) с НП, которых распределили на следующие группы: 1-я (n=33) – без ССВР, 2-я (n=29) – с 1-2 критериями ССВР, 3-я (n=38) – с сепсисом, 4-я (n=8) – с тяжелым сепсисом и 5-я (n=3) – с септическим шоком. Результаты анализа пресепсина оценивали в соответствии с технической документацией: 300 пг/мл – системная инфекция (сепсис) возможна; >500 пг/мл – умеренный риск развития системной инфекции (тяжелый сепсис); >1000 пг/мл – высокий риск развития системной инфекции (тяжелый сепсис/септический шок). Диагностическую значимость уровня пресепсина определяли с помощью построения ROC кривых и измерения площади под кривой (area under the curve – AUC) Значения AUC в первых трех группах составили 30,1%, 44,4% и 64,5% и указывали на низкое диагностическое значение концентрации пресепсина. AUC была достаточно высокой (75,2%) только у пациентов с тяжелым сепсисом. Выявлена статистически значимая корреляционная связь между уровнями пресепсина и сывороточного креатинина (r=0,439; р Заключение Результаты ROС-анализа у пациентов с НП свидетельствует о невысоком диагностическом значении референсных показателей маркера сепсиса пресепсина у больных с умеренно выраженными признаками ССВР. Информативность данного показателя повышалась у пациентов с принаками тяжелого сепсиса. Интерпретировать содержание пресепсина у пациентов с НП следует с учетом комплекса клинических и лабораторно-инструментальных данных. Нозокомиальная пневмония (НП) является одной из наиболее распространенных нозокомиальных инфекций, возникающих в отделении реанимации и интенсивной терапии (ОРИТ) [1]. Согласно международным исследованиям смертность от НП на фоне искусственной вентиляции легких достигает 4,4% (95% доверительный интервал [ДИ] 1,6-7,0) на 30-й день и 5,9% (95% ДИ 2,5-9,1) на 60-й день [2]. НП сопровождается развитием системной воспалительной реакции, а также приводит к развитию сепсиса, что требует быстрой диагностики и адекватной антибактериальной терапии (АБТ). Хотя смертность пациентов с НП и сепсисом постепенно снижается, она по-прежнему остается высокой [3]. Высокий уровень смертности от сепсиса в определенной степени связан с трудностями его диагностики [4,5]. Клинические критерии характеризуются низкой чувствительностью и специфичностью [6], что может приводить как к гипердиагностике, так и гиподиагностике сепсиса. Критерии диагностики и классификации сепсиса были предложены на конференции American College of Chest Physicians (ACCP)/S):1–112. ociety of Critical Care Medicine (S):1–112. CCM) еще в 1992 г. Последние поправки в данные критерии были внесены в марте 2016 г., в частности было исключено понятие “тяжелого сепсиса” [7,8]. Особую сложность представляют клинические ситуации, когда существует риск развития раннего послеоперационного сепсиса, например, после обширных хирургических вмешательств (абдоминальных, кардиохирургических, торакальных операций) [9]. Для послеоперационного периода характерно развитие синдрома системной воспалительной реакции (ССВР), который зависит от типа и объема оперативного вмешательства, а также возможных интраоперационных осложнений. Его бывает сложно отличить от раннего сепсиса на фоне НП или других инфекций [1013]. Поэтому необходим универсальный диагностический маркер, который позволил бы клиницисту судить о наличии сепсиса на фоне различных инфекционных осложнений, в частности НП. С этой целью в настоящее время используют С-реактивный белок и прокальцитонин. Изучается также диагностическое значение лейкоцитарного индекса интоксикации, фактора некроза опухоли-α, интерлейкина-6 [14]. На данные маркеры возлагались большие надежды, однако все они имеют ряд недостатков и не позволяют своевременно диагностировать ранний послеоперационный сепсис 15. Одним из современных маркеров сепсиса является пресепсин – растворимый аминоконцевой фрагмент кластера дифференцировки (CD) маркерного белка CD14. Пресепсин высвобождается в кровоток при активации моноцитов. В доклинических и клинических исследованиях было показано, что он является высокочувствительным и высокоспецифичным маркером сепсиса. Однако чувствительность и специфичность пресепсина в ранней диагностике сепсиса, а также возможность использования биомаркера для оценки его тяжести, динамики состояния пациента на фоне лечения и прогноза остаются неясными. Мало изучено влияние сопутствующей патологии, медикаментозной терапии, генетических факторов на уровень пресепсина [18,19]. Целью исследования было оценить диагностическое значение референсных значений уровня пресепсина в диагностике ССВР и сепсиса у пациентов с НП. Материал и методыВ ретроспективное исследование включали пациентов с НП, которые находились в отделениях реанимации и интенсивной терапии университетской клинической больницы 1 Первого МГМУ им. И.М. Сеченова. Диагноз НП №1 им. Н.И. Пирогова. Рациональная фармакотерапия в устанавливали в соответствии с клиническими рекомендациями (Нозокомиальная пневмония у взрослых, 2016 г.) [20], сепсиса – на основании критериев ACCР/S):1–112. CCM 2001 г. [21]. Пациенты с установленным диагнозом сепсиса получали терапию согласно стандартам и протоколам ведения больных сепсисом (S):1–112. urviving S):1–112. epsis Campaign, 2012 г.). Концентрацию пресепсина в крови определяли в экспресс-лаборатории УКБ 1 методом иммунохемилюми№1 им. Н.И. Пирогова. Рациональная фармакотерапия в несцентного анализа (автоматический анализатор PATHFAS):1–112. T LS):1–112. I Medience Corporation). Результаты интерпретировали в соответствии с технической документацией: 300 пг/мл – системная инфекция (сепсис) возможна; >500 пг/мл – умеренный риск развития системной инфекции (тяжелый сепсис); >1000 пг/мл – высокий риск развития системной инфекции (тяжелый сепсис/септический шок). Анализировали следующие переменные: возраст, пол, наличие и характер оперативного вмешательства, уровень пресепсина, длительность искусственной вентиляции легких (ИВЛ), результаты микробиологического исследования, клиренс креатинина и летальность. С помощью ROC анализа площади под кривой оценивали диагностическое значение уровня пресепсина при различных клинических состояниях [22]. При анализе площади под кривой (AUC ROC) использовали следующие значения для определения диагностического значения модели: 50-60% – неудовлетворительное, 60-70% – среднее, 70-80% – хорошее, 80-90% – очень хорошее, 90-100% – отличное. Статистический анализ выполнен с помощью пакета статистических программ IBM S):1–112. PS):1–112. S):1–112. S):1–112. tatistics 18.0. Данные представлены в виде средних значений и стандартных отклонений, медиан и интерквартильного размаха. Доверительные интервалы для частоты рассчитывали на основе биномиального распределения. Достоверность различий частот определяли при помощи критерия χ2 (для таблиц 2×2 – в точном решении Фишера). Достоверность различий средних арифметических значений в группах определяли при помощи дисперсионного анализа. Поскольку величина коэффициента эксцесса у пресепсина достаточно большая, даже в группе более 30 человек использование параметрических методов статистики может быть некорректным. Поэтому помимо дисперсионного анализа, использовали непараметрические методы, определяли достоверность различия средних рангов между двумя группами с помощью критерия U Mann-Whitney-Wilcoxon, а между тремя и более группами с помощью критерия Kruskal–Wallis. Различия считали статистически достоверными при р РезультатыВ ретроспективное исследование были включены 100 пациентов с НП, которых распределили на следующие группы: 1-я – отсутствие критериев ССВР, 2-я – наличие 1-2 критериев ССВР, 3-я – сепсис, 4-я – тяжелый сепсис, 5-я – септический шок (табл. 1). В группах пациентов без ССВР и с 1-2 критериями ССВР уровень пресепсина был достоверно ниже, чем в группах пациентов с сепсисом, в то время как между группами пациентов с сепсисом, тяжелым сепсисом и септическим шоком он существенно не различался (табл. 2).
Уровень пресепсина не зависел от локализации дополнительного очага инфекции (табл. 3). Исклю чение составили пациенты с сочетанием НП и нозокомиального трахеобронхита, ассоциированного с проведением ИВЛ, у которых уровень пресепсина был достоверно выше, чем в других группах (р=0,029). Также был проведен анализ уровня пресепсина у пациентов, перенесших различные типы оперативных вмешательств (табл. 3). У больных, которым были выполнены кардиохирургические и торакальные вмешательства, а также у пациентов, находившихся в отделении гнойной хирургии, уровень пресепсина был достоверно выше, чем у других больных (р=0,011, р=0,019 и р=0,002, соответственно) (табл. 3). В то же время он не отличался между указанными группами (р=0,712, р=0,885 и р=0,658 соответственно).
AUC, рассчитанная с помощью ROC-анализа, у больных НП без ССВР и с 1-2 критериями ССВР составила 30,1% (95% ДИ 19,7-40,5) и 44,4% (95% ДИ 32,056,1), соответственно. что указывало на низкое диагностическое показателя при данных состояниях (рис. 1). У пациентов с сепсисом значение AUC достигло 64,5% (95% ДИ 51,6-71,4), что также свидетельствовало о невысоком диагностическом значении концентрации пресепсина. Значение AUC было диагностически значимым только у пациентов с развернутой клинической картиной тяжелого сепсиса – 75,2% (95% ДИ 65,0-85,1). У 3 пациентов с септическим шоком значение AUC не рассчитывали. Результаты ROC-анализа также показали, что уровень пресепсина не позволял с достаточной точностью предсказать относительный риск летального исхода (AUC 65,4%; 95% ДИ 54,6-76,2). Выявлены положительные корреляционные связи уровня пресепсина с сывороточной концентрацией креатинина (r=0,439; р ОбсуждениеУ пациентов, перенесших различные оперативные вмешательства и находящихся на искусственной вентиляции легких в отделении интенсивной терапии, значительно повышается риск развития НП и сепсиса. В данной ситуации необходим точный диагностический маркер, позволяющий диагностировать сепсис, развившийся на фоне НП. Соответственно, целесообразно оценить возможность применения заявленных производителем референсных значений пресепсина с дифференциально-диагностической целью в данной когорте пациентов. Однако в большинстве исследований референсные значения данного маркера определяли у здоровых добровольцев. Так, в исследованиях D. Giavarina и соавт. [23] и С. Chenevier-Gobeaux и соавт. [24] у пациентов без ССВР референсные значения пресепсина не превышали 184 и 202 пг/мл, соответственно. Однако они не анализировались у больных с очагом инфекции, у которых отсутствовал ССВР или имелись только 1-2 критерия ССВР. Кроме того, во многих исследованиях сравнивали значение уровня пресепсина и других общепринятых маркеров – С-ре ак тивного белка и прокальцитонина [19]. Полученные нами данные свидетельствуют о невысоком значении референсных значений концентраций пресепсина в диагностике сепсиса у пациентов с НП в обычной клинической практике. В связи с этим при интерпретации содержания пресепсина следует учитывать как клинические, так и лабораторно-инструментальные данные. Необходимо проведение дополнительных исследований для изучения уровня пресепсина у пациентов с предполагаемым сепсисом на фоне НП или других инфекционных осложнений (перитонита, медиастинита, трахеобронхита и др.), так как он может отличаться у больных разного профиля. В двух исследованиях референсные значения уровня пресепсина у пациентов, которым проводилась ИВЛ, и больных с интрабдоминальными инфекциями были сопостави с таковыми у пациентов с сепсисом [25,26]. Наши данные демонстрируют высокое диагностическое значение концентрации пресепсина у пациентов с НП, сочетавшейся с ИВЛ-ассоциированным трахеобронхитом и сепсисом. В исследовании J. Bojan и соавт. была отмечена высокая информативность уровня пресепсина у пациентов с НП, развившейся на фоне ИВЛ, и сепсисом [27]. Полученные нами данные во многом согласуются с результатами исследований, продемонстрировавших четкую зависимость между сывороточными уровнями креатинина и пресепсина у пациентов с нарушением функции почек [28,29]. Наличие такой связи свидетельствует о необходимости более тщательного изучения содержания пресепсина у пациентов с нарушением функции почек, в частности с острым почечным повреждением, развившимся в раннем послеоперационном периоде или индуцированным сепсисом, при проведении сеансов заместительной почечной терапии. Наше исследование имеет ряд ограничений, основным из которых является ретроспективный дизайн. Кроме того, мы не оценивали концентрацию пресепсина в динамике. ЗаключениеРезультаты ROС-анализа свидетельствует о невысоком диагностическом значении референсных показателей маркера сепсиса пресепсина у больных с умеренно выраженными признаками ССВР на фоне НП, хотя информативность показателя повышалась у пациентов с принаками тяжелого сепсиса. Интерпретировать содержание пресепсина у пациентов с НП следует с учетом других клинических и лабораторно-инструментальных данных. Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу. Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||



.jpg)