Вакцина для профилактики синегнойной инфекции
Торговое название: Псевдовак
Международное название: Вакцина для профилактики синегнойной инфекции& (Vaccine Pseudomonas aeruginosa)
Фармакологическая группа: МИБП-вакцина
Фармакологическая группа по АТХ: J07AX. Другие противобактериальные вакцины
При использовании вакцины Псевдовак в профилактических или лечебных целях препарат стимулирует активный иммунитет, что проявляется повышением уровня антител к синегнойным бактериям в плазме крови. Введение вакцины непосредственно после получения травмы способствует снижению риска бактериемии и сепсиса, вызванных Pseudomonas aeruginosa.
Показания к применению:
Вакцина Псевдовак применяется с целью формирования активного иммунитета к синегнойным инфекциям и может использоваться при любых состояниях, сопровождающихся повышенным риском синегнойных инфекций или сепсиса, в особенности у больных с обширными ожогами.
В профилактических целях - с целью формирования активного иммунитета к синегнойным инфекциям при длительной госпитализации, интубации, искусственной вентиляции легких, катетеризации, рецидивирующих инфекциях, различных видах ран, в том числе послеоперационных.
В лечебных целях - у, пациентов с лабораторно доказанными синегнойными инфекциями, такими как пневмония, инфекции нижних дыхательных путей, инфекции мочевыводящих путей и другие, для усиления специфического иммунитета и уменьшения риска бактериемии и сепсиса.
- Острые инфекции с лихорадкой, не вызванные бактериями Pseudomonas aeruginosa.
Легкие инфекции не являются противопоказанием для использования вакцины.
- Обострение хронического заболевания. В этих случаях вакцинация проводится после достижения ремиссии.
- Беременность и лактация.
- Аллергические реакции на предшествующее введение вакцины или гиперчувствительность к компонентам препарата.
НЕ ВВОДИТЬ ВНУТРИВЕННО.
У детей с 1 месяца и взрослых вакцину Псевдовак в лечебных и профилактических целях следует использовать согласно приведенному ниже протоколу:
ДЕНЬ ---------- ОБЪЕМ ВАКЦИНЫ
При иммунизации ожоговых больных введение вакцины начинают как можно раньше (через 1-3 дня после получения травмы), строго соблюдая приведенную выше схему.
При развитии побочных реакций локального или системного характера допускается увеличение интервала между введениями препарата или повторное введение вакцины в той же дозе при очередной инъекции, конечная доза препарата, однако, должна составлять 1,0 мл. Превышение конечной дозы (1,0 мл) не допускается.
В редких случаях возможно развитие следующих побочных реакций:
- Локальные реакции: покраснение, болезненная припухлость.
- Общие реакции: головная боль, повышение температуры тела, утомляемость.
Симптомы обычно проходят через 24-48 ч.
До настоящего времени нет данных.
До настоящего времени нет данных.
До настоящего времени нет данных.
Перед применением вакцины необходимо провести медицинское обследование пациента и проанализировать данные анамнеза, а также сведения о вакцинациях, проводившихся ранее.
Перед каждой инъекцией вакцины следует спросить пациента, не было ли у него каких-либо неприятных симптомов после предыдущего введения препарата.
Такая методика позволяет оценить риск побочных эффектов иммунизации.
В связи с опасностью развития анафилактического шока, связанной с использованием биологических препаратов, при введении вакцины следует подготовить необходимый набор противошоковых средств.
ПОСЛЕ ИНЪЕКЦИИ ВРАЧ ДОЛЖЕН НАБЛЮДАТЬ ЗА СОСТОЯНИЕМ ПАЦИЕНТА В ТЕЧЕНИЕ 30 МИНУТ.
Влияние на способность управлять транспортными средствами, механизмами
До настоящего времени нет данных.
Не использовать по истечении срока годности, указанного на упаковке.
В защищенном от света месте при температуре от 2 до 8 град.С
Хранить в недоступных для детей местах.
Дата актуализации инструкции 13.11.2013
Владелец регистрационного удостоверения: Мединторг ЗАО, Россия
Формы выпуска: раствор для внутримышечного введения, ампулы
Условия отпуска: для лечебно-профилактических учреждений
Данные гос. регистрации: ЛП-001290 от 28.11.2011
Дата переоформления РУ: 15.08.2017
Состояние регистрационного удостоверения: действующее
Номер фармстатьи: ЛП 001290-150317
Откройте актуальную версию документа прямо сейчас или получите полный доступ к системе ГАРАНТ на 3 дня бесплатно!
Если вы являетесь пользователем интернет-версии системы ГАРАНТ, вы можете открыть этот документ прямо сейчас или запросить по Горячей линии в системе.
Новинка!

Псевдовак— уникальная поливалентная вакцина для профилактики и терапии синегнойной инфекции. Псевдовак назначается как профилактически, так и терапевтически — для получения активного иммунитета против инфекций, для увеличения специфической активности и снижения риска бактериемии и сепсиса при имеющихся инфекциях, вызванных Pseudomonas aeruginosa. Основным предназначением вакцины Псевдовак является стимуляция иммунной системы.
Нозокомиальные (внутрибольничные) инфекции встречаются во всех больницах, независимо от их уровня. Штаммы Pseudomonas aeruginosa (синегнойная палочка) являются причиной до 15% внутрибольничных инфекций: заражений крови, эндокардита, нагноения ран, внутрибольничных инфекций мочевыводящих путей, инфекций у пациентов с ожогами, инфекций подкожно-жирового слоя и дыхательной системы. Особенно это касается пациентов с муковисцидозом (кистозным фиброзом) и пациентов, находящихся на аппарате ИВЛ. Псевдовак содержит антигены Pseudomonas aeruginosa 7 иммунотипов — активные вещества, хорошо зарекомендовавшие себя в медицинской практике.
Вакцинация вакциной Псевдовак рекомендована всем пациентам с плановыми операциями, а также пациентам с ослабленным иммунитетом до госпитализации в отделения повышенного риска (заболевания респираторной и пищеварительной системы, обширные дерматологические операции). Пациентам с обширными ожогами и серьёзными травмами рекомендована иммунизация в день госпитализации.
Поливалентная вакцина Псевдовак, произведенная Институтом биотехнологий, сывороток и вакцин АО БИОМЕД, состоит из 8 активных веществ, смешанных в равных объемах. Эти активные вещества представляют собой надосадочные жидкости, содержащие структурные и внеклеточные антигены инактивированных штаммов P. aeruginosa, принадлежащих к 7 иммунотипам по классификации Фишера и др.
Торговое (патентованное) название: Псевдовак
Группировочное название: вакцина для профилактики синегнойной инфекции
Химическое название: нет
Лекарственная форма и назначение: раствор для внутримышечного введе-ния.
Описание. Прозрачный раствор светло-желтого цвета.
Состав. 1 мл препарата содержит:
Активные вещества: антигены иммунотипа 1 – 0,125 мл, антигены иммунотипа 2 – 0,125 мл, антигены иммунотипа 3 – 0,125 мл, антигены иммунотипа 4 – 0,125 мл, антигены иммунотипа 5 – 0,125 мл, антигены иммунотипа 6 – 0,125 мл, антигены иммунотипа 7 – 0,125 мл, антигены иммунотипа 3,7 – 0,125 мл,
Вспомогательные вещества: фенол – 2 4 мг.
Вакцинные штаммы Pseudomonas aeruginosa культивированы на искусственной среде Дэвиса.
Фармакотерапевтическая группа: МИБП-вакцина
Код АТХ: [J07AX]
Фармакологические свойства
При использовании вакцины Псевдовак в профилактических или лечеб-ных целях препарат стимулирует активный иммунитет, что проявляется повы-шением уровня антител к синегнойным бактериям в плазме крови. Введение вакцины непосредственно после получения травмы способствует снижению риска бактериемии и сепсиса, вызванных Pseudomonas aeruginosa.
Показания к применению
Вакцина Псевдовак применяется с целью формирования активного им-мунитета к синегнойным инфекциям и может использоваться при любых состояниях, сопровождающихся повышенным риском синегнойных инфекций или сепсиса, в особенности у больных с обширными ожогами. В профилактических целях — с целью формирования активного иммуни-тета к синегнойным инфекциям при длительной госпитализации, интубации, искусственной вентиляции легких, катетеризации, рецидивирующих инфекциях, различных видах ран, в том числе послеоперационных. В лечебных целях — у пациентов с лабораторно доказанными синегной-ными инфекциями, такими как пневмония, инфекции нижних дыхательных путей, инфекции мочевыводящих путей и другие, для усиления спе-цифического иммунитета и уменьшения риска бактериемии и сепсиса.
Противопоказания
Острые инфекции с лихорадкой, не вызванные бактериями Pseudomonas aeruginosa (легкие инфекции не являются противопоказанием для использования вакцины). Обострение хронического заболевания (в этих случаях вакцинация проводится после достижения ремиссии). Беременность и лактация. Аллергические реакции на предшествующее введение вакцины или гиперчувствительность к компонентам препарата.
Режим дозирования и способ введения
Вводить внутримышечно. Не вводить внутривенно. У детей с 1 месяца и взрослых вакцину Псевдовак в лечебных и профи-лактических целях следует использовать согласно приведенному ниже протоколу:
День 1 — 0,2 мл / День 4 — 0,4 мл
День 6 — 0,6 мл / День 8 — 0,8 мл
День 10 — 1,0 мл
При иммунизации ожоговых больных введение вакцины начинают как можно раньше (через 1-3 дня после получения травмы), строго соблюдая приведенную выше схему.
При развитии побочных реакций локального или системного характера допускается увеличение интервала между введениями препарата или повторное введение вакцины в той же дозе при очередной инъекции, конечная доза препарата, однако, должна составлять 1,0 мл. Превышение конечной дозы (1,0 мл) не допускается.
Побочное действие
В редких случаях возможно развитие следующих побочных реакций: Локальные реакции: покраснение, болезненная припухлость. Общие реакции: головная боль, повышение температуры тела, утомляемость. Симптомы обычно проходят через 24 48 ч.
Особые указания
Перед применением вакцины необходимо провести медицинское обсле-дование пациента и проанализировать данные анамнеза, а также сведения о вакцинациях, проводившихся ранее. Перед каждой инъекцией вакцины следует спросить пациента, не было ли у него каких-либо неприятных симптомов после предыдущего введения препарата. Такая методика позволяет оценить риск побочных эффектов иммунизации. В связи с опасностью развития анафилактического шока, связанной с ис-пользованием биологических препаратов, при введении вакцины следует подготовить необходимый набор противошоковых средств. После инъекции врач должен наблюдать за состоянием пациента в течение 30 минут.
Передозировка
До настоящего времени нет данных.
Взаимодействие с другими лекарственными средствами
До настоящего времени нет данных.
Фармацевтическая несовместимость
До настоящего времени нет данных.
Влияние на способность управлять транспортными средствами, механизмами
До настоящего времени нет данных.
Форма выпуска
Раствор для внутримышечного введения. По 1 мл в стеклянную (тип 1) ампулу. По 5 ампул помещают в пластиковую контурную ячейковую упаковку. По 1 контурной ячейковой упаковке вместе с инструкцией по примене-нию помещают в картонную пачку.
Условия хранения
В защищенном от света месте при температуре от 2 до 8 °С. Не замораживать. Хранить в недоступных для детей местах. Срок годности 1,5 года. Не использовать по истечении срока годности, указанного на упаковке.
Условия отпуска
Для лечебно-профилактических учреждений.
Владелец регистрационного удостоверения:
Произведено:
Лекарственная форма
рег. №: ЛП-001290 от 28.11.11 - ДействующееФорма выпуска, упаковка и состав препарата Псевдовак
Раствор для в/м введения прозрачный, светло-желтого цвета.
| 1 мл | |
| вакцина для профилактики синегнойной инфекции | 1 доза, в т. ч.: |
| антигены иммунотипа 1 | 0.125 мл |
| антигены иммунотипа 2 | 0.125 мл |
| антигены иммунотипа 3 | 0.125 мл |
| антигены иммунотипа 4 | 0.125 мл |
| антигены иммунотипа 5 | 0.125 мл |
| антигены иммунотипа 6 | 0.125 мл |
| антигены иммунотипа 7 | 0.125 мл |
| антигены иммунотипа 3,7 | 0.125 мл |
Вспомогательные вещества: фенол 2-4 мг.
1 мл (1 доза) - ампулы стеклянные (5) - упаковки ячейковые контурные пластиковые (1) - пачки картонные.
Фармакологическое действие
При использовании вакцины Псевдовак в профилактических или лечебных целях препарат стимулирует активный иммунитет, что проявляется повышением уровня антител к синегнойным бактериям в плазме крови. Введение вакцины непосредственно после получения травмы способствует снижению риска бактериемии и сепсиса, вызванных Pseudomonas aeruginosa.
Показания препарата Псевдовак
- с целью формирования активного иммунитета к синегнойным инфекциям и может использоваться при любых состояниях, сопровождающихся повышенным риском синегнойных инфекций или сепсиса, в особенности у больных с обширными ожогами;
- в профилактических целях с целью формирования активного иммунитета к синегнойным инфекциям при длительной госпитализации, интубации, искусственной вентиляции легких, катетеризации, рецидивирующих инфекциях, различных видах ран, в т.ч. послеоперационных;
- в лечебных целях у пациентов с лабораторно доказанными синегнойными инфекциями, такими как пневмония, инфекции нижних дыхательных путей, инфекции мочевыводящих путей и другие, для усиления специфического иммунитета и уменьшения риска бактериемии и сепсиса.
| Код МКБ-10 | Показание |
| B96.5 | Pseudomonas (aeruginosa) (mallei) (pseudomallei) как причина болезней, классифицированных в других рубриках |
| Z23.8 | Необходимость иммунизации против другой одной бактериальной болезни |
Режим дозирования
Вводить внутримышечно. Не вводить внутривенно.
У детей с 1 месяца и взрослых вакцину Псевдовак в лечебных и профилактических целях следует использовать согласно приведенному ниже протоколу:
| День | Объем вакцины |
| 1 | 0,2 мл |
| 4 | 0,4 мл |
| 6 | 0,6 мл |
| 8 | 0,8 мл |
| 10 | 1,0 мл |
При иммунизации ожоговых больных введение вакцины начинают как можно раньше (через 1-3 дня после получения травмы), строго соблюдая приведенную выше схему.
При развитии побочных реакций локального или системного характера, допускается увеличение интервала между введениями препарата или повторное введение вакцины в той же дозе при очередной инъекции, конечная доза препарата, однако, должна составлять 1,0 мл. Превышение конечной дозы (1,0 мл) не допускается.
Побочное действие
В редких случаях возможно развитие следующих побочных реакций:
- Локальные реакции: покраснение, болезненная припухлость.
- Общие реакции: головная боль, повышение температуры тела, утомляемость.
Симптомы обычно проходят через 24-48 ч.
Противопоказания к применению
- острые инфекции с лихорадкой, не вызванные бактериями Pseudomonas aeruginosa;
- обострение хронического заболевания. В этих случаях вакцинация проводится после достижения ремиссии;
- беременность и лактация;
- аллергические реакции на предшествующее введение вакцины или гиперчувствительность к компонентам препарата/
Легкие инфекции не являются противопоказанием для использования вакцины.
Поиск путей повышения эффективности лечения больных с нозокомиальными инфекциями является актуальной проблемой практического здравоохранения. Актуальность проблемы обусловлена сохраняющимися в XXI веке частотой и тяжестью течения инфекций, трудностями ранней диагностики, негативными последствиями для здоровья пациентов. Ввиду повсеместной распространенности нозокомиальных инфекций профилактика и повышение эффективности лечения носят глобальный характер [5]. Так, по данным статистики, ежегодно в Российской Федерации от нозокомиальных инфекций страдает 2-2,5 млн человек [5]. По различным оценкам, нозокомиальными инфекциями поражены 5-10% пациентов стационаров [2; 5]. Нозокомиальные инфекции являются второй по частоте причиной всех неблагоприятных последствий госпитализации [5]. Удельный вес хирургических больных в общей структуре нозокомиальных инфекций достигает 85% в масштабах страны [5]. Четвертая часть случаев внутрибольничного инфицирования происходит в отделениях реанимации и интенсивной терапии (ОРИТ) [5]. Практическая медицинская деятельность свидетельствует об увеличении сроков лечения пациентов с нозокомиальными инфекциями в 2,5 раза по сравнению с аналогичными пациентами без признаков инфекции [5]. Таким образом, выписка из стационара пациентов с нозокомиальными инфекциями задерживается в среднем на 10 дней, что влечет к увеличению стоимости лечения [5]. Помимо этого, внутрибольничное инфицирование приводит к потере репутации лечебного учреждения, что трудно оценить в финансовом выражении [5].
Одним из наиболее частых возбудителей нозокомиальных инфекций является Pseudomonas aeruginosa. Этим микроорганизмом обусловлено 16% случаев нозокомиальных пневмоний, 12% нозокомиальных инфекций мочевыводящих путей, 8% инфекций хирургических ран, 10% случаев инфекций кровотока [5]. В исследовании NPRS, проведенном в России и охватывающем 28 стационаров в 14 городах, показано, что уровень резистентности синегнойной палочки как возбудителя нозокомиальных инфекций в ОРИТ составляет: к меропенему — 3%, к амикацину — 6,3%, к цефтазидиму — 12,2%, к имипенему — 22,9%. Высокий уровень резистентности отмечен к ципрофлоксацину (32,8%) и гентамицину (73,9%) [2].
Критерии включения: оперированные пациенты с диагнозом острый тяжелый панкреатит, инфицированный панкреонекроз, у которых при бактериологическом исследовании отделяемого операционной раны выявлялась Pseudomonas aeruginosa в диагностическом титре 105 и более. Точкой включения больных в группу исследования являлось обнаружение в результатах бактериологических исследований амикацин-резистентной синегнойной палочки, чувствительной к полимиксину В.
Критерии исключения: легкая форма острого панкреатита - 12 пациентов, больные острым тяжелым панкреатитом, умершие в раннюю фазу заболевания - 1 пациент, пациенты с неинфицированным панкреатогенным инфильтратом, которые не были оперированы – 3 пациента.
Среди 12 больных группы исследования у 7 пациентов в связи с выявлением гнойного оментобурсита выполнялась верхнесрединная лапаротомия, вскрытие, дренирование, тампонирование сальниковой сумки. У 5 пациентов с гнойным оментобурситом и левосторонней забрюшинной флегмоной проведена верхнесрединная лапаротомия, вскрытие, дренирование, тампонирование сальниковой сумки и вскрытие, дренирование и тампонирование левосторонней забрюшинной флегмоны.
Среди 10 пациентов группы сравнения у 6 пациентов с гнойным оментобурситом выполнялась верхнесрединная лапаротомия, вскрытие, дренирование, тампонирование сальниковой сумки. У 4 пациентов с гнойным оментобурситом и левосторонней забрюшинной флегмоной проведена верхнесрединная лапаротомия, вскрытие, дренирование, тампонирование сальниковой сумки и вскрытие, дренирование и тампонирование левосторонней забрюшинной флегмоны. В дальнейшем пациентам обеих групп производились этапные санации.
Во всех случаях операционные раны не ушивались, были сформированы на швах – держалках, тампонирование выполнялось при помощи перчаточно-марлевых тампонов.
Возрастной диапазон пациентов составил от 34 до 65 лет. В группе исследования пациентов в возрасте от 34 до 40 лет, от 40 до 55 лет, от 55 до 65 лет насчитывается по 4 человека, что составило 33,3% от общего количества пациентов данной группы. Группа сравнения включает пациентов в возрасте от 34 до 40 лет – 3 человека, от 40 до 55 лет - 6 человек, от 55 до 65 лет – 1 человек. Доля пациентов возрастных категорий, входящих в группу сравнения, от общего количества пациентов указанной группы составила 30, 60 и 10% соответственно. Средний возраст пациентов группы исследования - 47,5 года (стандартное отклонение – 9,69), группы сравнения – 45,4 года (стандартное отклонение – 8,14). Таким образом, возрастные категории и средней возраст пациентов двух групп позволяют объективно осуществлять сравнительный анализ действия лекарственного препарата с учетом возрастных изменений фармакокинетики.
При сравнении половой принадлежности больных в сформированных группах установлено преобладание пациентов мужского пола: в группе исследования – 10 человек, в группе сравнения – 7 человек.
В группах оценивались степень тяжести состояния больных по шкалам Ranson, Apache II, а также нарушения функций дыхательной, сердечно-сосудистой и выделительной систем пациентов с помощью модифицированной шкалы Marshall.
С целью изучения микробной флоры во время каждого хирургического вмешательства (первичной операции и этапных санаций) взятие материала для бактериологического исследования производилось после вскрытия гнойно-некротических полостей и эвакуации гноя. Оценка результатов выполнялась со дня обнаружения Pseudomonas aeruginosa в диагностически значимом титре 105 и более. Таким образом, первый посев – в день обнаружения в бактериологическом посеве амикацин-резистентной синегнойной палочки, второй посев – на 10-й день, третий посев – на 13-й день, четвертый посев – на 15-й день, пятый посев – на 17-й день, шестой посев – на 20-й день в послеоперационном периоде.
Статистическая обработка данных производилась с помощью программного обеспечения StatSoft Statistica 10.0, Microsoft Office Excel 2007.
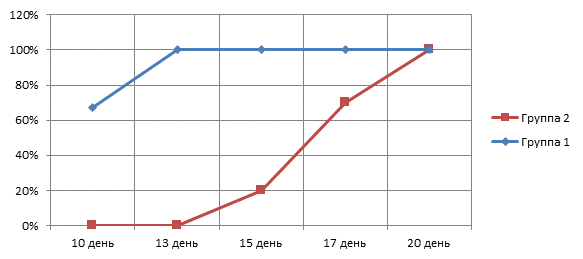
Сроки элиминации микрофлоры
Полный текст:
Адрес для переписки: Кудрявцев Игорь Владимирович ФГБНУ «Институт экспериментальной медицины 197376, Россия, Санкт-Петербург, ул. акад. Павлова, 12. Тел.: 8 (812) 234-29-29 E-mail: igorek1981@yandex.ru
1. Козлов В.А., Борисов А.Г., Смирнова С.В., Савченко А.А. Практические аспекты диагностики и лечения иммунных нарушений. Новосибирск: Наука, 2009. 274 с. [Kozlov V.A., Borisov A.G., Smirnova S.V., Savchenko A.A. Practical aspects of diagnosis and treatment of immune disorders]. Novosibirsk: Nauka, 2009. 274 p.
2. Савченко А.А., Шимохина Н.Ю., Петрова М.М., Борисов А.Г., Пилюгина М.С., Мошев А.В. Фенотипический состав лимфоцитов крови у больных острым коронарным синдромом в сочетании с расстройствами тревожно-депрессивного спектра // Российский иммунологический журнал, 2014. Т. 8 (17) № 4. С. 1019-1027. [Savchenko A.A., Shimohina N.Ju., Petrova M.M., Borisov A.G., Pilyugina M.S., Moshev A.V. Phenotype of blood lymphocytes of patients with acute coronary syndromes in conjunction with anxiety-depressive disorder. Rossiyskiy immunologicheskiy zhurnal = Russian Journal of Immunology, 2014, Vol. 8 (17), no. 4, pp. 10191027. (In Russ.)]
3. Савченко А.А., Модестов А.А., Мошев А.В., Тоначева О.Г., Борисов А.Г. Цитометрический анализ NKи NKT-клеток у больных почечноклеточным раком // Российский иммунологический журнал, 2014. Т. 8 (17), № 4. С. 1012-1018. [Savchenko A.A., Modestov A.A., Moshev A.V., Tonacheva O.G., Borisov A.G. Flow cytometry of NKand NKT-cells in patients with renal cell carcinoma. Rossiyskiy immunologicheskiy zhurnal = Russian Journal of Immunology, 2014, Vol. 8 (17), no. 4, pp. 1012-1018. (In Russ.)]
4. Соловей Н.В. Клинические особенности и исходы терапии внутрибольничных инфекций, вызываемых синегнойной палочкой с различным уровнем устойчивости к антибиотикам // Клиническая инфектология и паразитология., 2013. № 4 (07). С. 26-39. [Solovey N.V. Clinical features and treatment outcomes of nosocomial infections caused by Pseudomonas aeruginosa with different levels of resistance to antibiotics. Klinicheskaya infektologiya i parazitologiya = Clinical Infectology and Parasitology, 2013, no. 4 (07), pp. 26-39. (In Russ.)]
6. Цеймах И.Я., Момот А.П., Костюченко Г.И., Мамаев А.Н., Филонова Ю.А., Корнилова Т.А., Чучалин А.Г. Роль дисфункции эндотелия, сопряжения гемостатических и системных воспалительных реакций в патогенезе обострения хронической обструктивной болезни легких, зависимого от инфекционного воспаления // Терапевтический архив, 2013. Т. 85, № 3. С. 17-22. [Ceymah I.Ya., Momot A.P., Kostyuchenko G.I., Mamaev A.N., Filonova Yu.A., Kornilova T.A., Chuchalin A.G. The role of endothelial dysfunction, hemostatic interface and systemic inflammatory response in the pathogenesis of chronic obstructive pulmonary disease exacerbation dependent from infectious inflammation. Terapevticheskiy arkhiv = Therapeutic Archive, 2013, Vol. 85, no. 3, pp. 17-22. (In Russ.)]
7. Чучалин А.Г., Белевский А.С., Овчаренко С.И., Королева И.А. Улучшение качества жизни и предотвращение обострений – реально достижимые цели терапии ХОБЛ (результаты национального исследования ИКАР-ХОБЛ) // Практическая пульмонология, 2006. № 2. С. 48-51. [Chuchalin A.G., Belevskij A.S., Ovcharenko S.I., Koroleva I.A. Improving of life quality and prevention of exacerbations – achievable goals of COLD treatment (results of a national study ICAR-COLD). Prakticheskaya pul`monologiya = Practical Pulmonology, 2006, no. 2, pp. 48-51. (In Russ.)]
8. Шубин И.В., Татевосов В.Р., Костинов М.П., Чучалин А.Г. Оценка эффективности вакцинотерапии в комплексном лечении нетяжелой внебольничной пневмонии у лиц молодого возраста в организованных коллективах // Практическая медицина, 2013. № 5 (74). С. 110-113. [Shubin I.V., Tatevosov V.R., Kostinov M.P., Chuchalin A.G. Evaluating the effectiveness of vaccine therapy in treatment of non-severe community-acquired pneumonia in young people in organized groups. Prakticheskaya meditsina = Practical Medicine, 2013, no. 5 (74), pp. 110-113. (In Russ.)]
9. Ярилин А.А. Иммунология. М.: ГЭОТАР-Медиа, 2010. 752 с. [Yarilin A.A. Immunology]. Moscow: GEOTAR-Media, 2010. 752 p.
10. Alikhan M.M., Lee F.E. Understanding nontypeable Haemophilus influenzae and chronic obstructive pulmonary disease. Curr. Opin. Pulm. Med., 2014, Vol. 20, no. 2, pp. 159-164.
11. Almagro P., Salvadó M., Garcia-Vidal C., Rodríguez-Carballeira M., Cuchi E., Torres J., Heredia J.L. Pseudomonas aeruginosa and mortality after hospital admission for chronic obstructive pulmonary disease. Respiration, 2012, Vol. 84, no. 1, pp. 36-43.
12. Baccioglu A., Gulbay B.E., Acıcan T. Body composition in patients with stable chronic obstructive pulmonary disease: comparison with malnutrition in healthy smokers. Eurasian J. Med., 2014, Vol. 46, no. 3, pp. 169-175.
13. Bhela S., Kempsell C., Manohar M., Dominguez-Villar M., Griffin R., Bhatt P., Kivisakk-Webb P., Fuhlbrigge R., Kupper T., Weiner H., Baecher-Allan C. Nonapoptotic and Extracellular Activity of Granzyme B Mediates Resistance to Regulatory T Cell (Treg) Suppression by HLA-DR-CD25hiCD127lo Tregs in Multiple Sclerosis and in Response to IL-6. J. Immunol., 2015, Vol. 194, no. 5, pp. 2180-2189.
14. Borge C.R., Mengshoel A.M., Omenaas E., Moum T., Ekman I., Lein M.P., Mack U., Wahl A.K. Effects of guided deep breathing on breathlessness and the breathing pattern in chronic obstructive pulmonary disease: A double-blind randomized control study. Patient Educ. Couns., 2015, Vol. 98, no. 2, pp. 182-190.
15. Clancy R.L. Towards a vaccine for chronic obstructive pulmonary disease. Intern. Med. J., 2012, Vol. 42, no. 6, pp. 607-613.
16. Ghazarian L., Simoni Y., Magalhaes I., Lehuen A. Invariant NKT cell development: focus on NOD mice. Curr. Opin. Immunol., 2014, Vol. 27, pp. 83-88.
17. He X., Liang H., Hong K., Li H., Peng H., Zhao Y., Jia M., Ruan Y., Shao Y. The potential role of CD16+ Vγ2Vδ2 T cell-mediated antibody-dependent cell-mediated cytotoxicity in control of HIV type 1 disease. AIDS Res. Hum. Retroviruses., 2013, Vol. 29, no. 12, pp. 1562-1570.
18. Issazadeh-Navikas S. NKT cell self-reactivity: evolutionary master key of immune homeostasis? J. Mol. Cell. Biol., 2012, Vol. 4, no. 2, pp. 70-78.
19. Kim M., Cha S.I., Choi K.J., Shin K.M., Lim J.K., Yoo S.S., Lee J., Lee S.Y., Kim C.H., Park J.Y., Yang D.H. Prognostic value of serum growth differentiation factor-15 in patients with chronic obstructive pulmonary disease exacerbation. Tuberc. Respir. Dis. (Seoul), 2014, Vol. 77, no. 6, pp. 243-250.
20. Kroegel C., Bakakos P. The inflammatory effector cell pattern in asthma and chronic obstructive pulmonary disease – what is it good for? Respiration, 2012, Vol. 83, no. 1, pp. 17-19.
21. Lertworapreecha M., Patumraj S., Niruthisard S., Hansasuta P., Bhattarakosol P. Cytotoxic function of gamma delta (gamma/delta) T cells against pamidronate-treated cervical cancer cells. Indian J. Exp. Biol., 2013, Vol. 51, no. 8, pp. 597-605.
22. Létourneau S., Krieg C., Pantaleo G., Boyman O. IL-2and CD25-dependent immunoregulatory mechanisms in the homeostasis of T-cell subsets. J. Allergy Clin. Immunol., 2009, Vol. 123, no. 4, pp. 758-762.
23. Li X., Zheng Y. Treg identity protection by an epigenetic switch. Cell Cycle, 2014, Vol. 13, no. 20, pp. 31593160.
24. Lim Y.J., Koo J.E., Hong E.H., Park Z.Y., Lim K.M., Bae O.N., Lee J.Y. A Src-family-tyrosine kinase, Lyn, is required for efficient IFN-β expression in pattern recognition receptor, RIG-I, signal pathway by interacting with IPS-1. Cytokine, 2015, Vol. 72, no. 1, pp. 63-70.
25. Linterman M.A., Denton A.E. Treg cells and CTLA-4: the ball and chain of the germinal center response. Immunity, 2014, Vol. 41, no. 6, pp. 876-878.
26. Luider J.1., Cyfra M., Johnson P., Auer I. Impact of the new Beckman Coulter Cytomics FC 500 5-color flow cytometer on a regional flow cytometry clinical laboratory service. Lab. Hematol., 2004, Vol. 10, pp. 102-108.
27. Maecker H., McCoy P., Nussenblatt R. Standardizing immunophenotyping for the human immunology project. Nat. Rev. Immunol., 2012, Vol. 12, pp. 191-200.
28. Mayer A., Debuisson D., Denanglaire S., Eddahri F., Fievez L., Hercor M., Triffaux E., Moser M., Bureau F., Leo O., Andris F. Antigen presenting cell-derived IL-6 restricts Th2-cell differentiation. Eur. J. Immunol., 2014, Vol. 44, no. 11, pp. 3252-3262.
29. Miravitlles M., Anzueto A. Antibiotics for acute and chronic respiratory infection in patients with chronic obstructive pulmonary disease. Am. J. Respir. Crit. Care Med., 2013, Vol. 188, no. 9, pp. 1052-1057.
30. Miyara M., Ito Y., Sakaguchi S. TREG-cell therapies for autoimmune rheumatic diseases. Nat. Rev. Rheumatol., 2014, Vol. 10, no. 9, pp. 543-551.
31. Oosting M., Cheng S.C., Bolscher J.M., Vestering-Stenger R., Plantinga T.S., Verschueren I.C., Arts P., Garritsen A., van Eenennaam H., Sturm P., Kullberg B.J, Hoischen A., Adema G.J., van der Meer J.W., Netea M.G., Joosten L.A. Human TLR10 is an anti-inflammatory pattern-recognition receptor. Proc. Natl. Acad. Sci. USA, 2014, Vol. 111, no. 42, pp. E4478-E4484.
32. Rabe K.F., Hurd S., Anzueto A. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary. Am. J. Respir. Crit. Care Med., 2007, Vol. 176, pp. 532555.
33. Rakhimova E., Wiehlmann L., Brauer A.L., Sethi S., Murphy T.F., Tümmler B. Pseudomonas aeruginosa population biology in chronic obstructive pulmonary disease. J. Infect. Dis., 2009, Vol. 200, no. 12, pp. 1928-1935.
34. Sawant D.V., Vignali D.A. Once a Treg, always a Treg? Immunol. Rev., 2014, Vol. 259, no. 1, pp. 173-191.
35. Vasudev A., Ying C.T., Ayyadhury S., Puan K.J., Andiappan A.K., Nyunt M.S., Shadan N.B., Mustafa S., Low I., Rotzschke O., Fulop T., Ng T.P., Larbi A. γ/δ T cell subsets in human aging using the classical α/β T cell model. J. Leukoc. Biol. 2014, Vol. 96, no. 4, pp. 647-655.
36. Wark P.A., Tooze M., Powell H., Parsons K. Viral and bacterial infection in acute asthma and chronic obstructive pulmonary disease increases the risk of readmission. Respirology, 2013, Vol. 18, no. 6, pp. 996-1002.
37. Wen W., Wang A.M., Liu D.L., Zhang Y.B., Yao L.Q., Lai G.X. Expression of connective tissue growth factor and bone morphogenetic protein-7 in Pseudomonas aeruginosa-induced chronic obstructive pulmonary disease in rats. COPD, 2013, Vol. 10, no. 6, pp. 657-666.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Читайте также:


