Повышенный билирубин при туберкулезе
Эпидемическая ситуация, связанная с распространением туберкулеза в России, в настоящее время продолжает оставаться одной из важных социальных медицинских проблем, особенно в педиатрической практике.
Эпидемическая ситуация, связанная с распространением туберкулеза в России, в настоящее время продолжает оставаться одной из важных социальных медицинских проблем, особенно в педиатрической практике. Поэтому для детей, больных туберкулезом или входящих в группу риска, чрезвычайно важно проведение наряду с химиотерапией и химиопрофилактикой и комплексного этиопатогенетического лечения [2, 5, 7].
Среди многообразных нарушений физиологических процессов при туберкулезе — нарушение функции печени. При туберкулезе печень работает с большей перегрузкой, вследствие массового уничтожения микобактерий туберкулеза (МБТ) и нейтрализации продуктов их обмена. Под влиянием токсинов МБТ в большей или меньшей степени выявляются нарушения белкового, углеводного и ферментативного обмена.
Одним из грозных осложнений химиотерапии туберкулеза являются медикаментозные поражения печени. Известно, что основные противотуберкулезные препараты (ПТП) (изониазид, пиразинамид и рифампицин) обладают гепатотоксическим действием и приводят к развитию токсического гепатита, а при их комбинированном применении усиливается токсический эффект, который наиболее часто возникает при сочетании препаратов с рифампицином или его аналогами. Значительный рост остропрогрессирующих и распространенных форм туберкулеза у детей, а также увеличение числа случаев полирезистентных форм МБТ вынуждают использовать в химиотерапии комбинацию из 5–6 препаратов, что также ведет к развитию токсического гепатита [1, 2, 3].
Под воздействием этих препаратов часто развиваются токсические реакции, сопровождающиеся появлением желтухи, ухудшением общего самочувствия, снижением аппетита, тошнотой, рвотой, увеличением размеров печени, появлением болей в правом подреберье, нарушением пищеварения, ухудшением биохимических показателей крови.
Между тем по литературным и статистическим данным известно, что более 30% детей до начала терапии ПТП уже имеют сопутствующую патологию со стороны желудочно-кишечного тракта (ЖКТ), печени, желчевыводящих путей или имеют в анамнезе перенесенные вирусные гепатиты. В патогенезе острых и хронических вирусных гепатитов лежит синдром цитолиза, который приводит к повышению проницаемости печеночно-клеточных мембран, к потере биологически активных веществ, к потере ферментов и, как следствие, к нарушению всех видов обмена. Все это приводит к нарушению внешнесекреторной функции печени, изменению нормального процесса пищеварения, нарушению желчеобразующей и желчевыделяющей функции [2, 4, 6].
Вышеизложенные данные создают определенные трудности при назначении ПТП. В связи с этим весьма актуальным является поиск методов профилактики гепатотоксических реакций у детей, получающих ПТП. Одним из способов защиты печени от токсических реакций является включение гепатопротекторов (Эссенциале, Сирепар, Карсил, Урсосан, ЛИВ.52) и желчегонных средств.
ЛИВ.52 оказывает достаточно выраженный гепатопротективный эффект: снижает застойные явления и устраняет воспаление печени, стимулирует процесс регенерации гепатоцитов, усиливает внутриклеточный обмен, уменьшает дегенеративные, жировые и фиброзные изменения, стимулирует биосинтез белков и фосфолипидов. Оказывает защитное действие против перекисного окисления липидов, благодаря повышению уровня токоферолов (антиоксидантов) печеночной клетки. Защищает эндоплазматический ретикулюм клеток печени, активизирует активность печеночных микросомальных ферментативных систем, повышает уровень цитохрома Р-450, играющего важную роль в метаболизме лекарственных средств и детоксикации ядов [5].
Актуально использование данного препарата как в лечении сопутствующей патологии печени, такой как острый и хронический вирусный гепатит, дискинезии желчного пузыря, так и при медикаментозных поражениях печени. ЛИВ.52 — это комплексный лекарственный препарат, в состав которого входит тысячелистник обыкновенный, паслен черный, цикорий обыкновенный, дымянка лекарственная, кассия западная, терминалия арджуна, тамарикс гальский, тиноспора сердцелистная, оксид железа [1, 8].
Материалы и методы исследования
Целью данной работы была оценка эффективности препарата ЛИВ.52 в профилактике гепатотоксических реакций у детей, больных туберкулезом как с поражением, так и без патологии печени, получающих противотуберкулезную терапию.
Нами были поставлены следующие задачи:
Под наблюдением находилось 150 детей, которые были разделены на 2 группы: 1 группа из 100 детей, получающих специфическую терапию и ЛИВ.52 (из них — 18 детей с поражением печени и 82 ребенка без патологии печени); контрольная группа из 50 детей без патологии печени, получающих специфические химиопрепараты, без назначения ЛИВ.52.
Все дети, больные туберкулезом, до назначения ЛИВ.52 подвергались тщательному клиническому обследованию, включающему в себя сбор жалоб, сбор данных анамнеза жизни, заболевания; объективному осмотру и общеклиническим и лабораторным методам исследования: общие анализы крови, мочи, биохимические исследования крови. У детей с сопутствующей патологией печени и желчевыводящих путей с особым вниманием наблюдали за аппетитом ребенка, режимом и характером питания, переносимостью тех или иных продуктов питания и аллергическими реакциями, болями в животе, частыми запорами или поносами.
Продолжительность курса лечения составила 3 месяца, все данные фиксировались в истории болезни. Для оценки эффективности препарата ЛИВ.52 в динамике лечения проводились комплексные наблюдения за объективным статусом ребенка среди детей обеих групп (оценка общего состояния, состояния кожных покровов, размеров печени), общеклинические исследования крови, мочи (стандартными методами), изучались состояния ЖКТ (тошнота, рвота, горечь во рту, тяжесть и боль в правом подреберье, анорексия). Также в динамике проводилось биохимическое исследование крови с определением содержания белка (альбумина и глобулиновых фракций) билирубина, холестерина, аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), тимоловой пробы 1 раз в месяц. При возникновении гепатотоксической реакции контроль над сроком ее исчезновения проводили 1 раз в 10 дней.
Несомненно, основным методом обследования детей для изучения состояния печени в процессе лечения в настоящее время стал ультразвуковой метод исследования (УЗИ), который по сравнению с другими методиками имеет определенные преимущества — отсутствие лучевой нагрузки, высокая информативность, неинвазивный метод обследования. УЗИ отражает в основном анатомическую структуру органа (форму, контур, размер, эхогенность, посторонние включения, новообразования и т. д.). Поэтому всем детям, больным туберкулезом с поражением и без патологии печени, получающим лечение химиопрепаратами, проводилось УЗИ органов брюшной полости и печени 1 раз в 3 месяца, при выявлении патологии — по показаниям.
В 1 группе из 100 детей под наблюдением находилось 18 детей с патологией печени в анамнезе; у всех наблюдались выраженные симптомы интоксикации, как по основному процессу, так и в связи с сопутствующей патологией печени. У 6 детей в анамнезе был перенесенный вирусный гепатит (ВГ): ВГА — у 2 детей, ВГВ — у 3 детей, ВГС — у 1 ребенка; также у этих детей наблюдалось наличие в крови НВsAg антигена. У 12 детей (ранее получивших лечение до поступления в институт) отмечались явления токсического гепатита. Из всех 18 детей с активным туберкулезом легких в сочетании с патологией печени — у 11 детей (в 61,1% случаев) отмечалось увеличение размеров печени на 2–3 см, с умеренной или выраженной болезненностью при пальпации в области правого подреберья. Жалобы были на снижение аппетита, тошноту, иногда на рвоту после приема пищи и химиопрепаратов.
Несмотря на поражение печени, всем больным детям назначалось полноценное специфическое химиотерапевтическое лечение 4 антибактериальными препаратами в сочетании с гепатопротектором ЛИВ.52. Особое внимание нами было уделено диетотерапии с содержанием достаточного количества растительной клетчатки, растительных жиров с содержанием в них полиненасыщенных жирных кислот, необходимых для обменных процессов в печени, и продуктов, стимулирующих отток желчи.
На фоне комплексного лечения отмечалось улучшение общего состояния, уменьшение симптомов как туберкулезной, так и печеночной интоксикации, повышение аппетита. Нормализация размеров печени отмечена: через 1 мес в 16% случаев, через 2 мес — 41%, через 3 мес — у 100% детей.
Патологические изменения в биохимических показателях крови до начала лечения ЛИВ.52 (повышение общего билирубина, трансаминаз, тимоловой проб, повышение уровня щелочной и кислой фосфатаз) отмечались в 72,2% случаев.
Нормализация биохимических показателей крови отмечена через 1 мес — в 23% случаев, через 2 мес — в 67% случаев, к концу 3-го мес — достигнута в 100% случаев. Дополнительным подтверждением эффективности препарата ЛИВ.52 является и более быстрая нормализация аминотрансфераз на 3–4 неделе лечения, т. е. купирование синдрома цитолиза, характерного для токсического гепатита. Это обусловлено его стимулирующим действием на регенерацию гепатоцитов, мембраностабилизирующим действием, что особенно ценно при длительной противотуберкулезной терапии. Отмечалось снижение активности щелочной и кислой фосфатаз, что свидетельствует о нормализации функциональной активности печени и функции желчеобразования.
По данным УЗИ детей с патологией печени, особенно после перенесенных вирусных гепатитов, у 4 детей (22,2% случаев) — усиление эхогенности печени за счет внутриклеточного холестаза, а также густой осадок в желчном пузыре. Ликвидация этих явлений зафиксирована у всех детей, получивших ЛИВ.52, на 5–6 неделе лечения. Также у 11 детей с увеличением печени отмечались изменения ультразвуковой картины печени в виде повышения плотности, увеличения размеров и выраженности стенок желчных протоков. При контроле за исчезновением изменений в области печени УЗИ проводилось 1 раз в 10 дней, нормализация показателей отмечалась через 3–4 недели лечения.
Таким образом, у детей с туберкулезом в сочетании с патологией печени включение в комплексную химиотерапию и гепатопротектора ЛИВ.52 приводило к более быстрой и благоприятной динамике клинико-лабораторных показателей и позволяло проводить полноценное лечение туберкулезного процесса.
В 1 группе детей с туберкулезом легких, но без патологии печени (82 ребенка), дети также получали наряду с химиопрепаратами гепатопротектор ЛИВ.52 с целью профилактики токсических реакций со стороны печени. Более половины детей переносили специфическое лечение удовлетворительно, и никаких нарушений со стороны функционального состояния печени у них не отмечено. В процессе лечения только у 2 детей наблюдались жалобы на рвоту, тошноту, расстройство стула, связанные с погрешностью в диете.
Функциональные нарушения со стороны печени в процессе лечения отмечены у 18 (21,5%) детей. Эти нарушения характеризовались невыраженными симптомами печеночной интоксикации, жалобами на подташнивание после приема препаратов и незначительным снижением аппетита. Общее состояние ребенка при этом не страдало и оставалось удовлетворительным, увеличения печени не отмечалось. В биохимических показателях крови были выявлены незначительные повышения общего билирубина или трансаминаз. Одной из причин таких нарушений со стороны печени явился длительный прием рифампицина или одновременный прием изониазида, рифампицина и пиразинамида, при такой комбинации гепатотоксические реакции развивались достоверно чаще. Другой причиной был одновременный прием 5–6 ПТП с включением как основных (изониазид, пиразинамид и рифампицин), так и резервных препаратов (протионамид, аминосалициловая кислота, капреомицин и т. д.) у детей с лекарственно-устойчивым туберкулезом, особенно с высоким уровнем полирезистентности МБТ к ПТП (к 3–4-м и более препаратам).
В контрольной группе больных (50 детей), с активным туберкулезным процессом и не получающих ЛИВ.52 на фоне приема специфических антибактериальных препаратов, у детей в 30,0% случаев наблюдались расстройства со стороны ЖКТ в виде тошноты, рвоты, расстройства стула и снижения аппетита. В 26,0% случаев к окончанию лечения специфическими препаратами была выявлена патология со стороны желчевыводящих путей (дискинезия желчевыводящх путей, острый холецистит) и у 2 детей были выявлены признаки реактивного панкреатита.
Заключение
Вышеизложенное позволяет заключить, что своевременное выявление заболеваний печени и оптимальный подбор противотуберкулезных препаратов позволяют обеспечивать непрерывность терапии туберкулеза и достигать положительного эффекта в легких, а также стойкого восстановления функции печени при ее изменениях в анамнезе в течение от 1,5 до 2 месяцев. У детей с сопутствующей патологией печени гепатотоксические реакции развиваются чаще, чем у больных без таковых, однако проведение превентивной коррекции функции печени путем введения гепатопротектора ЛИВ.52 позволяет снизить частоту гепатотоксических реакций.
Гепатопротектор ЛИВ.52 способствует ускорению нормализации биохимических показателей крови (снижение показателей билирубина, трансаминаз и тимоловых проб до нормальных величин). Снижение активности щелочной и кислой фосфатаз приводит к нормализации функциональной активности печени и функции желчеобразования.
ЛИВ.52 хорошо переносится детьми, не вызывает неприятных ощущений. Его защитное (антиоксидантное) действие при применении ПТП является благоприятным фоном для проведения адекватной химиотерапии у детей как с патологией печени, так и без патологии.
Таким образом, химиотерапия туберкулеза в комплексе с гепатопротекторами позволяет добиться желаемого эффекта при лечении туберкулеза у детей без токсических проявлений со стороны желудочно-кишечного тракта. Препарат ЛИВ.52 не проявляет токсичности, не оказывает побочных эффектов и способствует как профилактике, так и лечению гепатотоксических реакций и дает возможность проводить полноценное (без перерыва) специфическое лечение туберкулезного процесса.
Литература
В. А. Аксенова, доктор медицинских наук, профессор
В. Г. Мадасова
НИИ фтизиопульмонологии, ММА им И. М. Сеченова, Москва

Актуальность проблемы. Лекарственно-индуцированные поражения печени (ЛИПП) при лечении туберкулеза заслуживают особого внимания в связи с тем, что в последние десятилетия наблюдается рост заболеваемости туберкулезом и распространение его не только среди асоциальных слоев общества как в мире [5], так и в Российской Федерации [2]. А также широкое распространение лекарственно-устойчивых форм микобактерий туберкулеза, достигающее в последние годы 47,5-54,2 %, что вынуждает фтизиатров назначать одновременно несколько противотуберкулезных препаратов, при том, что все они в той или иной степени гепатотоксичны и назначение их в комбинации усиливает этот эффект. Следствием такого положения является частое (до 70 %) развитие поражений печени и гепатобилиарного тракта, что обусловлено различными факторами (воздействием туберкулезной интоксикации; длительным приемом гепатотоксичных туберкулостатических препаратов хроническим алкоголизмом, употреблением наркотиков, наличием сопутствующих заболеваний) [4]. Данные о гепатотоксичности противотуберкулёзных препаратов достаточно противоречивы, поскольку это свойство связано не только с химическим строением препарата, но и с особенностями метаболических возможностей печени каждого больного, величиной печёночного кровотока, уровнем развития портокавальных анастомозов, степенью связывания препаратов белками плазмы [3]. Важной задачей в профилактике лекарственного гепатита, возникающего на фоне противотуберкулезной терапии (ПТТ), является применение фармакологической коррекции до возникновения его клинических проявлений, что невозможно без определения времени начала изменений биохимических показателей крови - маркеров цитолиза гепатоцитов. Учитывая высокую распространенность лекарственно-индуцированных поражений печени, разработка методов их профилактики и лечения является актуальной научной проблемой.
Цель исследования. Разработать современный комплексный метод мониторинга состояния печени у больных туберкулезом легких, получающих специфическую терапию. Исследовать гепатопротекторную активность таурина, и разработать рекомендации по профилактике и лечению лекарственно-индуцированных поражений печени.
Второй этап: сравнительное проспективное исследование в параллельных группах: в клиническом исследовании приняли участие 50 пациентов с туберкулезом легких, получающих специфическую терапию по 1 режиму. Контрольную группу составили 30 здоровых лиц, сопоставимых по полу и возрасту.
Третий этап: сравнительное проспективное исследование в параллельных группах: в клиническом исследовании приняли участие три группы пациентов по 20 человек с туберкулезом легких, получающих специфическую терапию по 1 режиму и дополнительно гепатопротекторные, антиоксидантные препараты или их комбинацию. Группу сравнения составили 20 больных туберкулезом, получающих специфическую терапию по 1 режиму, не получающих дополнительных гепатопротекторных средств, не отличающихся по полу и возрасту.
Материалы и методы. Для постановки диагноза гепатита и оценки функционального состояния печени применялся комплекс лабораторных исследований, включающий общий клинический анализ крови, общий анализ мочи, биохимические тесты: количественное определение общего билирубина и его прямой фракции, определение активности аланинаминотрансферазы (АлАТ), аспартатаминотрансферазы (АсАТ), щелочной фосфотазы (ЩФ), холестерина, триглицеридов (ТГ), концентрации белка и др. У всех больных методом иммуноферментного анализа (ИФА) определялись основные маркеры вирусных гепатитов. Обязательным условием включения пациента в исследование являлось отсутствие злоупотребления алкоголем в анамнезе и отрицательные результаты анализов на маркеры вирусных гепатитов. Оценивалась длительность пребывания больного в стационаре, выделение микобактерий после окончания курса химиотерапии. Переносимость лечения учитывалась при ежедневном опросе пациентов.
Статистическая обработка данных проводилась с помощью пакета статистических программ «Statistica 6.0 для Windows," с использованием непараметрического метода анализа с коэффициентом корреляции Спирмена [1].
Результаты ретроспективного анализа (I этап). На данном этапе были проанализированы истории болезни 250 пациентов с туберкулезом легких, находившихся на лечении в ВОКПД в 2007-2008 годах, с отрицательными результатами анализов на маркеры вирусных гепатитов и не злоупотребляющие алкоголем по анамнезу. Среди них 165 мужчин (66 %) и 85 женщин (34 %). Возраст больных от 15 до 73 лет (средний 38,9±6,6 лет). Преобладали пациенты с впервые выявленным туберкулезом легких, ранее не получавшие противотуберкулезные препараты - 231 пациент (92,4 %).
В зависимости от формы процесса и чувствительности микобактерии туберкулеза к антибактериальным препаратам больные получали лечение по стандартным режимам химиотерапии. 1-й режим - 166 человек (66,4 %), 2а - режим 12 человек (4,8 %), 2б режим - 52 человека (20,8 %), 3-й режим - 8 человек (3,2 %), 4-й режим - 12 человек (4,8 %).
Функциональные показатели оценивались ежемесячно по данным биохимических анализов крови (АлАТ, АсАТ, общий билирубин, тимоловая проба), входящих в стандарт обследования больных туберкулезом легких. Были выявлены достоверные гендерные различия в скорости развития цитолитического синдрома. Так, вне зависимости от схемы лечения у женщин наблюдался более выраженный подъем уровня АлАТ за первый месяц терапии - на 60 %, при этом у мужчин подъем составил 30 % от исходного уровня. Уровень АсАТ у женщин повысился на 28,5 %, у мужчин - на 21 %. Тимоловая проба возросла у женщин - на 22,8 %, у мужчин - на 12,8 %. Оценивалась также разновидность поражения печени на основании расчета коэффициента R (cоотношение АлАТ / щелочная фосфатаза). При 1 и 2-м режимах терапии преобладали гепатоцеллюлярные типы поражения печени (при значениях коэффициента R>5). При третьем режиме терапии преобладали комбинированные типы (2 0,05

Лекарственные поражения печени (ЛПП) являются одной из серьезных проблем в гепатологии. На долю медикаментозных поражений печени приходится до 9,5% всех регистрируемых побочных реакций и в 15% случаев они заканчиваются летальным исходом. На долю возникновения желтухи приходится 2-6%, а острых гепатитов - 10-20% случаев побочных эффектов [1]. Во фтизиатрии их частота составляет от 15 до 20% и обусловлена необходимостью применения полихимиотерапии в лечении туберкулеза, создающей высокую медикаментозную нагрузку на гепатоциты, осуществляющих метаболизм лекарственных препаратов [5,9,16]. Наиболее часто эффекты встречаются в группах риска, это, прежде всего, пациенты, страдающие патологией печени, принимающие одновременно несколько лекарственных средств (ЛС). Побочные эффекты в 0,2-5% случаев являются причиной летальных исходов, причем четверть смертей в стационаре связана с медикаментозными осложнениями [11].
В основе патогенеза ЛПП лежат нарушения функций митохондрий, развивается тканевой гипоксия с истощением запасов АТФ, избыточным образованием свободных радикалов и активизацией перекисного окисления липидов (ПОЛ) с последующим повреждением клеточных мембран (цитоплазматической, митохондриальной) [15], делая оправданным применение лекарственных препаратов с антигипоксантным и антиоксидантным действием [10,117]. Поражение печени провоцирует появление токсичности лекарственного средства, поскольку снижается интенсивность его метаболизма, нарушается детоксикационная функция печени, возрастает количество свободных радикалов с активацией реакций ПОЛ. На фоне падения синтеза альбуминов возрастает токсичность ЛС, в норме обладающих высоким уровнем связывания с белками плазмы [12].
Преимущества сукцината (ЯК) в скорости окисления над другими субстратами клеточного дыхания наиболее выражено в условиях гипоксии, когда НАД-зависимый транспорт электронов дыхательной цепи тормозится, а активность сукцинатдегидрогеназы и продукция эндогенного сукцината возрастает [10].
Сукцинатсодержащим антиоксидантом/антигипоксантом является раствор ремаксола, усиливающий скорость анаэробного гликолиза, при этом обеспечивается поставка готового НАД + и уменьшаются проявления жировой дистрофии гепатоцитов - морфологического проявления ЛПП [3].
Материал и методы
14 (23,3%) пациентов составили подгруппу, где в качестве сопутствующей патологии определялся хронический вирусный гепатит С (ПГ1).
Больным (70,6%) при лечении специфического процесса использовался 1-й или 3-й режимы химиотерапии с применением препаратов основного ряда - изониазида, рифампицина, стрептомицина, пиразинамида, этамбутола. В остальных случаях применялись режимы 2Б/4 (при наличии предполагаемой или доказанной устойчивости к препаратам основного ряда), а также индивидуальный режим (при явлениях непереносимости основных препаратов), которые требовали назначения резервных препаратов - канамицина, протионамида и фторхинолонов.
Ремаксол применялся курсом в течение 10 дней по 400мл один раз в день внутривенно капельно медленно. Эффективность гепатопротекторной терапии оценивалась по динамике клинических проявлений лекарственной гепатотоксичности, активности индикаторных цитолитических печеночных ферментов и биохимических маркеров синдрома холестаза (с оценкой протеинограммы и типов адаптационных реакций организма). Значимыми считали изменения активности биохимических показателей более чем на 10% от исходного уровня.
Обсуждение результатов
До начала терапии клинические проявления ЛПП определялись у 18 (29,5%) больных (из них - 6,6% больных с ВГ). Доминирующим синдромом был диспепсический (тошнота, рвота, боли и тяжесть в правом подреберье, чувство горечи во рту) - у 23,0% обследованных. В 13,1% случаев он протекал изолированно, в 6,6: - сочетался с астеновегетативным, а в 3,3% - с гепатомегалией. Астеновегетативный синдром (резкая слабость, утомляемость) регистрировался у 9,9% пациентов, в 3,3% он протекал изолированно, в остальных случаях сочетался с диспепсическим.
Исчезновение клинических проявлений ЛПП отмечалось на 3-й день (диспепсический синдром), на 5-6-й день (астеновегетативный синдром), на 8-й день (гепатомегалия). У больных с сопутствующим ВГ сроки купирования клинической симптоматики не отличались.
До начала лечения активность АлАТ в основной группе была повышена в 4,5 раза, а у больных ПГ1 - в 5,4 раза по сравнению с нормой.
По окончании терапии (основная группа больных) снижение на 61,5% от исходного уровня активности АлАТ наблюдалось у 84,8% больных. У 10,9% пациентов отмечено повышение показателя на 76,7% от исходного, а у 4,3% пациентов за время терапии активность фермента не менялась. У больных с сопутствующим вирусным поражением печени (ПГ1) активность АлАТ снизилась на 31,1% у 57,1% пациентов.
Нормализация активности АлАТ после курса терапии (основная группа больных) наблюдалась у 47,8% пациентов, а у 15,2% обследованных показатель не превышал величины 2-х максимальных норм (2N). У больных ПГ1 активность ферментов нормализовалась только в двух (14,2%) случаях. Активность АсАТ изначально повышена в 3,1 раза у 69,2% больных основной группы.
По окончании терапии активность фермента у 77,7% больных основной группы снизилась на 45,5% от исходного уровня. У 8,3% пациентов показатель увеличился на 110%, а у 14% - оставался без изменений. У больных ПГ1 в 57,1% случаев отмечено снижение (на 25,4%) активности АсАТ, а у 14,3% показатель увеличился на 49,3%, в 28,6% оставался без изменений.
Нормализация активности АсАТ по окончании лечения отмечалась у 38,8% больных, ау 41,7% - не превышала уровня 2N. У больных с ВГ нормализации активности фермента отмечено не было, а уровень 2N достигнут в 28,6% случаев.
Средние значения коэффициента де Ритиса, отражающего соотношение активности биохимических маркеров цитолиза, у наблюдаемых больных были в 2,4 раза ниже нормальных значений (рис.1). К окончанию лечения у больных основной группы коэффициент нормализовался (0,9±0,09), у больных ПГ1 он составил 0,67±0,08.
Рис. 1. Средние значения коэффициента де Ритиса у обследованных больных
Увеличение (на 18,6%) коэффициента де Ритиса к 6-му дню лечения наблюдалось у 54,8% больных основной группы, у 13% пациентов показатель не менялся. По окончании терапии показатель возрос (на 55,6%) у 76,0% больных, в то время как у больных ПГ1 его рост наблюдался только в 42,9% случаев.
До начала терапии гипербилирубинемия отмечалась у 9,7% обследованных больных основной группы, и у 3,2% больных 2-й . По окончании терапии у больных основной группы ее частота снизилась до 6,6%, а у больных ПГ1 после окончания терапии гипербилирубинемии не наблюдалось (табл. 1).
Таблица 2. Значения маркеров холестаза у наблюдаемых больных

Дата публикации: 19.01.2018 2018-01-19
Статья просмотрена: 1576 раз
Среди ПР при туберкулезе легких особое место занимает поражение печени [5, с.357; 7, с.17; 2, c.68], Туберкулезная инфекция создает предпосылки для поражения печени, угнетая ферментативную активность и гликогенобразование [3, с.5; 9, с.280], вызывая различного вида морфологические изменения [8,40]. Побочные реакции со стороны печени наблюдаются у 11–46,5 % больных туберкулезом. [9, с.15; 10, с.16],
Клинико-лабораторная характеристика состояния печени до химиотерапии трудна, так как изменения в печени, вызванные самим туберкулезным процессом, наслаиваются на изменения, обусловленные возможными последствиями перенесенного вирусного гепатита [6, с.19; 4, с.12].
С целью изучения состояния печени у больных с туберкулезом легких при побочных реакциях проведено наблюдение и комплексное обследование 226 больных туберкулезом легких, находившихся на лечении в терапевтических отделениях клиники РСНПМЦФиП 2001–2011 гг. Для оценки функционального состояния печени определяли в крови активность ферментов: аспартатаминотрансферазы — АсТ (N — 0,43±0,05 ммоль/ч.л.) и аланинаминотрансферазы — АлТ (N — 0,20±0,03 ммоль/ч.л.) методом S.Rautman — S.Frenkel (1957); холинэстеразы методом В. Г. Колба (1972; N — 74,98±10,15мкм/ч.л.), содержание общего билирубина и его фракций методом Йендрашека (1972; N — 7,4±0,25 мкмоль/л). [1 ,с.180],
Из общего числа обследованных мужчин было 111 (49,1 %), женщин — 115 (50,9 %) в возрасте от 17 до 65 лет. Инфильтративный туберкулез легких установлен у 134 (59,2 %) больных, фиброзно-кавернозный туберкулез легких у 30 (13,3 %), кавернозный и диссеминированный туберкулез легких 18 (8 %). Впервые выявленных больных было 194 (85,8), т. е. абсолютное большинство, ранее леченых — 32 (14,1 %).
Сопутствующие заболевания выявлены у 177 (77,8) больных: ХОБЛ — у 31 %, анемии — у 33,8±3,1 %, заболевания ЖКТ и печени — у 11,3 %, сахарный диабет — у 19,7 %.
В процессе химиотерапии побочные реакции отмечены у 145 больных (64,5 %). В своей работе мы применяли по синдромную классификацию побочных реакций от противотуберкулезных препаратов [9, с.31]. Частота и характер ПР представлены на рис. 1.
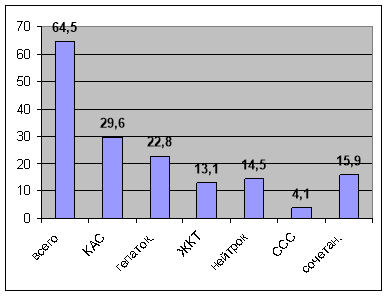
Рис. 1. Частота и характер побочных реакций от противотуберкулезных препаратов у больных туберкулезом легких
Как видно из рис 1, побочные реакции со стороны печени отмечены у 33 (22,8±3,4 %) больных.
Анализ характера клинических симптомов поражения печени при гепатоксических реакциях (рис.2) показывает преобладание диспепсического синдрома.
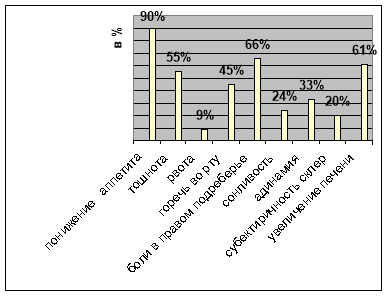
Рис 2. Клинические симптомы гепатотоксических реакций у больных туберкулезом легких
С целью установления взаимосвязи частоты и характера отдельных синдромов ПР с поражением печени и почек было изучено динамика нарушений функции печени на основе определения индикаторных ферментов в крови и моче.
Характеризуя функциональное состояние печени у больных нужно, прежде всего, отметить, что сама туберкулезная интоксикация сопровождается интоксикационным синдромом. Печень при этом обеспечивает удаление из крови продуктов микробных и поврежденных клеток, а также обезвреживание эндогенных метаболитов.
Кроме того, необходимо учитывать локализацию ферментов АсТ и АлТ в субклеточных структурах. Известно, что АсТ значительно в большей степени связана с митохондриями и ядерными структурами, чем АлТ, которая сосредоточена в гиоплазме. Поэтому АлТ легче попадает в кровь, и повышение ее активности при повреждении клеток печени определяется раньше.
Коэффициент Де Ритиса у всех больных особенно с гепатоксическими реакциями, был меньше 1,0, билирубиновый показатель также не превышал 50 %, что указывает на наличие нарушения на уровне мембраны гепатоцитов.
Функциональное состояние печени убольных туберкулезом при развитии побочных реакций от противотуберкулезных препаратов
Читайте также:


