Окраска по граму при туберкулезе
Консультант по гематологии,
цитохимии и микробиологии
Важное место в общем комплексе клинико-лабораторных исследований, применяемых для профилактики, диагностики и лечения гнойно-воспалительных заболеваний и осложнений у больных в лечебно-профилактических учреждениях занимают микробиологические исследования. Современная клиническая медицина предъявляет к микробиологическим (бактериологическим) исследованиям возрастающие требования по увеличению объема, повышению качества исследований, разработке и внедрению новых более совершенных методов. Это связано как с новыми научными достижениями в области эпидемиологии и бактериологии, так и с увеличением гнойно-воспалительных заболеваний, ростом госпитальных инфекций.
Материалом для изучения этиологии заболеваний дыхательных путей служат: отделяемое зева и носа; мокрота; содержимое бронхов, полученное при бронхоскопии или при отсасывании через трахеостому (у больных, находящихся на аппаратном дыхании); экссудаты; резецированные ткани и др. Материал собирают с соблюдением правил асептики в предварительно простерилизованные баночки или пробирки и доставляют в лабораторию. Хранение материала способствует размножению сапрофитирующей микрофлоры, развитию процессов гниения и брожения, что искажает результаты анализа. Интервал между взятием материала и его посевом не должен превышать 1-2 часа. Самым простым методом выявления микобактерий туберкулеза в выделениях больных является микроскопия мазка, приготовленного из мокроты. При бактериоскопии мазка, окрашенного по Цилю-Нильсену, микобактерии туберкулеза могут быть обнаружены при наличии не менее 100 000 - 1 000 000 бактериальных клеток в 1 мл патологического материала (мокроты). Такое большое количество микобактерий встречается у больных с далеко зашедшими прогрессирующими формами заболевания (диссеминированными и фиброзно-кавернозными). У значительно большего числа больных количество выделяемых ими микобактерий ниже предела метода бактериоскопии.
Чувствительность метода люминесцентной микроскопии значительно выше - от 10 000 до 100 000 микобактерий в 1 мл материала, кроме того, этот метод дает возможность за значительно более короткое время просмотреть необходимое количество препаратов. Эффективность бактериоскопии повышается также при передаче изображения на компьютер при помощи присоединенной к микроскопу видеокамеры.
Чтобы диагностировать туберкулез, необходимо сделать все возможное для выявления возбудителя заболевания. Микробиологически диагноз может быть подтвержден на основе результатов культурального исследования на комплекс M. tuberculosis (или, при возможности, путем идентификации специфических последовательностей нуклеиновых кислот) в пробах, взятых в месте локализации патологического процесса. Однако на практике в настоящее время многие лаборатории не располагают материально-технической базой для проведения культуральных исследований. К счастью, микроскопия окрашенных препаратов мокроты доступна практически везде, поэтому диагностика туберкулеза может проводиться на основе выявления кислотоустойчивых микобактерий. На территориях с высокой распространенностью туберкулеза выявление кислотоустойчивых микобактерий в окрашенных препаратах мокроты демонстрирует высокую специфичность, поэтому положительный результат микроскопии мокроты можно рассматривать как подтверждение диагноза. Кроме высокой специфичности к комплексу M. tuberculosis, выявление кислотоустойчивых микобактерий при микроскопии играет важную роль по трем причинам: это – наиболее быстрый метод диагностики туберкулеза; позволяет выявить больных с тяжелым развитием патологии, чреватым высоким риском летального исхода; дает возможность выявить больных, являющихся распространителями инфекции.
Оценка качества работы лабораторий микроскопии должна проводиться соответствующим государственными органом (как правило, представителями национальной программы борьбы с туберкулезом).
Неправильный диагноз, поставленный перед началом лечения, приводит к риску ненужного, неправильного или неудачного лечения. Более того, подобный подход чреват несвоевременной постановкой правильного диагноза и назначением соответствующего лечения. При надлежащем подходе и контроле в большинстве случаев у детей в возрасте пяти лет и старше могут быть получены образцы мокроты. У подростков (хотя они часто относятся к детской возрастной группе, по крайней мере, до 15 лет) получить пробы мокроты не составляет большого труда. Поэтому фактор возраста не может рассматриваться как препятствие для сбора проб мокроты у детей и подростков.
Исходя из имеющихся данных, можно прийти к заключению, что для диагностики туберкулеза необходимо взять не менее двух проб мокроты. В случаях, когда имеются соответствующие возможности, можно направлять для лабораторного исследования еще и третью пробу, но исследование более трех проб мокроты вряд ли целесообразно, поскольку не может в значительной мере повысить эффективность диагностики. Кроме того, исследование третьей пробы может оказаться полезным только для подтверждения диагноза, если одна или две предыдущие пробы дали положительный результат. Крайне желательно, чтобы результаты микроскопии мокроты направлялись лечащему врачу в течение одного рабочего дня с момента отправки проб. Не меньшее значение имеет также и время сбора проб. Результаты исследований показывают, что эффективность лабораторных анализов максимальна, если пробы мокроты получены утром, после пробуждения от ночного сна. Возможно, совершенно необязательно собирать только утренние пробы, но, про крайней мере, одна из них должна быть получена утром.
Как правило, внелегочные очаги туберкулезного процесса содержат гораздо меньшее количество M. tuberculosis, поэтому микроскопическое выявление кислотоустойчивых микобактерий в пробах из внелегочных очагов весьма затруднено, и в таких случаях результаты культуральных исследований приобретают большое значение. Учитывая низкую результативность микроскопии, при внелегочном туберкулезе культуральные и морфологические исследования приобретают особое значение, например, в диагностическом исследовании проб ткани лимфатических узлов, полученных при помощи игловой биопсии.
Лечение пациентов, у которых наблюдаются тяжелое или быстро развивающееся заболевания, ассоциированные с туберкулезом, необходимо начинать немедленно, даже до лабораторного подтверждения диагноза. Лечение следует начинать до получения результатов лабораторного исследования и лишь позднее внести необходимые поправки и изменения в схему лечения с учетом результатов микроскопии.
Хотя микроскопия мокроты является наиболее доступным бактериологическим тестом, там, где ресурсы позволяют и имеются условия для качественной лабораторной диагностики, в диагностический алгоритм необходимо включать культуральные исследования мокроты, в случаях отрицательных результатов микроскопии. Правильное проведение культуральных исследований связано с определенными трудностями и дополнительными затратами, но этот метод отличается более высокой чувствительностью и повышает вероятность раннего выявления больных туберкулезом.
Микроскопия мазков мокроты по Циль-Нильсену является важнейшим элементом диагностики туберкулеза. Исследование 3 мазков мокроты позволяет выявить более 60% случаев туберкулеза легких и 95% наиболее заразных случаев (исследование одного мазка мокроты выявляет 75% наиболее заразных случаев, исследование второго мазка мокроты добавляет еще 20%, а исследование третьего - еще 5%).
Микроскопия мазков мокроты по Циль-Нильсену позволяет быстро получить результаты, выявить основные источники инфекции, является менее дорогостоящей, чем посев мокроты и широко доступна для применения. Но она должна быть надежной и хорошо контролироваться. Вероятность обнаружения МБТ при бактериоскопии мазков мокроты прямо пропорциональна концентрации возбудителя в исследуемом материале. Например, когда в 1 мл мокроты содержится от 1000 до 10000 МБТ, то вероятность получения положительного результата составляет около 40-50%. При концентрации МБТ менее 1000 в 1 мл мокроты вероятность их обнаружения резко снижается – отрицательные результаты получаются примерно в 96% случаев.
Основным и наиболее часто изучаемым биоматериалом в пульмонологической практике является мокрота. Требования к забору и качеству мокроты следующие:
1) первую пробу мокроты желательно получить до начала курса антибиотикотерапии;
2) мокроту оптимально собирать утром, до приема пищи, после тщательного туалета полости рта (полоскание кипяченой водой);
3) больным нужно доступно объяснить, что требуется получить именно содержимое нижних отделов дыхательных путей, а не ротоглотки, и, по возможности, проконтролировать их действия;
4) забор материала проводить в стерильные интактные контейнеры;
5) продолжительность хранения мокроты в контейнерах не должна превышать 2 ч (в летнее время желательно не более 1 ч);
6) в условиях лаборатории качество мокроты оценивается после окрашивания мазка по Граму (при наличии в мазке менее 25 лейкоцитов и более 10 эпителиальных клеток, при просмотре не менее 8-10 полей зрения при малом увеличении, мокрота признается некачественной, дальнейшее ее исследование нецелесообразно, так как, скорее всего, материал получен из ротовой полости);
7) высокая диагностическая ценность исследования признается при выделении возбудителя в концентрации і106 КОЕ/мл.
Вообще, в диагностике заболеваний туберкулезом можно выделить несколько этапов:
· Преаналитический этап (предварительный диагноз, выбор материала и метода исследования, забор биомтериала и его транспортировка)
· Аналитический этап (непосредственно проведение анализа)
· Постаналитический этап (оценка результатов)
Часть этих этапов проводится вне лаборатории, поэтому очень важна согласованная и качественная работа всех специалистов, привлеченных в этот процесс. Важен правильный выбор исследуемого материала. Важным этапом диагностики являются процедуры взятия и доставки материала в лабораторию.При взятии всех видов исследуемого материала следует ориентироваться на стандартные системы для этой цели: тампоны, цитощетки, тубсеры, контейнеры и т.п. Эффективность аналитического этапа во многом определяется уровнем технического оснащения лабораторий. Постаналитический этап исследования включает две составляющие: проверку достоверности полученного результата и оценку этиологической значимости выделенных штаммов. В лаборатории должен осуществляться строгий внутренний контроль качества исследований, важной составляющей которого является проверка полученных результатов на достоверность. Оценка этиологической значимости выделенных микроорганизмов принципиальна для выбора адекватной терапии. Процедура приготовления мазков начинается с подготовки предметных стекол. Необходимо использовать только новые, отмытые и обезжиренные в спирте или смеси для обезжиривания предметных стекол (производство АБРИС+) стекла без царапин и сколов. При повторном использовании стекла могут быть недостаточно хорошо отмыты от предыдущего материала, что может привести к получению ложноположительных результатов. Не рекомендуется использовать саморезанные стекла, которые приводят к значительным аберрациям исследуемого изображения. Стекла должны соответствовать ГОСТу. Стекла, на которых при микроскопическом исследовании были обнаружены кислотоустойчивые микобактерии, сохраняются в лаборатории в течение 1 года, а затем подлежат обязательному уничтожению и не должны использоваться повторно. Новые предметные стекла кипятят 15 минут в 1% растворе питьевой соды (10 г двууглекислого натрия на 1 л воды), промывают в 1% растворе соляной кислоты (к 1 л воды добавляют 10 мл концентрированной соляной кислоты), а затем промывают в проточной воде и протирают насухо.
Фиксированный мазок окрашивается генцианвиолетом 1-2 минуты
Обесцвечивание спиртом до 30 секунд
Докраска водным фуксином 1-2 минуты
грамположительные бактерии имеют в составе клеточной стенки толстый слой пептидогликана и не успевают за 30 секунд обесцветиться спиртом – остаются синими
грамотрицательные бактерии имеют в составе клеточной стенки тонкий слой пептидогликана, успевают обесцветиться спиртом и докрашиваются водным фуксином – становятся красными (розовыми)
Окраска по Цилю-Нильсену Этапы:
на фиксированный мазок кладут фильтровальную бумагу и наливают на неё карболовый фуксин (фуксин Циля)
прогревают над пламенем до появления парения (трижды)
охлаждают стекло с мазком
обесцвечивают серной кислотой (1% – для выявления спор; 5% – для идентификации микобактерий туберкулеза)
докрашивают метиленовой синькой 3-5 минут
споры и микобактерии туберкулеза не окрашиваются анилиновыми красителями в обычных условиях – для их окраски используют термо-кислотное протравливание (фуксин Циля содержит карболовую кислоту), в результате которого они окрашиваются в красный цвет
одновременно споры и микобактерии туберкулеза являются кислотоустойчивыми и не обесцвечиваются серной кислотой; вегетативная же часть клетки, а также все другие бактерии, кроме микобактерий туберкулеза, обесцвечиваются кислотой
все, что обесцветилось кислотой на предыдущем этапе (вегетативные клетки, все бактерии, кроме микобактерий туберкулеза) окрашивается метиленовой синькой в синий цвет, а споры и микобактерии туберкулеза остаются красными.
Основные отличия прокариотической клетки от эукариотической. Форма и размеры истинных бактерий.
Наличие внутриклеточных мембранных структур
Спирально закрученные белковые субъединицы
По форме и размерам истинные бактерии можно разделить на следующие группы:
А. Кокки (круглые бактерии), имеют размер около 1 мкм
1. Стафилококки – располагаются группами, схожими с гроздьями винограда
2. Стрептококки – располагаются цепочками
3. Диплококки – располагаются попарно (пнемнококки, энтерококки, гонококки и менингококки)
Б. Палочки (бактерии цилиндрической формы)
I. Спорообразующие (палочки средних и крупных размеров, т.е. порядка 10 мкм)
1. Бациллы (споры не превышают диаметр клетки)
2. Клостридии (споры превышают диаметр бактериальной клетки)
1. Коккобактерии (по размеру схожие с кокками)
б. Бордетеллы (возбудители коклюша)
в. Бруцеллы (возбудители бруцеллеза)
г. Франциселлы (возбудители туляремии)
д. Yersinia pestis (возбудитель чумы)
2. Прямые (по размеру – мелкие и средние, т.е. до 5-7 мкм)
3. Изогнутые (аналогичные по размерам прямым)
а. Имеющие один изгиб и похожие на запятую – вибрионы
б. Имеющие три-четыре изгибы и похожие на детский рисунок летящей чайки – кампилобактеры и геликобактеры
4. Ветвящиеся и склонные к ветвлению (по размеру схожие со спорообразующими)
а. Актиномицеты (возбудители актиномикоза)
б. Микобактерии (возбудители, например, туберкулеза)
в. Коринебактерии (возбудители дифтерии)
В. Извитые (очень тонкие и очень длинные) – спирохеты
1. Трепонемы (возбудители сифилиса)
2. Лептоспиры (возбудители лептоспироза)
3. Боррелии (возбудители возвратных тифов).
Г. Бактерии, не имеющие определенной формы вследствие отсутствия клеточной стенки – микоплазмы
Структура бактериальной клетки. Клеточная стенка: функции и типы строения. Дефектные формы бактерий.
Бактериальная клетка имеет обязательные структуры, без которых её функционирование невозможно, и может иметь структуры, наличие которых зависит от стадии развития бактерий, а также от их принадлежности к тому или иному морфовару.
К обязательным структурам бактериальной клетки относятся:
Нуклеоид – представляет собой двухцепочечную, циркулярно замкнутую, суперспирализованную молекулу ДНК
Цитоплазма – аналогична цитоплазме эукариотических клеток
Рибосомы – имеют иной, нежели рибосомы эукариот, молекулярный вес
Цитоплазматическая мембрана – аналогична таковой у эуариот, но в отличие от последних, не содержащая стеринов (они содержаться в ЦПМ только у микоплазм)
Клеточная стенка (отсутствует полностью лишь у микоплазм)
К необязательным структурам относятся:
Включения – например, включения волютина (полиметафосфатов, запаса питательных веществ) у коринебактерий дифтерии
Плазмиды – аналогичные нуклеоиду молекулы ДНК, но значительно меньшего размера, несущие дополнительную наследственную информацию
Пили – короткие полые белковые трубочки, играющие роль адгезинов, а также (особые их виды) служащие средством передачи плазмид из одной бактериальной клетки к другой
Клеточная стенка выполняет следующие основные функции – формообразующую и защитную (прежде всего от осмотического давления, которое внутри грамположительных бактерий достигает 30 атм.).
Различают два типа строения клеточной стенки:
Грамположительная клеточная стенка – содержит толстый слой пептидогликана (полисахаридных цепей, соединенных пептидными мостиками), пронизанного тейхоевыми кислотами и вплотную прилегающего к цитоплазматической мембране
Грамотрицательная клеточная стенка – содержит тонкий слой пептидогликана, отделенного от цитоплазматической мембраны периплазматическим пространством, и так называемой наружной мембраны, основным компонентом которой является липополисахарид.
Грамположительную клеточную стенку имеют кокки (за исключением гонококков и менингококков), спорообразующие и ветвящиеся или склонные к ветвлению палочки, а также листерии (возбудители листериоза). Все остальные бактерии (кроме, разумеется, микоплазм) имеют грамотрицательную клеточную стенку.
Если бактерии по тем или иным причинам (например, под действием антибиотиков) теряют клеточную стенку, то они превращаются в дефектные формы: сферопласты (частично потерявшие клеточную стенку) или протопласты (потерявшие её полностью). При этом они сохраняют способность к метаболическим процессам, но не к делению.
Дефектные формы бактерий, сохранившие способность к делению, называются L-формами бактерий.
Защитные приспособления бактерий: спора и капсула. Жгутики бактерий, классификация бактерий по числу и расположению жгутиков.
Спора защищает бактерии от неблагоприятных физико-химических факторов внешней среды (высушивание, температура, рН и т.п.), а также образуется при истощении питательной среды. При этом спора значительно превосходит вегетативную клетку по своей устойчивости к неблагоприятным факторам внешней среды благодаря особенностям своего химического состава.
Спорообразующие бактерии образуют спору только во внешней среде, так как находясь внутри человеческого организма нужде в ней не испытывают.
Сказанное относится в эндоспоре (которая в единственном числе образуется внутриклеточно у бацилл и клостридий). Актиномицеты внеклеточно образуют многочисленные экзоспоры, основная функция которых – размножение.
Капсула защищает бактерии от фагоцитов и антител и поэтому образуется только внутри человеческого организма.
Чтобы бактерии, способные образовывать капсулу, образовали её на искусственных питательных средах, необходимо в последние добавить сыворотку или кровь. Единственно клебсиеллы (один из родов энтеробактерий) образует капсулу на простых искусственных питательных средах.
Жгутики служат органами движения бактерий (у спирохет эту функцию выполняет осевая нить, состоящая, как и жгутики, из сократительного белка флагеллина).
По числу и расположению жгутиков бактерии классифицируются следующим образом:
Монотрихи – имеют один жгутик (чаще – на полюсе клетки)
Политрихи – имеют более одного жгутика
Лофотрихи – имеют один пучок жгутиков (чаще – на полюсе клетки)
Амфитрихи – имеют два жгутика (или два пучка жгутиков) на противоположных полюсах клетки
Перитрихи – имеют множество жгутиков по всему периметру клетки
Атрихи – не имеют жгутиков.
Обмен веществ и энергии у микробов: особенности метаболизма бактерий и вирусов, особенности метаболизма риккетсий, хламидий, микоплазм.
Особенности метаболизма бактерий:
для синтеза основных химических соединений могут использовать любые источники
исключительно высокая скорость метаболических процессов
исключительно высокая адаптационная способность бактериальной популяции к меняющимся условиям окружающей среды
Вирусы не обладают собственным метаболизмом – для своей жизнедеятельности они используют метаболические потенции клетки-хозяина (поэтому могут реплицироваться только внутриклеточно).
Особенности метаболизма некоторых бактерий:
Риккетсии – не способны синтезировать некоторые макромолекулы и вынуждены брать их у клетки-хозяина в готовом виде (поэтому, как и вирусы, относятся в облигатным внутриклеточным паразитам)
Хламидии – обладают теми же особенностями метаболизма, что и риккетсии, но в дополнение к этому не способны синтезировать АТФ (поэтому их называют еще “энергетическими паразитами”)
Микоплазмы – патогенные виды не могут синтезировать нужные им для построения цитоплазматической мембраны стерины и берут их в готовом виде из мембраны клетки-хозяина (поэтому их называют “мембранными паразитами”).
Типы питания у бактерий: способы переноса питательных веществ через мембрану; классификации бактерий по источнику углерода, источнику и путям получения энергии, донорам электронов. Классификация бактерий по потреблению кислорода. Классификация бактериальных ферментов.
Способы переноса питательных веществ через мембрану у бактерий
А. Не требующие для своего осуществления затрат энергии, так как перенос питательных веществ происходит по градиенту их концентрации (т.е. их концентрация вне клетки выше, чем внутри клетки):
Облегченная диффузия (с помощью пермеаз – специальных белков)
Б. Происходящие с затратой энергии, так как перенос питательных веществ осуществляется против градиента концентрации:
Активный транспорт (с помощью пермеаз)
Транслокация химических групп (если при активном транспорте происходит временная химическая модификация переносимого субстрата – например, фосфорилирование)
Классификация бактерий по источнику углерода:

Окраска по Цилю-Нильсену – это один из методов, используемый для обнаружения при исследовании анализов больного различных заболеваний. В случае изучения мокроты пациента на предмет наличия возбудителей, к примеру, туберкулеза широко используется данный метод. В этой статье пойдет речь о нюансах его проведения, а также о некоторых аналогичных методах.
Область применения метода
Этот метод окрашивания используется в тех случаях, когда необходимо выявить в образце кислотоустойчивые микроорганизмы, к которым относятся возбудители туберкулеза, проказы и микробактериозов. Такие бактерии характеризуются, прежде всего, медленной скоростью роста, общими морфологическими особенностями, а также устойчивостью к кислотам и некоторым другим химическим веществам. Из-за последнего свойства такие бактерии плохо поддаются окраске обычными разведенными красителями. Для окрашивания таких бактерий на препарат наносится и в дальнейшем поджигается фуксин Циля, причем полученная окраска не исчезает под воздействием спирта и кислот.

Необходимые реактивы и оборудование
Для проведения окраски образца по методу Циля-Нильсена необходимы следующие реактивы:
- Метиленовый синий с 10%-ным содержанием спирта;
- Раствор солянокислого спирта;
- Фуксин Циля, состоящий из фенола, фуксина и этилового спирта в количестве 50 г, 10 г и 10 г соответственно.
Также потребуется следующие инструменты:
- Газовая горелка;
- Часы для слежения за временем;
- Вода;
- 96%-ный этиловый спирт;
- Перчатки.

Ход процедуры
Окрашивание по методу Циля-Нильсена состоит из следующих этапов:
- На мазок, находящийся на предметном стекле, накладывается фильтровальная бумага, на которую затем наносится небольшое количество фуксина Циля.
- Затем предметное стекло нагревается до появления характерного пара. После появления пара стеклу нужно дать остыть. Затем нужно повторить эту процедуру еще 2 раза, а затем дать подогретому мазку остыть.
- После этого нужно смыть фуксин с приборного стекла, предварительно убрав бумагу, с помощью дистиллированной воды.
- Затем стекло помещается в раствор соляной или серной кислоты до полного обесцвечивания.
- Наконец, на обесцвеченный препарат наносится раствор метиленового синего. Стекло промывается дистиллированной водой и высушивается для дальнейшего исследования образца под микроскопом.
Липиды, которые содержатся в клеточной стенке кислотоустойчивых бактерий, хорошо удерживают цвет основного красителя. В некислотоустойчивых бактериях стабильно удерживается цвет как основного красителя, так и дополнительного.
Показания к применению метода
При подозрениях на туберкулез исследуется мокрота больного. Длительный кашель с обильными выделениями является показанием для проведения подобного исследования. Визуально наличие возбудителей туберкулеза в организме может выдать мокрота характерной жидкой, пенистой консистенции и признаками гноя, а также мокрота, смешанная с кровью. Обнаружение возбудителей туберкулеза – рисовидных телец, известных также как линзы Коха, облегчается при использовании методов окраски образца. Таких как вышеописанный метод Циля-Нильсена или метод Грама, суть которого будет описана ниже.
Метод Грама
Окраска препарата по методу Грама проводится следующим образом:
- Сперва препарат обрабатывается раствором Люголя на протяжении минуты;
- Затем препарат обесцвечивается с использованием спирта;
- Наконец, препарат промывается с использованием воды и дополнительно окрашивается фуксином.
Классификацию бактерий на грамположительные и на грамотрицательные можно наглядно увидеть при проведении подобной окраски. Первый тип бактерий окрашивается в темно-фиолетовый цвет, тогда как второй тип – в красный цвет. Исходя из такой классификации, можно судить о химическом составе клеточной стенки бактерии и о других ее характерных свойствах.
Заключение
Анализ мокроты пациента является жизненно необходимым для своевременного выявления заболеваний, затрагивающих дыхательные пути, в том числе и туберкулеза. Окрашивание по методу Циля-Нильсена помогает выявить микроорганизмы и возбудители подобных болезней. В том числе и в случаях, когда речь идет об атипичных бактериях. Тем самым позволяет производить более точную и качественную диагностику подобных болезней.
Если вы сталкивались с подобными заболеваниями, знакомы с техниками исследования анализов больного на предмет наличия в них возбудителей инфекции или же у вас есть вопрос по теме, вы можете оставить свой комментарий.
Родовое название Mycobacterium (грибовидные бактерии) предложено Леманом и Нойманом в 1896 г., обративших внимание на плесневидную пленку, которая образуется при росте туберкулезной палочки на поверхности жидких сред (аэробы!). Вскоре коллекция микобактерий была дополнена видами, изолированными из внешней среды. Оказалось, что именно свободно живущие сапрофиты составляют большинство этой своеобразной группы прокариот, а истинно паразитические микобактерии представлены всего несколькими видами, патогенными для человека и животных. Впрочем, известную опасность представляют и некоторые микобактерии-сапрофиты (рис. 1). Они вызывают оппортунистические инфекции (микобактериозы) у иммунокомпрометированных лиц, а при заражении в раннем детстве могут извращать реактивность организма к возбудителям туберкулеза.
Рис. 1. Микобактерии, патогенные для человека
Известно более 60 видов микобактерий. Они объединены в род Mycobacterium семейства Mycobacteriaceae, которое относится к порядку Actinomycetales. В этом есть логика. Подобно актиномицетам, микобактерии образуют ветвящиеся клетки (особенно in vitro). Но сходство имеет и более глубокие корни, по крайней мере с соседями по порядку — нокардиями и коринебактериями. И те и другие содержат липиды, которые напоминают миколовые кислоты, хотя и уступают микобактериям по сложности строения этих уникальных компонентов клеточной стенки.
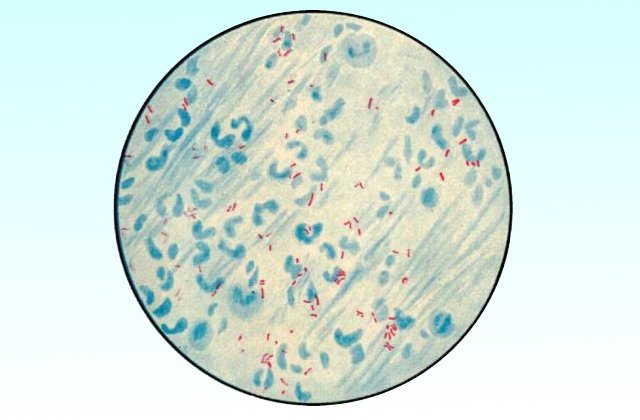
Микобактерии туберкулеза представляют собой тонкие, прямые или слегка изогнутые палочки, длиной 1—4 мкм и около 0,3 мкм в ширину (рис. 2). Они неподвижны, не образуют спор и капсулы, если не считать микозидной оболочки, которую иногда сравнивают с микрокапсулой. Они плохо окрашиваются по Граму, но, восприняв окраску, не обесцвечиваются этанолом, поэтому их считают грамположительными, хотя правильнее не относить ни к тем, ни к другим. С трудностями окраски туберкулезной палочки впервые столкнулся Кох, сумевший разглядеть их в мазках из мокроты лишь после 24—30-часовой (!) инкубации в щелочном растворе метиленовой синьки.
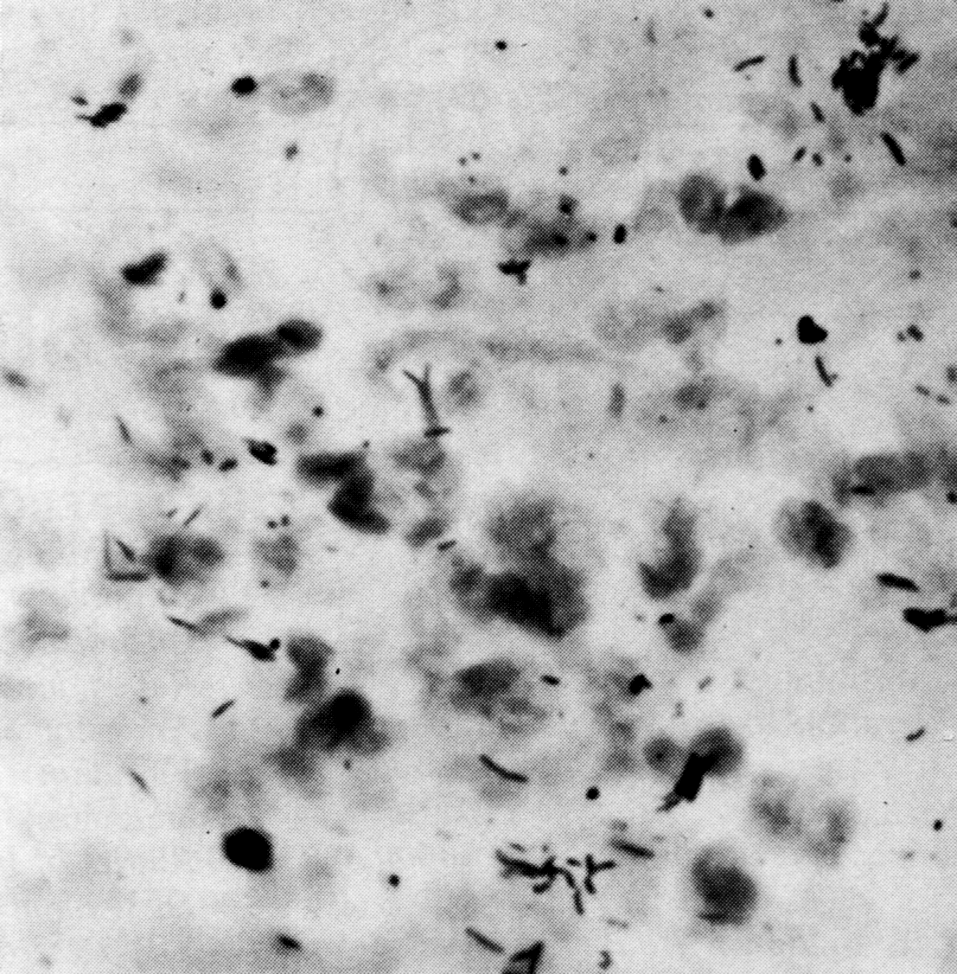
Рис. 2. M. tuberсulosis. Мазок из мокроты больного туберкулезом легких. Окраска по Цилю—Нильсену, х1050
Избирательная окраска основана на так называемой кислотоустойчивости микобактерий и включает два основных этапа. Сначала повышают проницаемость клеточной стенки для насыщенного раствора красителя (расплавление восковидного слоя путем прогревания или протравливания детергенами), а затем окрашенный препарат промывают разведенными кислотами. Обесцвечивая большинство бактерий, это сохраняет окраску микобактериальных клеток. По классической методике Циля—Нильсена на фиксированный мазок наливают карболовый фуксин, нагревают до отхождения паров, промывают закисленным этанолом (3% НСl в 85% растворе этанола) и докрашивают метиленовой синькой. Микобактерии удерживают фуксин и выглядят как красные палочки на голубом фоне; остальные бактерии теряют фуксин и окрашиваются в синий цвет. Этанол здесь не обязателен, но делает фон более чистым. Устойчивость к обесцвечиванию (она связана с образованием прочных комплексов между красителем и миколовыми кислотами клеточной стенки) проявляется не только в отношении кислот, но также щелочей и спиртов. Поэтому с равной справедливостью микобактерии можно называть также щелоче- и спиртоустойчивыми.
Морфологические и тинкториальные признаки микобактерий имеют много исключений, породивших немало споров о природе возбудителя. Туберкулезная палочка может терять кислотоустойчивость и хорошо окрашиваться по Граму, превращаться в филаментозные и даже мицелиоподобные формы, распадающиеся на палочки и кокки (гранулы/зерна Муха). Некоторые из них настолько малы, что проходят через бактериальные фильтры (фильтрующиеся формы). Теперь ясно: речь идет о фенотипической изменчивости, которая отражает экологическую пластичность возбудителя и его способность выживать в неблагоприятных условиях. Отсюда не удивительно, что плеоморфизм туберкулезной палочки сильнее проявляется в инвитровых культурах, т.е. в неестественной среде обитания.
Туберкулезные микобактерии — строгие аэробы и мезофилы, т.е. растут в диапазоне 30—42° С, лучше всего при 37°С. Размножение происходит очень медленно: период генерации составляет 14—16 ч (типичные бактерии делятся каждые 15 мин). Поэтому для получения обильного роста требуется не менее 4—6 нед, хотя миниатюрные колонии могут появиться через 7—10 дней. Туберкулезная палочка принадлежит к числу наиболее вяло реплицирующихся микобактерий. Большинство сапрофитических видов размножаются быстрее, их рост заметно отстает от других прокариот и хорошо заметен не ранее чем через 5—7 дней. Одной из причин отсроченного размножения микобактерий является высокая гидрофобность, связанная с обилием липидов в клеточной стенке. Это затрудняет поступление в бактерии питательных веществ, снижая их метаболическую активность.
Выделение первичных культур (т.е. непосредственно от больного) проводят на специальных средах, самые сложные из которых содержат яйца, картофельную муку и глицерин. Для подавления сопутствующей микрофлоры добавляют малахитовый зеленый или генцианвиолет. При субкультивировании туберкулезная палочка становится менее прихотливой и растет на обычных средах с добавкой глицерина.
В жидких средах рост происходит на поверхности (аэроб!). Нежная сухая пленка со временем утолщается, становится бугристо-морщинистой и обретает желтоватый оттенок, часто сравниваемый с цветом слоновой кости. Бульон остается прозрачным и добиться диффузного роста удается только в присутствии детергентов, например твина-80. В микроколониях (они образуются на ранних сроках и заметны только под микроскопом) формируются структуры, напоминающие жгуты — признак, который связывают с так называемым корд-фактором М. tuberculosis (рис. 3).

Рис. 3. Образование жгутов в микрокультуре М. tuberculosis
Морфотинкториальная изменчивость, о которой говорилось выше, весьма характерна для туберкулезной палочки, но это — фенотипические варианты, которые не переходят в генетически закрепленные биовары. Попытки выявить устойчивые серотипы М. tuberculosis и М. bovis не увенчались успехом, прежде всего из-за спонтанной агглютинации клеток, которая является следствием их высокой гидрофобности (см. ниже). Более удачным оказался опыт фаготипирования, но и он не закрепился в лабораторной практике.
В современных исследованиях много внимания уделяется дифференцировке (клонированию) микобактериальных штаммов по генетическим маркерам, прежде всего по особенностям хромосомного профиля ДНК. Генотипирование обычно проводится на основе вставочных генов — инсерционных последовательностей (англ. insertion sequences — IS). Они отличаются структурным полиморфизмом, позволяя классифицировать штаммы по степени генетического родства. Чаще используется анализ последовательности IS6110. Применяются и другие, дополнительные методы, основанные на особенностях генетического аппарата М. tuberculosis. К их числу относится сполиготипирование (от англ. spacer oligotyping), сравнение по числу прямых повторов и полиморфной G-С-обогащенной повторяющейся последовательности.
Полная идентичность возможна лишь внутри одного клона бактерий. Отсюда сравнение с отпечатками пальцев — англ. DNA fingerprinting. Каждое очередное поколение (т.е. каждый новый клон) несет хотя бы небольшие генетические различия. Накапливаясь со временем, они ведут к формированию клоногрупп, объединяемых в семейства. Тенденцию к распространению имеют клональные кластеры, еще не достигшие статуса группы. Наиболее изученным и распространенным (в том числе в России) является W-Beijing-семейство штаммов микобактерий туберкулеза. Оно включает более десятка клоногрупп — генетических ответвлений, эволюционировавших по IS6110 в различных географических зонах. Факторы, содействующие селекции штаммов W-Beijing, не известны. Возможно, это связано с повышенной контагиозностью, устойчивостью во внешней среде, резистентностью к антибиотикам. Именно первый W-штамм (акроним выбран произвольно), изолированный в 1990 г. в США, открыл тревожную эру лекарственной полирезистентности микобактерий туберкулеза. Есть мнение, что W-Beijing-штаммы более удачливы в преодолении барьера, создаваемого BCG-вакцинацией. Впрочем, каждая из перечисленных позиций встречает возражения.
Большую озабоченность вызывает эволюция лекарственной устойчивости на основе генетически закрепленных мутаций М. tuberculosis. Распространение резистентных биоваров может обезоружить в борьбе с туберкулезом или, по крайней мере, заметно снизить ее эффективность. Не случайно в системе лабораторий США, работающих с возбудителями особо опасных инфекций, организован центр, единственная задача которого — изучение штаммов туберкулезной палочки с множественной устойчивостью к антибиотикам.
Разгадка своеобразия микобактерий связана с необычностью их поверхностных структур. В клеточной стенке, устроенной сложнее, чем у других бактерий, преобладают липиды (более 60% сухой массы), в том числе специфичные для микобактерий. Именно они определяют нестандартность тинкториальных, физиологических и экологических свойств туберкулезной палочки (см. таблицу). Разнообразие микобактериальных липидов, в которых с трудом ориентируются даже искушенные биохимики, заставляет пользоваться такими собирательными понятиями, как миколовые кислоты, микозиды, сульфолипиды, корд-факторы и пр.
| Признак | Причина |
| Тинкториальные свойства: | |
| неокрашиваемость обычными способами | Слабая проницаемость клеточной стенки |
| кислото-, щелоче-, спиртоустойчивость | Связывание красителей миколовыми кислотами |
| Медленное размножение | Низкая скорость внутриклеточной диффузии питательных веществ |
| Культуральные свойства (сухие, морщинистые колонии), спонтанная агглютинация бактериальных клеток | Гидрофобность клеток |
| Устойчивость во внешней среде | Защита от высыхания |
| Устойчивость к дезинфектантам | Медленное проникновение антисептиков в клетку |
| Взаимоотношения с макрофагами: | |
| поглощение | Гидрофобность клеток |
| внутриклеточное выживание | Блокада образования фаголизосом, нейтрализация антимикробных факторов, ускользание в цитоплазму (повреждение фагосомальных мембран) |
| Цитотоксичность | Повреждение митохондриальной мембраны |
| Особенности иммунитета, иммунопатогенез | Иммуноадъювантная активность, CD1-зависимое представление антигенов (гликолипидов) |
Читайте также:


