Молекулярно-биологические методы исследования туберкулеза
Туберкулез - хроническая инфекция с длительным периодом выделения возбудителя, многообразием клинических проявлений, поражением различных органов и систем - представляет непростую задачу для лабораторной диагностики. Молекулярно-биологические методы (ПЦР) используются для выявления, видовой дифференциации и определении лекарственной устойчивости микобактерий туберкулезного комплекса.
Ввиду биологических особенностей возбудителя и иммунного ответа человека диагностика туберкулеза не может ограничиваться каким-либо одним методом и должна проводиться комплексно.
Возбудители туберкулеза могут быть обнаружены в различных биоматериалах, природа которых определяет выбор наборов реагентов для экстракции ДНК. Ключевой принцип выбора биоматериала для диагностики туберкулеза методом ПЦР: необходимо выбирать биоматериал, соответствующий клинической форме туберкулезной инфекции.
Например, для диагностики туберкулеза мочеполовой системы нужно исследовать мочу или менструальную кровь, рекомендуется также исследовать биоптаты из подозрительного очага. Для диагностики туберкулеза легких используется мокрота, бронхо-альвеолярный лаваж.
Реагенты и оборудование для предобработки биоматериалов и экстракции ДНК
| Наборы реагентов для экстракции ДНК из мокроты, бронхо-альвеолярного лаважа, мочи, синовиальной жидкости и смывов с объектов окружающей среды | АмплиПрайм ДНК-сорб-В и АмплиПрайм РИБО-преп |
| Реагент для разжижения мокроты и синовиальной жидкости | Муколизин |
| Набор для экстракции ДНК, используемый при исследовании биоптатов (легкие, лимфатические узлы, почки, печень, мозг, селезенка) | ДНК-сорб-С |
| Оборудование для гомогенизации биоптатов | TissueLyser LT или TissueLyser II |
| Парафиновые блоки нарезают на микротоме или вырезают фрагмент ткани одноразовым скальпелем, а затем проводят экстракцию ДНК, например, с помощью набора реагентов QIAamp DNA FFPE Tissue Kit (50) | QIAamp DNA FFPE Tissue Kit (50) |
Наборы реагентов для ПЦР-диагностики туберкулеза
Применение молекулярно-биологических методов (в частности, выявление ДНК методом ПЦР) в диагностике туберкулеза регламентировано Приказом Минздрава РФ от 21.03.2003 № 109 "О совершенствовании противотуберкулезных мероприятий в Российской Федерации" (ред. от 29.10.2009).
Выявление микобактерий туберкулезного комплекса
Набор реагентов АмплиСенс® МТС-FL предназначен для обнаружения ДНК микобактерий туберкулеза – Mycobacterium tuberculosis complex (MTC), включающий в себя виды микобактерий разной степени вирулентности, вызывающих туберкулез у человека (M.tuberculosis, M.bovis, M.africanum, M.microti, M.canetti, М.pinipedii).
Микобактерии туберкулеза выявляются без видовой дифференциации; микобактерии, не относящиеся к MTC (например, M.avium и M.paratuberculosis) - не выявляются. Данный набор реагентов используется в топической диагностике туберкулеза и позволяет быстро (за несколько часов) с высокой чувствительностью и специфичностью (близким к 100%) определять наличие микобактерий туберкулеза в образце биоматериала.
Благодаря высокой скорости и информативности в диагностике туберкулеза, методы амплификации нуклеиновых кислот (в том числе ПЦР) в 2010 году были предложены CDC США для подтверждения диагноза туберкулеза наряду с культуральным методом.
Видовая дифференциация микобактерий туберкулеза методом ПЦР
Не менее важно дифференцирование до вида внутри группы MTC. Это связано с необходимостью определения источника заболевания, определения тактики противотуберкулезной терапии, а также для подтверждения случаев поствакцинальных осложнений.
С этой задачей позволяет справиться набор реагентов АмплиСенс® МТС-diff-FL, предназначенный для дифференцирования видов микобактерий туберкулеза внутри MTC: человеческого (M.tuberculosis), бычьего (M.bovis) и вакцинного штамма (M.bovis BCG) – в клиническом материале и культурах микроорганизмов.
Актуальность видовой дифференциации определяется, например, тем, что разные виды микобактерий отличаются профилем лекарственной устойчивости. Например, M.bovis и её вакцинный штамм M.bovis BCG отличаются природной резистентностью к одному из основных противотуберкулезных препаратов - пиразинамиду. Поэтому при туберкулезе, вызванной M.bovis, и БЦЖите пиразинамид не назначается.
Приказом Минздрава РФ от 21.03.2003 № 109 "О совершенствовании противотуберкулезных мероприятий в Российской Федерации" (ред. от 29.10.2009) регламентировано применение наборов реагентов, дифференцирующих M.bovis от ее вакцинного штамма M.bovis BCG, для диагностики БЦЖита.
Определение лекарственной устойчивости туберкулеза
Распространение штаммов туберкулеза с лекарственной устойчивостью, в том числе с множественной лекарственной устойчивостью (МЛУ, или MDR) составляет одну из серьезнейших проблем современного здравоохранения. Определение лекарственной устойчивости туберкулеза с помощью молекулярно-биологических методов всё шире применяется ввиду высокой скорости получения результатов (1-2 дня), что становится возможным благодаря использованию не только первичной культуры, но и непосредственно клинического материала.
Важно понимать, что наборы реагентов, основанные на разных молекулярно-биологических методах, характеризуются разными показателями диагностической чувствительности и специфичности.
| Наименование набора реагентов | АмплиСенс® MTC-Rif-Seq | АмплиСенс® MTC-PZA-Seq |
| Исследуемый ген | rpo B | pnc A |
| Препараты, к которым определяется устойчивость | рифампицин | пиразинамид |
| Кол-во выявляемых мутаций | более 200 | более 500 |
Наборы включают реагенты для амплификации фрагментов ДНК микобактерий туберкулеза, очистки продуктов амплификации (сорбентным методом), определения концентрации очищенного продукта амплификации и праймеры для секвенирования. Наборы для экстракции ДНК (АмплиПрайм РИБО-преп или ДНК-сорб-С ) и реагенты для проведения реакции секвенирования приобретаются отдельно.

Нормативные документы, публикации, информационные материалы >>
К прямым методам обнаружения микобактерий туберкулеза можно отнести и бурно развивающиеся в последние годы подходы, сущность которых состоит в выявлении в исследуемых образцах диагностического материала специфических фрагментов цепи ДНК возбудителя. Среди применяемых для этого молекулярно-биологических методик наиболее широкое распространение получил метод полимеразной цепной реакции (ПЦР), в основе которого лежит многократное увеличение числа копий специфического участка ДНК (так называемая направленная амплификация ДНК): 20 циклов ПЦР приводят к увеличению исходной ДНК в 1 миллион раз, что позволяет визуализировать результаты методом электрофореза в агарозном геле. Очень высокий уровень чувствительности (95 % и более), являющийся главным достоинством метода, достигается за счет того, что в результате многократного копирования уровень специфической олигонуклеотидной последовательности в редакционной пробе возрастает в 106 раз. По своей чувствительности метод ПЦР при туберкулезе органов дыхания в два раза превосходит эффективность культуральной диагностики.
Метод особенно актуален для туберкулеза, поскольку эффективен в отношении возбудителей с высокой антигенной изменчивостью, определение которых требует длительного культивирования или сложных питательных сред.
ПЦР-диагностика туберкулеза, как правило, строится на использовании последовательностей ДНК специфичных для всех 4 видов группы туберкулеза. Часто для этих целей используют праймеры для выявления последовательностей IS-элементов, например, IS-986 или IS-6110, поскольку данные мигрирующие элементы характерны только для видов микобактерий группы туберкулеза и присутствуют в геноме микобактерий в числе нескольких копий. Выделение ДНК из чистых культур и клинических образцов (мокроты больных) возможно осуществлять любым приемлемым методом, например, методом Boom с использованием лизирующего буфера на основе гуанидина, тиоционата и двуокиси кремния в качестве носителя ДНК.
Проведение ПЦР-диагностики туберкулеза
В качестве примера праймеров [49] для идентификации микобактерий группы туберкулеза можно привести праймеры, фланкирующие фрагмент размером 245 пар нуклеотидов мигрирующего элемента IS-986, содержащегося в геноме M.tuberculosis в числе 2-8 копий.
Амплифицированный фрагмент выявляют электрофорезом в 1,6 % агарозном геле.
Данная пара праймеров была проверена на специфичность с использованием в качестве контроля 100 нг/проба ДНК близкородственных микроорганизмов; ДНК возбудителей легочных заболеваний; ДНК микроорганизмов, входящих в микрофлору человека (например, E.coli, S. aureus и др.); образцов ДНК человека.
Испытания данной пары праймеров с параллельным бактериоскопическим и культуральным обследоваванием были проведены на клинических образцах мокроты, полученных от больных с различными клиническими формами туберкулеза. Методом ПЦР возбудитель был выявлен у 90,6% больных туберкулезом, в то время как значительно более длительными по времени микробиологическими методами микобактерии были выявлены только у 39,6% больного.
Роль молекулярной диагностики в клинической практике повышается, поскольку увеличивается число больных со скудным бактериовыделением.
Однако применение метода ПЦР чревато получением большого количества ложноположительных результатов, обусловленных как техническими погрешностями, так и особенностями самого метода. Кроме того, метод не позволяет определять степень жизнеспособности выявляемых микобактерий.
Основным недостатком ПЦР является опасность лабораторной контаминации микобактериальной ДНК. Поэтому в настоящее время разработаны достаточно жесткие сертификационные требования для ПЦР-лабораторий, предусматриваюшие наличие трех изолированных помещений. ПЦР - это сложная современная технология, использование которой требует помимо соответствующей аппаратуры наличия высококвалифицированного персонала.
Таким образом, при постановке диагноза результаты ПЦР являются дополнительными и должны сопоставляться с данными клинического обследования, рентгенографии, микроскопии мазка, посева и даже ответа на специфическое лечение.
К прямым методам обнаружения микобактерий туберкулеза можно отнести и бурно развивающиеся в последние годы подходы, сущность которых состоит в выявлении в исследуемых образцах диагностического материала специфических фрагментов цепи ДНК возбудителя. Среди применяемых для этого молекулярно-биологических методик наиболее широкое распространение получил метод полимеразной цепной реакции (ПЦР), в основе которого лежит многократное увеличение числа копий специфического участка ДНК (так называемая направленная амплификация ДНК): 20 циклов ПЦР приводят к увеличению исходной ДНК в 1 миллион раз, что позволяет визуализировать результаты методом электрофореза в агарозном геле. Очень высокий уровень чувствительности (95 % и более), являющийся главным достоинством метода, достигается за счет того, что в результате многократного копирования уровень специфической олигонуклеотидной последовательности в редакционной пробе возрастает в 106 раз. По своей чувствительности метод ПЦР при туберкулезе органов дыхания в два раза превосходит эффективность культуральной диагностики.
Метод особенно актуален для туберкулеза, поскольку эффективен в отношении возбудителей с высокой антигенной изменчивостью, определение которых требует длительного культивирования или сложных питательных сред.
ПЦР-диагностика туберкулеза, как правило, строится на использовании последовательностей ДНК специфичных для всех 4 видов группы туберкулеза. Часто для этих целей используют праймеры для выявления последовательностей IS-элементов, например, IS-986 или IS-6110, поскольку данные мигрирующие элементы характерны только для видов микобактерий группы туберкулеза и присутствуют в геноме микобактерий в числе нескольких копий. Выделение ДНК из чистых культур и клинических образцов (мокроты больных) возможно осуществлять любым приемлемым методом, например, методом Boom с использованием лизирующего буфера на основе гуанидина, тиоционата и двуокиси кремния в качестве носителя ДНК.
29. Лучевые методы исследования туберкулеза.
В развитии фтизиатрии лучевые методы исследования обогатили знания клиницистов в отношении развития, проявления и течения чрезвычайно разнообразных форм туберкулеза и помогли решить ряд практических задач в области борьбы с данным заболеванием.
Распознавание большинства форм туберкулеза в основном основывается на результатах рентгенологического метода исследования, который является связующим звеном между клиникой и патологической анатомией, обладает документальностью и обеспечивает возможность динамического наблюдения.
К методам лучевой диагностики при туберкулезе легких относятся:
цифровая малодозная флюорография;
различные виды томографии, в том числе компьютерная томография (КТ);
ультразвуковое исследование (УЗИ) грудной клетки.
Крупнокадровая флюорография (размер кадров 70×70,100×100 и 110×110 мм), широко использовавшаяся ранее при массовых флюорографических обследованиях населения, уступает место прогрессивным высокотехнологичным цифровым методам исследования.
Цифровая малодозная флюорография. За последнее десятилетие в нашей стране создано несколько типов цифровых флюорографов, в которых с помощью ЭВМ цифровое изображение органов грудной клетки выводится на экран видеомонитора для визуального анализа. Цифровой метод позволяет получить снимок на экране уже через несколько секунд после экспозиции, которая имеет длительность всего лишь 0,01 — 0,05 с.
Рентгеноскопия относится к методам углубленного рентгенологического исследования, проводится строго по показаниям и его объем определяется характером патологического процесса и поставленной задачей.
Особенностью рентгеноскопии является возможность обзора всех образований грудной полости: легких, сердца, крупных сосудов, диафрагмы. Она играет важную роль не только в уточнении топографии патологических образований (отношение к костным компонентам грудной клетки, плевральным листкам, легочной ткани или органам средостения), но и в оценке функции органов.
Рентгенография. В большинстве случаев прямую обзорную рентгенограмму дополняют рентгенографическим исследованием в боковой проекции, что позволяет выявлять изменения в междолевых плевральных пространствах, в области корней легких.
Рентгенограммы в боковых проекциях позволяют определить локализацию патологического процесса по долям и сегментам и служат основой для назначения глубины оптимальных срезов при проведении томографического исследования.
На рентгенограммах грудной клетки, выполненных в косых проекциях (при повороте больного относительно фронтальной плоскости на 30—45°), отчетливее выделяются изменения реберной, верхушечной, междолевой и средостенной плевры, поражения нижних отделов легких.
Томография — послойное рентгенологическое исследование грудной клетки, дающее возможность получения снимков без суммационного эффекта, поскольку элементы других слоев легочной ткани при съемке меняют свое проекционное положение на пленке и не дают четкого изображения. Разработаны различные виды томографии: линейная томография с различной толщиной выделяемого слоя, зависящая от угла поворота рентгеновской трубки; томография с размазыванием — продольным, косым, поперечным. Томографическое исследование можно проводить в вертикальном и горизонтальном положениях и в различных проекциях — прямой, боковой, косых.
Рентгеноконтрастные методы. Для исследования применяют в основном водорастворимые рентгеноконтрастные вещества.
Бронхография — специальный метод получения изображения бронхиального дерева; может быть общей и селективной (осуществляется с помощью направленного введения катетера). Бронхография позволяет получать изображения мелких бронхов до уровня деления бронхов 3-5-го порядка и выявлять их деформацию: расширение, сужение, искривление, изменение топографии; уточнять наличие связи полостных образований с дренажными бронхами.
Фистулографию и плеврографию применяют в клинике грудной хирургии после резекций легких различного объема в случаях осложнений: бронхоторакальный, бронхоплевроторакальный свищ, остаточная плевральная полость, бронхо- и плевропищеводный свищ.
Ангиопульмонография применяется для уточнении морфологии и функции сосудов малого круга: выявления артериовенозных аневризм, варикозного расширения легочных вен, исследования бронхиальных артерий, определения источника кровохарканья. Во фтизиатрической клинике метод имеет наибольшее значение при так называемом разрушенном легком, фиброзно-кавернозном и цирротическом туберкулезе.
Рентгенологическое исследование с использованием в виде контрастного вещества воздуха (пневмомедиастинография) производится для диагностики поражений средостения (опухоли, кисты) или для уточнения отношения патологического образования к легочной ткани, грудной клетке или диафрагме (диагностический пневмоторакс).
Диагностика с помощью КТ основана на прямых рентгенологических симптомах, т. е. определении точной локализации, формы, размеров отдельных органов и патологических очагов, и, что особенно существенно, на показателях их плотности.
Компьютерные томографы 5-го поколения позволяют оценивать состояние легочной паренхимы на уровне дольковых и внутридольковых структур, а спиральная КТ дает трехмерное объемное изображение органа, приближенное к его реальной морфофункциональной характеристике.
Радионуклидная пневмосцинтиграфия применяется в основном у взрослых пациентов для выявления функциональных нарушений регионарного капиллярного кровотока и вентиляции легких.
Ультразвуковое исследование (УЗИ) дает информацию о состоянии плевры, плевральной полости, субплевральных отделах легочной ткани, диафрагмы, синусов.
Метод допплерэхокардиографии является наиболее распространенным непрямым методом измерения давления в легочной артерии; его результаты хорошо коррелируют с данными, полученными при катетеризации правых отделов сердца. С помощью допплерографии можно определить систолическое и диастолическое давление в легочной артерии (непрерывноволновой допплер); или среднее давление (допплер — эхокардиография в импульсном режиме).

В 2004 году по инициативе д.м.н., профессора Михаила Александровича Владимирского, заведующего сектором молекулярной диагностики туберкулёза НИИ Фтизиопульмонологии Первого МГМУ им. И.М.Сеченова, мы начали разработки в области ПЦР-диагностики туберкулёза.
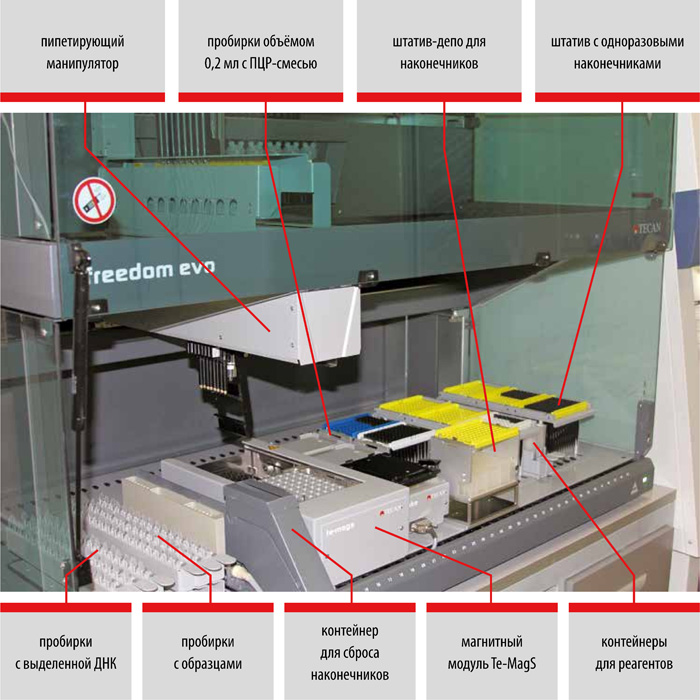
Выделение ДНК: использование оригинальных реагентов и магнитных частиц обеспечивает получение максимального количества чистой ДНК и позволяет автоматизировать процесс выделения ДНК.
ПЦР в реальном времени: одновременная детекция нескольких различных участков генома комплекса микобактерий туберкулёза (МБТ) увеличивает информативность и достоверность анализа.
I этап – Пробоподготовка, инактивация
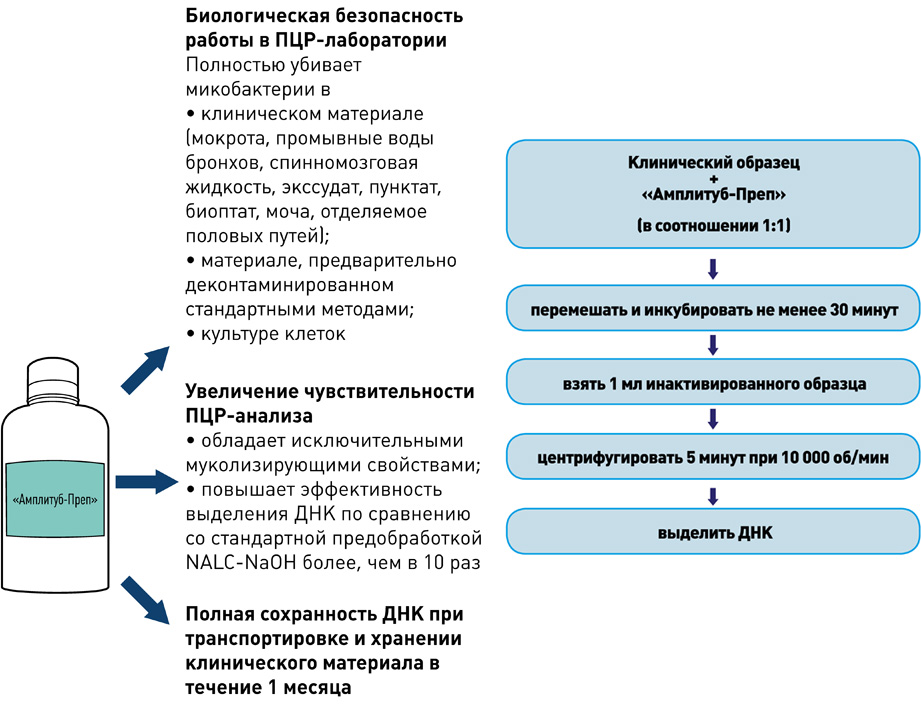
II этап – Выделение ДНК
набор реагентов для выделения ДНК (на магнитных частицах)
набор реагентов для выделения ДНК микобактерий из клинических образцов и культур клеток на автоматизированных станциях TECAN

- Снижение риска контаминации во время выделения ДНК практически до нуля.
- Значительное уменьшение трудоёмкости процесса выделения ДНК.
- Стандартизированное выделение ДНК из клинических образцов.
- Экономическая выгода: низкий расход пластика и реактивов.
набор реагентов для ускоренной пробоподготовки и выделения ДНК микобактерий из образцов мокроты
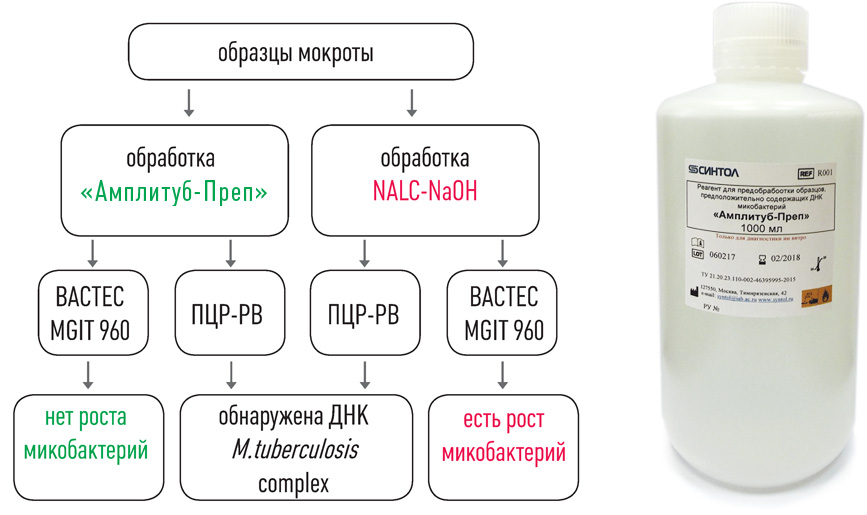
III этап – ПЦР в реальном времени
Обнаружение и количественное определение комплекса МБТ
Набор реагентов АМПЛИТУБ-РВ — это:
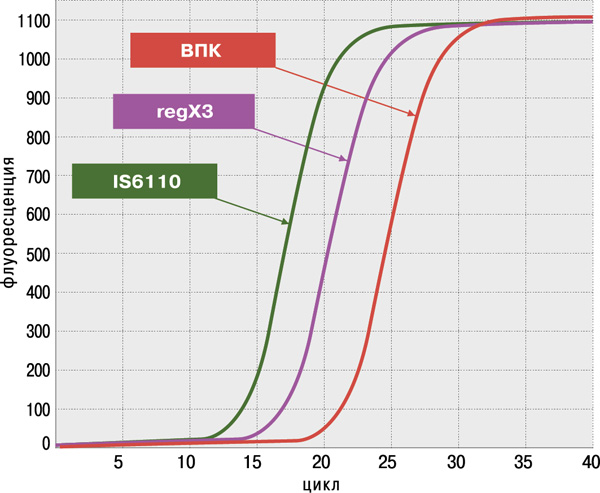
- высокая достоверность анализа благодаря одновременному обнаружению двух специфичных генов M.tuberculosis complex: IS6110 и regX3;
- оценка пригодности образца ДНК для определения антибиотикоустойчивости;
- высокая чувствительность (не более 100 КОЕ/мл мокроты или 1–10 копий фрагментов ДНК в реакции) и 100%‑ая специфичность, подтверждённые на панели QCMD (Quality Control for Molecular Diagnostics) Mtb EQA (UK).
Определение антибиотикоустойчивости МБТ к препаратам I и II ряда
Наборы реагентов АМПЛИТУБ-МЛУ-РВ, АМПЛИТУБ-FQ-РВ — это:
- диагностика форм туберкулеза с лекарственной устойчивостью, в том числе множественной лекарственной устойчивостью (МЛУ) и широкой лекарственной устойчивостью (ШЛУ);
- быстрая детекция мутаций M.tuberculosis, ассоциирующихся с устойчивостью к антибиотикам первого и второго ряда (рифампицину, изониазиду, этамбутолу, фторхинолонам);
- достоверность результатов, ежегодно подтверждаемая при проведении Федеральной службой внешней оценки качества (ФСВОК) Росздравнадзора испытаний шифрованных тест-культур и образцов.
Наборы АМПЛИТУБ-МЛУ-РВ и АМПЛИТУБ-FQ-РВ основаны на использовании оригинальной мультиконкурентной аллель-специфичной методики ПЦР в реальном времени, позволяющей выявлять мутации в генах микобактерий туберкулеза, ответственных за устойчивость к конкретным антибиотикам.

Принцип мультиконкурентной аллель-специфичной методики ПЦР в реальном времени
- В формате одной пробирки используются 5’-флуоресцентно-меченые аллель-специфичные праймеры с общим комплементарным им 3’-меченым олигонуклеотидом-гасителем и контрольный флуоресцентный зонд, комплементарный участку ДНК без мутаций.
- При отсутствии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается только по флуорофору зонда.
- При наличии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается как по флуорофору зонда, так и по флуорофору 5’-флуоресцентно-меченого аллель-специфичного праймера. Данный метод позволяет определить не только точку мутации, но и процент устойчивого мутантного штамма МБТ на фоне дикого.
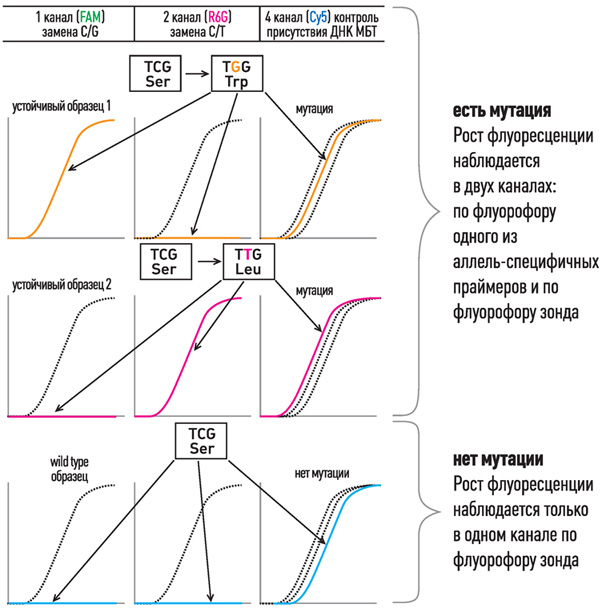
Интерпретация результатов выявления мутаций на примере
531 кодона rpoB гена M.tuberculosis
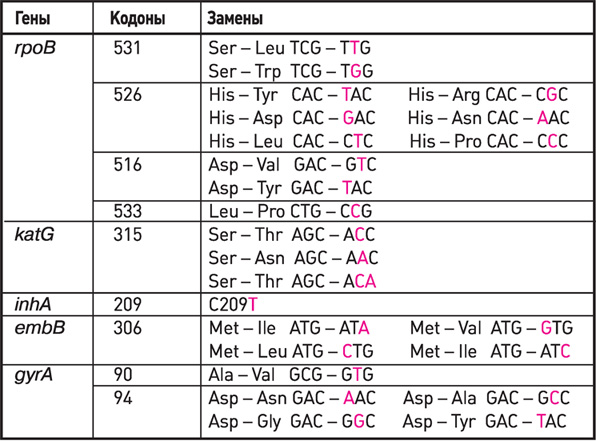
Гены, кодоны, замены, используемые в наборах реагентов
АМПЛИТУБ-МЛУ-РВ при определении антибиотикоустойчивости
Использование автоматизированных станций Freedom EVO (TECAN, Швейцария) для молекулярно-генетической диагностики туберкулёза
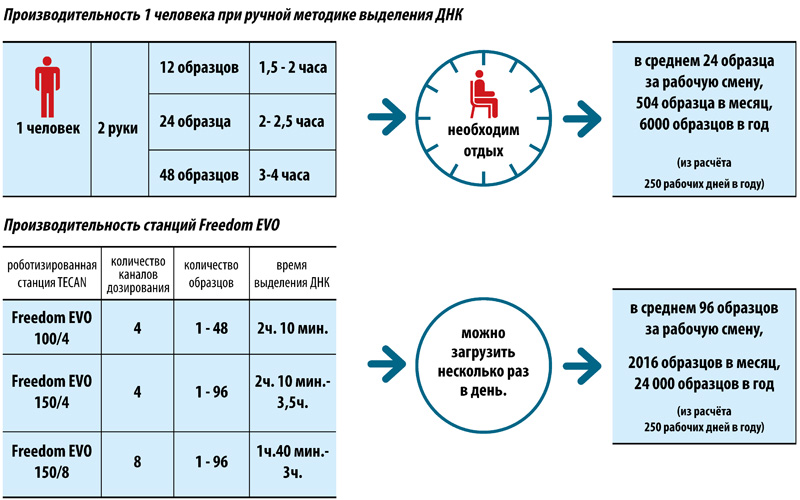

Трудозатраты — 1 час
Продолжительность выделения ДНК — не более 2 часов
Подготовка к амплификации и ПЦР-РВ — 1,5 часа
ИТОГО: результаты анализа будут готовы через 3,5 часа
Оператор затратит 1 час своего рабочего времени.

За последние годы возросло количество иммунодефицитных синдромов, связанных с хроническими заболеваниями, при которых встречаются ВИЧ - ассоциированные заболевания при отсутствии антител к ВИЧ. У лиц, инфицированных одновременно ВИЧ и возбудителем туберкулеза ежегодная вероятность развития туберкулеза составляет 5-10%, в то время как у неинфицированного населения подобная вероятность не превышает 10% на протяжении всей жизни. По прогнозам ВОЗ, заболеваемость туберкулезом может увеличиться в 3 раза, если 10% взрослого населения страны будет инфицировано ВИЧ. Только в 2015 году произошло 10,4 млн новых случаев туберкулезом, из которых 0,4 млн случаев произошли среди людей с ВИЧ. Это объясняется синергическими взаимодействиями возбудителей туберкулеза и ВИЧ-инфекции. В этой ситуации совершенствование и внедрение новых методов диагностики является важной задачей. Прогресс медицины в настоящее время обеспечивается фундаментальными разработками, среди которых на одном из первых мест находятся генетические исследования. Генодиагностика - относительно новый раздел диагностики, который позволяет обнаруживать гены или последовательности нуклеиновой кислоты, специфичные для определенного вида возбудителя инфекционного заболевания. В 1953 г. Дж. Уотсон и Ф. Крик опубликовали работу, посвященную структуре ДНК, в которой указывалось, что основной принцип, лежащий в основе живой материи - принцип комплементарности [7]. Этот принцип широко и успешно используется для решения различных научных проблем, в том числе для идентификации патогенных микроорганизмов. Однако метод генодиагностики, основанный на реакции гибридизации ДНК с ДНК, не отличается высокой чувствительностью и малоинформативен при диагностике инфекционных состояний.
В настоящее время предложены различные модификации ПЦР, показана возможность создания тест-систем для обнаружения микроорганизмов, выявления точечных мутаций. Существуют качественный и количественный варианты ПЦР. Качественную ПЦР можно использовать для диагностика инфекционных заболеваний, вызванных безусловными патогенами и выявления инфекционных агентов перед проведением количественной ПЦР. В настоящее время наиболее перспективным представляется метод ПЦР в реальном времени. Сущность метода заключается в исследовании накопления продуктов амплификации с помощью специального прибора без последующего электрофореза. Так как кинетика накопления продуктов амплификации связана с исходным количеством матрицы, это дает возможность точно оценить ее количество. Отличительными чертами данного метода является возможность количественного определения ДНК/РНК инфекционных агентов в исследуемом материале, отсутствие стадии электрофореза, менее строгие требования к организации ПЦР - лаборатории, автоматическая регистрация и интерпретация полученных результатов. Отсутствие стадии электрофореза позволяет минимизировать риск контаминации продуктами ПЦР и таким образом уменьшить число ложноположительных результатов. При детекции различных вариантов мутаций при анализе структуры ДНК расшифровка ее последовательности остается методом золотого стандарта в области ДНК-анализа. ПЦР имеет принципиальное преимущество перед культуральными методами. Диагностические возможности ПЦР не ограничиваются способностью микроорганизма расти на искусственных средах или в культуре клеток, поэтому основное преимущество ПЦР перед культуральными методами состоит не только в чувствительности ПЦР, а в способности идентифицировать, определять свойства и работать с большим количеством различных микроорганизмов, которые не удается по тем или иным причинам определять культуральными методами.
Метод ПЦР обладает высокой чувствительностью, дающей возможность обнаруживать единичные бактериальные клетки или вирусные частицы. Преимущество диагностики, основанной на использовании ПЦР, перед золотым стандартом, которым считается культивирование микроорганизмов, состоит в следующем: более высокая частота обнаружения микроба, время обнаружения возбудителя составляет 4–5 часов, определение возбудителей в образцах, взятых неинвазивным путем [4, 9].
В настоящее время актуальным для здравоохранения является клиническая интерпретация результатов ПЦР-исследований для диагностики туберкулеза у ВИЧ-инфицированных. Метод ПЦР основан на ферментативной амплификации выбранных специфических участков генома бактерий рода Mycobacterium tuberculosis, их дальнейшей детекции и идентификации. Аналитическая чувствительность метода, определяемая при последовательных разведениях суспензии бактериальных клеток, очень высока и составляет от 1 пг до 5 фг микобактериальной ДНК, что эквивалентно выявлению 1-10 бактериальных клеток. В настоящее время существует ряд разработок по использованию ПЦР в диагностике туберкулеза у ВИЧ-инфицированных.
ДНК микобактерий могут сохраняться в организме клинически излеченного или инфицированного туберкулезом в течение длительного периода времени. Их выявление не может являться единственным подтверждением активности туберкулеза и служит лишь основанием для проведения общепринятых дифференциально-диагностических исследований, дальнейшего наблюдения за больным.
Диагностику ПЦР можно использовать не только для обнаружения генетического материала возбудителя туберкулеза, но и для определения резистентности этого штамма к противотуберкулезным препаратам. Возрастающее число мультирезистентных штаммов M. tuberculosis представляет собой серьезную проблему для современного здравоохранения. Лечение пациентов, инфицированных мультирезистентными штаммами, требует применения более токсичных и дорогостоящих химиопрепаратов, длительной госпитализации и, тем не менее, часто остается неэффективным, обуславливая высокий удельный вес инвалидизации и смертности. Основным в решении этой проблемы является своевременная детекция мультирезистентных штаммов на ранних стадиях заболевания, которая позволит контролировать дальнейшее распространение конкретного выявленного штамма и подобрать оптимальную схему химиотерапии. Тем не менее, определение спектра лекарственной резистентности классическими методами на селекционных средах занимает от 3-х недель до 3-х месяцев, что делает полученный результат ретроспективным. [8]
Альтернативным и более перспективным вариантом решения этой проблемы является использование генотипических методов анализа, основанных на выявлении точечных мутаций или других генетических детерминант, обеспечивающих резистентность к антибиотикам. Его отличительной чертой является небольшой срок выполнения анализа, составляющий 2-3 дня.
Заключение. Внедрение молекулярно-биологических методов диагностики, основанных на применении полимеразной цепной реакции, значительно повышает эффективность выявления микобактерий туберкулезного комплекса по сравнению с традиционными микробиологическими методами (бактериоскопия, люминесцентная микроскопия, посев).
Сочетание молекулярных методов типирования микобактерий туберкулеза с методами прямой детекции (секвенирование) резистентности к химиопрепаратам позволит в дальнейшем проводить не только статистические мониторинговые эпидемиологические исследования, но и получать достоверные результаты в клинически значимом масштабе времени.
Приведенные выше данные многочисленных клинико-лабораторных исследований свидетельствуют об успешном внедрении метода полимеразной цепной реакции в практику противотуберкулезной службы. В настоящее время основным является определение показаний к применению ПЦР в определении возбудителя туберкулеза, ее диагностической значимости (в сравнении с микроскопическими и культуральными методами) и клиническая интерпретация получаемых с ее помощью результатов.
Читайте также:


