Гистологические окраски на туберкулез
Владельцы патента RU 2530574:
Изобретение относится к медицине и представляет собой способ ускоренной окраски гистологических препаратов для выявления микобактерий туберкулеза, включающий приготовление гистологических препаратов по общепринятой методике, окрашивание их по Циль-Нильсону, отличающийся тем, что после стандартной подготовки препаратов к окраске срезы проходят процедуру депарафинизации путем последовательного помещения их в ксилол и спирты нисходящей концентрации по 5 минут в термостат при температуре 54°C с последующим помещением их в воду, затем в 1% раствор йодной кислоты на 2 минуты и промыванием в проточной воде в течение 10 секунд, после чего на срез, покрытый фильтровальной бумагой, наливают карбол-фуксин Циля и подогревают над пламенем спиртовки до появления паров в течение 2 минут, оставляют краску на срезе после прекращения подогревания на 3-5 минут, убирают фильтровальную бумагу и ополаскивают срезы в воде, дифференцируют их 1% кислотным буфером, ополаскивают в водопроводной воде в течение 1 минуты, после чего на срез помещают раствор метиленового синего по Лефлеру и подогревают над пламенем спиртовки до появления паров, промывают в воде, дифференцируют в 1% кислотном буфере и хорошо промывают водой, обезвоживают в спиртах восходящей крепости в течение 1 минуты, помещают в ксилол и заключают в бальзам. 1 пр.
Изобретение относится к медицине, в частности к патологической анатомии и фтизиатрии, и касается способа ускоренной методики окраски гистологических препаратов для выявления микобактерий туберкулеза.
Известно большое количество способов окраски для выявления микобактерий туберкулеза. Ближайший аналог: это метод, описанный Г.Г.Автандиловым (Основы патологоанатомической практики. - Москва - 1994 г. - С.383). Методика окраски: срезы депарафинируют и доводят до спирта. На срез, покрытый фильтровальной бумагой, наливают карбол-фуксин и подогревают над пламенем спиртовки до появления паров. Потом подогревание ведут в течение 1-2 минут, затем краску оставляют на срезе после прекращения подогревания еще на 20-25 минут. Краску сливают, снимают фильтровальную бумагу. Дифференцируют в 1% солянокислом спирте (70°) до появления бледно-розового тона. Промывают в водопроводной воде 1-2 минуты. Докрашивают срезы метиленовым синим Лефлера в течение 0,5-0,6 минуты. Окрашивают несильно, затем дифференцируют в 0,5-1% солянокислом спирте и хорошо промывают в воде. Быстро проводят через спирты, ксилол и заключают в бальзам.
Однако предложенный способ неудобен тем, что окраска препаратов занимает большое количество времени. Поэтому необходимо усовершенствовать данный метод для достоверности и объективизации посмертного патологоанатомического исследования туберкулеза с целью более быстрой диагностики.
Задачей настоящего изобретения является разработка ускоренного метода окраски, позволяющего за более короткий промежуток времени достоверно проводить посмертную диагностику туберкулеза легких.
Сущность изобретения заключается в том, что в способе ускоренной окраски гистологических препаратов для выявления микобактерий туберкулеза, включающем приготовление гистологических препаратов по общепринятой методике, окрашивание их по Циль-Нильсону, после стандартной подготовки препаратов к окраске срезы проходят процедуру депарафинизации путем последовательного помещения их в ксилол и спирты нисходящей концентрации по 5 минут в термостат при температуре 54°C с последующим помещением их в воду, затем в 1% раствор йодной кислоты на 2 мин и промыванием в проточной воде в течение 10 секунд, после чего на срез, покрытый фильтровальной бумагой, наливают карбол-фуксин Циля и подогревают над пламенем спиртовки до появления паров в течение 2 минут, оставляют краску на срезе после прекращения подогревания на 3-5 минут, убирают фильтровальную бумагу и ополаскивают срезы в воде, дифференцируют их 1% кислотным буфером, ополаскивают в водопроводной воде в течение 1 минуты, после чего на срез помещают раствор митиленового синего по Лефлеру и подогревают над пламенем спиртовки до появления паров, промывают в воде, дифференцируют в 1% кислотном буфере и хорошо промывают водой, обезвоживают в спиртах восходящей крепости в течение 1 минуты, помещают в ксилол и заключают в бальзам, причем просветление в карбол-ксилоле не допустимо, так как это может привести к вымыванию красителя.
Задача достигается следующим образом.
По общепринятой методике ткань легких, лимфатических узлов, бронхов извлекаются при аутопсии. Помещаются в емкость, заполненную 10% раствором нейтрального формалина. Через 12-24 часа из материала вырезаются продольные кусочки исследуемых тканей толщиной до 05, -1,0 см и вновь погружают в емкость с 10% раствором нейтрального формалина. Затем через 12 часов после тщательной промывки в течение 5 часов в проточной воде материал обезвоживают в спиртах восходящей крепости (50% (3 часа), 60% (3 часа), 70% (12 часов), 80% (12 часов), 96% (12 часов), 100% (12 часов)) с последующим погружением в касторовое масло на 12-24 часа.
Для удаления спиртов кусочки погружают в хлороформ (3 порции со сменой через 1,5 часа), далее для удаления хлороформа помещают поочередно в три порции расплавленного парафина по 1,5 часа в каждой. После всего этого кусочки заливаются расплавленным парафином в специальные бумажные коробочки с этикетировкой материала. Полученные блоки наклеиваются на пластиковую кассету и с помощью микротома изготавливаются гистологические срезы толщиной 5 мкм. И наклеиваются на предметное стекло с последующим окрашиванием по Циль-Нильсону. Сначала срезы проходят процедуру депарафинизации путем последовательного помещения их в ксилол и спирты нисходящей концентрации по 5 минут в термостат при температуре 54°C с последующим помещением в воду. Затем срезы помещают в 1% раствор йодной кислоты на 2 мин. Промывают в проточной воде в течение 10 секунд. На срез, покрытый фильтровальной бумагой, наливают карбол-фуксин Циля и подогревают над пламенем спиртовки до появления паров в течение 2 минут, затем оставляют краску на срезе после прекращения подогревания на 3-5 минут. Далее убирают фильтровальную бумагу и ополаскивают срезы в воде, дифференцируют 1% кислотным буфером, ополаскивают в водопроводной воде в течение 1 минуты. Далее на срез помещают раствор метиленового синего по Лефлеру и подогревают над пламенем спиртовки до появления паров, промывают в водопроводной воде, дифференцируют в 1% кислотном буфере и хорошо промывают водой. Обезвоживают в спиртах восходящей крепости в течение 1 минуты, помещают в ксилол и заключают в бальзам. Просветление в карбол-ксилоле не допустимо, так как это может привести к вымыванию красителя. Общее время окраски данным методом 20-25 минут, а предложенными методами других авторов более одного часа.
Пример использования предложенного способа.
Предложенным способом были окрашены ткань легких, лимфатических узлов и бронхов у 105 умерших больных лекарственно-устойчивым туберкулезом в возрасте от 21 до 60 лет. Исследуемый материал извлекался, фиксировался, промывался, обезвоживался и заливался в парафин. Далее проводилась окраска по Цилю-Нильсону. Сначала срезы проходят процедуру депарафинизации путем последовательного помещения их в ксилол (5 минут в термостате при температуре 54°C) и спирты нисходящей концентрации (5 минут в термостате при температуре 54°C) с последующим помещением в воду. Затем срезы помещают в 1% раствор йодной кислоты на 2 мин. Промывают в проточной воде в течение 10 секунд. На срез, покрытый фильтровальной бумагой, наливают карбол-фуксин Циля и подогревают над пламенем спиртовки до появления паров в течение 2 минут, затем оставляют краску на срезе после прекращения подогревания на 3-5 минут. Убирают фильтровальную бумагу и ополаскивают срезы в воде, дифференцируют 1% кислотным буфером, ополаскивают в водопроводной воде в течение 1 минуты. Далее на срез помещают раствор метиленового синего по Лефлеру и подогревают над пламенем спиртовки до появления паров, промывают водой, дифференцируют в 1% кислотном буфере и хорошо промывают водой. Обезвоживают в спиртах восходящей крепости в течение 1 минуты, помещают в ксилол и заключают в бальзам. Просветление в карбол-ксилоле не допустимо, так как это может привести к вымыванию красителя. Общее время окраски данным методом 20-25 минут, а предложенными методами других авторов более одного часа.
Технический результат использования изобретения:
1. Достоверность и объективизация посмертной патологоанатомической диагностики туберкулеза.
2. За счет нагревания растворов в термостате и над пламенем спиртовки улучшается качество окраски гистологических срезов.
3. Сокращается время исследования, что позволяет сделать заключение в более ранние сроки, снизить токсическое влияние реагентов на медицинский персонал.
4. Данный способ может применяться для дифференцированной диагностики различных гранулематозных образований.
5. Способ может быть использован для срочной интраоперационной диагностики (путем изготовления гистологических срезов на замораживающем микротоме).
1. Автандилов Г.Г. Основы патологоанатомической практики. - Москва, 1994, - с.383.
3. Гринберг Л.М. Баранова Е.Ю, Кондратов Д.Л. Гистобактериоскопия в морфологической диагностике туберкулеза легких: Пособие для врачей.- Уральский НИИ фтизиопульмонологии. - Екатеренбург, 2004.
4. Цинзерлинг А.В. Обработка и окраска мазков и срезов для выявления микроорганизмов // Архив патологии 1992. №5, - с.35-40.
5. Хмельницкий O.K., Белянин В.Л. Выявление возбудителей инфекционных болезней при морфологическом исследовании: Пособие для врачей. - Санкт-Петербург: СПбМАПО, 1996, - с.62.
Способ ускоренной окраски гистологических препаратов для выявления микобактерий туберкулеза, включающий приготовление гистологических препаратов по общепринятой методике, окрашивание их по Циль-Нильсону, отличающийся тем, что после стандартной подготовки препаратов к окраске срезы проходят процедуру депарафинизации путем последовательного помещения их в ксилол и спирты нисходящей концентрации по 5 минут в термостат при температуре 54°C с последующим помещением их в воду, затем в 1% раствор йодной кислоты на 2 минуты и промыванием в проточной воде в течение 10 секунд, после чего на срез, покрытый фильтровальной бумагой, наливают карбол-фуксин Циля и подогревают над пламенем спиртовки до появления паров в течение 2 минут, оставляют краску на срезе после прекращения подогревания на 3-5 минут, убирают фильтровальную бумагу и ополаскивают срезы в воде, дифференцируют их 1% кислотным буфером, ополаскивают в водопроводной воде в течение 1 минуты, после чего на срез помещают раствор митиленового синего по Лефлеру и подогревают над пламенем спиртовки до появления паров, промывают в воде, дифференцируют в 1% кислотном буфере и хорошо промывают водой, обезвоживают в спиртах восходящей крепости в течение 1 минуты, помещают в ксилол и заключают в бальзам, причем просветление в карбол-ксилоле не допустимо, так как это может привести к вымыванию красителя.

Дата публикации: 06.08.2016 2016-08-06
Статья просмотрена: 321 раз
Актуальной проблемой современной медицины является развитие и течение туберкулезной инфекции лёгких у больных, инфицированных вирусом иммунодефицита человека (ВИЧ, Human immunodeficiency virus – HIV). По данным ВОЗ на 2014 – 2015 год микобактериями туберкулеза инфицировано 33% населения планеты. В тоже время ежегодно в мире регистрируют до 8 млн. новых случаев туберкулеза и до 2 млн. смертей от него. Наибольший риск заражения туберкулезом у ВИЧ - инфицированных. У этих больных заболеваемость туберкулезной инфекцией в 200 раз выше, чем в других группах населения [1,2]. В настоящее время туберкулез занимает первое место в структуре оппортунистических инфекций у ВИЧ-инфицированных.
Целью работы явилось изучение морфологических особенностей туберкулеза легких у ВИЧ-инфицированных больных.
Анализировался аутопсийный материал с различными типами тканевой реакции в легких при туберкулезной инфекции в зависимости от давности заболеваний, степени иммунодепрессии, гендерной принадлежности и возраста респондентов.
Были изучены протоколы вскрытия и гистологические препараты аутопсийного материала 39 умерших больных с сочетанием ВИЧ-инфекции и туберкулеза легких за 2015 год РФ РОПАБ. В работе использовались следующие гистологические окраски: гематоксилин-эозином, по Цилю-Нильсену (для обнаружения M. Tuberculosis в некротических очагах), окраска пикрофуксином по ван-Гизону. Микроскопия осуществлялась с помощью микроскопа Leica с увеличением 10*10, 10*20, 10*40, 10*90. Возраст умерших больных и распределение по полу представлены в графике 1.
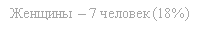


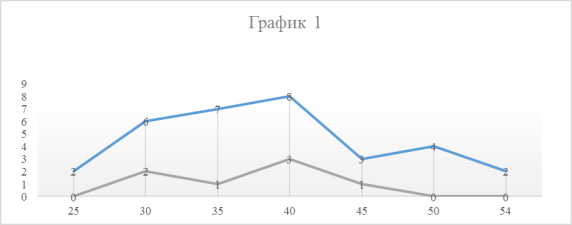
Как видно из графика возраст умерших больных чаще приходился на четвертое десятилетие (69%) случаев. Имело место превалирование мужчин - 32 больных (82%) над женщинами - 7 больных (18%).
Согласно современной классификации стадийности ВИЧ-инфекции по В.И. Покровскому (2001 год) развитие туберкулезной инфекции больного с ВИЧ соответствует 4 стадии HIV (стадия вторичных заболеваний) [3]. Она характеризуется гибелью CD4-клеток и истощению их популяции, что приводит к развитию вторичных (оппортунистических), инфекционных или онкологических заболеваний на фоне иммунодефицита. В зависимости от тяжести вторичных заболеваний выделяют стадии 4А, 4Б, 4В.
Стадия 4Б у ВИЧ-инфекционных умерших встретилась в 16 (41%) случаев. Для нее характерен уровень иммуносупрессии 200 – 350 кл. в 1 мкл. В наших наблюдениях иммунограмма выполнена в 10 (62,5%) случаях, в 7 (70%) из которых количество РНК-копий вируса в сыворотки крови составило от 25 до 300 тыс. В легких при макроскопических исследованиях в 5 (31,25%) наблюдениях встретился милиарный или мелкоочаговый двусторонний диссеминированный туберкулез легких. В 10 (62,5%) случаях имела место крупноочаговая диссеминация, в 1 случае (6,25%) – казеозная пневмония. Морфологически в данной группе респондентов микроскопическая картина изменений в легких имела следующие особенности: была отмечена утрата черт специфичности морфологической картины воспаления и отсутствовали признаки волнообразного течения процесса, характерного для туберкулеза. Помимо очагов казеозного некроза наблюдались очаги специфического гнойно-некротического характера воспаления, обычно располагающиеся периваскулярно. Это объяснялось явлениями неспецифического деструктивного васкулита, который часто сопровождался тромбированием сосудов. Внутригрудные лимфатические узлы были увеличены и гиперплазированы, гистологически в них отмечена картина гнойного воспаления. Очаги казеозного некроза с формированием гигантоклеточных бугорков в них были отмечены лишь в 2 (12,5%) случаях из 16. При окраске по Циль-Нильсену Mycobacterium tuberculosis отмечалась лишь в фокусах казеозного некроза. В тех участках легкого, где имело место гнойно-некротическое воспаление она отсутствовала.
У 21 (53,8%) умершего больного стадийность ВИЧ-инфекции была определена как 4В. В 15 (71,4%) случаях была выполнена иммунограмма, в которой уровень CD4-клеток составил менее 200 кл. в 1 мкл. У этих же 15 больных количество РНК-копий вируса в 1 мл сыворотки крови составило от нескольких сотен тысяч до 3 млн. Морфологические изменения легких характеризовались диффузным поражением всей легочной ткани. Превалировали поражения нижних долей с диссеминацией процесса не только в лёгких, но и с поражением внутригрудных лимфатических узлов. При морфологическом исследовании регистрировалась ареактивная картина. Имело место развитие очагов казеозного некроза от миллиарных до нескольких сантиметров с тенденцией к распаду и формированием острых каверн. Перифокальная воспалительная реакция была представлена слабо и в основе характеризовалась скудной лимфоэпителиоидной инфильтрацией без гигантских клеток Пирогова-Ланганса в спавшейся легочной ткани. При окраске по Циль-Нильсену в казеозных массах отмечается большое количество палочковидных форм Mycobacterium tuberculosis. Явлений некроза даже при длительном течение заболевания (до нескольких месяцев) при окраске по ван-Гизону не наблюдалось [5].
Исходя из анализа полученных данных, мы отметили следующие морфологические особенности сочетания туберкулеза легких с ВИЧ-инфекцией:
- Стадия 4А характеризовалась выраженной реакцией специфического продуктивного воспаления с эпителиоидно-гигантоклеточной и лимфоидной реакцией по периферии гранулём. Имелись признаки волнообразного течения заболевания в виде наличия довольно хорошо отграниченных за счет пневмофиброза фокусов казеозного некроза. При нарастании иммуносупрессии изменения в легких характеризовались в основном как развитием специфического воспаления, так и формированием очагов гнойно-некротического характера. В этих случаях имелась картина гнойно-некротического васкулита сосудов легкого с их тромбированием и последующим развитием некротических изменений в легком. Макроскопически поражение легких имело более распространенный характер с поражением уже всех легочных долей.
- Стадия 4Б как и терминальная стадия СПИДа характеризовалась отсутствием или слабовыраженной ответной воспалительной реакцией на появление в легких очагов казеозного некроза. Помимо резко выраженной иммуносупрессии в эту стадию наблюдалось резкое увеличение в сыворотке крови РНК-копий вируса от нескольких сотен до нескольких млн. Поражение лимфоузлов в эту стадию имело черты специфического туберкулезного воспаления также без формирования типичных туберкулезных гранулём.
В соответствии с современными программами ВОЗ, основой выявления туберкулёза за рубежом считают проведение микроскопии мазков мокроты, полученной от кашляющих больных, обратившихся к врачам общей практики; мазки окрашивают по Цилю-Нильсену. Эта методика входит в отечественный поликлинический и клинический минимум обследования пациента, выделяющего мокроту. В 1995 г. Минздравмедпром России в приказе № 8 "О развитии и совершенствовании деятельности лабораторной клинической микробиологии (бактериологии) лечебно-профилактических учреждений" подтвердил эту обязанность клинико-диагностических лабораторий. Обязательное бактериологическое исследование мокроты на М. tuberculosis должно быть организовано для нетранспортабельных больных, больных хроническими заболеваниями органов дыхания и мочевыводящей системы, а также для работников неблагополучных по туберкулёзу животноводческих хозяйств. Этот старейший метод полностью сохраняет свое значение вследствие доступности для практических клинико-диагностических лабораторий, низкой стоимости и быстроты выполнения.
При бактериоскопии мазка, окрашенного по Цилю-Нильсену, микобактерии туберкулеза могут быть обнаружены при наличии не менее 100 000 - 1 000 000 бактериальных клеток в 1 мл патологического материала (мокроты). Такое большое количество микобактерий встречается у больных с далеко зашедшими прогрессирующими формами заболевания (диссеминированными и фиброзно-кавернозными). У значительно большего числа больных количество выделяемых ими микобактерий ниже предела метода бактериоскопии, что и является большим минусом этого метода. Только при идеальном выполнении всех требуемых условий, указанных в Приказе № 109 МЗ РФ,-исследование не менее трех проб диагностического материала, правильный сбор мокроты, наличие современного бинокулярного микроскопа и высококачественных реактивов, просмотр до 300 полей зрения - возможно повышение чувствительности до 10000 микробных клеток.
Микобактерии туберкулёза имеют вид тонких, слегка изогнутых палочек различной длины с утолщениями на концах или посередине, располагаются группами и поодиночке (рисунок 1,а) Окрашенные по Цилю-Нильсену мазки микроскопируют с иммерсионной системой не менее 10 мин.
Люминесцентная микроскопия
Метод основан на проникновении в микробную клетку карболового производного флюоресцентного красителя (аурамина, родамина). При окраске флюоресцентным красителем аурамином-родамином микобактерии можно видеть при неиммерсионном 100-кратном увеличении. Более точен результат при окраске по Цилю-Нильсену карболфуксином и иммерсионной микроскопии при 1000-кратном увеличении. Именно окраска мазка по Цилю-Нильсену рекомендована при применении технологий DOTS. Микобактерии в этом случае выглядят светящимися желтыми палочками (рисунок 1, б). Метод имеет неоспоримые преимущества, так как позволяет при меньшем увеличении микроскопа просмотреть фактически весь мазок, так же этот метод экономически более эффективен, так как уменьшается время, затрачиваемое на просмотр мазков.
К недостаткам метода ЛМ следует отнести значительно более высокую стоимость люминесцентного микроскопа, при процедуре окрашивания- соблюдение и коррекция pH мазка, а также освобождение микобактерий в диагностическом материале (особенно в мокроте) от окружающей их слизи, которая препятствует проникновению флуоресцентного красителя в микробную клетку. Поэтому нецелесообразно использование ЛМ для нативной мокроты, но применять этот метод рекомендуется при исследовании мазков, приготовленных после центрифугирования из осадка материала, обработанного для культурального исследования и нейтрализованного после деконтаминации. Поэтому метод ЛМ следует применять в бактериологических лабораториях, где культуральное и микроскопическое исследование может быть произведено из одной и той же порции диагностического материала.
При гистологическом или цитологическом исследовании иногда можно обнаружить характерные для туберкулёза клетки, являющиеся результатом защитной реакции организма на внедрение туберкулёзной палочки. Наличие в цитограмме гигантских клеток Лангханса с несомненностью решает диагноз туберкулёза. Эти клетки имеют очень большие размеры (80 - 90 мкм и более в диаметре). Цитоплазма окрашена в серо-голубой цвет. По её периферии расположено в ряд большое количество ядер (до 20), расположенных в форме кольца (рисунок 1, в).
Другим признаком туберкулёза является присутствие в препарате так называемых эпителиоидных клеток, из которых и развиваются клетки Лангханса. Это происходит при увеличении количества ядер без разделения цитоплазмы, которая только увеличивается в размерах (рисунок 1, г).
Микроскопия позволяет быстро получить результат, но обладает низкой чувствительностью и специфичностью, невозможностью дифференциации кислотоустойчивых микобактерий.
Рисунок 1
Микобактерии туберкулеза
а - метод окраски по Цилю-Нельсену
б - метод люминисцентной микроскопии
в - клетки Лангхаса
г - эпителиоидные клетки
Наиболее распространенным методом выявления микобактерий туберкулеза в нашей стране является культуральный метод. Это "золотой стандарт" бактериологической диагностики туберкулеза, так как чувствительность метода существенно выше микроскопического и дает возможность получить чистую культуру микобактерий для её последующей идентификации и исследования лекарственной устойчивости. Этот метод дает положительные результаты при наличии в исследуемом материале от 20 до 100 жизнеспособных микробных клеток в 1 мл. Однако он трудоемок и длителен в связи с тем, что микобактерии туберкулеза растут очень медленно и их обнаружение может быть зарегистрировано только через 3 недели культивирования.
Исторически сложилось, что питательные среды на яичной основе (Левенштейна-Йенсена, Финна-2, Огавы, Аникина, "Новая", Попеску) получили наибольшее распространение среди плотных питательных сред, применяемых для выделения МБТ. Посев материала на среду Левенштайна-Йенсена проводят в бактериологической лаборатории. Рост первых колоний на классических средах отмечают через 4 - 8 недель. Однако появившиеся в последние годы агаровые среды Миддлбрука (7Н10, 7Н11) позволяют быстрее обнаружить рост микобактерий (от двух до четырех недель) и обеспечивают лучшие возможности для изучения морфологии колоний, чем на яичных средах. Недостатком агаризованных питательных сред является необходимость инкубации посевного материала в термостате с углекислым газом, поэтому агаризованные среды в России практически не применяются.
Следует отметить, что в связи с высокой избирательностью различных штаммов микобактерий и потребностью в полноценных белках до сих пор нет универсальной питательной среды, способной заменить все остальные. В Приказе № 109МЗ РФ для посева диагностического материала на МБТ рекомендуется использовать по одной пробирке международной питательной среды Левенштейна-Йенсена и Финна-2. Однако практика показывает, что кроме указанных сред целесообразно использовать и какую-либо из дополнительных, а посев на три пробирки питательной среды также повышает эффективность культуральной диагностики.
Для полноценной культуральной диагностики туберкулеза необходимо иметь соответствующие помещения и оборудование. Особенно важно наличие центрифуги и антиаэрозольной защитой и способностью обеспечить ускорение 3000g. А также шкафов биологической безопасности для предотвращения внутрилабораторного инфицирования.
Основным недостатком культуральной диагностики туберкулеза является длительность исследования - от трех недель до трех месяцев. Поэтому остаются актуальными дальнейшие исследования по разработке методов ускорения роста микобактерий.
Культуральная диагностика туберкулеза переживает в настоящее время принципиальные изменения, связанные с внедрением в практику полностью автоматизированных систем культивирования МБТ. Главное отличие этих методов - применение жидких питательных сред для культивирования с последующей радиометрической (BACTEC 460), колорометрической (Mb-Bact, Вас- tALERT) и люминесцентной детекцией роста (BACTEC MGIT 960). Рост МБТ на жидкой питательной среде в этих системах удается обнаружить уже через 1 - 2 недели в зависимости от их исходного количества в диагностическом материале. Частота выявления микобактерий так же несколько выше, чем на плотных питательных средах. Автоматизированные системы BACTEC с использованием соответствующих флаконов, содержащих различные противотуберкулезные препараты, позволяют сократить время исследования лекарственной устойчивости микобактерий до 10 - 14 суток.
Из перечисленных автоматизированных систем наиболее эффективна в настоящее время система BACTEC MGIT 960BD. Флаконы MGIT с жидкой питательной средой 7Н9 содержат в придонной части под силиконом флуоресцентный индикатор, "погашенный" высокими концентрациями кислорода. При наличии роста микобактерий в процессе поглощения кислорода индикатор начинает светиться, регистрация флуоресценции в сисиеме BACTEC MGIT производится автоматически. Использование флаконов MGIT возможно и "вручную", тогда регистрацию свечения производят с помощью трансиллюминатора на флаконах MGIT составляет 11 суток.
Основным недостатком BACTEC MGIT, как и других систем BACTEC, является высокая стоимость оборудования (до 100000 долларов США) и флаконов с питательной средой - посев одной пробы диагностического материала стоит до 400 рублей.
Так называемые дефектные по клеточной стенке L-формы микобактерий и других инфекционных патогенов являются результатом изменчивости и основным видом персистирования, то есть переживания в неблагоприятных условиях. Посев на L-формы особенно эффективен при внелегочном туберкулезе, поскольку вегетация МБТ в очагах ВЛТ при повышенном ацидозе и анаэробиозе приводит к снижению их жизнеспособности и ферментативной активности.
Диагноз не может быть поставлен только на основании выявления L-форм микобактерий, но их обнаружение, особенно при верификации методом ПЦР, является весомым аргументом в пользу туберкулезной природы заболевания. В очагах внелегочного туберкулеза наблюдается ранняя L-трансформация микобактерий, поэтому их обнаружение позволяет поставить диагноз на начальных стадиях заболевания.
Метод основан на наблюдении микроскопических объектов с использованием их способности к свечению. По сравнению с методами обычной микроскопии исследование в свете люминесценции обладает рядом преимуществ: цветное свечение, высокая степень контрастности светящихся объектов на темном фоне, значительно большая площадь поля зрения.
Суть люминесцентной микроскопии заключается в том, что объекты (бактериальные клетки), окрашенные специальными красителями (флюорохромами), под действием облучения их ультрафиолетом испускают излучение в видимом спектре света В случае, когда объект не окрашен специальными красителями, ультрафиолетовый свет, проходя через объектив и попадая на препарат, поглощается молекулярными структурами объекта и остается невидимым или почти невидимым для человеческого глаза. Если же какие-либо объекты окрашены специальным красителем, то молекулы красителя под действием ультрафиолета возбуждаются и начинают испускать кванты света в длинноволновой области, иначе говоря - светиться. В этом случае клетка становится источником света определенного спектра и хорошо видна на общем темном контрастном фоне препарата.
Источник света должен содержать в своем спектре длину волны, возбуждающую молекулы красителя, а светофильтры подбираются таким образом, чтобы добиться хорошего расхождения между длинами волн возбуждающего ультрафиолетового света и излучения, испускаемого возбужденными объектами.
При люминесцентной микроскопии используют специальный микроскоп. Источником света в нем служит кварц-галогеновая или ртутная лампа. Для красителей системы аурамин/родамин используют подборку из следующих фильтров (на примере микроскопа РП08 ЛОМО):
- возбуждающий фильтр ФС 1-4,
- запирающий фильтр СЗС 21-2 и
- нейтральный фильтр БС 8-3.
Светофильтры возбуждения служат для выделения из потока излучения источника света тех лучей, которые обеспечивают возбуждение и свечение объекта; эти фильтры устанавливаются в ветви осветителя.
Запирающий светофильтр служит для ограничения (срезания) света возбуждения и пропускания только света люминесценции; этот фильтр устанавливается в наблюдательной ветви.
Наблюдательные (сменные) фильтры имеют разное назначение: фильтры для защиты глаз от попадания красных и инфракрасных лучей; теплозащитные фильтры и др. В отечественных микроскопах применяются фильтры из стекла БС8 для предохранения объектов микроскопии от выцветания.
Люминесцентные красители (аурамин ОО, родамин С и др.) связываются с воскоподобными структурами микробной клетки. При облучении окрашенных клеток возбуждающим источником света (определенный спектр ультрафиолетового излучения) они начинают светиться оранжевым или ярко-желтым светом на черном или темно-зеленом фоне.
За счет свечения вокруг клетки образуется ореол, благодаря которому видимые размеры светящейся клетки превышают ее физические размеры. В связи с этим окрашенные флюорохромными красителями препараты обычно исследуются при увеличении 250х-450х, тогда как окрашенные фуксином - при увеличении 800x-1000х. Разница в увеличении позволяет микроскописту видеть одновременно в 4-10 раз большее поле зрения, что существенно сокращает время, необходимое для просмотра мазка. Подсчитано, что если микроскопическое исследование необходимой площади мазка при окраске по Ziehl-Neelsen продолжается приблизительно 10 минут, то для исследования той же площади мазка методом люминесцентной микроскопии потребуется только 2-3 минуты.
Наряду с этим при люминесцентной микроскопии отмечается большая резкость и контрастность микроскопической картины, что повышает комфортность микроскопического исследования. Для глаза исследователя значительно легче обнаружить флюоресцирующие оранжевые или ярко желтые микобактерии на темном (при гашении фона метиленовым синим или перманганатом калия) или темно красном (при гашении фона акридиновым оранжевым) фоне, чем выявить красные микобактерии на голубом фоне клеточного детрита при окраске по Ziehl-Neelsen Это делает метод люминесцентной микроскопии особенно ценным при исследовании олигобациллярного материала.
Указанные преимущества наиболее выражены при использовании люминесцентной микроскопии в лабораториях, выполняющих ежедневно большое число исследований (порядка 30 и более).
Мазки для люминесцентной микроскопии предпочтительно готовить из осадка после обработки материала детергентом с последующим отмыванием и центрифугированием. Перед нанесением материала осадка на предметное стекло необходимо добиться нейтрального значения рН (6,8-7,0). С этой целью осадок нейтрализуют несколькими каплями 6% раствора соляной кислоты или 6% едкого натра (в зависимости от метода обработки материала), тщательно встряхивают и с помощью бумажной индикаторной полоски определяют уровень рН (оптимально 6,8) осадка.
Во всех сомнительных случаях микроскопической картины для контроля следует использовать микроскопию мазка, повторно окрашенного по методу Ziehl-Neelsen.
Читайте также:


