Четвертичные аммониевые соединения час при туберкулезе
Несмотря на то, что заболеваемость туберкулезом в России за последние восемь лет снизилась, по данным Минздрава, на 28%, а смертность – на 50%, Россия все еще входит в число стран с высоким бременем туберкулеза.
Большая проблема, препятствующая снижению заболеваемости, – это туберкулез со множественной лекарственной устойчивостью (МЛУ) и туберкулез, ассоциированный с ВИЧ-инфекцией. МЛУ-туберкулез лечить долго, трудно, и эффективность его лечения низкая, кроме того, появились формы широкой лекарственной устойчивости (ШЛУ). Для лечения таких больных необходима комбинация, как минимум состоящая из трех, четырех, пяти эффективных препаратов.
В этих условиях необходимо повышать эффективность профилактических мероприятий. Одним из направлений неспецифической профилактики туберкулеза являются дезинфекционные мероприятия. При туберкулезе проводится профилактическая и очаговая дезинфекция (текущая и заключительная).
Проблемы эффективной дезинфекции при туберкулезе
Палочка Коха обладает высокой выживаемостью в окружающей среде и имеет высокую природную устойчивость к различным физическим и химическим факторам.
Большую опасность представляет мокрота, контаминированная микобактерией туберкулеза. Дело в том, что в белковой среде устойчивость микобактерий значительно повышается. Особенно возрастает устойчивость микобактерий туберкулеза в высохшей мокроте. Чтоб обезвредить жидкую мокроту, ее нужно кипятить в течение 5 мин. В высохшей мокроте микобактерии туберкулеза погибают при 100 ° С через 45 минут.
К сожалению, многие пациенты имеют привычку отхаркивать мокроту на улице и в общественных местах. В солнечные дни в тонком слое жидкой мокроты под влиянием ультрафиолетовых лучей микобактерии туберкулеза погибают через 2–3 мин. В высохшей на солнце мокроте микобактерии туберкулеза не определяются. Но если мокрота попадет в темное место, то находящиеся в ней микобактерии могут сохранять жизнеспособность в течение 6–12 мес. Если мокрота попадает в сточные воды или на поля орошения, микобактерии туберкулеза сохраняют свою вирулентность более 30 дней.
Микобактерии туберкулеза неодинаково устойчивы против воздействия различных дезинфицирующих средств. Они устойчивы к воздействию многих дезинфицирующих средств: кислот, фенола, хлорамина, ЧАС, производных гуанидина и некоторых кислородсодержащих препаратов. Большой проблемой является способность микобактерии туберкулеза формировать устойчивость к дезинфекционным веществам. Альдегиды и другие средства, обладающие фиксирующим действием, неэффективны в отношении микобактерий, находящихся в мокроте.
Еще одна проблема – множество путей и факторов передачи туберкулезной инфекции (аэрогенный – аэрозольный, воздушно-пылевой, а также алиментарный и контактный) и следующее из этого разнообразие объектов обеззараживания. При туберкулезе дезинфекции подлежат: воздух, столовая и лабораторная посуда, мокрота, выделения больных, остатки пищи, белье, предметы ухода за больными, изделия медицинского назначения, медицинские отходы, поверхности (помещения, аппараты, приборы), руки медицинского персонала и пр. Причем, каждый из этих объектов требует индивидуального подхода к проведению дезинфекции. В каждом случае необходим выбор методов, средств, технологии и режимов обработки.
Выбор дезинфицирующих средств, способных обеспечить эффективную дезинфекцию
Раньше эффективность дезинфицирующих средств в отношинии микобактерии туберкулеза проверяли на эталонном штамме Mycobacterium B-5. Однако в экспериментальной работе Еремеевой Н.И. (2009 г.) было установлено, что при воздействии на клинические и музейные штаммы M tuberculosis средствами, тестированными на эталонном штамме Mycobacterium B-5, наблюдалась недостаточная их эффективность. Так после воздействия растворов ряда хлорсодержащих средств количество колоний микобактерий составляло от 0,25±0,1 до 67,8±10,7, после кислородсодержащих – 1,8±1,2, альдегидсодержащих – от 2,7±0,9 до 38,0±10,9; после КПАВ от 8,4±2,5 до 146,7±1 КОЕ.
С учетом определения эффективности дезинфицирующих средств по новой методике рекомендуется:
- при профилактической и текущей дезинфекции обработку поверхностей в помещениях, предметов ухода проводить моюще-дезинфицирующими туберкулоцидными средствами, не обладающими ингаляционной опасностью, а изделия медицинского назначения обрабатывать препаратами на основе альдегидов, кислородсодержащих соединений, надкислот;
- для проведения заключительной дезинфекций и генеральных уборок применять более надежные, универсальные средства. К ним относят: таблетки на основе дихлоризоциануровой и трихлорциануровой кислоты, хлорпроизводные гидантоина, композиции альдегидов и КПАВ.
Для обеззараживания мокроты рекомендуются хлорактивные дезинфицирующие средства (ДС) неорганической и органической природы. Такая целесообразность обуславливается тем фактом, что неорганические соединения хлора обладают уникальной способностью гомогенизировать органические вещества с экзотермической реакцией, что способствует более эффективному проникновению хлора в глубь субстрата и контакту с микроорганизмами.
Для снижения концентрации аэрозолей в воздухе помещений могут использоваться аэрозоли дезинфицирующих средств – диоксида хлора, перекиси водорода и композиций на ее основе, кислородактивных (НУК). Воздействие аэрозолями дезинфицирующих средств проводится при проведении дезинфекции по типу заключительной и при генеральных уборках в отсутствии людей с помощью специальной распыляющей
аппаратуры (генераторы аэрозолей).
Для эффективного обеззараживания объектов при туберкулезе рекомендуется использовать сочетанные методы дезинфекции. Например, при стирке белья сочетают физический метод обработки высокими температурами и химический метод с применением порошков, обладающих дезинфицирующими свойствами. Аналогичным образом сочетается температурный фактор и действие дезинфицирующего средства в установках для мытья посуды.
Профилактика устойчивости к дезинфицирующим средствам
С целью предупреждения формирования резистентности к ДС у возбудителей туберкулеза рекомендуется четко следовать рекомендациям по применению ДС в части соблюдения
концентрации, экспозиции, температуры. Необходимо избегать применения растворов в заниженных концентрациях. Также предусматривается использование дезинфицирующих средств из разных химических групп, отличающихся механизмом действия, и их правильное чередование при проведении текущих обработок и генеральных уборок. Не рекомендуется длительное хранение ДС и многократное использование рабочих растворов.
Нормативно-методическое регулирование использование дезинфицирующих средств при туберкулезе
Дезинфицирующие средства, содержащие в качестве действующих веществ (ДВ) соединения из группы поверхностно-активных веществ (ПАВ) [1], в частности четвертично-аммониевые соединения (ЧАС), имеют ряд преимуществ: их можно применять в присутствии пациентов (персонала) в лечебно-профилактических учреждениях (ЛПУ) и др.; они не раздражают верхние дыхательные пути, не имеют резкого запаха, не обесцвечивают ткани, не вызывают коррозии металлов. Кроме того, многие из них обладают, наряду с дезинфицирующими свойствами, моющим действием, что позволяет сочетать обеззараживание объектов с удалением загрязнений. В связи с этим дезинфектанты на основе ПАВ наиболее удобны при проведении текущей и профилактической дезинфекции.
Долгое время считалось, что к недостаткам средств из группы ПАВ можно отнести отсутствие способности инактивировать мелкие, не имеющие липидной оболочки РНК-содержащие, так называемые "гидрофильные" вирусы (энтеровирусы, вирусы полиомиелита и др.), вызывать гибель спор, микобактерий туберкулеза, некоторых видов грибов. В связи с этим такие средства были известны, в основном, как бактерициды и только некоторые из них - как слабые вирулициды, эффективные в отношении лишь некоторых "липофильных" вирусов (вирусы гриппа, парагриппа и др.).
Для расширения спектра антимикробной активности при разработке новых средств на основе ПАВ в состав их рецептур стали вводить такие компоненты, как глутаровый альдегид, перекись водорода и др., обуславливающие вирулицидное (Бианол, Аламинол, Пероксимед, ПВК, Септодор-форте и др.), туберкулоцидное и фунгицидное действие.
Учитывая, что для дезинфекции изделий медицинского назначения (ИМН) могут применяться только те средства, которые эффективны в отношении вируса гепатита В, других парентеральных вирусов и ВИЧ, а также необходимость обеззараживания всех ИМН после применения у пациентов, большой спрос и актуальность имеют средства, обладающие вирулицидным действием. В связи со сложившейся в стране ситуацией по туберкулезу не меньшую значимость приобретают средства для профилактики туберкулеза. Широкая распространенность дерматофитий определяет существенную роль фунгицидов в профилактике грибковых инфекций в ЛПУ, гостиницах, общежитиях, банях и др.)
В последние годы для регистрации в России из зарубежных стран все чаше стали поступать средства, содержащие в своих рецептурах ПАВы, предназначенные для дезинфекции при вирусных инфекциях (гепатите В, ВИЧ-инфекции), туберкулезе и грибковых инфекциях. При разработке отечественных средств больше внимания также стало уделяться приданию им вирулицидных, туберкулоцидных и фунгицидных свойств.
Нами проведена оценка спектра антимикробного действия некоторых средств, производимых в России и за рубежом, содержащих ПАВы в качестве действующих (ДВ). Для оценки вирулицидной активности использовали тест-вирус (вирус полиомиелита 1 типа, вакцинный штамм LSc 2ab), являющийся высокорезистентным к действию дезинфицирующих средств из различных химических групп; изучение туберкулоцидной и фунгицидной активности проводили с использованием культур Mycobacterium В5, Candida albicans, Trichophyton gypseum [2].
Перечень средств и спектр их антимикробной активности приведены в таблице.
Таблица
Спектр антимикробного действия некоторых дезинфицирующих средств из группы ПАВ отечественного и зарубежного производства
| Наименование средства, фирма-производитель | Действующие вещества | Антимикробное действие | |||
| Вирулицидное | Туберкулоцидное | Фунгцидное | |||
| Инактивация вируса полиомиелита | Разрушение HbsAg | ||||
| Катамин АБ ОАО "Синтез", Москва | ЧАС | - | не исследовалось | не исследовалось | не исследовалось |
| ПВК ОАО "Синтез", Москва | ЧАС, Перекись водорода | + | + | + | + |
| Аламинол ГНЦ "НИОПИК", Москва | ЧАС, глиоксаль | + | + | + | + |
| Бианол ГНЦ "НИОПИК", Москва | ЧАС, глутаровый альдегид | + | + | + | + |
| Септодор-форте Дорвет Лтд, Израиль | ЧАС, глутаровый альдегид | + | + | + | + |
| Септустин АОЗТ "Уралстинол-С", Россия | ЧАС | + | + | + | + |
| Септаксилин ЗАО "Акс-техно", Россия | ЧАС | + | + | + | + |
| Дезэффект "Ликва-Тех. Индастриес, Инк", США | ЧАС | + | + | + | + |
| РИК-Д ПКФ "Фантом", Россия | ЧАС | - | + | не исследовалось | + |
| Велтолен ЗАО "BEЛT", Оренбург | ЧАС | - | + | + | + |
| Септабик "Абик", Израиль | ЧАС | - | + | не исследовалось | + |
| Бромосепт "Абик", Израиль | ЧАС | - | + | + | + |
Согласно данным, приведенным в таблице, катамин АБ не способен инактивировать тест-вирус, но в сочетании с перекисью водорода (в виде средства ПВК) композиция приобретает вирулицидное действие. Наличием перекиси водорода обусловлена вирулицидная активность Пероксимеда. Широкий спектр активности Бианола, Аламинола и Септодора-форте объясняется присутствием в рецептурах этих средств альдегидов.
Совершенно непредсказуемым оказалось наличие вирулицидного действия, причем в отношении высокорезистентного вируса - вируса полиомиелита, у таких средств, как Септаксилин, Септустин и Дезэффект (прежнее название Санифект-128, в разработке и исследованиях средства Дезэффект принимали участие З. Гэлб, США, А.В. Ригберг и И.Л. Михно, Украина). Показано, что они вызывают гибель тест-микроорганизмов: Mycobacterium В5, С.albicans и T.gypseum. Кроме того, установлено, что растворы Дезэффекта при температуре 50 о С способны вызывать гибель спор B.cereus. Изучение в лабораторных условиях эффективности обеззараживания тест-объектов из различных материалов (металлов, стекла, резин, пластмасс и др.), контаминированных микобактериями, грибами и вирусами, позволило рекомендовать средства Септаксилин, Септустин и Дезэффект для дезинфекции поверхностей в помещениях, приборов, оборудования, белья, посуды и др. объектов при туберкулезе, вирусных и грибковых инфекциях в ЛПУ.
Исследования, проведенные в НИИ вирусологии им. А.И. Ивановского (Исаева Е.И.) показали, что средства Велтолен, Септабик, Бромосепт и РИК-Д способны разрушать HBsAg. Однако эти средства не вызывали инактивацию тест-вируса (вирус полиомиелита), более устойчивого к воздействию дезинфектантов, чем HBsAg. Установлено, что они способны также вызывать гибель грибов рода Candida и Trichophyton, а Велтолен и Бромосепт, кроме того, активны в отношении Mycobacterium В5 (исследование туберкулоцидных свойств Септабика и РИК-Д не проводилось).
Были изучены дезинфицирующие свойства Велтолена и Бромосепта при обеззараживании тест-поверхностей и изделий медицинского назначения из различных материалов, белья, посуды, предметов ухода за больными, контаминированных бактериями (в том числе микобактериями), вирусами (ВИЧ, HBsAg), грибами (рода Candida, Trichophyton) в зависимости от времени воздействия, концентрации раствора, способа обработки. Разработаны режимы обеззараживания ИМН и других объектов, вошедшие в методические указания по применению этих средств.
Таким образом, получена новая информация о спектре антимикробной активности средств из группы ПАВ, а именно: о способности некоторых из них - Септаксилина, Септустина, Дезэффекта инактивировать даже высокорезистентные к дезинфицирующим средствам мелкие РНК-содержашие вирусы, типичным представителем которых является вирус полиомиелита; о наличии у средств РИК-Д, Велтолен, Септабик, Бромосепт свойства разрушать HBsAg, выявляемого современными методами его индикации; способности вышеназванных средств из группы ПАВ вызывать гибель микобактерий туберкулеза, грибов рода Candida и дерматофитов рода Trichophyton.
Все вышеназванные средства зарегистрированы в России и разрешены МЗ РФ к применению в практике здравоохранения.
Литература
1. В.И. Вашков. "Антимикробные средства и методы дезинфекции при инфекционных заболеваниях", М., 1977.
2. "Методы испытаний дезинфекционных средств для оценки их безопасности и эффективности", Москва, Минздрав РФ, 1996 г.
Многие полагают, что среди средств дезинфицирующих, предназначенных для бактерицидной дезинфекции поверхностей, преобладают препараты на основе активного хлора. Вопреки сложившемуся стереотипу, последние исследования, проведенные специалистами портала ДЕЗРЕЕСТР (www.dezreestr.ru), показали, что среди дезинфектантов, обладающих режимами бактерицидной дезинфекции поверхностей, основная доля (19,6% наименований) приходится на средства дезинфицирующие, содержащие в качестве действующего вещества только один компонент – четвертичные аммониевые соединения (ЧАС).
Широкая распространённость средств на основе только ЧАС связана с их относительно низкой токсичностью и отсутствием выраженного коррозионного воздействия на предметы обихода и медицинский инструментарий.
Как правило, в ассортименте каждого производителя дезсредств есть одно или несколько наименований, содержащих в качестве действующего вещества (ДВ) только ЧАС. Это связано с доступностью сырья и его относительно низкой стоимостью. Достаточно сказать, что цена 1 кг субстанции, содержащей 50% ЧАС, стоит примерно 150-250 руб. и зависит от производителя субстанции и вариаций состава ЧАС. Упрощенно говоря, задача производителя дезсредства – разбавить субстанцию и добавить вспомогательные компоненты (ПАВ, соли, кислоты и др.).
Таким образом, средства на основе ЧАС удобны как для потребителей (низкая токсичность, малая коррозионная активность), так и для производителей (доступность сырья и относительно низкая его стоимость).
Для того чтобы среди большого количества торговых марок (более 100 наименований) средств на основе только ЧАС выбрать требуемый дезпрепарат, необходимо обладать знаниями о бактерицидных концентрациях ЧАС в рабочих растворах дезинфектантов.
Нужно отметить, что ответ на вопрос о бактерицидных концентрациях ЧАС в рабочих растворах до сих пор ставит в тупик многих практикующих больничных эпидемиологов. Одни считают, что ЧАС эффективны в крайне малых концентрациях, другие, наоборот, утверждают, что ЧАС не эффективны в малых концентрациях
Для того чтобы досконально разобраться с вопросом эффективных концентраций ЧАС, обратимся к научным исследованиям. Первое что нам необходимо - это разобраться с терминологией. Существует, как минимум, два научных термина, связанных с концентрацией бактерицидных агентов: минимальная ингибирующая концентрация (МИК) и минимальная бактерицидная концентрация (МБК).
Применительно к дезсредствам на основе ЧАС термин минимальная ингибирующая концентрация (МИК) трактуется следующим образом: это минимальная концентрация ЧАС в рабочем растворе дезсредства, которая предотвращает рост бактериальных клеток. Следует отметить, что МИК не обеспечивает полного уничтожения бактериальных клеток, а лишь препятствует размножению бактерий.
Термин минимальная бактерицидная концентрация (МБК) применительно к ЧАС можно сформулировать таким образом – это минимальная концентрация ЧАС в рабочем растворе дезсредства, при которой обеспечивается полное уничтожение клеток бактерий.
МИК и МБК являются параметрами специфическими и часто характеризуют определенный штамм какого-либо бактериального микроорганизма, более того, термин МИК более характерен для исследования активности антибиотиков, но тем не менее, часто используется в научной литературе при исследовании активности дезсредств. В контексте данной статьи МИК - это бактериостатическая концентрация, тем не менее, будем использовать более общий термин - МИК.
Таким образом, для целей бактерицидной дезинфекции необходимо чтобы в рабочем растворе концентрация ЧАС была, по крайней мере, не менее МБК, более того, концентрация ЧАС в растворе не должна быть меньшей МИК.
В сороковых годах прошлого века, когда ученые активно исследовали новую по тем временам дезинфицирующую субстанцию - ЧАС, некоторыми исследователями была сделана методическая ошибка: они приняли МИК за МБК. Далее эта ошибка была исправлена путем введения в методику исследований этапа нейтрализации ДВ и др.
Всё дело в том, что если обработать контаминированные объекты раствором, содержащим ЧАС в концентрациях равных МИК, визуальный контроль эффективности покажет отсутствие роста микроорганизмов на питательной среде. Но этот факт не будет означать, что бактерии уничтожены. Это будет лишь свидетельством того, что живые бактерии находятся в условиях, неблагоприятствующих их размножению. И если, к примеру, в систему, где не наблюдался рост, добавить стерильную воду, через некоторое время можно будет наблюдать рост микроорганизмов, так как концентрация ЧАС в системе стала меньше МИК (за счет разбавления водой) и более не мешает запуску механизмов размножения у бактерий.
Итак, для того чтобы средство на основе ЧАС эффективно уничтожало бактерии, необходимо, чтобы концентрации ЧАС в рабочих растворах были не менее МБК, и уж тем более, не меньшей МИК (бактериостатических концентраций).
В таблице, приведенной ниже, собраны данные о значениях МИК и МБК для ЧАС, полученные исследователями для микроорганизмов в разных лабораториях.

Данные, приведенные в таблице, свидетельствуют, что жесткой границы между МБК и МИК по отношению к ЧАС указать невозможно. Более того, на первый взгляд, приведенные данные кажутся не совсем логичными. Так, например, для некоторых микроорганизмов, минимальные ингибирующие концентрации ЧАС, определенные одними авторами, могут быть выше минимальных бактерицидных концентраций ЧАС, но определенных другими исследователями.
Все это легко объяснимо тем, что в разных работах исследовались различные микроорганизмы с различной устойчивостью к ЧАС. Многие штаммы, описанные в таблице - это не музейные культуры, а реальные микробы, взятые непосредственно с объектов, или выделенные из субстратов.
Можно утверждать, что в большинстве случаев при концентрации ЧАС в растворе 0,01% (по ЧАС) будет проявлять бактерицидное действие на штаммы S. Aureus, E. Coli, но на некоторые устойчивые штаммы – только ингибирующее (бактериостатическое).
В одной из работ 4 , было установлено, что реально существующий штамм сальмонеллы S. Typhimurium оказался устойчив к концентрации ЧАС 0,0256% (МИК).
Таким образом, для бактерий S. Aureus, E. Coli можно определить ограничение на необходимое содержание ЧАС в растворе: оно должно быть не менее 0,01% ЧАС, для того чтобы уничтожить возможные устойчивые штаммы указанных микроорганизмов.
Для сальмонелл, на примере устойчивого штамма S. Typhimurium, можно условно определить нижнюю границу эффективности содержания действующего вещества в растворах как 0,025% ЧАС. Такая концентрация, вероятно, может справиться с большинством устойчивых вариаций сальмонелл.
Таким образом, несмотря на большой разброс данных, касающихся бактерицидных и бактериостатических концентраций ЧАС, путем сопоставления и анализа данных можно сделать следующие выводы:
- для предотвращения образования устойчивых штаммов бактерий типа S. Aureus, E. Coli необходимо выбирать такие средства на основе только ЧАС, у которых режимы гарантируют наличие в рабочем растворе 0,01% ЧАС и более;
- для предотвращения образования устойчивых штаммов бактерий сальмонелл необходимо выбирать такие средства на основе только ЧАС, у которых режимы гарантируют наличие в рабочем растворе 0,025% ЧАС и более;
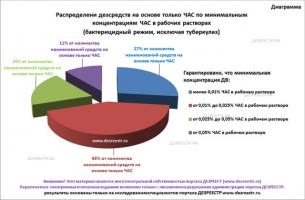
Каково же распределение средств на основе только ЧАС в зависимости от концентраций ЧАС в рабочих растворах в режимах бактерицидной дезинфекции поверхностей? Есть ли на рынке такие средства? Ответы на эти вопросы наглядно представлены на диаграмме, приведенной ниже.

Как видно, 19% от наименований существующих препаратов на основе только ЧАС в бактерицидных режимах гарантированно обеспечат концентрации ДВ в рабочих растворах от 0,025% до 0,05%, и 11% от наименований торговых марок дезинфектантов на основе только ЧАС, в антибактериальных режимах обеспечат концентрацию ЧАС в рабочих растворах не менее 0,05%. Всё это свидетельствует, что на российском рынке существуют средства на основе ЧАС, которые могут оказаться эффективными при бактерицидной (иск. туберкулез) дезинфекции поверхностей.
При использовании этой группы дезсредств необходимо учитывать высокую вероятность образования устойчивых штаммов возбудителей ВБИ, поэтому необходимо обеспечить мониторинг устойчивости бактериальной микрофлоры, циркулирующей в ЛПО, для своевременного проведения ротации дезинфектантов.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Mazzola P. G., Jozala A. F., Novaes L. C. L. , Moriel P. , Penna T. C. V. Minimal inhibitory concentration (MIC) determination of disinfectant and/or sterilizing agents, Brazilian Journal of Pharmaceutical Sciences v. 45, р.241-248, 2009
2. Fazlara A., Ekhtelat M. The Disinfectant Effects of Benzalkonium Chloride on Some Important Foodborne Pathogens, American-Eurasian J. Agric. & Environ. Sci., 12(1), p. 23-29, 2012
3. Bridier A. , Briandet R., Thomas V., Dubois-Brissonnet F. Comparative biocidal activity of peracetic acid, benzalkonium chloride and ortho-phthalaldehyde on 77 bacterial strains, Journal of Hospital Infection v. 78, p. 208-213, 2011
4. Aylin Akoglu, Evrim Gunes Altuntas, Gokce Polat Yemis A Modified Selective Medium Containing Benzalkonium Chloride (BKC) for the Isolation of Pseudomonas aeruginosa from Raw Milk, Food and Nutrition Sciences, v.3, p. 947-950, 2012
5. Pseudomonas aeruginosa cells adapted to benzalkonium chloride show resistance to other membrane-active agents but not to clinically relevant antibiotics
1) Обоснования выбора дезинфектантов - стерилянтов.
2) Тактика выбора антисептика для рук.
ЧАС, глутаровый альдегид – вопросы и ответы (токсичность для персонала, реальное воздействие на возбудителей).
Причины недостаточной эффективности дезсредств.
Обоснования выбора химических дезинфицирующих и стерилизующих средств.
Основные действующие компоненты антисептиков.
Приоритет- этанолсодержащим – почему?
Каковы предложения отечественных и зарубежных производителей спиртовых антисептиков ( практический анализ).
– 1. Нами проведенные исследования дают основания утверждать, что микроорганизмы более устойчивы к дезинфектантам в сравнении с литературными данными.
– 2. Мутагенные изменения, происходящие в бактериальной клетке, являются следствием действия дезинфектанта на пороге их жизнедеятельности. Микроорганизмы находятся в "дремлющем состоянии", при благоприятных условиях они опять таки могут вызвать патогенные процессы.
3.1. ИЗУЧЕНИЕ БАКТЕРИЦИДНОГО И БАКТЕРИОСТАТИЧЕСКОГО ДЕЙСТВИЯ ДЕЗИНФИЦИРУЮЩИХ И АНТИСЕПТИЧЕСКИХ
СРЕДСТВ ПРОТИВ САНИТАРНО-ПОКАЗАТЕЛЬНЫХ ТЕСТ-
МИКРОБОВ (E.coli, St.epidermidis, Pr.vulgaris, Ps.aeroginosa,
Salmonella cholera suis)
Особенно надо отметить, что выделенные из объектов окружающей среды бактерии (выбранные из группы тест-микробов) проявляют высокую резистентность по сравнению с референтными штаммами. Это явление, по нашему мнению, связано с частым контактом вышеупомянутых микроорганизмов с антисептическим и дезинфицирующими средствами и естественным отбором селективных мутантов.
Тут резистентность протеуса и синегнойной палочки превосходит спорообразующих микроорганизмов (Cl.perfringens), что требует большого внимания медиков и ветеринаров при проведении дезинфекции.
Против использованных тест-микробов лучший бактерицидный и бактериостатический эффект проявил водный раствор иода. Его 1%водный р-р с 2-хчасовой экспозицией губительно действует как на референтные штаммы, так и на микробы-изоляты.
3.5. МУТАГЕННЫЙ ЭФФЕКТ ДЕЗИНФИЦИРУЮЩИХ И
АНТИСЕПТИЧЕСКИХ СРЕДСТВ
Тест-микробы E.coli, Ps.aeroginosa, Pr.vulgaris, Salmonella cholera suis в течении 5 лет находились в пробирках с дезинфектантом. Они не утратили свою жизнедеятельность. Бактериальные клетки проявили устойчивость к дезинфектантам (таблица 4, 5).
Однако приобретая устойчивость к дезинфектанту, а тем более сразу к нескольким дезинфектантам, такие бактерии получают наивыгоднейшие преимущества: благодаря селективному давлению дез.растворов происходит вытеснение чувствительных к ним штаммов данного вида, а дезинфектантоустойчивые варианты выживают и начинают играть главную роль в эпидемиологии данного заболевания. Именно они и становятся источниками формирования тех типов бактерий, которые обеспечивают устойчивость.
Эксперименты показывают, что раньше всего гены дезинфицируюшей устойчивости к каждому новому дезинфектанту появляются у клинических штаммов, а затем начинается их дальнейшая циркуляция в природе.
Безопасность на рабочем месте: ЛПУ
Тактика выбора антисептика для рук.
1) ЗНАЧЕНИЕ СРЕДСТВ АНТИСЕПТИКИ И ТАКТИКА ИХ ВЫБОРА В ПРОФИЛАКТИКЕ ВНУТРИБОЛЬНИЧНЫХ ИНФЕКЦИЙ
Большое значение имеет правильный выбор антисептиков для гигиенической и хирургической обработки рук
Для создания антисептиков в настоящее время применяют всего около 10 химических веществ и соединений, отвечающих требованиям микробиологической эффективности и токсичности: спирты, галогены, катионные поверхностно-активные вещества (ПАВ), окислители
По составу выделяют водные и спиртосодержащие кожные антисептики, по форме выпуска – гели, жидкие средства (растворы) и салфетки. Для обеззараживания рук применяют спиртосодержащие и другие разрешенные к применению в ЛПУ кожные антисептики, в том числе гели в индивидуальной упаковке (флаконы)
Наиболее перспективной и эффективной группой кожных антисептиков признаны спиртосодержащие препараты как безопасные и не оказывающие токсического действия на кожу.
Спирты не обладают спороцидной активностью, но активны в отношении большинства грамположительных и грамотрицательных бактерий, оказывают вирулицидное и фунгицидное действие, активны в отношении микобактерий туберкулеза. Важное достоинство спиртосодержащих средств – их эффективное действие на микроорганизмы с множественной лекарственной резистентностью
Этиловый спирт (этанол) является хорошим природным антисептиком, минимально токсичным при максимальной эффективности. Для обработки им кожи рук требуется минимум времени и, что важно, у микрофлоры не развивается резистентность к нему.
Этиловый спирт не вызывает аллергии.
Антисептические препараты, действующим веществом (ДВ) которых является хлоргексидин биглюконат, имеют достаточно широкий спектр активности. Они более активны в отношении грамположительных бактерий, оказывают незначительное действие на грибы, но малоактивны в отношении грамположительных бактерий и микобактерий туберкулеза. Скорость развития бактерицидного действия хлоргексидина – средняя.
Медицинские работники наиболее удобными признают гелевые антисептики, которые применяются для гигиенической и хирургической обработки рук. Гель не расслаивается, хорошо удерживается при нанесении на руки, что позволяет втирать его в кожу в полном объеме, без потерь. Особенно удобны гелевые антисептики для врачей скорой медицинской помощи, участковых врачей, при выездах на дом, у постели больного и в чрезвычайных ситуациях. Недостаток гелевых антисептиков – невозможность их использования для обработки кожи операционного и инъекционного полей и их неустойчивость к отрицательным температурам
Антисептическое действие пропиловых спиртов также основано на денатурации белков микроорганизмов.
Минусом пропанол-содержащих препаратов является
- их малая активность в отношении устойчивых форм вирусов,
- и, кроме этого, пропанолы, относящиеся к 3-му классу умеренно-опасных веществ значительно токсичнее этанола.
Помимо негативного воздействия на кожу и непереносимый многими запах, пропанолы токсичны при вдыхании, их ПДК в воздухе в 100 раз ниже, чем у этанола.
3) Есть ли отличия в антимикробной активности этилового и изопропилового спирта?
4) Токсичность компонентов дез. средств:
ПДК (предельно допустимая концентрация) в воздухе раб. Зоны (пары) мг/м.куб.
Этанол –1000 (4 класс токсичности),
Пропанол – 10, (3 класс токсичности)
Алкилдиметиламмоний хлорид (ЧАС) – 1, (2 класс токсичности)
А) Веткина И.Ф., Комаринская Л.В., Ильин И.Ю., Cоловьева М.В.
СОВРЕМЕННЫЙ ПОДХОД К ВЫБОРУ ДЕЗИНФИЦИРУЮЩИХ СРЕДСТВ В СИСТЕМЕ ПРОФИЛАКТИКИ ВНУТРИБОЛЬНИЧНЫХ ИНФЕКЦИЙ (ВБИ)
ФАРМиндекс-Практик" выпуск 7 год 2005 стр. 13-20
Четвертичные аммониевые соединения (ЧАС). В 1916 году начали появляться данные об антимикробной активности ЧАС, однако настоящий бум начался в 1935 году. Большинство экспериментальных работ в середине 30-х годов было посвящено ЧАС, показан широкий спектр антимикробной активности, включая спороцидную и туберкулоцидную активность при низких концентрациях (Dogmak, 1935). В 40-х годах было показано, что эти данные были результатом неадекватной нейтрализации ЧАС при проведении экспериментов in vitro и статический эффект был принят за цидный. В настоящее время на территории США, Японии, Европы препараты на основе ЧАС запрещены к применению для обработки инструментов и эндоскопов и остаются актуальны лишь для предметов больничного окру-жения или в пищевой промышленности [11].
Однако, в России из всех зарегистрированных на рынке препаратов, на долю ЧАС приходится 35%. Относительно их эффективности, особенно в отношении полирезистентной больничной флоры, вирусов и микобактерий в нашей стране несколько лет велись дебаты, в то время как зарубежные руководства (например рекомендации Ассоциации специалистов по противоинфекционной работе и эпидемиологии) рекомендуют использование ЧАС для рутинной очистки мебели, стен, полов, некритичных предметов и оборудования [4]. На Съезде дезинфекционистов в 2002 году академик М.Г.Шандала подтвердил сомнительную активность ЧАС в отношении вирусов и микобактерий туберкулеза [1]. Из более чем 150 зарегистрированных ЕРА ( Агенство США по охране окружающей среды) в США поверхностных дезинфектантов, разрешенных для дезинфекции при туберкулезе, имеется только 3 рецептуры, имеющие в комбинации ЧАС (в России не зарегистрированы и аналогов не имеют). В нашей же стране все дезинфектанты на основе ЧАС разрешены для дезинфекции при туберкулезе
Основные характеристики дезинфектантов и химических стерилянтов, используемых в здравоохранении (S.S.Block, 2001 [8] с изм. и доп.)
| Действующее вещество | Активность | Преимущества | Недостатки | Использование | |
| Четвертичные аммониевые соединения | Эффективность против грамм положительных и некоторых граммотрицательных вегетативных Бактерий, грибов, липофильных вирусов. | Детергентная активность. (моющее действие) | Подавление эффективности в присутствии органических материалов. Нет спороцидного и туберкулоцидного эффектов, отсутствие эффективности против гидрофильных вирусов. Легко абсорбируются и нейтрализуются многими материалами ( хлопок, шерсть). Несовместимы с мылом из-за щелочности. Некоторые могут быть контаминированы Гр (-) мк/о. | Рутинная очистка стен, полов, мебели. Могут использоваться для дезинфекции некритических поверхностей | |
ЧАС проявляют сравнительно узкий спектр противомикробной активности — эффективны в отношении возбудителей кишечных и капельных инфекций бактериальной этиологии, грибов некоторых внеклеточно расположенных вирусов, однако недостаточно активны в отношении культур Proteus vulgaris, Proteus morganii, Pseudomonas aeruginosa, что существенно ограничивает возможности их применения для профилактики нозокомиальных инфекций. По данным [17], около 89,5% госпитальных штаммов микроорганизмов рода Proteus резистентны к ЧАС. Имеют место случаи нозокомиальных инфекций (сепсис с высоким процентом летальности), которые связаны с использованием в клинике растворов ЧАС, контаминированных культурами Pseudomonas aeruginosa [18]. Большинство препаратов этой группы не активны в отношении внутриклеточно локализованных вирусов, споровых форм бактерий и микобактерий туберкулеза [19, 20, 21]
Расширение Роспотребнадзором перечня лабораторий, осуществляющих испытание дезпрепаратов для их последующей госрегистрации, без организации действенного, экспериментально подтверждаемого контроля за профессионализмом, объективностью, стандартностью проводимых в этих лабораториях испытаний и выдаваемых рекомендаций, создало опасную тенденцию появления дезсредств с сомнительными по обоснованности и эффективности режимами применения.
В первую очередь, это касается дезсредств на основе ЧАС. Доля таких препаратов, как отмечалось выше, составляет около 60% от всех зарегистрированных средств и порядка 80- 90% от средств, используемых в ЛПУ.
Таким образом, ЧАС создают неблагоприятную среду для жизни спор, но не умерщвляют их. Как только споры бактерий оказываются отмытыми от ЧАС, они переходят в вегетативные формы и микроорганизм продолжает размножаться.
| Санитель (гель) | Россия, Джонсон | Этанол - (62,0%), глицерин |
| Деласепт - гель | Россия, Петроспирт | Этанол- (67,9%) Феноксиэтанол - (0,84%) |
| Хосписепт (р-р), Хосписепт - спрей Хосписепт-Тух (салф.) | Россия, Лизоформ | Пропанол - 1, (55%) Этанол – (15%) |
| Софта-ман (руки) (гель) | Б. Браун, Щвейцария | Пропанол -1, (18%) Этанол - (45%) |
| Ахдез 3000 (ж-сть) | Россия, Петроспирт | Этанол - (79,0%), Глицерин Хлоргексидин - (0,5%) |
| Амидин плюс (ж-сть) | Россия, Петроспирт | Этанол - (34,1%) 2-Феноксиэтанол- (1,2%) Хлоргексидин – (0,7%) |
| Софта-ман (руки) (ж-сть) | Б. Браун, Щвейцария | Пропанол -1, (18%) Этанол - (45%) |
| Йодполиком (ж-сть) (опер. поле) | Россия, Инполимед-В | Йод - (3%), полимер (6%) Этанол |
Новый концентрат группы перекисных соединений, содержащий в качестве действующих веществ пероксид водорода (50%) и комплексные соли серебра (750 мг/Л).
Присутствие в составе комплексных солей серебра позволяет пролонгировать эффект дезинфекции, усиливает действие пероксида водорода и проникающие свойства препарата в целом
Разрешен для применения в отделениях неонатологии, роддомах, палатах новорожденых.
Имеет хорошие моющие и дезодорирующие свойства, не портит обрабатываемые объекты (из дерева, стекла, пластмасс, других полимерных материалов, коррозионностойкого металла, резин, керамики), не фиксирует органические загрязнения
SEKUSEPT® AKTIV - 50г Перборат натрия моногидрат (Эколаб)
(гибкие эндоскопы –очистка (0,5% - 15 мин), дезинфекция (2% - 5 мин)
ДВУ (2% - 5 мин), стерилизация (2% - 90 мин)
Хелипур Ультра - 50% пербората натрия, лимонную кислоту 20 %
(Б.Браун Медикал А.)
В качестве причин необеспечения необходимой целевой эффективности при применении дезинфицирующего средства, в данной работе указываются:
· неправильный выбор дезсредства по его антимикробным свойствам и назначению самим потребителем (персоналом ЛПУ);
· отступление персоналом от рекомендаций, данных в инструкции по применению;
· фальсификация средства или фальсификация рекомендаций в инструкциях производителем или продавцом дезсредства
Письма НИИД Роспотребнадзора . 10.05.2011 г.
О совершенствовании экспертизы дезинфицирующих средств.
В соответствии с поручением Роспотребнадзора, специалисты НИИД приступили к анализу материалов , характеризующих прошедшие государственную регистрацию дез. средств.
Об использовании дезсредств.
В НИИД проведен анализ материалов, характеризующих дезсредства, также проведены выборочные исследования ряда дезсредств с целью подтверждения их заявленной эффективности в режимах, указанных в инструкциях.
Установлено, что в отношении возбудителей туберкулеза не эффективны ВСЕ средства на основе ЧАС и производных гуанидина.
Средства из группы ПАВ- на основе ЧАС, производных гуанидина, третичных аминов не обладают спорацидным действием не могут применятся для целей стерилизации ИМН, для ДВУ эндоскопов, а также для дезинфекции объектов, контаминированых спорами, в первую очередь возбудителем сибирской язвы.
Учитывая, что в предстоящие месяцы, многие ЛПУ будут формировать заявки на закупку дезсредств на 2012 г, Роспотребнадзор рекомендует внимательно изучить состав предлагаемых к закупке препаратов, не допускать приобретения тех из них, которые по своему составу не смогут обеспечить требуемой эффективности.
МР 3.5.1.- 2011 . Дезинфектология (Проект)
Обоснования выбора химических дезинфицирующих и стерилизующих средств для применения в организациях, осуществляющих медицинскую деятельность
3. Критерии выбора средств для дезинфекции ИМН
3.3 В отношении устойчивых вирусов – полиомиелита,Коксаки, ЕСНО, гепатита А, не выбирают и не применяют неактивные средства на основе изопропилового спирта, водных растворов хлоргексидина биглюконата, клатрата дидецилдиметиламмония бромида с мочевиной.
Для дезинфекции при инфекциях, вызываемых ротавирусами, норовирусами, аденовирусами, риновирусами со средней устойчивостью к химическим средствам выбирают те же средства, что и в отношении устойчивых вирусов, если в инструкции по применению средства нет режимов, эффективных в отношении конкретных вирусов.
3.5 Туберкулоцидная активность присуща средствам на основе перечисленных соединений, за исключением ЧАС и полимерных производных гуанидина.
3.6 Спороцидной активностью обладают дезсредства на основе альдегидов, кислородосодержащих соединений , хлорсодержащих соединений.
6. Критерии выбора кожных антисептиков
6.1 Критерии выбора кожных антисептиковдля обработки рук медработников
6.1.6. Антисептики на основе этилового спирта вызывают гибель бактерий ( в том числе микобактерии туберкулеза), вирусов ( в том числе , относящихся к группе устойчивых- энтеровирусов Коксаки, ЕСНО, полиомелита, гепатита А), грибов рода Cаndida. Для работы в инфекционных стационарах, где находятся больные с такими инфекциями, выбирают антисептики только на основе этилового спирта.
6.1.8. Антисептики на основе изопропанола отличаются только тем, что не действуют на перечисленные в п. 6.1.6. вирусы.
Особенно это касается композиционных средств, содержащих 2-3 ДВ. При таком их применении в ЛПУ, мы можем со временем получить клинические штаммы возбудителей ВБИ, высоко устойчивые ко всем дезсредствам, содержащим ЧАС, полигексаметиленгуанидин хлорид, амины и альдегиды
Если стоит вопрос выбора антисептика, то, конечно, лучше использовать антисептик на ЭТИЛОВОМ спирте.
Уважаемые коллеги!
Все методические рекомендации, пособия и т.д. интеллектуальная собственность авторов, Ассоциации и являются архивными материалами разных лет!!
Читайте также:


