Физическая нагрузка провоцирует развитие тяжелой интоксикации при поражении веществами
УДУШАЮЩИЕ ОТРАВЛЯЮЩИЕ ВЕЩЕСТВА (син.асфиксанты) — группа отравляющих веществ, вызывающих поражение преимущественно органов дыхания. Удушающие ОВ широко применялись в годы первой мировой войны: ок. 80% всех случаев смерти вследствие применения хим. оружия были обусловлены фосгеном.
К наиболее известным веществам данной группы относят фосген, дифосген, фосгеноксим,хлор (см.) и др.
Фосген (карбонил хлорид, COCl2) получен в 1812 г. англ. химиком Дэви (Н. Davy) в результате взаимодействия хлора и окиси углерода при ярком солнечном свете (отсюда его название — светорожденный). Фосген — бесцветный газ с запахом свежескошенного сена (при низких концентрациях) или гнилых плодов; t°пл—1180; t°кип 8,2°; плотность в жидком состоянии при t° 0° 1,432. Пары фосгена в 3,5 раза тяжелее воздуха, максимальная концентрация пара при t 20° — 6370 мг/л. Коэффициент растворимости в воде ок. 2. Хорошо растворим в толуоле, ксилоле, хлорбензоле. Устойчив при обычной температуре и отсутствии влаги. В воде гидролизуется с образованием HCl, под влиянием света диссоциирует на Cl2 на CO. Активно взаимодействует со щелочами, аммиаком, уротропином, образуя нетоксичные продукты. Токсичен в газообразном состоянии. При концентрации в воздухе 0,004 мг/л фосген даже в течение длительного времени (1—2 часа) не вызывает отравления; при концентрации 0,01 мг/л и экспозиции ок. 1 часа возникают признаки интоксикации; при концентрации 0,1 мг/л и воздействии в течение 30—60 мин в 50% случаев наступает смерть; при концентрации 1 мг/л в течение 5 мин. погибает 50—75% пострадавших; концентрация 5 мг/л при экспозиции 2—3 сек. смертельна. Тяжесть возникающего отравления зависит не только от величины токсической дозы, но и от степени физической нагрузки у пострадавших после контакта с ОВ. Так, одна и та же доза О В вызывает легкую форму отравления в состоянии покоя и может привести к смертельному исходу при интенсивной физической нагрузке.
Дифосген (трихлорметиловый эфир хлоругольной кислоты, COClOCCl3) — бесцветная маслянистая жидкость с запахом, аналогичным фосгену; t°пл—57°; t°кип 128°; уд. вес (масса) 1,653. Максимальная концентрация в воздухе при t° 20° — 120 мг/л. Стойкость на местности 30—60 мин. летом и 10—12 час. зимой. В жидком состоянии не проникает через неповрежденную кожу, поражения возникают при вдыхании паров. Хорошо растворим в органических растворителях, плохо растворяется в воде. При нагревании разлагается на две молекулы фосгена. Токсикол. характеристика дифосгена такая же, как у фосгена.
Фосгеноксим (Cl2C = NOH) по своим основным характеристикам соответствует фосгену, вызывает сильное раздражение слизистых оболочек и язвенно-некротические изменения на коже. При попадании в глаза приводит к поверхностному воспалению, временной слепоте.
Удушающие ОВ избирательно действуют на легочную мембрану и капилляры альвеол, вызывая развитие деструктивных процессов, повышение проницаемости (см.) капиллярной стенки и заполнение альвеолтранссудатом (см.). Последний отличается большим содержанием белков плазмы, отсутствием фибрина и клеточных элементов, а также малым поверхностным натяжением. В результате транссудации плазмы в альвеолы значительно увеличивается вязкость крови.
В момент контакта с удушающими ОВ симптомы поражения могут отсутствовать или проявляться раздражением верхних дыхательных путей. У пораженных появляются чувство жжения, царапания в носоглотке, сдавления в груди, резь в глазах, слезотечение, иногда небольшой кашель, рвота. При действии очень малых концентраций у человека изменяются вкусовые ощущения, становится неприятным или невозможным курение. При прекращении контакта с ОВ признаки поражения постепенно затихают или даже исчезают. Наступает период мнимого благополучия (скрытый период) длительностью 1—24 часа (чаще 4—6 час.), после к-рого начинают проявляться признаки отравления. Физическая нагрузка (бег, поднятие тяжестей и т. п.), охлаждение тела значительно сокращают длительность скрытого периода. При легкой и средней степенях интоксикации преобладают симптомы острого бронхита. Отмечаются повышенная утомляемость, нарушения дыхания и деятельности сердечно-сосудистой системы даже при небольших физических нагрузках, предрасположенность к заболеваниям, особенно инф. характера. Период разгара тяжелой интоксикации характеризуется быстрым увеличением частоты дыхания и появлением одышки (см.), что свидетельствует о начале развития отека легких (см.), являющегося наиболее типичным ее клин, проявлением. Возникает и постепенно усиливаетсякашель (см.) с отделением серозной мокроты. В легких выслушиваются мелкопузырчатые хрипы. В период выраженного отека легких количество выделяемой отечной жидкости, иногда с примесью крови, достигает нескольких литров. Нарушение кровообращения сопровождается цианозом (см.), отдельными кровоизлияниями на слизистой оболочке рта и коже конечностей. Температура тела постепенно повышается до 38—39°. На этой стадии интоксикации (так наз. синей аноксемии) в течение 1—2 сут. нарастает дыхательная и сердечная недостаточность, что может привести к летальному исходу.
При более тяжелой интоксикации наблюдается так наз. серая аноксе-мия, развивается коллапс (см.), резко снижается АД, пульс частый, нитевидный, кожа приобретает пепельно-серый цвет, тело покрыто липким потом. В крови значительно уменьшается содержание кислорода и углекислоты. Сочетание выраженной типоксемии (см.Гипоксия) сгипокапнией (см.), прогрессирующее уменьшение pH крови и щелочного резерва прогностически неблагоприятно. Смерть наступает обычно в течение нескольких часов. При патологоанатомическом исследовании у умерших на 1—2-е сутки вес (масса) легких увеличена в 3—5 раз. Легкие дианотичны, ткань их пропитана пенистым мутным желтоватого цвета транссудатом. Отмечается неравномерное полнокровие, иногда тромбоз сосудов в легких. Сердце несколько увеличено в размерах, его полости содержат темные свертки крови. Внутренние органы полнокровны, наблюдается тромбоз мелких периферических сосудов.
При благоприятном течении тяжелой интоксикации выздоровление наступает через 2—3 нед. Возможны осложнения в виде эмфиземы легких (см.), инфаркта легких (см. Легкие. заболевания), развития бронхоэктазов (см.),бронхита (см.), функциональных нарушений сердечно-сосудистой системы. После стихания острых явлений пострадавшие. как правило, в течение длительного времени (месяцы, годы) жалуются на повышенную утомляемость, ощущение нехватки воздуха при физических нагрузках, состояние дискомфорта.
Специфические средства профилактики и лечения отравлений удушающими ОВ отсутствуют. Основное значение имеют средства патогенетической и симптоматической терапии. При оказании первой медицинской помощи (см. Первая помощь, первая медицинская помощь) основное внимание уделяют мероприятиям по предупреждению дальнейшей интоксикации (надевание противогаза, вынос, вывоз из зараженной зоны), ограничение физической нагрузки (ходьбы. передвижения), предотвращение переохлаждения. При поражении глаз их промывают водой. В тяжелых случаях проводятискусственное дыхание (см.). Мероприятия доврачебной помощи (см.) предусматривают согревание пострадавших, введение средств, нормализующих деятельность сердечнососудистой и дыхательной систем, кислородную терапию (см.). Дальнейшую эвакуацию осуществляют в положении лежа. Первая врачебная помощь (см.) включает кислородную терапию всех тяжелопораженных, введение им хлористого кальция и глюкозы, дыхательных аналептиков (этимизол), сердечно-сосудистых средств. При начальных признаках отека легких рекомендуется кровопускание (см.) до 250—300 мл. Квалифицированная медицинская помощь (см.) тяжелопораженным включает ингаляции кислородно-воздушной смеси с пеногасителями, введение мочегонных средств, препаратов кальция, средств, нормализующих деятельность сердечно-сосудистой и дыхательной системы, корригирующих кислотно-щелочное равновесие и электролитный баланс. Показано также применение антибактериальных средств, антикоагулянтов, стероидных гормонов. Легкопораженным проводят симптоматическое лечение. При оказании специализированной медицинской помощи (см.) основное значение придают мероприятиям по уменьшению гидростатического давления в сосудах малого круга кровообращения и объема циркулирующей крови, устранению состояния гипоксии.
Библиогр.: Вайль С. С. Патологическая анатомия поражений, вызываемых отравляющими веществами, Л., 1958; Л у ж н и к о в Е. А. Клиническая токсикология, М., 1982; Неотложная помощь при острых отравлениях, под ред. СЛ1. Голикова, М., 1977; Руководство по токсикологии отравляющих веществ, под ред. С. Н. Голикова, с. 275, М., 1972; Ф р а н-к е 3. Химия отравляющих веществ, пер„ с нем., т., 1, с„ 109, М., 1973,
Источник: Большая Медицинская Энциклопедия (БМЭ), под редакцией Петровского Б.В., 3-е издание
Тябут Тамара Дмитриевна, профессор кафедры кардиологии и ревматологии Бел МАПО, доктор медицинских наук
Год здоровья. Прочитай и передай другому
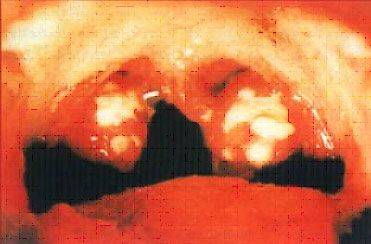
Тонзиллит, вызванный бета-гемолитическим стрептококком.
При наличии хронического тонзиллита в лакунах скапливается большое количество гноя, состоящего из погибших микробов, белых кровяных телец - лейкоцитов, других клеток (гнойно-казеозные пробки). В гнойном содержимом лакун размножаются болезнетворные микробы. Продукты жизнедеятельности микробов из миндалин попадают в кровь и приводят к развитию тонзиллогенной интоксикация, проявляющейся утомляемостью, болями в мышцах и суставах, головными болями, снижением настроения, субфебрилитетом. Миндалины превращаются в хранилище инфекционных агентов, откуда они могут распространяться по организму и быть причиной воспалительных процессов. Частые болезни еще более ослабляют иммунитет, что приводит к дальнейшему развитию тонзиллита. Так формируется порочный круг заболевания.
Хронический тонзиллит опасен осложнениями, связанными с распространением инфекции по организму. К ним относятся паратонзиллярные абсцессы, ·поражение сердца (тонзилогенная миокардиодистрофия, острая ревматическая лихорадка), сосудов, почек.
Тонзиллогенная миокардиодистрофия относится к часто развивающимся, но гораздо реже диагностируемым поражениям сердечной мышцы при хроническим тонзиллите. Она вызывается токсинами бактерий, находящихся в миндалинах, и продуктами местного воспаления и распада тканей.
Клинические признаки тонзиллогенной дистрофии миокарда обусловлены нарушением деятельности вегетативной нервной системы (вегетативной дисфункцией) и нарушением различных видов обмена в сердечной мышце (электролитного, белкового), следствием которых является нарушение образования энергии в сердечной мышце. На ранних этапах развития тонзилогенная миокардиодистрофия проявляется высокой частотой сердечных сокращений - тахикардией, перебоями в работе сердца - экстрасистолией, одышкой при интенсивных физических нагрузках, нарушением общего самочувствия больных. При поздней диагностике появляются признаки сердечной недостаточности, уменьшается объем нагрузки, вызывающей одышку, появляются более тяжелые нарушения ритма и проводимости. При своевременной диагностике и лечении внесердечного фактора - хронического тонзиллита, вызвавшего перечисленные изменения в сердечной мышце, они обратимы и постепенно структура и функции сердечной мышцы
восстанавливаются.
Наибольшую опасность для прогноза и качества жизни пациентов представляет поражение сердца при острой ревматической лихорадке.
Острая ревматическая лихорадка (ОРЛ) - постинфекционное осложнение тонзиллита (ангины) или фарингита, вызванных бета - гемолитическим стрептококком группы А, в виде системного воспалительного заболевания соединительной ткани с преимущественной локализацией патологического процесса в сердечно-сосудистой системе (кардит), суставах (мигрирующий полиартрит), мозге (хорея) и коже (кольцевидная эритема, ревматические узелки), развивающегося у предрасположенных лиц, главным образом молодого возраста (7-15 лет). В Российской Федерации и в РБ заболеваемость ревматической лихорадкой составляет от 0,2 до 0,6 случаев на 1000 детского населения. Первичная заболеваемость ОРЛ в России в начале ХХI века составила 0,027 случая на 1000 населения. Частота впервые выявленной хронической ревматической болезни сердца (ХРБС), которая включает пороки сердца и специфические изменения клапанов (краевой фиброз), выявляемые при ультразвуковом исследовании сердца - 0,097случаев на 1000 населения, в том числе ревматических пороков сердца - 0,076 случаев на 1000 взрослого населения. Имеющиеся статистические различия между частотой первичной заболеваемости острой ревматической лихорадкой и хронической ревматической болезнью сердца свидетельствует о наличии большого количества не диагностированных острых форм болезни.
Временной интервал между перенесенным острым стрептококковым тонзиллитом, фарингитом, обострением хронического тонзиллита и возникновением проявлений острой ревматической лихорадки составляет 3-4 недели. При острой ревматической лихорадке могут поражаться все структуры сердца - эндокард, миокард, перикард. Поражение миокарда (мышцы сердца) встречается всегда. Проявлениями поражения сердца могут быть сердцебиение, одышка, связанная с физической нагрузкой или в покое, боли в области сердца ноющего характера, которые в отличие о стенокардии не имеют четкой связи с физической нагрузкой и могут сохраняться длительный период времени, сердцебиение, перебои в работе сердца, приступообразные нарушения ритма - мерцательная аритмия, трепетание предсердий. Обычно поражение сердца сочетается с суставным синдромом по типу артралгий - болей в крупных суставах (коленных, плечевых, голеностопных, локтевых) или артрита (воспаления) этих же суставов. Для воспаления суставов характерны боль, изменения формы сустава, вызванные отеком, покраснение кожи в области пораженного сустава, местное повышение температуры и нарушение функции сустава в виде ограничения объема движений. Мелкие суставы поражаются гораздо реже. Воспалительный процесс в суставах носит мигрирующий характер и быстро проходит на фоне правильного лечения. Поражение сердца и суставов обычно сопровождается повышением температуры тела, слабостью потливостью, нарушением трудоспособности. У части пациентов встречаются поражения нервной системы, кожные сыпи по типу кольцевидной эритемы и подкожные ревматические узелки.
Для постановки диагноза острой ревматической лихорадки существуют диагностические критерии, которые включают клинические, лабораторные и инструментальные данные, а также информацию о перенесенной инфекции, вызванной бета-гемолитическим стрептококком группы А, его ревматогенными штаммами. Своевременно поставленный диагноз позволяет добиться выздоровления больного при проведении терапии антибиотиками, глюкокортикоидными гормонами, нестероидным противовоспалительными препаратами. Однако, при поздно начатом лечении, несоблюдении пациентами двигательного режима, наличии генетической предрасположенности, не санированной очаговой инфекции (декомпенсированный тонзиллит, кариес) исходом острой ревматической лихорадки может быть хроническая ревматическая болезнь сердца с пороком сердца или без него. Порок сердца возникает как исход воспалительного поражения клапанов сердца. Наличие порока сердца ревматической этиологии требует отнесения пациента к группе высокого риска развития инфекционного эндокардита, наиболее тяжелой формы поражения сердца, связанного с инфекционными агентами.
Острая ревматическая лихорадка относится к заболевания, при которых профилактика имеет важное значение для снижения как первичной заболеваемости, так и повторных эпизодов болезни (повторная острая ревматическая лихорадка).
Первичная профилактика имеет своей целью снижение первичной заболеваемости и включает комплекс медико-санитарных и гигиенических мероприятий, а так же адекватное лечение инфекций, вызванных бета-гемолитическим стрептококком группы А. Первое направление включает мероприятия по закаливанию, знакомство с гигиеническими навыками, санацию хронических очагов инфекции, в первую очередь - хронического тонзиллита и кариеса. Миндалины тщательно санируют повторными полосканиями и промываниями растворами антибактериальных средств, вакуум-аспирацией патологического содержимого лакун. Если это не дает желаемого результата обсуждается вопрос хирургического лечения - удаления миндалин. В каждом конкретном случае выбор тактики лечения определяет врач отоларинголог и терапевт, кардиолог или ревматолог.
Адекватное лечение ангины и фарингита направлено на подавление роста и размножения стрептококка в организме при развитии стрептококкового фарингита, ангины, тонзиллита. Основу лечения составляет антибиотикотерапия в сочетании с противовоспалительными средствами, которые должны проводиться не менее 10 дней с обязательным контролем общего анализа крови, мочи, а по показаниям биохимического анализа крови при возникновении признаков болезни, при окончании лечения и через месяц от появления первых признаков болезни. Лабораторное исследование, проведенное в эти сроки, позволяет правильно поставить диагноз, определить эффективность лечения, и что самое главное, не пропустить начало развития осложнения в виде острой ревматической лихорадки.
Вторичная профилактика имеет своей целью предупреждение развития повторной острой ревматической лихорадки и прогрессирования заболевания у лиц, перенесших ОРЛ. Она проводится у пациентов, не имеющих аллергии к препаратам пенициллинового ряда. Лекарственным средством, используемым для профилактики у взрослых является бензатинбензилпенициллин (экстенциллин, ретарпен) в дозе 2 400 000 ЕД 1 раз в 3 недели внутримышечно. Профилактические режимы зависят от возраста пациента и исхода острой ревматической лихорадки. В соответствии с рекомендациями Ассоциации ревматологов России вторичная профилактика включает следующие режимы:
Наиболее тяжелым и прогностически неблагоприятным заболеванием сердца, связанным с инфекцией считается инфекционный эндокардит - заболевание, характеризующееся развитием воспалительного процесса на клапанном или пристеночном эндокарде, включающее поражение крупных внутригрудных сосудов, отходящих от сердца, возникающее вследствие воздействия микробной инфекции. Наиболее часто это различные бактерии- стрептококки, стафилококки, энтерококки, кишечная палочка, синегнойная палочка и многие другие. Описано 119 различных возбудителей, приводящих к развитию заболевания.
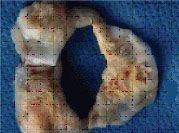
Аортальный клапан
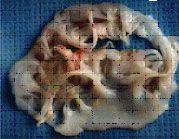
Митральный клапан
Так выглядят клапаны сердца при развитии инфекционного эндокардита.
Наложения из микробов, клеток крови нарушают их функцию,
разрушают клапан и зачастую требуют экстренного хирургического лечения.
Распространенность инфекционного эндокардита в начале 21 века составляла 2- 4 случая на 100 000 населения в год. Отмечается повсеместный рост заболеваемости, наиболее выраженный в старших возрастных группах и составляющий 14, 5 случая на 100 000 населения в возрасте 70-80 лет. Диагностика заболевания сложна. При первом обращении к врачу диагноз ставится только у 19 - 34,2% больных. Средний срок от первичного обращения до постановки диагноза составляет не менее 1,5 - 2 месяцев.
Выделяют группу больных с высоким риском развития инфекционного эндокардита, в которую входят:
- пациенты с ранее перенесенным инфекционным эндокардитом,
- пациенты с протезированными клапанами сердца,
- пациенты с синими врожденными пороками,
- пациенты после хирургических операций на аорте, легочных сосудах
- пациенты с приобретенными пороками сердца, в первую очередь ревматической этиологии (ХРБС).
Кроме этого выделена группа умеренного (промежуточного) риска, объединяющая пациентов со следующими заболеваниями:
- Пролапс митрального клапана, обусловленный миксоматозной дегенерацией или другими причинами с регургитацией 2-3 степени или пролапсы нескольких клапанов
- Нецианотичные врожденные пороки сердца (исключая вторичный ДМПП)
- Бикуспидальный (двухстворчатый)аортальный клапан
- Гипертрофическая кардиомиопатия (идиопатический гипертрофический субаортальный стеноз).
Установлено, что для развития инфекционного эндокардита необходимо попадание возбудителя в кровь. Наиболее частой причиной этого могут быть стоматологические манипуляции, сопровождающиеся повреждением десны и кровоточивостью. При наличии кариеса или заболеваний десен, бактериемия (наличие возбудителя в крови) может возникать достаточно часто.
Токсичность (от греч. toxikon - яд) - ядовитость, свойство некоторых химических соединений и веществ биологической природы при попадании в определенных количествах в живой организм (человека, животного и растения) вызывать нарушения его физиологических функций, в результате чего возникают симптомы отравления (интоксикации, заболевания), а при тяжелых - гибель.
Вещество (соединение), обладающее свойством токсичности, называется токсичным веществом или ядом.
Токсичность - обобщенный показатель реакции организма на действие вещества, который во многом определяется особенностями характера его токсического действия.
Под характером токсического действия веществ на организм обычно подразумевается:
- o механизм токсического действия вещества;
- o характер патофизиологических процессов и основных симптомов поражения, возникающих после поражения биомишеней;
- o динамика развития их во времени;
- o другие стороны токсического действия вещества на организм.
Среди факторов, определяющих токсичность веществ, одним из важнейших является механизм их токсического действия.
Механизм токсического действия - взаимодействие вещества с молекулярными биохимическими мишенями, что является пусковым механизмом в развитии последующих процессов интоксикации.
Взаимодействие между токсичными веществами и живым организмом имеют две фазы:
- 1) действие токсических веществ на организм - токсикодинамическая фаза;
- 2) действие организма на токсические вещества - токсикокинетическая фаза.
Токсикокинетическая фаза в свою очередь состоит из двух видов процессов:
- а) процессы распределения: поглощение, транспорт, накопление и выделение токсических веществ;
- б) метаболические превращения токсических веществ - биотрансформация.
Распределение веществ в организме человека зависит в основном от физико-химических свойств веществ и структуры клетки как основной единицы организма, в особенности структуры и свойств клеточных мембран.
Важным положением в действии ядов и токсинов является то, что они оказывают токсический эффект при действии на организм в малых дозах. В тканях-мишенях создаются очень низкие концентрации токсичных веществ, которые соизмеримы с концентрациями биомишеней. Высокие скорости взаимодействия ядов и токсинов с биомишенями достигаются благодаря высокому сродству к активным центрам определенных биомишеней.
Однако, прежде чем "поразить" биомишень, вещество проникает с места аппликации в систему капилляров кровеносных и лимфатических сосудов, затем разносится кровью по организму и поступает в ткани-мишени. С другой стороны, как только яд поступает в кровь и ткани внутренних органов, он претерпевает определенные превращения, которые обычно приводят к детоксикации и "расходу" вещества на так называемые неспецифические ("побочные") процессы.
Одним из важных факторов является скорость проникновения веществ через клеточно-тканевые барьеры. С одной стороны, это определяет скорости проникновения ядов через тканевые барьеры, отделяющие кровь от внешней среды, т.е. скорости поступления веществ по определенным путям проникновения в организм. С другой стороны, это определяет скорости проникновения веществ из крови в ткани-мишени через так называемые гистогематические барьеры в области стенок кровеносных капилляров тканей. Это, в свою очередь, определяет скорость накопления веществ в области молекулярных биомишеней и взаимодействия веществ с биомишенями.
В некоторых случаях скорости проникновения через клеточные барьеры определяют избирательность в действии веществ на определенные ткани и органы. Это влияет на токсичность и характер токсического действия веществ. Так, заряженные соединения плохо проникают в центральную нервную систему и обладают более выраженным периферическим действием.
В целом в действии ядов на организм принято выделять следующие основные стадии.
- 1. Стадия контакта с ядом и проникновения вещества в кровь.
- 2. Стадия транспорта вещества с места аппликации кровью к тканям-мишеням, распределения вещества по организму и метаболизма вещества в тканях внутренних органов - токсико-кинетическая стадия.
- 3. Стадия проникновения вещества через гистогематические барьеры (стенки капилляров и другие тканевые барьеры) и накопления в области молекулярных биомишеней.
- 4. Стадия взаимодействия вещества с биомишенями и возникновения нарушений биохимических и биофизических процессов на молекулярном и субклеточном уровнях - токсико-динамическая стадия.
- 5. Стадия функциональных расстройств организма развития патофизиологических процессов после "поражения" молекулярных биомишеней и возникновения симптомов поражения.
- 6. Стадия купирования основных симптомов интоксикации, угрожающих жизни пораженного, в том числе с использованием средств медицинской защиты, или стадия исходов (при отражениях смертельными токсодозами и несвоевременном использовании средств защиты возможна гибель пораженных).
Показателем токсичности вещества является доза. Доза вещества, вызывающая определенный токсический эффект, называется токсической дозой (токсодозой). Для животных и человека она определяется количеством вещества, вызывающим определенный токсический эффект. Чем меньше токсическая доза, тем выше токсичность.
Ввиду того что реакция каждого организма на одну и ту же токсодозу конкретного токсического вещества различна (индивидуальна), то и степень тяжести отравления применительно к каждому из них не будет одинаковой. Некоторые могут погибнуть, другие получат поражения различной степени тяжести или не получат их совсем. Поэтому токсодоза (D) рассматривается как случайная величина. Из теоретических и экспериментальных данных следует, что случайная величина D распределена по логарифмически нормальному закону с параметрами: D - медианное значение токсодозы и дисперсией логарифма токсодозы - 
. В связи с этим на практике для характеристики токсичности используют медианные значения относительной, например к массе животного, токсодозы (далее токсодоза).
Отравления, вызванные поступлением яда из окружающей человека среды, носят название экзогенных в отличие от эндогенных интоксикаций токсическими метаболитами, которые могут образовываться или накапливаться в организме при различных заболеваниях, чаще связанных с нарушением функции внутренних органов (почки, печень и др.). В токсикогенной (когда токсический агент находится в организме в дозе, способной оказывать специфическое действие) фазе отравления выделяют два основных периода: период резорбции, продолжающийся до момента достижения максимальной концентрации яда в крови, и период элиминации, от указанного момента до полного очищения крови от яда. Токсический эффект может возникнуть до или после всасывания (резорбции) яда в кровь. В первом случае он называется местным, а во втором - резорбтивным. Различают также косвенный рефлекторный эффект.
При "экзогенных" отравлениях выделяют следующие основные пути поступления яда в организм: пероральный - через рот, ингаляционный - при вдыхании токсических веществ, перкутанный (накожный, в военном деле - кожно-резорбтивный) - через незащищенные кожные покровы, инъекционный - при парентеральном введении яда, например при укусах змей и насекомых, полостной - при попадании яда в различные полости организма (прямую кишку, влагалище, наружный слуховой проход и т.п.).
Табличные значения токсодоз (кроме ингаляционного и инъекционного путей проникновения) справедливы для бесконечно большой экспозиции, т.е. для случая, когда посторонними методами не прекращается контакт токсичного вещества с организмом. Реально для проявления того или иного токсического эффекта яда должно оказаться больше, чем приведенные в таблицах токсичности. Это количество и время, в течение которого яд должен находиться, например, на кожной поверхности при резорбции, помимо токсичности, в значительной мере обусловлено скоростью всасывания яда через кожу. Так, по данным американских военных специалистов, боевое отравляющее вещество вигаз (VX), характеризуется кожно-резорбтивной токсодозой 6-7 мг на человека. Чтобы эта доза попала в организм, 200 мг капельно-жидкого VX должно быть в контакте с кожей в течение примерно 1 ч или ориентировочно 10 мг - в течение 8 ч.
Сложнее рассчитать токсодозы для токсичных веществ, заражающих атмосферу паром или тонкодисперсным аэрозолем, например, при авариях на химически опасных объектах с выбросом аварийно химически опасных веществ (АХОВ - по ГОСТ Р 22.0.05-95), которые вызывают поражение человека и животных через органы дыхания.
Прежде всего, делают допущение, что ингаляционная токсодоза прямо пропорциональна концентрации АХОВ во вдыхаемом воздухе и времени дыхания. Кроме того, необходимо учесть интенсивность дыхания, которая зависит от физической нагрузки и состояния человека или животного. В спокойном состоянии человек делает примерно 16 вдохов в минуту и, следовательно, в среднем поглощает 8-10 л/мин воздуха. При средней физической нагрузке (ускоренная ходьба, марш) потребление воздуха увеличивается до 20-30 л/мин, а при тяжелой физической нагрузке (бег, земляные работы) составляет около 60 л/мин.
Таким образом, если человек массой G (кг) вдыхает воздух с концентрацией С (мг/л) в нем АХОВ в течение времени τ (мин) при интенсивности дыхания V (л/мин), то удельная поглощенная доза АХОВ (количество АХОВ, попавшее в организм) D(мг/кг) будет равна

Немецкий химик Ф. Габер предложил упростить это выражение. Он сделал допущение, что для людей или конкретного вида животных, находящихся в одинаковых условиях, отношение V/G постоянно, тем самым его можно исключить при характеристике ингаляционной токсичности вещества, и получил выражение К=Сτ (мг · мин/л). Произведение Сτ Габер назвал коэффициентом токсичности и принял его за постоянную величину. Это произведение, хотя и не является токсодозой в строгом смысле этого слова, позволяет сравнивать различные токсичные вещества по ингаляционной токсичности. Чем оно меньше, тем более токсично вещество при ингаляционном действии. Однако при таком подходе не учитывается ряд процессов (выдыхание обратно части вещества, обезвреживание в организме и т.п.), но тем не менее произведением Сτ до сих пор пользуются для оценки ингаляционной токсичности (особенно в военном деле и гражданской обороне при расчете возможных потерь войск и населения при воздействии боевых отравляющих веществ и АХОВ). Часто это произведение даже неправильно называют токсодозой. Более правильным представляется название относительной токсичности при ингаляции. В клинической токсикологии для характеристики ингаляционной токсичности предпочтение отдается параметру в виде концентрации вещества в воздухе, которая вызывает заданный токсический эффект у подопытных животных в условиях ингаляционного воздействии при определенной экспозиции.
Относительная токсичность ОВ при ингаляции зависит от физической нагрузки на человека. Для людей, занятых тяжелой физической работой, она будет значительно меньше, чем для людей, находящихся в покое. С увеличением интенсивности дыхания возрастет и быстродействие ОВ. Например, для зарина при легочной вентиляции 10 л/мин и 40 л/мин значения LCτ50 составляют соответственно около 0,07 мг · мин/л и 0,025 мг · мин/л. Если для вещества фосгена произведение Сτ 3,2 мг · мин/л при интенсивности дыхания 10 л/мин является среднесмертельным, то при легочной вентиляции 40 л/мин - абсолютно смертельным.
Следует заметить, что табличные значения константы Сτ справедливы для коротких экспозиций, при которых Сτ = const. При вдыхании зараженного воздуха с невысокими концентрациями в нем токсичного вещества, но в течение достаточно длительного промежутка времени значение Сτ увеличивается вследствие частичного разложения токсичного вещества в организме и неполного поглощения его легкими. Например, для синильной кислоты относительная токсичность при ингаляции LСτ50 колеблется от 1 мг · мин/л для высоких концентраций его в воздухе до 4 мг · мин/л, когда концентрации вещества невелики. Относительная токсичность веществ при ингаляции зависит также и от физической нагрузки на человека и его возраста. Для взрослых людей она будет снижаться с увеличением физической нагрузки, а для детей - с уменьшением возраста.
Таким образом, токсическая доза, вызывающая равные по тяжести поражения, зависит от свойств вещества, пути его проникновения в организм, от вида организма и условий применения вещества.
Для веществ, проникающих в организм в жидком или аэрозольном состоянии через кожу, желудочно-кишечный тракт или через раны, поражающий эффект для каждого конкретного вида организма в стационарных условиях зависит только от количества проникшего яда, которое может выражаться в любых массовых единицах. В токсикологии количество яда обычно выражают в миллиграммах.
Токсические свойства ядов определяют экспериментальным путем на различных лабораторных животных, поэтому чаше пользуются понятием удельной токсодозы - дозы, отнесенной к единицеживой массы животного и выражаемой в милиграммах на килограмм.
Токсичность одного и того же вещества даже при проникновении в организм одним путем различна для разных видов животных, а для конкретного животного заметно различается в зависимости от способа поступления в организм. Поэтому после численного значения токсодозы в скобках принято указывать вид животного, для которого эта доза определена, и способ введения ОВ или яда. Например, запись: "зарин Dсмерт0,017 мг/кг (кролики, внутривенно)" означает, что доза вещества зарин 0,017 мг/кг, введенная кролику в вену, вызывает у него смертельный исход.
Токсодозы и концентрации токсических веществ принято подразделять в зависимости от степени выраженности вызываемого ими биологического эффекта.
Основными показателями токсичности в токсикометрии промышленных ядов и в чрезвычайных ситуациях являются:
Limir - порог раздражающего действия на слизистые оболочки верхних дыхательных путей и глаз. Выражается количеством вещества, которое содержится в одном объеме воздуха (например, мг/м 3 ).
Смертельная, или летальная, доза - это количество вещества, вызывающее при попадании в организм смертельный исход с определенной вероятностью. Обычно пользуются понятиями абсолютно смертельных токсодоз, вызывающих гибель организма с вероятностью 100% (или гибель 100% пораженных), и среднесмертельных (медленносмертельных) или условно смертельных токсодоз, летальный исход от введения которых наступает у 50% пораженных. Например:
LD50 (LD100) - (L от лат. letalis - смертельный) среднесмертельная (смертельная) доза, вызывающая гибель 50% (100%) подопытных животных при введении вещества в желудок, в брюшную полость, на кожу (кроме ингаляции) при определенных условиях введения и конкретном сроке последующего наблюдения (обычно 2 недели). Выражается количеством вещества, отнесенным к единице массы тела животного (обычно, мг/кг);
LC50 (LС100) - среднесмертельная (смертельная) концентрация в воздухе, вызывающая гибель 50% (100%) подопытных животных при ингаляционном воздействии вещества при определенной экспозиции (стандартная 2-4 часа) и определенном сроке последующего наблюдения. Как правило, время экспозиции указывается дополнительно. Размерность как для Limir
Выводящая из строя доза - это количество вещества, вызывающее при попадании в организм выход из строя определенного процента пораженных как временно, так и со смертельным исходом. Ее обозначают ID100 или ID50 (от англ. incapacitate - вывести из строя).
Пороговая доза - количество вещества, вызывающее начальные признаки поражения организма с определенной вероятностью или, что-то же самое, начальные признаки поражения у определенного процента людей или животных. Пороговые токсодозы обозначают PD100 или PD50 (от англ. primary - начальный).
КВИО - коэффициент возможности ингаляционного отравления, представляющий собой отношение максимально достижимой концентрации токсичного вещества (Сmах, мг/м 3 ) в воздухе при 20°С к средней смертельной концентрации вещества для мышей (КВИО = Cmax/LC50). Величина безразмерная;
ПДК - предельно допустимая концентрация вещества - максимальное количество вещества в единице объема воздуха, воды и др., которое при ежедневном воздействии на организм в течение длительного времени не вызываете нем патологических изменений (отклонения в состоянии здоровья, заболевания), обнаруживаемых современными методами исследования в процессе жизни или отдаленные сроки жизни настоящего и последующих поколений. Различают ПДК рабочей зоны (ПДКр.з, мг/м 3 ), ПДК максимально разовая в атмосферном воздухе населенных мест (ПДКм.р, мг/м 3 ), ПДК среднесуточная в атмосферном воздухе населенных мест (ПДКс.с, мг/м 3 ), ПДК в воде водоемов различного водопользования (мг/л), ПДК ( или допустимое остаточное количество) в продуктах питания (мг/кг) и др.;
ОБУВ - ориентировочный безопасный уровень воздействия максимального допустимого содержания токсичного вещества в атмосферном воздухе населенных мест, в воздухе рабочей зоны и в воде водоемов рыбохозяйственного водопользования. Различают дополнительно ОДУ - ориентировочный допустимый уровень вещества в воде водоемов хозяйственно-бытового водопользования.
В военной токсикометрии наиболее употребительны показатели относительных медианных значений среднесмертельной (LCτ50), средневыводящей (IСτ50), средней эффективно действующей (EСτ50), средней пороговой (РСτ50) токсичности при ингаляции, выражающихся обычно в мг · мин/л, а также медианных значений аналогичных по токсическому эффекту кожно-резорбтивных токсодоз LD50, LD50, ED50, PD50 (мг/кг). При этом показатели токсичности при ингаляции используются также и для прогнозирования (оценки) потерь населения и производственного персонала при авариях на химически опасных объектах с выбросом широко используемых в промышленности АХОВ.
В отношении же растительных организмов вместо термина токсичность чаще применяют термин активность вещества, а в качестве меры его токсичности преимущественно используют величину CK50 - концентрация (например, мг/л) вещества в растворе, вызывающая гибель 50% растительных организмов. На практике пользуются нормой расхода действующего (активного) вещества на единицу площади (массы, объема), обычно кг/га, при которой достигается необходимый эффект.
По своему происхождению токсические вещества могут быть синтетическими и природными (табл. 4.2, 4.3).
Параметры токсичности некоторых синтетических веществ
LC50 (мг/м 1 ), биообъект, экспозиция
Читайте также:


