Изопринозин или циклоферон при герпесе

В своей практической деятельности врачи многих специальностей встречаются с заболеваниями, вызванными вирусами семейства Herpesviridae, которые широко распространены в человеческой популяции. Они способны поражать практически все органы и системы организма хозяина, вызывая латентную, острую и хроническую формы инфекции при этом, спектр клинических проявлений, развитие которых они обусловливают, чрезвычайно широк [7]. Особого внимания заслуживает рецидивирующая форма герпетической инфекции (ГИ), относящаяся к числу наиболее распространенных психосоматических кожных заболеваний. Хроническое течение, зуд, частая локализация и характер высыпаний на лице или интимно значимых участках кожного покрова сопровождаются изменениями эмоциональной сферы. В свою очередь, состояния стресса, восприятие самим пациентом проявлений болезни оказывает влияние на интенсивность и частоту рецидивов простого герпеса (ПГ) [24].
Многочисленные исследования в области проблемы ГИ, особенно вызванные вирусами простого герпеса (ВПГ) 1 и 2 типов, не теряют своей актуальности в настоящее время [21, 16].
Серьёзной проблемой является высокая инфицированность здорового населения, преимущественно молодого, трудоспособного возраста. В мире ежегодно заражаются от 16 до 800, а в России – от 40 до 80 человек на 100 тыс. населения. В настоящее время заболеваемость ПГ крайне высока, по статистике ВОЗ, она занимает второе место среди вирусных поражений, уступая лишь гриппу. ВПГ-1 инфицировано около 90 % взрослого населения планеты, распространенность ВПГ-2 колеблется от 7 до 40 %. В США ежегодно регистрируется до 98 млн случаев лабиального герпеса и 20 млн случаев рецидивирующего герпеса гениталий, 500 тыс. случаев офтальмогерпеса и более 5 тыс. случаев герпетического энцефалита, около 1 тыс. случаев герпеса новорожденных. По мнению ведущих специалистов, в нашей стране ежегодная заболеваемость герпесом губ составляет 10 млн, герпесом кожи – 1 млн, офтальмогерпесом – 250 тыс. случаев. Рецидивирующими формами герпеса страдают от 10 до 20 % населения, а ежегодный прирост увеличивается на 15–17 % [3, 13, 23].
Литературные данные свидетельствуют, что большинство населения Земли инфицировано ВПГ-1, ВПГ-2 или тем и другим вирусом одновременно. Первичная инфекция, ассоциированная с ВПГ-1 или ВПГ-2, может протекать в клинически выраженной форме в очаге инфицирования (например, в орофациальной или генитальной области) либо как бессимптомная или нераспознанная инфекция. Генитальная форма простого герпеса может быть связана с ВПГ-1, так же как и лабиальная форма – с ВПГ-2. После первичного инфицирования у 50–75 % больных отмечается рецидивирующее течение простого герпеса. В течение первых 12 месяцев после инфицирования ВПГ-2 рецидив возникает у 80 % пациентов, ВПГ-1 – у 55 % [15, 26].
Современная медицина не располагает методами лечения, позволяющими элиминировать ВПГ из организма человека. Целью лечения герпеса является: 1) подавление репродукции ВПГ в период обострения (купирование рецидива); 2) снижение частоты и длительности рецидивов заболевания, тяжести их течения; 3) формирование адекватного иммунного ответа и его длительное сохранение с целью блокирования реактивации ВПГ в очагах персистенции.
Всё разнообразие методов терапии и профилактики обострения герпесвирусных инфекций можно сгруппировать в направления этиотропного, патогенетического и симптоматического лечения с применением химиотерапии, иммунотерапии и комплексного лечения [1, 7, 11].
Большое внимание уделяется антигерпетическим соединениям растительного происхождения, природным антиоксидантам, адаптогенам из лекарственного растительного сырья и витаминно-минеральным комплексам, ввиду изменения иммунного статуса пациентов [14, 19].
Патогенетическая терапия направлена на нормализацию функции иммунной системы организма, в том числе на активацию системы интерфероновой защиты, как правило, связанная с применением интерферонов (ИФН), индукторов ИФН и иммуномодуляторов. Специфическая иммунотерапия состоит в применении герпетической вакцины, хотя ряд исследователей считает, что надежды, возлагаемые на специфическую вакцинопрофилактику, не оправдали себя [11, 19]. Иммунотропные препараты, обладающие активностью против вируса герпеса, разнообразны и представлены в таблице.
Иммунотропные препараты, обладающие активностью против вируса герпеса
Использование противовирусной химиотерапии велико при лечении рецидивирующих форм простого герпеса с поражением кожи и слизистых оболочек. В лечении простого герпеса с применением противогерпетических химиопрепаратов можно выделить два принципиально отличающихся друг от друга подхода: 1) эпизодическое лечение – прием ациклических нуклеозидов (АН) в момент рецидива в терапевтических дозах при соблюдении кратности и длительности лечения; 2) супрессивная терапия – длительный, иногда многолетний, постоянный прием препаратов АН вне рецидива в более низких дозах [9, 25].
Согласно проведенным исследованиям, биодоступность (per os) противогерпетических препаратов из группы ациклических нуклеозидов возрастает следующим образом: ацикловир – 20 %, валацикловир – 54 % и фамцикловир – 77 % [24]. Тем не менее применение ацикловира по-прежнему остаётся востребованным среди врачей и пациентов в настоящее время, и одновременно ведутся исследования по увеличению растворимости ацикловира [5] и синтезу его производных [8].
В разные годы предпринимались многочисленные попытки повысить эффективность лечения ПГ путем комбинированной терапии. С этой целью использовались различные сочетания средств иммунного влияния, а также препаратов, отличающихся по этиопатогенетическому механизму действия [20].
Возможно сочетанное использование противовирусной терапии и глюкокортикостероидов. Выявлено, что такая комбинация эффективнее монотерапии противовирусными препаратами, особенно для лечения острой боли и коррекции различных аспектов качества жизни пациентов. Комбинация ацикловир + преднизолон значительно быстрее купирует острую боль и возвращает пациента к обычной жизнедеятельности в случае постгерпетической невралгии [2].
Наружные средства дополняют системную противовирусную терапию. Многочисленные наблюдения подтверждают, что в случае назначения таблетированных форм ациклических нуклеозидов на стадии предвестников в сочетании с наружной противовирусной терапией значительно чаще удается полностью прервать дальнейшее развитие рецидива или наблюдать его абортивное течение [20].
Местная терапия противовирусных лекарственных средств при герпесе кожи и слизистых оболочек требуется для уменьшения отёка, экссудации, боли и зуда, ускорения заживления язвочек и эрозий и сокращения длительности выделения вируса на участках поражения [22]. Применение данных лекарственных форм начинают при появлении первых признаков активации инфекции (чувство жжения, зуд и т.д.) и продолжают вплоть до эпителизации эрозий. Рано начатое местное лечение может предотвратить развитие везикул.
В комплексную терапию пациентов с простым герпесом необходимо включать местные противовирусные средства, способствующие стабилизации и разрешению процесса [12].
При анализе ассортимента противовирусных средств на российском рынке установлено, что большинство противовирусных препаратов выпускается в виде твёрдых лекарственных форм – 66 %, в виде мягких лекарственных форм – 22 %, а в форме жидких – 12 % [22], лидером же является ацикловир [6].
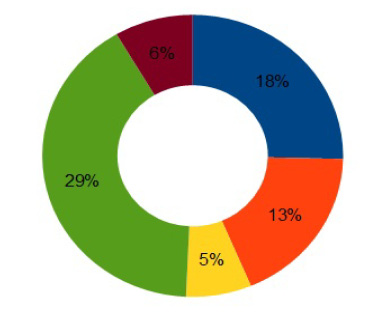

Ассортимент лекарственных форм, содержащих ацикловир
Следует отметить, что современная фармакотерапия герпеса эффективно уменьшает его клинические проявления, положительно влияет на психическое состояние пациентов и приобретает комплексный подход. Несмотря на различные достижения в лечении герпеса, ацикловир по-прежнему играет значительную роль в данном направлении и привлекает внимание исследователей по созданию комбинированных препаратов. В связи с чем актуальными являются исследования по разработке лекарственной формы комбинированного состава, обладающей противогерпесным эффектом – медицинские карандаши.
Рецензенты:
Степанова Э.Ф., д.фарм.н., профессор, профессор кафедры технологии лекарств ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск;
Хаджиева З.Д., д.фарм.н., профессор, профессор кафедры технологии лекарств ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.
Albina Glisic/Getty Images/Life Stic/Flickr/Indicator.Ru
Из чего же, из чего
В основе Изопринозина – молекулы инозина и димепранолацедобена. Эти вещества, по мнению производителей, должны либо действовать в направлении стимулирования иммунитета, призывая наши лимфоциты работать сверхурочно, либо мешать воспроизводству вирусных частиц, взявших наши клетки на абордаж.
Авторы обзора 1986 года в журнале Drugs предположили, что противовирусного эффекта у препарата нет, но зато есть иммуностимулирующее. Механизм этого действия, согласно тому же обзору, неизвестен, а большинство экспериментальных и клинических испытаний предварительные, да еще и дизайн их оставляет желать лучшего.
Добавилась новая информация по сайтам связывания: например, в статье фармакологов из США и Тайваня, опубликованной на страницах Journal of Biomedical Science, высказано предположение, что инозин может воздействовать на бензодиазепиновый рецептор, но к антивирусному действию это вряд ли как-то относится.
Как обстоит дело с клиническими исследованиями, разрешениями и одобрением ведущих организаций в сфере здравоохранения?
В списках (не) значился
На портале Госреестра лекарственных средств большинство зарегистрированных исследований касаются биоэквивалетности (сопоставления дозировки, при которых вещество равны по действию) разных форм препарата, а также русских таблеток и зарубежных. Пострегистрационные исследования эффективности и безопасности средства проводятся и по сей день. Одно из них завершилось в 2015 году, но публикацию найти так и не удалось.
Изопринозин входит в классификацию ATC Всемирной организации здравоохранения – однако, как мы уже не раз выясняли, это ничего не говорит об эффективности препарата, а лишь дает понять, что ВОЗ знает о его существовании. В этой классификации он значится как противовирусное лекарство.
В многоцентровом двойном слепом плацебо-контролируемом исследовании на 463 пациентах, проведенном венгерскими учеными, сравнивалась скорость излечения от гриппа. Хотя авторы статьи сообщают, что в группе препарата участники выздоравливали быстрее, они же отмечают, что различие было статистически незначительным.
Посмотрев на график выздоровления, где на осях обозначены дни от начала терапии и процент еще не излечившихся участников, можно увидеть, что линии группы плацебо и группы препарата почти совпадают.
Jiří Beran et al
Если говорить о профилактике инфекций у детей, то Изопринозин и здесь не смог выделиться положительным примером. Чешская статья о двойном слепом плацебо-контролируемом клиническом испытании препарата на 108 детях гласит, что хотя уровень CD3+, CD4+ и CD8+ Т-лимфоцитов у участников несколько вырос за те шесть недель, пока им давали препарат, на частоту заболеваемости это никак не влияло. Продолжительность ОРВИ у детей тоже не стала короче, да и на количество дней проявления симптомов (температуры, кашля, фарингита, насморка) Изопринозин никак не повлиял.
На 17 пациентах Изопринозин тестировали против вирусного гепатита С, но доказать, что он хоть сколько-нибудь полезен, снова не получилось. Данные из статьи об исследовании на 42 пациентах не расходятся с этим результатом. Неутешительный вывод ждет и прочитавших статью об испытаниях препарата против опоясывающего лишая и против генитальных бородавок.
Наконец, есть обнадеживающая статья об успешном лечении от папиллом вирусного происхождения (на 55 участниках), но этот результат не был подтвержден другими исследованиями с 1996 года.
(Не)палочка-(не)выручалочка
Но есть и менее популярные направления использования, которые относятся к альтернативной терапии. Так, принимая инозин, можно повысить уровень мочевой кислоты в крови, и поскольку болезнь Паркинсона обычно медленнее прогрессирует у пациентов, у которых этот уровень выше, инозин сейчас находится на третьей фазе испытаний в качестве возможного лекарства от этого недуга.
Впрочем, с рассеянным склерозом такой подход уже не сработал. Авторы статьи, основанной на данных о лечении 52 пациентов с этой болезнью при помощи Изопринозина, приходят к выводу, что после внесения поправок на множественные группы сравнения эффекта препарата выявить не удалось.
С инсультом, несмотря на действие на клетках и подопытных животных, тоже продвинуться не получилось. Возможно, потому, что во время ишемического инсульта как раз и нарушена доставка питания к пораженному участку, так что даже полезные вещества цели не достигают.
Проверяли Изопринозин и как альтернативное средство от хронической усталости, однако успеха такой подход тоже не имел: по мнению авторов обзора, данных оказалось недостаточно для выводов.
В еще одной работе Изопринозин испытывали на 24 пациентах как лекарство от ревматоидного артрита, но никаких доказательств его полезности по сравнению с группой плацебо не нашлось, зато уровень уратов (солей мочевой кислоты) в крови участников, получивших Изопринозин, вырос. Кстати, об увеличении количества уратов в крови стоит задуматься – этот побочный эффект упоминали практически во всех статьях о клинических испытаниях.
Indicator.Ru заключает: доказательства минимальны, и они не в пользу Изопринозина
Изопринозин не одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and drug administration, или FDA). Эта организация много раз отказывала производителям зарегистрировать препарат и его прямые аналоги как лекарство для больных ВИЧ, ведь пациенты могут использовать его вместо, а не вместе со специфической антиретровирусной терапией. Хотя на этот счет и есть клиническое испытание, показывающее, что в группе Изопринозина болезнь прогрессирует меньше, процент людей, у которых ВИЧ перешел в СПИД за два года, очень низок, так что могла сыграть свою роль статистическая погрешность.
Механизм его действия на молекулярном уровне неизвестен, а все эффекты, наблюдаемые на клетках, тканях и крысах, на уровне клинических испытаний не дают никакого результата. На сайте Cochrane Collaboration тоже нет обзоров, которые бы подтвердили эффективность Изопринозина (хотя опровержения тоже отсутствуют).
Хотя препарат во многом состоит из компонента, который встречается в человеческих клетках, он вызывает повышение уровня мочевой кислоты в организме. К сожалению, это может не только замедлить прогресс болезни Паркинсона, но и вызвать приступы подагры, так что если у вас проблемы с суставами (да еще и диета включает много продуктов животного происхождения), осторожность не помешает.
Наши рекомендации нельзя приравнивать к назначению врача. Перед тем, как начать принимать тот или иной препарат, обязательно посоветуйтесь со специалистом.
Действующее вещество

Фармакологическая группа
Нозологическая классификация (МКБ-10)
Состав
| Таблетки | 1 табл. |
| активное вещество: | |
| инозин пранобекс (Изопринозин) | 500 мг |
| вспомогательные вещества: маннитол; крахмал пшеничный; повидон; магния стеарат |
Описание лекарственной формы
Таблетки: продолговатые, двояковыпуклой формы белого или почти белого цвета с легким аминовым запахом, с риской на одной стороне.
Фармакологическое действие
Фармакодинамика
Изопринозин — синтетическое комплексное производное пурина, обладающее иммуностимулирующей активностью и неспецифическим противовирусным действием.
Восстанавливает функции лимфоцитов в условиях иммунодепрессии, повышает бластогенез в популяции моноцитарных клеток, стимулирует экспрессию мембранных рецепторов на поверхности Т-хелперов, предупреждает снижение активности лимфоцитарных клеток под влиянием ГКС , нормализует включение в них тимидина. Изопринозин оказывает стимулирующее влияние на активность цитотоксических Т-лимфоцитов и естественных киллеров, функции Т-супрессоров и Т-хелперов, повышает продукцию IgG, интерферона-гамма, ИЛ-1 и ИЛ-2, снижает образование провоспалительных цитокинов — ИЛ-4 и ИЛ-10, потенцирует хемотаксис нейтрофилов, моноцитов и макрофагов.
Препарат проявляет противовирусную активность in vivo в отношении вирусов Herpes simplex, ЦМВ и вируса кори, вируса Т-клеточной лимфомы человека типа III, полиовирусов, гриппа А и В, ЕСНО-вируса (энтероцитопатогенный вирус человека), энцефаломиокардита и конского энцефалита. Механизм противовирусного действия препарата Изопринозин связан с ингибированием вирусной РНК и фермента дигидроптероатсинтетазы, участвующего в репликации некоторых вирусов, усиливает подавленный вирусами синтез мРНК лимфоцитов, что сопровождается подавлением биосинтеза вирусной РНК и трансляции вирусных белков, повышает продукцию лимфоцитами обладающих противовирусными свойствами интерферонов-альфа и -гамма. При комбинированном назначении усиливает действие интерферона-альфа, противовирусных средств ацикловира и зидовудина.
Фармакокинетика
После приема внутрь препарат хорошо всасывается из ЖКТ . Cmax ингредиентов в плазме крови определяется через 1–2 ч.
Быстро подвергается метаболизму и выделяется через почки. Метаболизируется аналогично эндогенным пуриновым нуклеотидам с образованием мочевой кислоты. N-N-диметиламино-2-пропранолон метаболизируется до N-оксида, а пара-ацетамидобензоат — до о-ацилглюкуронида. Не обнаружено кумуляции препарата в организме. T1/2 составляет 3,5 ч — для N-N-диметиламино-2-пропранолона и 50 мин — для пара-ацетамидобензоата. Элиминация препарата и его метаболитов из организма происходит в течение 24–48 ч.
Показания препарата Изопринозин
лечение гриппа и других ОРВИ;
инфекции, вызываемые вирусом Herpes simplex 1, 2, 3 и 4-го типов: генитальный и лабиальный герпес, герпетический кератит, опоясывающий лишай, ветряная оспа, инфекционный мононуклеоз, вызванный вирусом Эпштейна-Барр;
корь тяжелого течения;
папилломавирусная инфекция: папилломы гортани/голосовых связок (фиброзного типа), папилломавирусная инфекция гениталий у мужчин и женщин, бородавки;
Противопоказания
повышенная чувствительность к компонентам препарата;
хроническая почечная недостаточность;
детский возраст до 3 лет (масса тела до 15–20 кг).
Применение при беременности и кормлении грудью
Не рекомендуется применять препарат во время беременности и в период кормления грудью, т.к. безопасность применения не исследовалась.
Побочные действия
Частота развития побочных эффектов после применения препарата классифицирована согласно рекомендациям ВОЗ : часто (≥1 и ЖКТ : часто — тошнота, рвота, боль в эпигастрии; иногда — диарея, запор.
Со стороны печени и желчевыводящих путей: часто — временное повышение активности трансаминаз и ЩФ в плазме крови, повышение концентрации мочевины в плазме крови.
Со стороны кожи и подкожно-жировой клетчатки: часто — зуд.
Со стороны нервной системы: часто — головная боль, головокружение, слабость; иногда — сонливость, бессонница.
Со стороны мочевыделительной системы: иногда — полиурия.
Со стороны опорно-двигательного аппарата и соединительной ткани: часто — боль в суставах, обострение подагры.
Взаимодействие
Иммунодепрессанты могут снижать эффективность действия препарата. Ингибиторы ксантиноксидазы и урикозурические средства ( в т.ч. диуретики) могут способствовать риску повышения уровня мочевой кислоты в сыворотке крови пациентов, принимающих препарат Изопринози.
Способ применения и дозы
Внутрь, после еды, запивая небольшим количеством воды.
Рекомендуемая доза взрослым и детям с 3 лет (масса тела от 15–20 кг) составляет 50 мг/кг/сут, разделенная на 3–4 приема. Взрослым — по 6–8 табл./сут, детям — по 1/2 табл./5 кг/сут. При тяжелых формах инфекционных заболеваний доза может быть увеличена индивидуально до 100 мг/кг/сут, разделенных на 4–6 приемов. Максимальная суточная доза для взрослых — 3–4 г/сут, для детей — 50 мг/кг/сут.
При острых заболеваниях: продолжительность лечения у взрослых и детей обычно от 5 до 14 дней. Лечение необходимо продолжать до момента исчезновения клинических симптомов и в течение еще 2 дней уже при отсутствии симптомов. При необходимости длительность лечения может быть увеличена индивидуально под контролем врача.
При хронических рецидивирующих заболеваниях у взрослых и детей лечение необходимо продолжать несколькими курсами по 5–10 дней с перерывом в приеме в 8 дней.
Для проведения поддерживающей терапии доза может быть снижена до 500–1000 мг в сутки (1–2 табл.) в течение 30 дней.
При герпетической инфекции взрослым и детям назначают в течение 5–10 дней до исчезновения симптомов заболевания, в бессимптомный период — по 1 табл. 2 раза в день в течение 30 дней для уменьшения числа рецидивов.
При папилломавирусной инфекции взрослым препарат назначают по 2 табл. 3 раза в день, детям — по 1/2 табл./5 кг массы тела/сут в 3–4 приема в течение 14–28 дней в виде монотерапии.
При рецидивирующих остроконечных кондиломах взрослым препарат назначают по 2 табл. 3 раза, детям — по 1/2 табл./5 кг/сут в 3–4 приема в день либо в качестве монотерапии, или в комбинации с хирургическим лечением в течение 14–28 дней, далее с трехкратным повторением указанного курса с интервалами в 1 мес.
При дисплазии шейки матки, ассоциированной с вирусом папилломы человека, назначают по 2 табл. 3 раза в день в течение 10 дней, далее проводят 2–3 аналогичных курса с интервалом в 10–14 дней.
Передозировка
Случаи передозировки препарата не описаны.
Особые указания
После 2-недельного применения Изопринозина следует провести контроль концентрации мочевой кислоты в сыворотке крови и моче.
При длительном приеме, после 4 нед применения целесообразно каждый месяц проводить контроль функций печени и почек (активность трансаминаз в плазме крови, креатинин, мочевая кислота).
Необходимо контролировать уровень мочевой кислоты в сыворотке крови при назначении Изопринозина в сочетании с препаратами, увеличивающими уровень мочевой кислоты, или препаратами, нарушающими функцию почек.
Влияние на способность управлять транспортными средствами и другими механизмами. Нет специальных противопоказаний.
Форма выпуска
Таблетки, 500 мг. В блистере (ПВХ/ПВДХ и алюминиевая фольга), 10 шт. 2, 3 или 5 блистеров помещают в пачку картонную.
Производитель
Юридическое лицо, на имя которого выдано регистрационное удостоверение: Тева Фармацевтические Предприятия Лтд., Израиль.
Тел./факс: (495) 644-22-34/35/36.
Условия отпуска из аптек
Условия хранения препарата Изопринозин
Хранить в недоступном для детей месте.
Срок годности препарата Изопринозин
Не применять по истечении срока годности, указанного на упаковке.

Для лечения гриппа и других ОРВИ АМИКСИН ® может применяться у взрослых и детей с 7 лет.
Узнать подробнее про АМИКСИН ® …

Противовирусный препарат АМИКСИН ® направлен на борьбу с большинством распространенных респираторных вирусов, включая вирусы гриппа.
Узнать больше…

Современные противовирусные препараты, такие как АМИКСИН ® , могут способствовать снижению риска развития осложнений на фоне гриппа и других ОРВИ.
Подробнее…


Для лечения гриппа и других ОРВИ у детей старше 7 лет АМИКСИН ® выпускается в дозировке 60 мг.
Узнать подробнее о детском "Амиксине"…

АМИКСИН ® обладает не только иммуностимулирующим, но и противовирусным действием за счет подавления трансляции вирус-специфических белков.
Узнать подробнее…

Вирусы гриппа и других ОРВИ способны формировать устойчивость к некоторым противовирусным препаратам. АМИКСИН ® способствует стимулированию собственных ресурсов организма на борьбу с инфекцией…
Читать подробнее…

Механизм действия противовирусных средств
Иммунная система умеет распознавать зараженные клетки, поэтому многие противовирусные лекарственные средства направлены на стимулирование собственного иммунитета. Они называются иммуностимуляторами (иммуномодуляторами).
Вообще, создание эффективного противовирусного средства — задача нетривиальная, поскольку вирусы паразитируют внутри клеток, и как в этом случае уничтожить пришельца, не нанеся вреда организму хозяина?
На сегодня в России чаще всего применяется клинико-фармакологическая классификация, означающая, что разделение препаратов на группы производится в зависимости от того, на какие именно виды вирусов они воздействуют [2] . Внутри каждой узкоспециализированной группы препаратов обычно приводится классификация противовирусных средств по механизмам их действия. Давайте изучим вопрос на конкретном примере:
Как можно убедиться, спектр противовирусных лекарственных средств весьма широк. Большую его часть составляют препараты прямого противовирусного действия (ПППД), что означает их специфичность, направленность на конкретные виды вирусов. Однако эти лекарства зачастую оказывают разрушающее воздействие не только на геном вируса и его способность к репликации (размножению), но и на здоровые клетки хозяина. В общем случае можно констатировать, что чем мощнее противовирусный препарат, тем больше у него побочных эффектов. Это обязательно следует учитывать.
В то же время существует категория противовирусных средств неспецифичного (широкого) спектра действия. Преимущественно, это иммуностимуляторы (иммуномодуляторы), призванные активизировать резервные силы организма для борьбы с самыми разнообразными вирусами и другими микроорганизмами.
Итак, вот пример некоторых противовирусных препаратов, разрешенных детям:
Ограничения по возрасту могут быть вызваны не только составом средства, но и его формой выпуска. Например, таблетки не рекомендуются для приема детям до 3 лет, а капсулы — до 7 лет.
- прикрепление вирусов к клеткам;
- проникновение их в клетки;
- размножение;
- выход из клеток.
Основой профилактических и терапевтических стратегий борьбы с герпесвирусной инфекцией является улучшение локального врожденного и адаптивного иммунитета слизистых оболочек. Именно поэтому одним из значимых подходов к оптимизации базисной терапии считается использование иммуномодуляторов направленного действия, способствующих повышению функциональной активности фагоцитов как основной популяции клеток врожденного иммунитета. В качестве таковых перспективными признаны агонисты их рецепторов в виде синтетических и природных минимальных биологически активных фрагментов (МБАФ) патоген-ассоциированных молекул, в частности единственный зарегистрированный в России лекарственный препарат синтетического МБАФ глюкозаминилмурамилдипептида иммуномодулятор Ликопид. В статье проанализированы результаты клинико-лабораторных наблюдений, посвященных использованию Ликопида при герпесвирусных инфекциях у детей (респираторно-герпетическое инфицирование, осложненные формы острых респираторных вирусных инфекций, перинатальная герпесвирусная инфекция, упорно-рецидивирующий орофациальный герпес, вирус Эпштейна – Барр, врожденная цитомегаловирусная инфекция). Полученные данные свидетельствуют о высокой клинико-иммунологической эффективности препарата и целесообразности его использования для потенцирования защитных сил организма в реализации иммунотропной стратегии борьбы с герпетическими инфекциями у детей.
Основой профилактических и терапевтических стратегий борьбы с герпесвирусной инфекцией является улучшение локального врожденного и адаптивного иммунитета слизистых оболочек. Именно поэтому одним из значимых подходов к оптимизации базисной терапии считается использование иммуномодуляторов направленного действия, способствующих повышению функциональной активности фагоцитов как основной популяции клеток врожденного иммунитета. В качестве таковых перспективными признаны агонисты их рецепторов в виде синтетических и природных минимальных биологически активных фрагментов (МБАФ) патоген-ассоциированных молекул, в частности единственный зарегистрированный в России лекарственный препарат синтетического МБАФ глюкозаминилмурамилдипептида иммуномодулятор Ликопид. В статье проанализированы результаты клинико-лабораторных наблюдений, посвященных использованию Ликопида при герпесвирусных инфекциях у детей (респираторно-герпетическое инфицирование, осложненные формы острых респираторных вирусных инфекций, перинатальная герпесвирусная инфекция, упорно-рецидивирующий орофациальный герпес, вирус Эпштейна – Барр, врожденная цитомегаловирусная инфекция). Полученные данные свидетельствуют о высокой клинико-иммунологической эффективности препарата и целесообразности его использования для потенцирования защитных сил организма в реализации иммунотропной стратегии борьбы с герпетическими инфекциями у детей.
Разработка новых стратегий борьбы с герпетической инфекцией – одна из приоритетных задач современного мирового медицинского сообщества. При этом основой ряда профилактических и терапевтических стратегий борьбы с вирусом простого герпеса (ВПГ) является улучшение локального врожденного и адаптивного антигерпетического иммунитета слизистых оболочек [1]. В этом отношении клинический и диагностический интерес представляют исследования инфицирования вирусами семейства Herpesviridae (цитомегаловирус (ЦМВ), ВПГ), отличающимися различными механизмами ускользания от иммунного надзора [2], широким распространением и высокой частотой передачи от матери ребенку [3, 4].
Врожденный иммунитет играет существенную роль в патогенезе ВПГ-инфекции, являясь первой линией обороны от антигенов вируса за счет гуморальных (система комплемента, цитокины, хемокины) и клеточных (фагоциты, NK-лимфоциты, гамма-дельта-T-клетки) факторов, обеспечивающих условия для реализации адаптивного противовирусного иммунитета [5, 6]. При этом цитокины оказывают противовирусный эффект либо непосредственно через рецепторы, либо опосредованно через иммунотропные эффекты других структур врожденного иммунитета.
В ряде клинических и экспериментальных исследований продемонстрирована эффективность цитокиновой (интерфероновой) терапии в отношении герпетической инфекции как эффективного средства для подавления вирусной инфекции и распространения ВПГ 1-го типа [7].
Кроме того, фагоцитирующие клетки врожденного иммунитета оказывают антигерпетическое действие. Так, в первые часы после заражения активируются функции макрофагов (фагоцитарная, цитотоксическая, секреторная и антигенпрезентирующая) [8], тогда как нейтрофилы играют ключевую роль в рекрутировании Т- и B-лимфоцитов и контроле вирусной репликации при ВПГ 1-го и 2-го типов некоторых слизистых оболочек [9].
Исходя из сказанного одним из перспективных подходов к оптимизации базисной терапии герпесвирусных инфекций считается включение в нее иммуномодуляторов направленного действия, способствующих усилению функциональной активности фагоцитов как основной популяции клеток врожденного иммунитета. Перспективными корректорами дефектов функциональной активности клеток врожденного иммунитета (нейтрофильных гранулоцитов, моноцитарно-макрофагальных клеток) признаны агонисты их рецепторов в виде синтетических и природных минимальных биологически активных фрагментов (МБАФ) патоген-ассоциированных молекул. В частности, речь идет о единственном зарегистрированном в России в качестве лекарственного препарата синтетического МБАФ глюкозаминилмурамилдипептида (ГМДП) иммуномодуляторе Ликопиде [10]. ГМДП представляет собой МБАФ пептидогликана клеточной стенки всех известных бактерий [11]. Его основной точкой приложения являются фагоцитирующие клетки [12, 13], активация которых происходит при взаимодействии ГМДП и специфических внутриклеточно расположенных NOD2-рецепторов с последующим синтезом провоспалительных цитокинов [14]. Таким образом, основные механизмы действия ГМДП заключаются в увеличении экспрессии HLA-DR антигенов, усилении поглощения микроорганизмов и завершенности фагоцитарного акта за счет повышения уровня лизосомальных ферментов и образования активных форм кислорода, увеличении продукции провоспалительных цитокинов (интерлейкинов 1-бета и 12, фактора некроза опухоли альфа, колониестимулирующего фактора), а также усилении цитотоксичности по отношению к вирус-инфицированным и опухолевым клеткам. Об эффективности Ликопида в терапии герпесвирусных инфекций у детей свидетельствуют накопленные к настоящему времени данные клинико-лабораторных наблюдений.
При поиске клинико-лабораторных критериев для дифференцированной терапии детей раннего возраста с перинатальной герпесвирусной инфекцией обоснована необходимость иммуномодулирующей терапии. При оценке иммунного статуса у пациентов было выявлено увеличение относительного содержания клеток с маркерами активации (CD71, CD95) и концентрации интерферона (ИФН) гамма, а также снижение относительной доли лимфоцитов CD3+, CD4+, CD8+ и концентрации ИФН-альфа. Это позволило не только обосновать диспансерное наблюдение в течение первого года жизни за такими пациентами, но и определить дифференцированный подход к иммуномодулирующей терапии [16]. В частности, установлено, что использование Ликопида в составе базисной терапии стабилизирует преимущественно гуморальный иммунный ответ пациентов, тогда как его сочетание с Вифероном оказывает нормализующее действие на клеточно-опосредованный иммунитет (см. таблицу).
В основу дифференцированного подхода к иммунотерапии детей, инфицированных герпесвирусами и имеющих клинические признаки гипотрофии, лимфопролиферативного и катарального синдрома, легли лабораторные критерии лимфоцитов CD21+ (менее 15,81%) и концентрация IgG (менее 4,2 г/л) (рис. 1).
Достоверную клинико-иммунологическую эффективность сочетанной терапии Ликопидом и рекомбинантным ИФН-альфа (Вифероном) у детей с ассоциированными респираторными и герпетическими вирусными инфекциями продемонстрировали результаты исследования, проведенного в 2014 г. [17].
Наряду с клинической эффективностью (сокращение частоты ОРВИ, увеличение длительности клинически благополучного периода, уменьшение количества детей с рецидивами ВПГ-инфекции) зафиксированы достоверные иммунотропные эффекты сочетанной базисной традиционной терапии с использованием иммуномодулятора Ликопида в виде нормализации уровня ИФН-альфа (рис. 2), а также числа активно фагоцитирующих нейтрофильных лейкоцитов, их поглотительной, переваривающей способности и усиления резервной NADPH-оксидазной активности нейтрофильных гранулоцитов (рис. 3).
По мнению авторов, включение в программу комбинированной интерфероно- и иммунотерапии иммуномодулирующей терапии Ликопидом при наличии преобладающего дефектного функционирования нейтрофильных гранулоцитов у детей с ассоциированными возвратными респираторными и различными герпетическими вирусными инфекциями имеет существенные преимущества, связанные с эффективной коррекцией выявленных нарушений в системе нейтрофильных гранулоцитов – важных клеточных факторов врожденного иммунитета, являющихся весомым компонентом клеточной иммунной реакции против вирус-инфицированных клеток в ранней фазе вирусной инфекции [5]. Необходимо отметить, что выраженная клинико-иммунологическая эффективность последовательной терапии иммуномодулятором Ликопид на фоне стандартной базисной терапии (Изопринозин, интерферонотерапия) подтверждена указанными исследователями и у взрослых пациентов, страдающих хроническим упорно-рецидивирующим орофациальным герпесом [18].
В публикациях приводятся данные об использовании Ликопида у детей с выявленной предрасположенностью к бактериальным инфекциям и инфицированных вирусом Эпштейна – Барр для предотвращения иммунологической дисфункции и негладкого течения периода реконвалесценции [19]. У пациентов, получавших иммунотропную терапию Ликопидом, отмечались купирование астеновегетативного синдрома (76,9%), достоверное снижение содержания атипичных мононуклеаров в крови (с 9,1 ± 1,2% до 1,0 ± 0,5%), нормализация уровня содержания ИФН-гамма (снижение в 1,4 раза). При наблюдении в течение года за больными, получавшими Ликопид в периоде ранней реконвалесценции, было установлено, что частота интеркуррентных заболеваний у них была в три раза ниже, чем в группе контроля.
Клинические эффекты комплексного этиотропного лечения, включающего иммуномодулятор Ликопид в сочетании с иммунозаместительной терапией (Иммуновенин) у новорожденных и детей грудного возраста с инфекцией, вызванной ВПГ 1-го и 2-го типов, состоят в значимом сокращении длительности конъюгационной желтухи, везикулярной сыпи, лимфоаденита и частоты ОРВИ, увеличения размеров печени и гипотрофии [20]. Выявлены отчетливые иммуномодулирующие эффекты комплексной иммунотропной терапии, характеризующиеся достоверно более высоким содержанием относительного и абсолютного количества Т-лимфоцитов (CD3+, CD8+) и снижением относительного количества В-лимфоцитов (CD20+) через три месяца после окончания курса лечения [20].
Выявленная высокая фармакоэкономическая эффективность Ликопида в терапии вирусного гепатита у детей с врожденной ЦМВ-инфекцией основана на достоверных данных о сокращении длительности периода активности заболевания, длительности противовирусной терапии, быстром улучшении состояния, снижении потребности в применении глюкокортикоидных гормонов, сочетающихся с выраженным иммуномодулирующим действием иммуномодулятора (устранение глубоких дефектов продукции ИФН-гамма, восстановление фагоцитарной функции лейкоцитов, содержания цитотоксических CD8+ Т-лимфоцитов, а также В-клеток (CD19+) с нормализацией продукции ими сывороточного IgG (рис. 4) [21].
Таким образом, отечественный иммуномодулятор Ликопид, представляющий собой активный фрагмент бактериальных клеточных стенок, ответственный за иммуностимулирующий эффект целых бактерий, является природным регулятором иммунитета, выработанным в процессе эволюции. Препарат характеризуется комплексным воздействием на иммунную систему организма, стимулирует функциональную активность фагоцитирующих клеток, усиливает пролиферацию Т- и В-лимфоцитов. Высокая клинико-иммунологическая эффективность Ликопида в составе комплексной терапии герпетических инфекций у детей обуславливает целесообразность его использования для потенцирования защитных сил организма в реализации иммунотропной стратегии борьбы с герпетическими инфекциями.
Читайте также:


