Ванкомицин при стафилококке отзывы
Врачу :: Новые антимикробные препараты :: Линезолид
Хотелось бы подчеркнуть пару моментов:
- В России на настощий момент нет штаммов золотистого стафилококка, резистентного к ванкомицину. Поэтому Ваша лаборатория абсолютно права.
- Существенных преимуществ по антимикробной активности линезолида в сравнении с ванкомицином нет. Однако, следует помнить о более благоприятном профиле безопасности линезолида, более удобном режиме дозирования, отсутствии необходимости коррекции дозы линезолида при почечной недостаточности. Оставлять в резерве - на какие возбудители?Только если на ванкомицинорезистентные энтерококки, которых также в России нет.
Поэтому решать вопрос о том, приобретать линезолид для стационара или нет, Вы должны сами на месте.
2. Что касается эндокардита, то, учитывая бактериостатическую активность линезолида, это не очень хороший выбор (особенно теперь, когда в РФ зарегистрирован даптомицин, для которого инфекции кровотока являются одним из основных показаний).
3. Применение линезолида у новорожденных вполне возможно в случае инфекции, вызванной возбудителями, устойчивыми к другим классам препаратов.
2. Ситуация с антибиоткорезистентностью нозокомиальных стафилококков и энтерококков может значительно различаться в разных стационарах и отделениях. Последние данные многоцентровых исследований по этой проблеме скоро будут опубликованы в журнале "Клиническая микробиология и антимикробная химиотерапия" (правда штаммов от новорожденных там очень немного).
3. Проблема резистентности к ванкомицину (по крайней мере высокого уровня) в целом в РФ пока остро не стоит. Это касается в основном специализированных крупных онкологических и гематологических стационаров, где уже достаточно часто встречаются ванкомицинорезистентные энтерококки. С ванкомицином есть другая проблема - сложность его дозирования, поскольку по хорошему, доза должна рассчитываться индивидуально на основании мониторинга остаточной к-ции в сыворотке крови, а также недостаточная эффективность в отношении штаммов с МПК >0,5 мг/л. Что касается информации по дозированию ванкомицина, - скоро в журнале "Клиническая микробиология и антимикробная химиотерапия" выйдет обзор американских рекомендаций по этому вопросу.
Насчёт прозвучавших фармакокинетических преимуществ линезолида - предлагаю перевод абстракта только что опубликованного мета-анализа сравнения линезолида и гликопептидов при нозокомиальной пневмонии (как Вы знаете, именно создание более высоких концентраций в легочной ткани линезолидом по сравнению с гликопептидами и конкретно ванкомицином является главным аргументом при выборе линезолида для лечения нозокомиальной пневмонии).
Walkey AJ, O'Donnell MR, Wiener RS. Linezolid versus Glycopeptide Antibiotics for the Treatment of Suspected Methicillin-Resistant Staphylococcus Aureus Nosocomial Pneumonia: A Meta-Analysis of Randomized Controlled Trials. Chest. 2010 Sep 23.
Основа: Метициллин-резистентный золотистый стафилококк (MRSA) является важной причиной нозокомиальной пневмонии. Руководства обществ внушают мысль, что линезолид может иметь преимущества при лечении нозокомиальной пневмонии, вызванной MRSA. Мы исследовали эффективность линезолида в сравнении с гликопептидными антибиотиками (ванкомицином или тейкопланином) при нозокомиальной пневмонии.
Методы: Систематический обзор и мета-анализ англоязычных рандомизированных контролируемых исследований сравнения линезолида и гликопетидных антибиотиков при подозрении на пневмонию, вызванную MRSA, у пациентов старше 12 лет. Высокочувствительный поиск по базам PubMed MEDLINE и Кохрейновский библиотеке выделил соответствующие исследования.
Результаты: Восемь исследований, включавших 1641 пациентов, соответствовало критериям включения. Линезолид не превосходил гликопептидные антибиотики по конечным точкам клинического успеха [RR линезолид vs. гликопептиды 1.04, 95% CI 0.97, 1.11, p=0.28], микробиологического успеха (RR 1.13, 95% CI 0.97, 1.31, p=0.12) или летальности (RR 0.91, 95% CI 0.69, 1.18, p=0.47). В добавлении, клинический успех в субпопуляции пациентов с MRSA-положительной культурой материала из респираторного тракта (RR 1.23, 95% CI 0.97, 1.57, p=0.09) статистически достоверно не отличался от соответствующих показателей в субпопуляции без выделения MRSA из респираторного тракта (RR 0.95, 95% CI 0.83, 1.09, p=0.48), p = 0.07. Риск нежелательных явлений не отличался в двух классах антибиотиков (RR 0.96, 95% CI 0.86, 1.07, p=0.48).
В продолжении вышесказанного - перевод абстракта ещё одного нового мета-анализа по сравнению терапии линезолидом vs ванкомицином или тейкопланином при нозокомиальной пневмонии - интересны данные не только по эффективности, но и по безопасности.
Kalil AC, Murthy MH, Hermsen ED, Neto FK, Sun J, Rupp ME. Linezolid versus vancomycin or teicoplanin for nosocomial pneumonia: a systematic review and meta-analysis. Crit Care Med. 2010 Sep;38(9):1802-8.
ВВЕДЕНИЕ: В сравнении с гликопептидами линезолид достигает высоких концентраций в среде легочной эпителиальной выстилки, что может коррелировать с повышением эффективности при лечении нозокомиальной пневмонии. Однако клиническое преимущество не демонстрируется.
ЦЕЛЬ: Исследовать гипотезу, что линезолид может иметь преимущества над гликопептидами.
МЕТОДЫ: Были включены проспективные рандомизированные исследования, в которых изучалось лечение нозокомиальной пневмонии линезолидом в сравнении с гликопептидами. Неоднородность была исследована при помощи I(2)- и Q-статистики. Относительный риск в мета-анализе основывался на постоянной модели и модели со случайными уровнями факторов. Исходы оценивались на данных клинического излечения, микробиологической эрадикации и побочных явлениях.
РЕЗУЛЬТАТЫ: Были включены 9 исследований с линезолидом (7 в сравнении с ванкомицином, 2 в сравнении с тейкопланином) (n = 2329). Анализ применения линезолида в сравнении с гликопептидами показал относительный риск клинического излечения 1.01 (95% конфиденциальный интервал, 0.93-1.10; p = 0.83; I(2) = 0%) и относительный риск микробиологической эрадикации 1.10 (95% конфиденциальный интервал, 0.98 -1.22; p = 0.10; I(2) = 0%). Анализ подгруппы с MRSA-инфекцией показал относительный риск микробиологической эрадикации 1.10 (95% конфиденциальный интервал, 0.87-1.38; p = 0.44; I(2) = 16%). При сравнении линезолида только с ванкомицином относительный риск клинического излечения составил 1.00 (95% конфиденциальный интервал, 0.90-1.12), относительный риск микробиологической эрадикации и MRSA-инфекции составил соответственно 1.07 (95% конфиденциальный интервал, 0.90-1.26; p = 0.45) и 1.05 (95% конфиденциальный интервал, 0.82-1.33; p = 0.71). Риск тромбоцитопении (относительный риск = 1.93; 95% конфиденциальный интервал, 1.30-2.87; p = 0.001) и гастроинтестинальные нарушения (относительный риск = 2.02; 95% конфиденциальный интервал, 1.10-3.70; p = 0.02) были выше при применении линезолида, но не наблюдалось различий в частоте почечных нарушений (относительный риск = 0.89; 95% конфиденциальный интервал, 0.56-1.43; p = 0.64) или всех случаев летальности (относительный риск = 0.95; 95% конфиденциальный интервал, 0.76-1.18; p = 0.63).

Наиболее трудными для лечения являются инфекции, вызванные метициллинорезистентными штаммами S. aureus (MRSA) и S. epidermidis (MRSE), в частности инфекции области хирургического вмешательства после больших ортопедических операций. Распространенность штаммов MRSA в России высока. Несмотря на то, что по данным многоцентрового исследования в структуре бактериальных возбудителей нозокомиальных инфекций за 2011–2012 гг. доля S. aureus составила 16,7 %, что сопоставимо с данными 2006–2008 гг. (19,5 %), существенно увеличилась значимость метициллинорезистентных штаммов данного возбудителя. Доля MRSA составляла 33,4 % в 2001–2002 гг. и 55,4 % в 2006–2008 гг., возросла до 66,9 % к 2011–2012 гг. [5]. Выделение метициллинорезистентных штаммов S. aureus и S. epidermidis из гнойного очага при перипротезной инфекции является неблагоприятным прогностическим признаком для эффективности антибактериальной терапии и лечения в целом. В РФ до настоящего времени препаратом выбора при MRSA- и MRSE-ассоциированных инфекциях остаётся гликопептидный антибиотик ванкомицин. Однако в настоящее время в научной медицинской литературе многие авторы отмечают снижение эффективности ванкомицина при антибактериальной терапии инфекций, вызванных метициллинорезистентными стафилококками, in vitro демонстрирующими чувствительность к ванкомицину [9]. Это определяет необходимость применения эффективных комбинаций уже известных лекарственных средств разных классов, обладающих синергидным действием в отношении лекарственноустойчивых микробных возбудителей. К примеру, сохранившие активность рифампицин и фузидиевую кислоту для достижения хорошего антистафилококкового эффекта необходимо сочетать c β-лактамами или фторхинолонами [8]. Многие зарубежные исследователи предлагают широко использовать комбинированную антибактериальную терапию при лечении инфекции протезированного сустава стафилококковой этиологии для усиления бактерицидного эффекта, воздействия на микробные биопленки и на клетки бактерий, расположенные внутриклеточно [8].
Целью настоящего исследования было оценить in vitro активность комбинации гентамицина и диоксидина, обладающих принципиально различным механизмом антимикробного действия, в отношении штаммов метициллинорезистентных стафилококков.
Материалы и методы исследования
FIX = FIC (одного антибиотика) + + FIC (второго антибиотика),
где FIC (fractional inhibitory concentrations) – фракционная ингибирующая концентрация исследуемого антибиотика, определяемая как отношение величины минимальной подавляющей концентрации (МПК) этого антибиотика в комбинации с МПК второго антибиотика. Характера взаимодействия препаратов определяли по величине коэффициента FIX согласно шкале: 4 антагонизм.
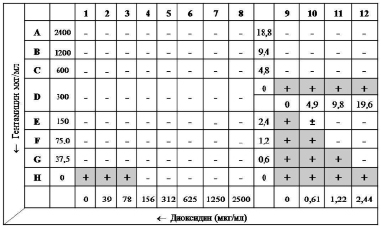
Технически метод осуществляли следующим образом: в каждую лунку 96-луночного планшета вносили по 50 мкл питательного бульона Мюллера-Хинтон (МХБ). Антимикробные препараты титровали серийно двукратно: гентамицин с концентрации 2400 до 0 мкг/мл (ряды A-H), диоксидин – с 2500 до 0 мкг/мл (колонки 1–12) (рис. 1).
Инокулюм каждой тест-культуры (0,5 McFarland) готовили в стерильном изотоническом растворе. В каждую лунку вносили по 100 мкл инокулюма и инкубировали планшет 18 ч при 37 °C. За МПК (в мкг/мл) принимали наименьшую концентрацию антимикробного средства, при которой не наблюдалось видимого роста микроорганизма. Далее для тестируемых штаммов S. aureus рассчитывали коэффициенты FIX. На основе значений фракционных коэффициентов FIC строили изоболограмму и оценивали ее характер.
Количественные результаты представлены в виде медиан, в качестве меры рассеивания использовали межквартильный интервал 25–75 % (МКИ 25–75 %).
Результаты исследования и их обсуждение
Установленные по результатам 3-х экспериментов медианы МПК (табл. 1) показали крайне невысокую активность диоксидина при воздействии как на штаммы устойчивые к метициллину (156 мкг/мл), так и чувствительные (39 мкг/мл). Кроме того, МПК гентамицина в отношении тестируемых изолятов MRSA также в 4 раза превысила МПК для чувствительных к метициллину референс-штаммов. Однако применение антимикробных препаратов в комбинации потребовало существенно меньших их концентраций для эффективного подавления возбудителей.
Медианы коэффициентов FIC и FIX взаимодействия гентамицина и диоксидина свидетельствуют (табл. 2) об эффективном действии изучаемой комбинации в отношении всех тестируемых культур стафилококков. Величина итоговых коэффициентов FIX во всех случаях не превысила 0,5 и составила для всех штаммов 0,09–0,26, что характерно для синергидного действия препаратов. Установлено, что, несмотря на выявленное синергидное действие в отношении метициллинорезистентных изолятов стафилококков устойчивых к гентамицину, коэффициент FIX для них был выше, чем для референс-штаммов, чувствительных к метициллину и гентамицину.
16 августа 2016
- 9979
- 7,0
- 0
- 6
Структурная формула нового пептидного антибиотика.
Немецкие ученые обнаружили новое оружие для борьбы с больничным монстром — мультирезистентным золотистым стафилококком. Долгие годы оно скрывалось не в вечной мерзлоте или Марианской впадине, а прямо под нашим носом. Вернее — в нём.
В последние годы во всем мире увеличилось количество инфекционных заболеваний, вызванных устойчивыми к антибиотикам бактериями. Организмы с множественной лекарственной резистентностью (multidrug-resistant organisms, MDRO), такие как метициллин-резистентный золотистый стафилококк, нечувствительные к ванкомицину энтерококки или резистентные к цефалоспоринам третьего поколения грамотрицательные бактерии, в ближайшие десятилетия могут стать более частыми причинами смерти, чем рак [1].
Несколько лет назад удалось обнаружить, что представители человеческой микробиоты способны производить бактериоцины, поражающие близкородственных бактерий [2]. Например, в 2014 году из человеческого комменсала Lactobacillus gasseri выделили и описали новый синтезируемый рибосомами тиопептидный антибиотик — лактоциллин [3].
Семейные разборки
Немецкий исследователь Александр Ципперер со своими сотрудниками в июле 2016 года сообщил о том, что обнаружил в человеческом носу бактерию Staphylococcus lugdunensis IVK28, которая подавляет рост метициллин-резистентного золотистого стафилококка (methicillin-resistant Staphylococcus aureus, MRSA) [1].
Стафилококки относятся к типичным бактериям-комменсалам, колонизирующим кожу и поверхности слизистых оболочек. Staphylococcus aureus — шаровидные грамположительные бактерии, вырабатывающие каротиноидный пигмент, который придает их клеткам золотистый цвет (рис. 1). Эти микроорганизмы чрезвычайно устойчивы к внешним воздействиям и выживают в воздухе, пыли, почве, продуктах питания, на оборудовании пищевых производств и предметах быта [6], [7].
Рисунок 1. Staphylococcus aureus и лейкоциты.
Рисунок 2. Метициллин-резистентные золотистые стафилококки.
Staphylococcus aureus — бактерия условно-патогенная, проявляющая свои патологические свойства только в благоприятных условиях, а создает их, как правило, ослабление иммунитета носителя. Активная жизнедеятельность стафилококка может привести к разнообразным заболеваниям [5], [7], [8]:
- кожи (прыщи, фурункулы, синдром ошпаренной кожи);
- органов дыхания (плеврит, пневмония);
- костной и соединительной тканей (артрит, остеомиелит);
- нервной системы и органов чувств (отит, менингит);
- сердечно-сосудистой системы (эндокардит, флебит, стафилококковая бактериемия).
Факторы патогенности S. aureus — это микрокапсула, компоненты клеточной стенки, ферменты агрессии и токсины. Микрокапсулы защищают клетки бактерий от фагоцитоза, способствуют их адгезии и распространению по организму хозяина. Составляющие клеточной стенки (например пептидогликан, тейхоевые кислоты и белок А) вызывают развитие воспаления, обездвиживают фагоциты и нейтрализуют иммуноглобулины. Коагулаза, главный фермент агрессии, вызывает свертывание плазмы крови [7], [9].
Наиболее опасны метициллин-резистентные стафилококки (methicillin-resistant S. aureus, MRSA) (рис. 2). Метициллин — это модифицированный пенициллин, с помощью которого еще недавно успешно боролись со стафилококковой инфекцией. MRSA устойчивы не только к метициллину, но и к другим антибиотикам пенициллиновой группы (диклоксациллину, оксациллину, нафциллину и др.), а также к цефалоспоринам. В последнее время выявлены штаммы и с более широким спектром устойчивости: ванкомицин-резистентные (VRSA) и гликопептид-резистентные (GISA) [6], [9], [10].
Штамм S. lugdunensis IVK28 эффективно боролся со своим вредоносным родственником лишь в условиях недостатка железа и только на твердых агаризованных средах (рис. 3, слева). Механизм противостояния был неясен, а потому Ципперер провел транспозонный мутагенез клеток выделенного штамма — чтобы выявить ген, ответственный за синтез смертельного для S. aureus вещества.

В итоге удалось получить мутанта IVK28, который не мог подавлять рост MRSA. Анализ места встройки транспозона показал, что тот нарушил структуру гена предполагаемой нерибосомной пептидсинтетазы (НРПС). Оказалось, что этот ген вместе с другими последовательностями, связанными с биосинтезом антибиотиков, входит в состав оперона размером 30 т.п.н. Это указывало на то, что предполагаемая молекула ингибитора может быть комплексом нерибосомных пептидов.
Оперон методом ПЦР обнаружили во всех культурах S. lugdunensis, а значит, он характерен для всего вида, а не только для штамма IVK28. Однако GC-состав оперона (26,9%) отличался от GC-состава остального генома S. lugdunensis (33,8%), что свидетельствовало о возможном заимствовании этого полезного генетического кластера у других видов бактерий — путем горизонтального переноса .
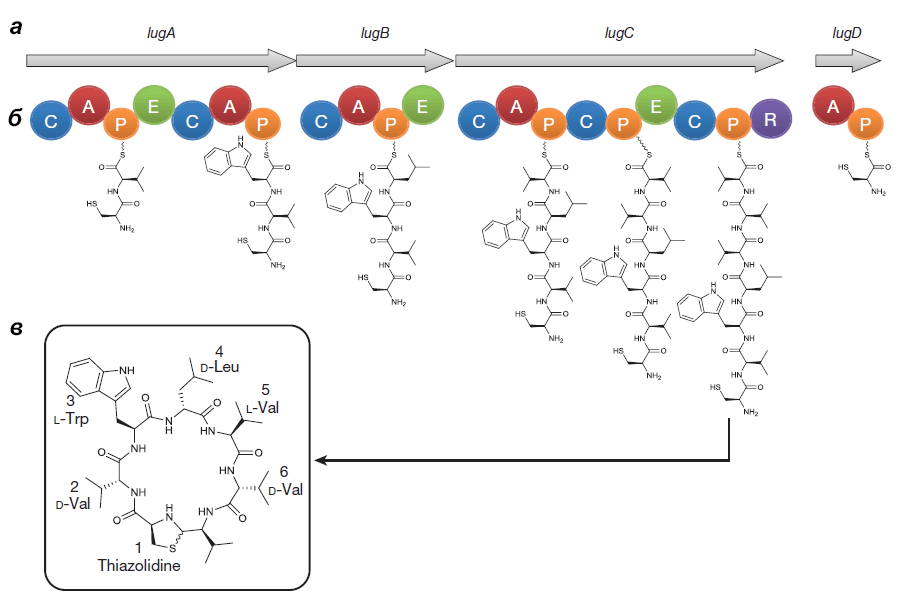
Оперон состоит из генов lugA, B, C и D, кодирующих пептидсинтетазные белки (см. врезку ниже), а также из других генов, чьи продукты необходимы для синтеза и транспорта нерибосомного пептида.
Чтобы окончательно вменить оперону участие в антибактериальной деятельности S. lugdunensis, наименьший ген (lugD) удалили. Мутант ΔlugD, как и ожидалось, не мог подавлять рост золотистого стафилококка, но когда в него ввели плазмиду с работающим геном lugD, агрессивный фенотип восстановился (рис. 3, в центре и справа).
Секретное оружие
Выделенный Ципперером продукт lug-оперона оказался нерибосомным циклическим пептидом, состоящим из пяти аминокислот (двух D-валинов, L-валина, D-лейцина и L-триптофана) и тиазолидинового гетероцикла (рис. 4). Назвали антибиотик лугдунином.
Химическим синтезом удалось получить продукт с идентичными природному лугдунину химическими свойствами и антибактериальным эффектом. Ученые предположили, что этот антибиотик ингибирует синтез бактериальных биополимеров — белков, ДНК и пептидогликанов [5].
Этот класс пептидов синтезируется в клетках низших грибов и бактерий без участия рибосом. Нерибосомные пептиды (НРП) также встречаются и у высших организмов, которые имеют бактерий-комменсалов [12].
НРП подразделяются на несколько функциональных групп [13]:
- антибиотики (ванкомицин);
- предшественники антибиотиков (ACV-трипептид — предшественник пенициллина и цефалоспорина);
- иммуносупрессоры (циклоспорин);
- противоопухолевые пептиды (блеомицин);
- сидерофоры (пиовердин);
- токсины (HC-токсин);
- сурфактанты (сурфактин).
Каждый модуль состоит как минимум из трех доменов:
- конденсирующего (принимающего пептидную цепь из предыдущего модуля);
- аденилирующего (выбирающего нужную аминокислоту);
- пептидильного (образующего пептидную связь).
Нередко модули включают и другие домены, в том числе эпимеризующий, который преобразует L-аминокислоты в D-формы [14].
По аналогии с триплетным рибосомным кодом для синтеза белка существует и нерибосомный, код НРПС, определяемый 10 остатками аминокислот в субстрат-связывающем кармане аденилирующего домена. От комбинации этих остатков зависит то, какая аминокислота будет встроена в пептид конкретным модулем НРПС. Зная этот код, можно предсказывать субстратную специфичность аденилирующих доменов и даже произвольно изменять ее посредством замены аминокислот в домене [14].
В экспериментах немецких ученых лугдунин действовал не только на метициллин-резистентных стафилококков, но и на гликопротеин-резистентных, и даже на других грамположительных бактерий типа листерии и ванкомицин-резистентного энтерококка (табл. 1). Минимальная ингибирующая концентрация (МИК) нового бактериоцина — 1,5–12 мкг × мл −1 , что говорит о высокой активности вещества. При этом такие концентрации никак не влияли на человеческую сыворотку, не вызывали лизис нейтрофилов или эритроцитов и не ингибировали метаболическую активность моноцитов. Бактериальные же клетки под действием лугдунина в концентрации даже ниже МИК прекращали синтезировать ДНК, РНК, белки и компоненты клеточной стенки. В этом отношении лугдунин напоминает даптомицин, дающий такой же эффект, но способ действия которого пока не изучен. Не было отмечено возникновения резистентности клеток S. aureus к лугдунину даже после их месячного выращивания на малых концентрациях.
| Виды и штаммы | Резистентность | МИК лугдунина (мкг × мл −1 ) |
|---|---|---|
| Staphylococcus aureus USA300 (LAC) | MRSA | 1,5 |
| + 50% человеческой сыворотки крови | 1,5 | |
| Staphylococcus aureus USA300 (NRS384) | MRSA | 1,5 |
| Staphylococcus aureus Mu50 | GISA | 3 |
| Staphylococcus aureus SA113 | 3 | |
| Staphylococcus aureus RN4220 | 3 | |
| Enterococcus faecium BK463 | VRE | 3 |
| Enterococcus faecalis VRE366 | VRE | 12 |
| Listeria monocytogenes ATCC19118 | 6 | |
| Streptococcus pneumoniae ATCC49619 | 1,5 | |
| Bacillus subtilis 168 (trpC2) | 4 | |
| Pseudomonas aeruginosa PAO1 | >50 | |
| Escherichia coli DH5α | >50 | |
| Условные обозначения: MRSA — метициллин-резистентные S. aureus; GISA — устойчивые к гликопротеинам S. aureus; VRE — ванкомицин-резистентные Enterococcus. Таблица из [1]. | ||
Испытания в боевых условиях
Как и полагается, способность лугдунина лечить стафилококковые инфекции продемонстрировали in vivo на мышиной модели (рис. 5). У шести мышей сбрили шерсть на спине и, повредив кожу многократным приклеиванием/отклеиванием пластыря, нанесли на это место золотистого стафилококка. Затем кожу обработали мазью, содержащей 1,5 мкг лугдунина, и спустя шесть часов оценили результат. Обработка новым антибиотиком сильно сокращала или даже полностью уничтожала популяцию S. aureus. Причем не только на поверхности кожи, но и в более глубоких ее слоях.
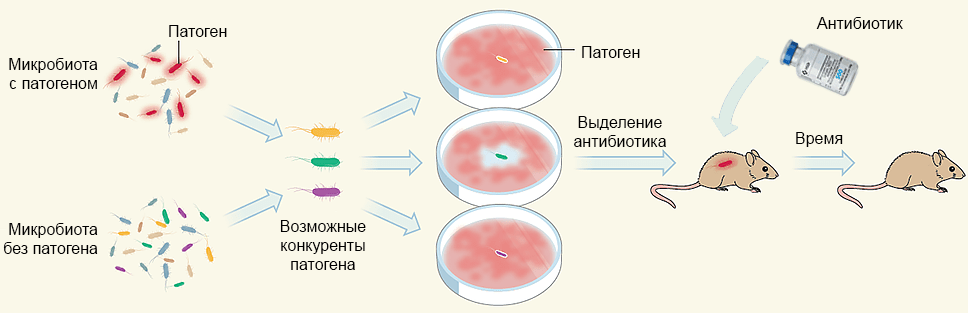
Рисунок 5. Общая схема подхода к идентификации природного антибиотика. Из бактериальных популяций человеческого тела отбирают представителей, которые не могут сосуществовать с интересующими патогенными бактериями. Этих возможных конкурентов тестируют по отдельности на средах с инфекционным агентом. Из культуры, успешно подавляющей рост патогенов, выделяют антибиотик, действие которого проверяют на животных моделях.
[5], рисунок модифицирован и адаптирован
Чтобы понять, может ли S. lugdunensis помешать колонизации носовой полости позвоночных животных золотистым стафилококком в естественных условиях, ученые провели следующий эксперимент. В носы хлопковых хомяков ввели два вида смешанных культур (S. aureus + S. lugdunensis IVK28 и S. aureus + S. lugdunensis IVK28ΔlugD) и каждую по отдельности. В контрольных случаях, когда вводили по одному штамму, все три культуры стабильно колонизировали носовую полость. Однако при введении смеси S. aureus + S. lugdunensis IVK28 количество золотистого стафилококка через 5 дней значительно уменьшилось по сравнению со смесью S. aureus + S. lugdunensis IVK28ΔlugD. Этот эксперимент показал, что продукция лугдунина позволяет штамму IVK28 эффективно конкурировать с золотистым стафилококком in vivo.
Оставалось разобраться, предотвращает ли присутствие S. lugdunensis в носу человека колонизацию бактериями S. aureus. Ципперер и его коллеги исследовали мазки из носовых ходов 187 госпитализированных больных. Из них у 60 человек (32,1%) обнаружили золотистого стафилококка и у 17 человек (9,1%) — S. lugdunensis. И только у одного пациента с S. lugdunensis в носу обитал S. aureus. У всех выделенных штаммов S. lugdunensis ПЦР-анализ продемонстрировал наличие lug-оперона, а все обнаруженные штаммы S. aureus оказались восприимчивы к лугдунину.
Перспективы
Лугдунин оказался первым обнаруженным бактериоцином нового класса — макроциклических тиазолидиновых пептидных антибиотиков. Все проверенные штаммы S. aureus (как природные, так и лабораторные) не смогли выработать резистентности к нему. Это дает надежду на то, что лугдунин в будущем станет коммерческим препаратом для борьбы с золотистым стафилококком.
И наконец, сам факт обнаружения нового антибиотика у представителя человеческой микробиоты должен послужить стимулом для активизации поиска других продуцентов бактериоцинов в составе именно таких сообществ. В дальнейшем это поможет медикам успешнее сдерживать наступление мультирезистентных патогенов.

Показания к применению
Антибиотик предназначен для борьбы с грамположительными микроорганизмами, когда лечение другими аналогичными препаратами не дает результата или невозможно. В зону действия входят следующие заболевания:
- Эндокардит. Сложность лечения заключается в обширном распространении возбудителей в нетипичных формах (стафилоккоков). Для приостановки процесса лечение назначают, не дожидаясь идентификации возбудителя. Ванкомицин является активным агентом против стафилококков. При комбинации средства с амингликозидами увеличивается эффективность терапии. При стафилококке, повлекшем патологию, препарат приводит к эрадикации вируса и выздоровлению в 90% случаях. Следует корректировать дозировку, в зависимости от степени поражения печени.
- Сепсис. Эффективность лечения основана на санации очага и использовании антибиотиков. Ванкомицин незаменим, если причиной заболевания является резистентный стафилококк или энтерококк. Чаще всего при сепсисе антибиотик выбирают эмпирическим путем, с учетом предполагаемого возбудителя и первичных источников. При проведении лечения следует учитывать возможность массового высвобождения токсинов, создаваемых стафолококком.
- Воспаления ЦНС. Антибиотик назначают сразу после постановки предварительного диагноза. Если предрасполагающий фактор является иммунносупрессивным, лечение проводят с использованием Ванкомицина в сочетании с Ампициллином. Цефтадизимом. Эффективна комплексная терапия при травмах головы, периоде после нейрохирургических операций, цереброспинальном шунтировании.
- Пневмония. Ванкомицин назначают, когда другие антибиотики оказываются неэффективными. Это связано с тем, что в большинстве случаев препараты первой линии перестают работать через определенное время. Из-за приобретенной резистентности требуется более мощное воздействие на бактерии. Средство выписывают, если пневмония связана со стафилококком. Анаэробная инфекция поддается лечению в сочетании с метронидозолом и бета-лактатами.
- Антибиотик эффективен при метициллин-резистентной флоре. Он считается наиболее мощным при проведении эмпирической терапии. Стартовое лечение тяжелых патологий, вызванных стафилококком, кластридиями, приводит к применению Ванкомицина при доказанных или предполагаемых воспалениях устойчивого характера.
- Инфекции суставов и костей. Антибиотик назначают для эмпирического лечения, так как пенициллиновая группа не является эффективной против большинства видов стафилококка. Такая же проблема существует при инфекции кожи и тканей, что обусловливает обязательное применение Ванкомицина.
- Энтероколиты и дисбактериоз. Вирус устойчив к большинству типов антибиотиков. Не способен противостоять Ванкомицину, который используют при псевдомембранозном колите. Препарат вводят перорально, так как микроорганизмы не попадают в слизистую оболочку. Средство считается наиболее предпочтительным при тяжелых формах поражения
- Энтерококк входит в состав здоровой микрофлоры, но при условиях его перерождения наступает время действия инфекционного агента. Антибиотик блокирует синтез ядер возбудителя, способствует его возвращению в нормальное состояние.
Имеются случаи выделения резистентных энтерококков, устойчивых к Ванкомицину. Целесообразно обеспечить обширный скрининг для определения дозировки и курса лечения.
Состав
1 флакон препарата содержит действующее вещество Vancomycinum hydrochloride ( также звучит название Ванкомицина на латинском в рецепте). Сухой порошок предназначен для приготовления инъекционного раствора.
Лечебные свойства
Механизм действия Ванкомицина заключается в уничтожении анаэробных бактерий граммположительного типа: стрептококка, энтерококка, стафилококка, кластридий, листерий, актиномицетов, дифтероидов. Активен против токсикогенных штаммов. Наиболее эффективно проявляется при рН8, с уменьшением показателя до индекса 6, влияние на вирусы резко сокращается. К Ванкомицину устойчивы граммотрицательные патогены. Перекрестный резистентный эффект с другими противобактериальными препаратами не выявлен.
Средство равномерно распределяется по всем тканям и кровеносной системе организма, 50/5 соединяется с белками плазмы. Максимальной концентрации достигает спустя час. Плохо всасывается при приеме перорально
Уровень метаболизма незначительный, полувыведение у детей грудникового возраста составляет 6 ч, до 12 лет – 2-3 ч, у взрослых – 4-10 ч. Небольшая часть средства выходит с желчью, 90% удаляется почками. У пациентов с нефропатологиями процесс выведения замедляется – может достигать недельного срока.
Формы выпуска
Средняя цена за один флакон: 200 руб
Ванкомицин поступает в продажу в стеклянных флаконах для инъекции, помещенных в белые картонные упаковки с широкой зеленой полосой. Также в коробку вложена инструкция с описанием препарата. В таблетках не выпускается. Для приема перорально в терапевтической практике используется редко по причине плохого всасывания. Порошок пористый, имеет белый цвет, аналоги бывают желтоватого, бледно-серого или розоватого оттенка. Вкус – неприятный, присутствует ярко выраженная горечь. В случаях назначения для детей рекомендуется разбавлять пищевым сиропом при приеме перорально (если нет возможности вводить капельным способом). Флакон закрыт резиновой пробкой с фольгированной оболочкой.
Инструкция по применению Ванкомицина
При использовании необходимо отогнуть край металлического колпачка, крышка снимается легко. Для приготовления раствора нужный объем воды вливают непосредственно во флакон с сухой стерильной массой, взбалтывают до получения однородной смеси. Перед инъекцией следует проверить состав на наличие лишних примесей.
Ванкомицин используется, как самостоятельное средство, может входить в комбинированную систему лечения. Раствор вводится капельным способом, в вену, быстрое повышение концентрации запрещено. Не рекомендуется делать внутримышечные инъекции, чтобы не допускать риск возникновения некротических образований в месте укола.
Ванкомицин для взрослых назначается из расчета 500 мг каждые 360 минут или 1000 мг – на 12 ч. Максимальная доза в сутки составляет 2 г.
Детям до недели вводят 15 мг/кг от массы тела, следующий подход – 10 мг/кг через 12 ч. Ребенку от 1 месяца требуется внутривенное вливание в таких же пропорциях, но с промежутком в 8 ч. Максимальная суточная доза – 2г. Концентрация раствора не должна превышать 2,5-5мг/мл, Лекарство следует вводить в течение 60 мин.
Пожилым пациентам и людям с проблемами функционирования почек в некоторых случаях требуется снижение количества препарат. Терапию больным с избыточной массой тела дозу корректируют индивидуально.
Раствор для инъекций готовят из расчета 500 мг на 10 мл воды. Прием внутрь возможен при наличии колита, возбудителем которого является энтерококк. 24-часовая доза для взрослых составляет 100 мг готового раствора, разделенного на 3-4 подхода. Если нет возможности внутривенного вливания, детям дают лекарство перорально: 40 мг/кг массы тела в течение дня. Порошок (500 гм) смешивают с водой (30 мл), добавляют ложку фруктового сиропа для вкуса. Лечение проводят 7-10 дней.
В 1 триместре препарат не назначают, во 2 и 3 периоде его используют только по жизненным показателям. Грудное вскармливание на весь срок терапии рекомендуется прекратить.
Противопоказания и меры предосторожности
Основной фактор отмены средства – это повышенная чувствительность к компоненту. Нельзя назначать антибиотик при нарушениях слуха (неврит нерва), заболеваниях почек.
Взаимодействия с другими средствами
Применение медикамента с некоторыми препаратам может вызвать ряд негативных реакций:
- При одновременном использовании с анестетиками у детей наблюдалась эритема кожи с расширением капилляров на лице. У взрослых может возникнуть нарушение сердечного ритма и блокада.
- Органы слуха и почки подвержены риску вследствие сочетания Ванкомицина с амфотерцином, цисплатином, диуретиками, полимиксинами.
- Препарат нельзя принимать одновременно с группой кортекостероидов, гепарином, фенобарбиталом.
- Следует избегать смешивания с антибиотиками бета-лактамного типа.
- Колестирамин приводит к снижению эффективности.
При лечении недоношенных младенцев необходимо контролировать содержание в сыворотке крови. В период терапии врач назначат обследования слуха, диагностику почек.
Побочные эффекты
В процессе приема антибиотика у некоторых пациентов были отмечены нарушения в сосудистой системе: повышение артериального давления, шум в сердце. Показатели проявлялись при быстром введении раствора. При псевдомембранозном колите и заражении энтерококком терапевтические методы могут вызвать тошноту, диарею, рвоту, горькую отрыжку. Функциональные нарушения почек приводят к недостаточности в случае потери контроля при приеме препарата.
Если пациент жалуется на звон в ушах и головокружение, стоит обратить внимание на органы слуха. Аллергические проявления довольно редки, но существуют случаи высыпаний на коже, дерматитов, крапивницы.
Передозировка
При избыточном накоплении лекарства в организме побочные явления усиливаются. Для коррекции требуется перерыв и очистка кожи методом гемоперфузии. Стойкий положительный результат появляется через 2 часа после начала процедуры.
Инструкции по условию и сроку хранения
Препарат годен в течении 2 лет с момента изготовления, при условии его содержания в темном сухом месте при температуре не ниже 20 0 С. Готовый раствор можно поместить в холодильник. Использовать необходимо на протяжении 14 дней. Просроченное лекарство категорически запрещено применять.
Аналоги
При индивидуальных показателях и невозможности использования Ванкомицина, по тем или иным причинам, применяют препараты с идентичным механизмом действия:
Верофарм, Россия
Цена: 350-550 руб
Vancomycin активен против энтерококка, других г/п бактерий. Выпускается в флаконах 500-1000 мг.
Плюсы:
- Действует бактерицидно на большинство микроорганизмов.
Минусы:
- Осторожно использование при аллергии на тейкопланин.
LP Inc, США
Цена: 400-650 руб
Vancomycin. Тяжелые инфекционные заболевания, вызванные возбудителем стафилококк, энтерококк. Выпускается в флаконах по 500 мг.
Плюсы:
- Высокая эффективность по отношению ко всем г\п вирусам.
Минусы:
- Имеются сильные побочные явления
- Не выпускается в виде таблеток
Читайте также:


