Стафилококк симуланс что это

Стафилококки (лат. Staphylococcus) — род повсеместно распространённых грамположительных бактерий-кокков.
Стафилококки встречаются в норме на всем протяжении желудочно-кишечного тракта человека, включая желудок (О.В. Добровольский, С.Ю. Сереброва), а также на коже, слизистой оболочке респираторных органов и в урогенитальном тракте.
Стафилококки представляют собой неподвижные шарообразные клетки диаметром от 0,5 до 1,5 мкм, располагающиеся одиночно, парами или гроздьями. Не образуют спор.
Стафилококки лучше других бактерий переносят воздействие высокой температуры, света, высушивания и химических агентов. Они выдерживают нагревание до 60°С в течение часа, а отдельные штаммы — до 80°С в течение получаса и 10 минут при нагревании до 150°С, солнечный свет в течение 10-12 часов, сухой жар — до 2-х часов. Стафилококки устойчивы к повышенному содержанию хлористого натрия (поэтому они хорошо сохраняются в консервированных продуктах), чистому этанолу и фенолу. Оптимальная температура для развития стафилококков 30–37 °С.
Частота выделения некоторых видов стафилококков от человека и ряда сельскохозяйственных и домашних животных (Широкова И.Ю.).
| Вид стафилококков | Вид хозяев (%) | ||||
| человек | ослы | овцы | козы | кошки | |
| S. aureus | 4,6 | 2,9 | 37,5 | 19,7 | 13,0 |
| S. epidermidis | 23,6 | 2,3 | 6,7 | 9,2 | 6,0 |
| S. hominis | 26,9 | 6,9 | — | — | — |
| S. capitis | 4,7 | 2,3 | — | — | 1,0 |
| S. haemolyticus | 11,8 | — | — | 18,5 | 2,0 |
| S. warneri | 4,6 | — | 2,5 | 13,0 | — |
| S. saprophyticus | 8,4 | 4,6 | 5,0 | 3,8 | — |
| S. cochnii | 4,2 | 2,3 | — | 1,7 | — |
| S. xylosus | 9,9 | 10,3 | 11,7 | 6,6 | 2,0 |
| S. simulans | 1,3 | — | 7,5 | — | 4,0 |
| S. intermedius | — | — | — | — | 10,0 |
| S. felis | — | — | — | — | 45,0 |
| S. sciuri | — | 25,1 | 17,5 | 5,8 | 6,0 |
Род стафилококки входит в семейство Staphylococcaceae, порядок Bacillales, класс Bacilli, тип Firmicutes, Terrabacteria group, царство Бактерии.
В род стафолококки входят следующие виды: S. agnetis, S. argensis, S. argenteus, S. arlettae, S. aureus (стафилококк золотистый), S. auricularis, S. capitis, S. caprae, S. carnosus, S. chromogenes, S. cohnii, S. condimenti, S. delphini, S. devriesei, S. epidermidis (стафилококк эпидермальный), S. equorum, S. faecalis, S. felis, S. fleurettii, S. gallinarum, S. haemolyticus, S. hominis, S. hyicus, S. intermedius, S. kloosii, S.leei, S. lentis, S. lugdunensis, S. lutrae, S. lyticans, S. massiliensis, S. microti, S. muscae, S. pasteuri, S. petrasii, S. pettenkoferi, S. piscifermentans, S. pseudintermedius, S. pseudolugdunensis, S. rostri, S. saccharolyticus, S. saprophyticus (стафилококк сапрофитный), S. schleiferi, S. schweitzeri, S. sciuri, S. simiae, S. simulans, S. stepanovicii, S. succinus, S. vitulus, S. warneri, S. xylosus.
У некоторых видов стафилококков выделены подвиды:
Ряд видов рода стафилококков, исходя из общности физиологических признаков и генетического родства, объединены в 4 группы:
- группа Staphylococcus epidermidis: S. epidermidis, S. capitis, S. warneri, S. haemolyticus, S. hominis и S. saccharolyticus
- группа Staphylococcus saprophiticus: S. saprophyticus, S. cohnii и S. xylosis
- группа Staphylococcus simulans: S. simulans и S. carnosus
- группа Staphylococcus sciuri: S. sciuri и S. lentus
В зависимости от способности продуцировать коагулазу, экстрацеллюлярный фермент, вызывающий свертывание плазмы крови, стафилококки подразделяются на коагулаза-положительные (коагулазопозитивные) и коагулаза-отрицательные (коагулазонегативные).
Коагулаза-положительными являются 5 видов стафилококков: Staphylococcus aureus (золотистый стафилококк), Staphylococcus delphini, Staphylococcus hyicus, Staphylococcus intermedius, staphylococcus lutrae, staphylococcus schleiferi subsp. coagulans, среди которых патогенный для человека только золотистый стафилококк. Кроме стафилококков коагулаза-положительной является бактерия Yersinia pestis — возбудитель чумы.
К коагулаза-отрицательным относятся эпидермальный и сапрофитный стафилококки, а также Staphylococcus caprae, Staphylococcus haemolyticus, Staphylococcus hominis, Staphylococcus lugdunensis, Staphylococcus pettenkoferi, Staphylococcus schleiferi, Staphylococcus warneri, Staphylococcus xylosus и другие виды. Коагулаза-отрицательные стафилококки менее патогенны, чем коагулазо-положительные.
Коагулаза-отрицательные стафилококки входят в состав нормальной микрофлоры кожи человека и обычно не вызывают серьёзных заболеваний. Staphylococcus lugdunensis более вирулентны, чем другие коагулаза-отрицательные стафилококки и, в случае имплантируемых медицинских изделий или катетеров, Staphylococcus lugdunensis могут быть причиной тяжело текущих инфекций костей и суставов, возникающих у пациентов, находящихся на лечении в стационаре.
При исследовании биологического материала человека при положительном тесте на коагулазу делается вывод о наличии золотистого стафилококка.
При микробиологическом анализе кала на дисбактериоз отдельно подсчитывают коагулаза-положительные (фактически золотистый стафилококк) и коагулаза-отрицательные (в основном это эпидермальный и сапрофитный) стафилококки. При этом в норме золотистый стафилококк должен отсутствовать, а количество коагулаза-отрицательных стафилококков не должно превышать 10 4 колониеобразующих единиц (КОЕ) на 1 г кала.
Коагулаза-отрицательные стафилококки обнаруживаются в кале у 15,0±3,0 % здоровых людей, причем среднее содержание в 1 г кала от 800 до 3200 КОЕ (М.Д.Ардатская, О.Н.Минушкин).
При избыточном росте стафилококка, как следствии дисбактериоза кишечника, кроме бактериофагов, при медикаментозной терапии применяются различные пробиотки (Бифидумбактерин, Бифиформ, Лактобактерин, Ацилакт, Линекс и др.) и/или адекватные конкретному штамму стафилококка и причине дисбактериоза антибиотики (у взрослых).

Цель. Изучение таксономической структуры микробиоценоза слизистой оболочки переднего отдела носа является одним из важнейших этапов его микроэкологической характеристики. Исходя из этого положения, представлялось важным изучение характера доминирования отдельных видов стафилококка в биотопе слизистых оболочек переднего отдела носа у детей, проживающих в районах с различной антропогенной нагрузкой.
Известно, что в состав микробиоценоза слизистой оболочки переднего отдела носа входят популяции различных видов микроорганизмов, но у детей доминируют представители кокковой микрофлоры, в основном различные виды рода Staphylococcus. Слизистая оболочка носа является основным биотопом стафилококка, где его персистенция протекает в виде бактерионосительства [1,4]. По мнению Д.Г. Дерябина [1], основными источниками стафилококковой инфекции являются носители, рост числа которых прямо пропорционально зависит от подъема заболеваемости.
Материалы и методы. Для анализа характеристики структуры стафилококка проводился отбор проб со слизистой оболочки переднего отдела носа у 521 ребенка в возрасте 8–12 лет. Обследуемые дети проживали в трех районах г. Красноярска с разной экологической обстановкой: 1 – Октябрьский (экологическая обстановка удовлетворительная), 2 – Кировский (экологическая обстановка неудовлетворительная), 3 – Советский (экологическая обстановка неудовлетворительная).
Обсуждение результатов. Проведенные микробиологические исследования показали, что у 454 (87,1 %) из 521 обследованного ребенка со слизистой оболочки переднего отдела носа высевалась кокковая микрофлора – представители рода Staphylococcus, у 38 (7,3 %) обследованных – палочковидная микрофлора и 29 (5,6 %) ребенка при первичном посеве рост отсутствовал.
У большинства обследованных детей, проживающих в Красноярске, со слизистой оболочки переднего отдела носа высевались коагулазоположительный золотистый стафилококк (58,6 %), коагулазоотрицательный эпидермальный стафилококк (16,5 %) и в 6,1 % случаях был идентифицирован коагулазоположительный S.intermedius. Распределение по районам проживания детей выглядело следующим образом. В первом районе золотистые стафилококки высевались в 37,6 % случаев, эпидермальный стафилококк – в 11,9 % и S.intermedius – в 8,4 %. Во втором и третьем районах превалировал S.aureus – 63,2 и 56,8 % соответственно; S. epidermidis встречался в 17,0 и 16,5 % случаев соответственно, S. intermedius регистрировался у 4,4 % обследованных из второго района и у 6,1 % из третьего.
Другие коагулазоотрицательные представители рода Staphylococcus представлены следующими видами: S. hyicus, S. xylosus, S. saprophyticus, S. capitis, S. caprae, S. warneri, S. hemolyticus, S. cohnii, S. simulans и высевались в 13,4 % случаев. Соотношение штаммов данных видов стафилококка, выделенных со слизистой оболочки переднего отдела носа у детей города Красноярска, представлено в таблице 1. Из данных таблицы следует, что помимо коагулазоотрицательных S.epidermidis на слизистой оболочки переднего отдела носа у детей города Красноярска встречаются S. saprophyticus (7,3 %), S. hyicus (2,3 %), S. capitis (1,1 %) и в менее 1 % случаев S. xylosus, S. caprae, S. warneri, S. hemolyticus. Распространенность коагулазоотрицательных культур стафилококка в зависимости от района выделения выглядит следующим образом. Во всех трех исследуемых районах на слизистой оболочке носа у детей из КОС преобладал S. saprophyticus, в первом районе данный вид стафилококка встречался в 4,9 %, во втором высевался у 8 % обследуемых, и в третьем районе у 9,3 %. Кроме S. saprophyticus, в первом районе микробиоценоз верхних дыхательных путей у детей был представлен S. hyicus (4,9 %), S. capitis (3 %), S. xylosus (2 %), S. hemolyticus (1,5 %), S. caprae, S. simulans (1 %) и в менее 1 % случаев встречались S. warneri и S. cohnii. Микробиоценоз слизистой оболочки верхних дыхательных путей у детей, проживающих во втором исследуемом районе, был представлен S. hyicus (1,5 %) и S.warneri (0,7 %). В третьем исследуемом районе микробиоценоз слизистой оболочки носа у детей был менее разнообразен и помимо S. saprophyticus из КОС другие виды не регистрировались.
Таким образом, микробиоценоз верхних дыхательных путей у детей, проживающих в первом исследуемом районе, более разнообразен и представлен 12 видами стафилококка, во втором и третьем районах количество встречаемых видов стафилококка значительно меньше – 6 и 4 соответственно.
Соотношение штаммов разных видов коагулазоотрицательных стафилококков (КОС) в зависимости от района выделения
Исследования последних лет свидетельствуют о том, что загрязнение окружающей среды приводит не только к широкому распространению экологически обусловленных заболеваний, угнетению иммунобиологической реактивности организма, нарушению репродуктивной функции и другим многочисленным негативным сдвигам в состоянии здоровья макроорганизма [1,2,4], но к качественному и количественному изменению микрофлоры организма человека [3,4]. В частности, по мнению Б.А. Шендорова (1998), различные поллютанты в порядке индукции защитных реакций у микробов могут вызывать существенные изменения в их патогенности. Поэтому изучение свойств патогенности у золотистых стафилококков, колонизирующих слизистые оболочки такого слабо адаптированного контингента, как младшие школьники, имеет важное научно-практическое значение [4].
Для более полной оценки микроэкологической характеристики биоценоза очень важно исследовать биологические свойства отдельных штаммов микроорганизмов, входящих в этот биоценоз. На первом этапе бактериологического исследования при индикации стафилококков обращали внимание на пигментообразование колоний. Большинство исследуемых штаммов S.aureus синтезируют пигмент: белый – 31,6 %, желтый – 41,0 %, кремовый – 14,6 % и только 12,8 % колоний стафилококка пигмента не имели. Распределение пигментообразования у культур золотистого стафилококка в зависимости от района выделения выглядело следующим образом: во всех трех исследуемых районах города Красноярска преобладали культуры стафилококка, продуцирующие желтый пигмент (46,1, 31,4 и 45,3 % соответственно), продукция белого пигмента была характерна для 35,5 % культур стафилококка, встречающихся в микробиоценозе слизистой оболочки носа у детей, проживающих в первом исследуемом районе, и в 29,0 и 30,7 % у культур, выделенных во втором и третьем районах соответственно. Наличие кремового пигмента или отсутствие пигментирования у культур золотистого стафилококка встречалось реже. Во втором исследуемом районе у 21,0 % изученных культур отсутствовало пигментообразование, в третьем районе таких культур было 12,5 %, а в первом только у 3,9 % выделенных культур золотистого стафилококка наличие пигмента не регистрировалось. Возможно, пигментообразование зависит от генотипа S.aureus, детерминирующего синтез различных реакций, а вместе с ним – цвет пигмента.
Таким образом, большинство изученных культур золотистого стафилококка (87,2 %), входящих в состав микробиоценоза слизистой оболочки верхних дыхательных путей у детей города Красноярска, продуцировали тот или иной пигмент (рисунок).
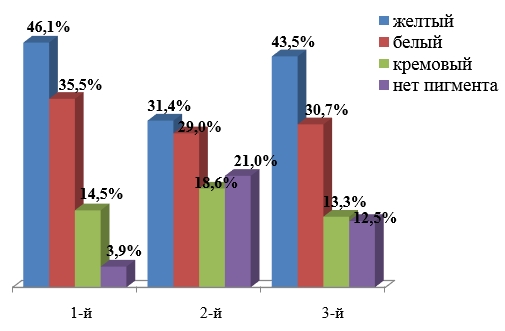
Частота пигментообразования штаммов стафилококка, выделенных со слизистой оболочки носа детей, проживающих в районах с различной антропогенной нагрузкой, %
Среди косвенных индикаторов патогенности большое значение имеют скорость и интенсивность биосинтетических и репродуктивных процессов. Частота появления дочерних клеток, характер их деления и накопления в пространстве отражается на размере и плотности грозди микроорганизмов. Для патогенных штаммов характерно быстрое деление и наличие мелких бактериальных клеток с одновременным формированием весьма массивных гроздей. По мнению авторов [1,4], подобное состояние микробного сообщества типично для микроорганизмов в неблагоприятных условиях, когда идет борьба за сохранения вида. В благоприятной обстановке, напротив, биосинтетические процессы в популяции протекают спокойно, полноценно, ускоренного преждевременного деления клеток нет, поэтому грозди малокомпонентны, микробные особи довольно крупные.
Используя окуляр и объектив микрометра, были проведены замеры особей в гроздях, учитывая компонентность последних.
Анализ полученных данных показал, что размеры клеток стафилококка и объемы гроздей варьируют в достаточно широких пределах в зависимости от района выделения. В первом исследуемом районе преобладали штаммы золотистого стафилококка, имеющие крупные клетки более 1,0 мкм в диаметре – 55,3 %; 36,8 % культур имели средние размеры микробных клеток (0,5–1,0 мкм в диаметре) и только у 7,9 % исследуемых культур S. aureus, выделенных со слизистой оболочки переднего отдела носа у детей, проживающих в первом исследуемом районе, имело клетки менее 0,5 мкм в диаметре, т.е. были мелкие.
Во втором исследуемом районе со слизистой оболочки переднего отдела носа у детей выделялись культуры золотистого стафилококка среднего (60,4 %) и мелкого размера (24,5 %), 15,1 % исследуемых культур имели диаметр бактериальных клеток более 1,0 мкм. В третьем исследуемом районе более 50 % изученных культур золотистого стафилококка имели мелкие размеры (51 %), средними размерами обладали 40,3 % культур, и только 8,7 % бактериальных клеток имели крупные размеры (более 1,0 мкм).
Изучив такой показатель, как объем формирующейся грозди стафилококковых культур, выделенных со слизистой оболочки переднего отдела носа у детей, проживающих в трех исследуемых районах города Красноярска, получили следующие результаты.
В первых двух исследуемых районах преобладали грозди культур стафилококка средние (67,1 и 68,6 % соответственно), а в третьем районе – крупные (51, %). В первом исследуемом районе крупные бактериальные грозди регистрировались у 11,8 % изученных культур, а во втором районе у 18,6 %. В третьем районе в 40,3 % встречались клетки стафилококка, имеющие средние объемы, и в 8,7 % – мелкий.
Заключение. Таким образом, со слизистой оболочки носа у детей, проживающих в первом исследуемом районе, выделялись культуры S. aureus, имеющие крупные размеры бактериальных клеток и средние объемы грозди. Во втором исследуемом районе преобладали культуры более мелкие в диаметре и имеющие средние объемы. В третьем же районе выделенные культуры стафилококка были мелкие и имели крупные объемы грозди, что характерно для патогенных штаммов.
Анализ данных количественной характеристики стафилококкового сообщества слизистой оболочки переднего отдела носа у детей, проживающих в исследуемых районах, показал, что к числу свойств, влияющих на формирование микробного биоценоза, а также определяющих потенциальную эпидемиологическую опасность штаммов, относится показатель микробной обсемененности.
Полученные данные свидетельствуют о высокой микробной обсемененности стафилококком слизистой оболочки переднего отдела носа у детей (103-104 КОЕ/мл), при которой происходит массивное выделение возбудителя во внешнюю среду, а носители являются основными источниками распространения стафилококков среди восприимчивых лиц в человеческой популяции.
Высокая микробная обсемененность (более 50 %) наблюдалась в посевах со слизистой оболочки носа у детей, проживающих во втором и третьем исследуемых районах (63,2 и 56,8 % соответственно), тогда как в посевах со слизистой оболочки носа у детей, проживающих в первом районе, высокая микробная обсемененность составила лишь 37,6 %. В посевах со слизистой носа наблюдался у 29,2 % детей из первого района незначительный рост (101-102 КОЕ/мл), у 33,2 % обследуемых детей рост культуры стафилококка отсутствовал. Во втором исследуемом районе при первичном посеве со слизистой оболочки переднего отдела носа у детей незначительный рост наблюдался у 31,6 % и у 5,14 % обследованных рост отсутствовал. Исследования, проводимые в третьем районе, показали, что у 7,6 % обследованных рост при первичном посеве со слизистой носа отсутствовал, а у 35,5 % при посеве исследуемого материала обсемененность была незначительной. Результаты исследования представлены в таблице 2.
Микробная обсемененность стафилококком слизистой оболочки
переднего отдела носа у детей, проживающих в экологически неравнозначных районах, %
, MD, FACP, Charles E. Schmidt College of Medicine, Florida Atlantic University;
, MD, Wellington Regional Medical Center, West Palm Beach
Last full review/revision September 2017 by Larry M. Bush, MD, FACP; Maria T. Perez, MD





Способность к тромбообразованию путем продуцирования коагулазы отличает вирулентный патоген, Staphylococcus aureus, от менее вирулентных коагулазонегативных штаммов стафилококка. Коагулазопозитивный S. aureus - один из самых распространенных и опасных для человека болезнетворных микроорганизмов из-за его высокой вирулентности и способности к формированию резистентности к антибиотикам.
Коагулазонегативные виды, такие как S. epidermidis все чаще ассоциируются с внутрибольничной инфекцией; S. saprophyticus является причиной инфекции мочевых путей. Коагулазонегативный S. lugdunensis может вызывать инвазивное заболевание с вирулентностью, аналогичной S. aureus. В отличие от большинства коагулазонегативных стафилококков, S. lugdunensis часто остается чувствительным к пенициллиназа-резистентным бета-лактамным антибиотикам (например, к метициллину).
Патогенные стафилококки распространены повсеместно. Около 30% здоровых взрослых, обычно временно, являются носителями стрептококков в носовых проходах и около 20% – на коже; отсюда стрептококки могут инфицировать самого носителя и других людей. Обсемененность пациентов стационаров и медперсонала значительно выше. Инфекция, вызванная S. aureus, чаще встречается среди бактерионосителей, чем среди лиц, которые таковыми не являются, и обычно вызвана колонизирующим штаммом.
Факторы риска
Людьми, предрасположенными к стафилококковой инфекции, являются:
Новорожденные младенцы и кормящие матери
Пациенты с гриппом, хроническими бронхолегочными заболеваниями (например, муковисцидоз, эмфизема), лейкемией, опухолями, хроническими кожными заболеваниями или сахарным диабетом
Пациенты с трансплантатами, имплантированными протезами, другими инородными телами или имплантированными внутрисосудистыми пластмассовыми катетерами
Пациенты, получающие глюкокортикоиды, иммуносупрессанты, лучевую терапию, или противоопухолевую химиотерапию
Пациенты с хронической болезнью почек и находятся на диализе
Пациенты с хирургическими разрезами, открытыми ранами или ожогами
Предрасположенным пациентам могут передаваться антибиотикорезистентные штаммы стафилококков от других пациентов, медперсонала или контактно-бытовым путем через предметы ухода за пациентами. Передача через руки персонала – наиболее распространенный способ заражения, воздушно-капельная передача также актуальна.
Болезни, вызываемые стафилококками
Стафилококки вызывают заболевание путем
Прямого проникновения в ткань
Иногда продукцией экзотоксина
Прямое проникновение в ткань является наиболее распространенным механизмом возникновения стафилококковых заболеваний, включая следующее:
Иногда стафилококками продуцируются множественные экзотоксины. Некоторые имеют локальные проявления; другие вызывают выработку цитокина из определенных Т-клеток, что ведет к серьезным системным поражениям (например, поражения кожи, шок, недостаточность органа, смерть). Лейкоцидин Пантона-Валентайна (PVL) является токсином, продуцируемым штаммами, инфицированными определенным бактериофагом. Лейкоцидин Пантон-Валентайна, как правило, присутствует в штаммах бытового метициллин резистентного стафилококка S. aureus (БМРЗС) и считается, что он опосредует способность к формированию некрозов; однако этот эффект не был доказан.
Токсин-опосредованные стафилококковые заболевания включают следующие:
Синдром токсического шока
Стафилококковый синдром ошпаренной кожи
Стафилококковое пищевое отравление
Упомянутые болезни обсуждаются далее в Р у к оводстве .
S. aureus вызываетбактериемию, которая часто приводит к появлению метастатических очагов инфекции, может возникнуть от инфекции S. aureus любой локализации, но особенно часто – от инфекции, связанной с присутствием внутрисосудистых катетеров или других инородных тел. Может также проявляться без какой-либо четко выявленной первичной локализации. S. epidermidis и другие коагулазонегативные стафилококки чаще вызывают внутрибольничную бактериемию, связанную с наличием внутрисосудистых катетеров и других инородных тел, так как они могут образовывать биопленки на этих материалах. Стафилококковая бактериемия является основной причиной заболеваемости (особенно удлинения периода госпитализации) и смертности среди ослабленных пациентов.
Инфекция кожи – наиболее распространенная форма стафилококкового заболевания. Поверхностные инфекции могут быть диффузными, с везикулярными пустулами, покрытыми коркой (импетиго), иногда в виде флегмоны или очаговыми с узловыми абсцессами (фурункулы и карбункулы). Более глубокие кожные абсцессы также широко распространены. Могут встречаться тяжелые некротизирующие инфекции кожи.




Стафилококки обычно являются причиной раневых и ожоговых инфекций, послеоперационных раневых инфекций и мастита или абсцесса груди у кормящих матерей.
Неонатальные инфекции обычно появляются у детей в течение 6 нед после рождения и включают:
Повреждения кожи с шелушением или без него
Пневмония, которая возникает в амбулаторных условиях, не является распространенной, однако может развиваться у пациентов
Пациенты, получающие кортикостероиды или иммуносупрессанты
Имеют хронические бронхолегочные или другие заболевания с высоким уровнем риска
Стафилококковая пневмония может быть первичной инфекцией, а также следствием гематогенного распространения инфекции S. aureus из других частей тела (например инфицирование внутривенного катетера, эндокардит, инфекция мягких тканей) или инъекционной наркомании. Однако S. aureus является частой причиной развития внутрибольничной пневмонии, включая вентиляторную пневмонию при ИВЛ
Стафилококковая пневмония иногда характеризуется формированием абсцессов легких, сопровождаемых быстрым развитием пневматоцеле и эмпиемы. Внебольничный MRSA часто является причиной развития тяжелой некротизирующей пневмонии.
Эндокардит может развиться у инъекционных наркоманов и пациентов с протезами клапанов сердца. Поскольку частота использования внутрисосудистых катетеров и имплантаций сердечных устройств увеличилась, S. aureus стал ведущей причиной бактериального эндокардита.
Эндокардит, вызванный S. aureus, является острым фебрильным заболеванием, которое часто сопровождается формированием висцеральных абсцессов, эмболий, перикардита, подногтевых петехий, кровоизлияний в конъюнктиву глаза, пурпуры, шумов в сердце и сердечной недостаточности, как следствие вторичного повреждения клапанов сердца.
Остеомиелит встречается наиболее часто у детей, вызывая озноб, лихорадку и боль поражённой кости. Впоследствии и мягкие ткани над зоной поражения становятся красными и отечными. Может наблюдаться суставная инфекция, что часто приводит к суставному выпоту, предполагая септический артрит, а не остеомиелит. Большинство инфекций позвонков и межпозвоночных дисков у взрослых связаны с S. aureus.
Стафилококковый синдром токсического шока может быть следствием применения вагинальных тампонов или осложнением любого типа инфекции S. aureus (например послеоперационная раневая инфекция, ожоговые инфекции, инфекции кожи). Хотя большинство случаев связано с метициллин-чувствительным S. aureus (MSSA), случаи, связанные с MRSA, становятся все более частыми.

Стафилококковый синдром ошпаренной кожи вызывается несколькими токсинами, так называемыми эксфолиатинами, и проявляется как детский эксфолиативный дерматит, характеризующийся крупными волдырями и шелушением верхнего слоя кожи. В конечном счёте происходит эксфолиация. Синдром "ошпаренной кожи" наиболее часто встречается у младенцев и детей
Стафилококковое пищевое отравление вызывается употреблением в пищу инфицированных стафилококками продуктов питания (устойчивый к высокой температуре стафилококковый энтеротоксин). Пища может быть заражена стафилококковыми носителями или людьми с выраженными заболеваниями кожи. В пище, недостаточно термически обработанной или оставленной при комнатной температуре, стафилококки активно размножаются и вырабатывают энтеротоксин. Многие продукты могут служить питательной средой, не изменяя при этом своих органолептических свойств (вкус и запах). Тяжелая тошнота и рвота начинаются спустя 2–8 ч после приема пищи, как правило, сопровождаемыми спазмами брюшной полости и диареей. Приступ непродолжительный, часто составляет 12 ч.
Диагностика
Цитобактерископия мазков, окрашенных по Граму, и посев на обогащенные питательные среды
Диагноз стафилококковой инфекции устанавливается после бактериоскопии мазков, окрашенных по Граму, и посевов инфицированного материала на питательные среды.
Необходимо провести тесты на восприимчивость, поскольку метициллин-резистентные микроорганизмы теперь повсеместно распространены и требуют альтернативной терапии.
Если подозревается стафилококковый синдром ошпаренной кожи, то следует провести посевы крови, мочи, носоглотки, отделяемого пупочного кольца, пораженной кожи или любого подозреваемого очага инфекции; интактные волдыри являются асептическими. Хотя диагноз обычно ставится клинически, биопсия зараженной кожи может помочь подтвердить диагноз.
Стафилококковое пищевое отравление обычно предполагают из-за регистрации однотипных случаев инфекции (например, в пределах семьи, среди посетителей массовых социальных учреждений или ресторанов). Подтверждение (как правило, отделом здравоохранения) подразумевает выделение стафилококков в подозрительной пище и иногда анализ на наличие энтеротоксинов.
При остеомиелите рентгенологические изменения могут не проявиться до 10–14 дней болезни, и размягчение кости, и периостальная реакция могут не выявляться и дольше. Отклонения по МРТ, КТ или сканирование радионуклида кости часто становятся очевидными раньше. Биопсия кости (открытая или перкутатная) должна быть проведена для идентификации патогена и анализа антибиотикорезистентности.
В некоторых учреждениях с высокой распространённостью метициллин - резистентных штаммов S. аureus обычно проверяют пациентов на стафилококковое носительство (активное наблюдение), используя лабораторные методы быстрой диагностики, чтобы оценить образцы мазков из носа. Некоторые учреждения проводят скрининг только у пациентов группы риска (например тех, кто поступает в отделение интенсивной терапии, у кого ранее была инфекция MRSA, кому планируются сосудистые, ортопедические оперативные вмешательства или операция на сердце).
Быстрая идентификация MRSA:
позволяет произвести изоляцию контактных носителей и, в случае необходимости предоперационной антибиотикопрофилактики против кожных микроорганизмов, назначить ванкомицин как часть их курса лечения
уменьшает распространение MRSA
может снизить частоту внутрибольничных инфекций MRSA
Однако лечение, направленное на деколонизацию (например, местное применение назального мупироцина), хотя иногда и проводится, но еще окончательно не доказало своей эффективности, так как выявлена резистентность к мупироцину. Ежедневное обмывание с хлоргексидином пациентов отделения интенсивной терапии снижает частоту инфекций, вызванных MRSA.
Лечение
Местные меры (например, санация раны, удаление катетеров)
Антибиотики выбираются с учетом тяжести заболевания и результатов антибиотикограммы
Контроль стафилококковых инфекций включает дренирование абсцесса, санацию некротической ткани, удаление инородных тел (включая внутрисосудистые катетеры) и назначение антибиотиков ( Лечение антибиотиками стафилококковых инфекций у взрослых).
Первоначальный выбор и дозировка антибиотиков зависят от
вероятности того, что задействованы резистентные штаммы
Таким образом, необходимо иметь данные о циркуляции антибиотикорезистентных штаммов в определенном регионе для стартовой терапии (и в конечном счете знать фактическую антибиотикочувствительность выделенного микроорганизма).
Лечение токсин-опосредованного стафилококкового заболевания (самым тяжелым из которых является синдром токсического шока) подразумевает деконтаминацию токсин-продуцирующих областей (ревизия хирургических ран, некрэктомия, промывание), интенсивную терапию (включая внутривенное введение жидкостей, вазопрессоры и респираторную поддержку), коррекцию водно-электролитного баланса и антибактериальные препараты. Доказательства in vitro свидетельствуют о предпочтительном назначении ингибиторов синтеза белка (например, клиндамицин по 900 мг внутривенно каждые 8 ч, линезолид 600 мг внутривенно каждые 12 ч) по сравнению с другими классами антибиотиков. В тяжелых случаях оправдано применение внутривенного иммуноглобулина.
Многие стафилококковые штаммы продуцируют пенициллиназу, фермент, который инактивирует некоторые бета-лактамные антибиотики; эти штаммы являются резистентными к пенициллину G, ампициллину и противопсевдомонадному пенициллину.
Внебольничные штаммы часто чувствительны к пенициллиназа-резистентным пенициллинам (например, метициллину, оксациллину, нафциллину, клоксациллину, диклоксациллину), цефалоспоринам, карбапенемам (например, имипенему, меропенему, эртапенему, дорипенему), тетрациклинам, макролидам, фторхинолонам, триметоприму/сульфаметоксазолу (TMP/SMX), гентамицину, ванкомицину и тейкопланину.
Изоляты MRSAстали повсеместно распространены, особенно в стационарах. Кроме того, внебольничный МRSA появился за последние несколько лет в большинстве географических регионов. Как правило, внебольничные MRSA обладают меньшей резистентностью ко многим антибиотикам, в отличие от внутрибольничных. Эти штаммы, хотя и резистентные к большинству бета-лактамов, обычно чувствительны к TMP/SMX, тетрациклинам (миноциклину, доксициклину) и часто чувствительны к клиндамицину, однако есть возможность развития резистентности к клиндамицину у штаммов с индуцируемой устойчивостью к эритромицину (эти штаммы могут быть выявлены с помощью D-теста). Ванкомицин эффективен против большинства MRSA, иногда в сочетании с рифампином и аминогликозидами при тяжелых инфекциях (таких как остеомиелит, инфекции протезированных суставов, эндокардит протезированного клапана). Назначение альтернативного препарата (даптомицин, линезолид, тедизолид, далбаванцин, оритаванцин, тигециклин, хинупристин/дальфопристин, TMP-SMX, возможно цефтаролин) следует рассматривать при лечении метициллин-резистентных штаммов S. аureus с МИК (минимальная ингибирующая концентрация) ванкомицина > 1,5 мкг/мл.
В США появились штаммы ванкомицин-резистентного S. aureus (VRSA; МИК > 16 мкг/мл) и штаммы S. aureus с умеренной чувствительностью к ванкомицину (VISA, МИК 4–8 мкг/мл). Для терапии инфекций, вызванных этими штаммами стафилококка, требуется назначение линезолида, тедизолида, хинупристина/дальфопристина, даптомицина, TMP/SMX или цефтаролина.
Поскольку распространённость метициллин - резистентных штаммов S. аureus увеличилась, стартовое лечение тяжелых стафилококковых инфекций (особенно тех, которые возникают в стенах учреждений здравоохранения) должно включать препарат с высокой активностью против метициллин-резистентного S. аureus. Таким образом, адекватными лекарственными средствами являются:
Для доказанных или подозреваемых инфекций кровотока– ванкомицин или даптомицин
Для пневмонии – ванкомицин, телаванцин или линезолид (т к даптомицин не проявляет должной активности в легких)
Читайте также:


