Сальмонеллез окраска по граму
ЦЕЛЬ ЗАНЯТИЯ. Изучить возбудителей сальмонеллезов и методы их бактериологической диагностики.
МАТЕРИАЛЬНОЕ ОСНАЩЕНИЕ. Для демонстрации таблица-схема проведения исследования на сальмонеллез, биопрепараты. Питательные среды: МПА, МПБ, Эндо, Плоскирева, Кларка и Симмонса, среда с лактозой, индикаторные среды для определения индола и сероводорода, диагностические агглютинирующие сыворотки для видовой дифференциации сальмонелл.
При подготовке к занятию необходимо уяснить следующие вопросы:
1. Виды сальмонелл, имеющие наибольшее значение в патологии животных.
2. Сальмонеллы, их морфологические и культуральные свойства, их роль в возникновении кишечных заболеваний у молодняка сельскохозяйственных животных.
3. Схема бактериологической диагностики болезней, вызванных сальмонеллами.
1. Классификация возбудителей
Виды сальмонелл, имеющих наибольшее значение в патологии животных:
1. S. enteritidis (dublin) - у телят.
2. S. choleraesuis (suipestifer)- у поросят.
3. S. typhisuis- у свиней.
4. S. typhimurium- у водоплавающей птицы.
5. S. abortus egui- аборт кобыл.
6. S. abortus ovis- у овец.
7. S. pullorum- у птиц.
2. Общая характеристика болезни:
Сальмонеллезы – группа инфекционных болезней преимущественно молодняка с.-х. животных и промысловых животных, характеризующихся при остром течений лихорадкой и профузным поносом, при хроническом – воспалением легких. У взрослых животных болезнь может протекать бессимптомно (сальмонеллоносительство), а у беременных самок возможны аборты. У человека могут возникать пищевые токсикоинфекции при употреблении продуктов, содержащих токсины сальмонелл.
3. Восприимчивые животные:
- все виды животных, особенно молодняк, включая птиц, промысловых животных и человека.
4. Патогенез и факторы вирулентности:
- Основные пути заражения – алиментарный, аэрогенный, возможно внутриутробное и трансовариальное.
- Размножаются в тонком кишечнике и гематогенным и лимфогенным путями разносятся в паренхиматозные органы, где вновь размножаются. При распаде их высвобождаются эндотоксины, которые вызывают патологические процессы.
- Сальмонеллы образуют два вида токсинов: экзо- и эндотоксины.
Методы диагностики (рис. 84)
А. Бактериологический метод:
1. Материал для исследования:
- при жизни – кал, сыворотка крови;
- посмертно – трупы мелких животных и птиц, паренхиматозные органы, мезентеральные лимфатические узлы, абортированный плод.
а) методы окраски: простой метод, по Граму;
б) микрокартина: палочки с закругленными концами до 4 мкм, располагаются одиночно или попарно (рис. 85);
г) спор не образуют;

Рис. 84. Схема лабораторной диагностики сальмонеллезов

Рис. 85. Возбудитель сальмонеллеза (чистая агаровая культура). Увеличение х900
д) капсулу не образуют;
е) подвижны (за исключением S. pullorum).
а) посев на питательные среды: МПА, МПБ, дифференциально-диагностические – Эндо, Левина и др., накопительные.
б) особенности выделения возбудителя
- оптимальная температура 37°С;
- срок культивирования 18-20 ч.
в) культуральные свойства:
все сальмонеллы имеют сходные культуральные признаки, близкие к эшерихиям:
- на МПБ – интенсивное помутнение, образование легко разбивающегося осадка,
- на МПА – сочные, круглые с ровными краями серо-белого цвета колонии,
- на среде Эндо – бесцветные или розоватые колонии, на среде Левина - светло-фиолетовые колонии.
После выделения чистой культуры лактозоотрицательных бактерий устанавливают их родовую принадлежность, затем дифференцируют до вида и сероварианта. С этой целью изучают их биохимические свойства и антигенное строение путем постановки пластинчатой реакции агглютинации (серологическая дифференциация).
г) биохимические свойства:
- обладают высокой сахаролитической активностью;
- сальмонеллы не разжижают желатин, образуют сероводород, не образуют индол;
- дают положительную реакцию с метиловым красным: среда окрашивается в розово-красный цвет, отрицательную реакцию Фогеса-Проскауэра — желтое окрашивание среды.
- в необходимых случаях заражают подкожно белых мышей.
Б. Серологический метод:
- используют РА с сывороткой крови (кровью) при диагностике паратифозного аборта кобыл, поллуроза у кур;
- используют РА для дифференциации выделенной культуры сальмонелл с целью определения их вида и сероварианта;
- у сальмонелл различают соматический термостабильный О-антиген и жгутиковый термолабильный Н-антиген;
- культуру сальмонелл предварительно проверяют с групповыми (поливалентными) сальмонеллезными агглютинирующими О-сыворотками в РА на стекле. На основе общего для нескольких видов сальмонелл О-антигена они подразделяются на серологические группы, обозначаемые заглавными буквами латинского алфавита. При положительном результате с групповой сывороткой проводят испытания той же культуры, выросшей на скошенном МПА с отдельными монорецепторными О-сыворотками, входящими в смесь поливалентной сыворотки. Затем эти же культуры испытывают с монорецепторными Н-сыворотками, 1-й и 2-й фазы, обозначенными цифрами и малыми буквами;
- используют реакцию иммунофлуоресценции (РИФ).
В. Аллергический метод:
4. Биопрепараты для специфической профилактики:
- инактивировшная концентрированная формолвакцина против паратифа телят и поросят;
- живая вакцина против паратифа свиней из штамма ТС-177.
5. Биопрепараты для специфической терапии:
- поливалентная антитоксическая сыворотка против паратифа и колибактериоза в двух вариантах:
а) для телят, ягнят, овец и птиц;
б) для телят, поросят, ягнят, овец и птиц:
- бактериофаг против паратифа и колибактериоза телят
- бактериофаг против пуллороза – тифа птиц.
Задания для самостоятельной работы
1. Изучить культуральные свойства сальмонеллы на обычных и дифференциально-диагностических средах.
2. Приготовить препараты-мазки из суточных культур сальмонелл, окрасить их по Граму и провести микроскопирование.
4. Приготовить препарат-отпечаток из органов белой мыши, павшей от сальмонелл, окрасить по Граму, провести микроскопию.
6. Провести видовую дифференциацию сальмонелл в РА с поливалентными и монорецепторными сыворотками.
Морфологические и культуральные признаки.
Подвижные грамотрицательные палочки, спор не имеют, капсулу не образуют, некоторые виды имеют микрокапсулу.
Растут на простых питательных и желчесодержащих средах, на плотных средах образуют блестящие колонии S- и R-типа, на жидких средах – диффузный рост. На среде Эндо образуют бесцветные колонии. Факультативные анаэробы.

Мазок из чистой культуры S.typhi. Окраска по Граму.
Сальмонеллы обладают О-, Н-, и некоторые К-антигенами. Разновидностью К-антигена у S. typhi, S. paratyphi A, S. paratyphi В является Vi-антиген. Согласно классификации Кауфмана-Уайта все сальмонеллы на основании О-антигена разделены на серогруппы, внутри серогорупп по Н-антигену – на серовары. Серогруппы обозначаются латинскими буквами: А, В, С и т.д, Внутри серогруппы серовары расположены в алфавитном порядке на основании видоспецифичкской фазы Н-антигена (Н-антиген состоит из 2-х фаз: первая – видоспецифичная, обозначается строчными буквами латинского алфавита, вторая – неспецифическая – обозначается цифрами).
По биохимическим свойствам род однороден. Дифференциально-диагностические признаки рода:
- ферментация глюкозы до кислоты и газа (за исключением Salmonella typhi),
- отсутствие ферментации лактозы,
Salmonella typhi – возбудитель брюшного тифа. Внутри вида выделяют фаговары A,B,C.
Salmonella paratyphi A – возбудитель паратифа А,
Salmonella paratyphi B – возбудитель паратифа В,
Salmonella typhimurium, Salmonella enteritidis, Salmonella cholirasuis – возбудители сальмонеллезов.
Патогенез брюшного тифа и паратифов.
Брюшной тиф - антропонозная инфекция, характеризующаяся язвенным поражением лимфатического аппарата тонкой кишки, бактериемией, интоксикацией, розеолезной сыпью, увеличением печени и селезенки.
Паратиф А и паратиф В – заболевания схожие с брюшным тифом по патогенезу, клиническим проявлениям и эпидемиологии.
Источник инфекции – больной или бактерионоситель, которые выделяют микроб с фекалиями, мочой, слюной. Особенно опасен носитель!
Основной механизм заражения - фекально-оральный. Основные пути передачи - водный, пищевой, редко - контактный.
Инфицирующая доза – 1000 клеток.
Входные ворота инфекции: слизистая оболочка тонкой кишки,
Факторы вирулентности: эндотоксин, каталаза, супероксиддисмутаза, белки наружной мембраны, микрокапсула.
После адгезии сальмонелл происходит частичная колонизация ими слизистой оболочки тонкой кишки и проникновение микробов в пейеровы бляшки – где формируется первичный очаг (микробы поглощаются макрофагами и размножаются в них). Затем сальмонеллы проникают в лимфоузлы, вызывая лимфаденит, и дальше – в лимфу, затем в кровь, вызывая бактериемию. С кровью сальмонеллы проникают в печень, легкие, костный мозг и селезенку, колонизируют их, заселяют желчный пузырь. С желчью сальмонеллы проникают в двенадцатиперстную кишку и вторично в тонкую кишку и пейеровы бляшки – развивается иммунное воспаление, в результате которого может развиться кишечное кровотечение, прободение стенки кишки и перитонит.
Основной метод диагностики – бактериологический.
- на первой неделе – кровь (метод выделения гемокультуры)
- со второй недели: моча (уринокультура), фекалии (копрокультура) желчь (биликультура).
Метод выделения гемокультуры: материал – кровь из вены – засевают на желчный бульон (элективная среда для патогенных сальмонелл) в соотношении 1:10. S. typhi, S. paratyphi A, S. paratyphi В на желчном бульоне дают диффузное помутнение. Выделяют чистую культуру и идентифицируют по биохимическим признакам, в реакции агглютинации на стекле. Для внутривидовой идентификации применяют фаготипирование.
Для обнаружения антигена возбудителя в биологических жидкостях применяют реакцию иммунофлюоресценции (РИФ).
- на первой неделе – кровь (метод выделения гемокультуры)
- со второй недели: моча (уринокультура), фекалии (копрокультура) желчь (биликультура).
Готовят мазки из материала на стекле и обрабатывают флюоресцирующими сыворотками, препараты изучают под люминесцентным микроскопом. В положительном случае обнаруживают свечение.
Серологический метод обнаружения O- и H- антител в реакции непрямой гемагглютинации (РНГА), реакции агглютинации (РА) Видаля, реакции Vi-гемагглютинации.
Материал: сыворотка крови.
РНГА: в пробирках готовят разведения сыворотки крови, добавляют эритроцитарный брюшнотифозный О- или Н-диагностикум.
РА Видаля: берут 4 ряда пробирок и в каждом готовят разведения сыворотки больного. В пробирки первого ряда добавляют брюшнотифозный О-диагностикум, второго ряда – брюшнотифозный Н-диагностикум, третьего ряда – паратифозный А диагностикум и четвекртого – паратифозный В диагностикум. Диагностический титр в РА Видаля 1:200.
Реавкция непрямой Vi-гемагглютинации применяется при обследовании реконвалесцентов и выявлении бактерионосителей. Готовят разведения сыворотки больного от 1:10 до 1:1280 добавляют эритроцитарный Vi-диагностикум (взвесь эритроцитов человека, обработанных формалином и нагруженных Vi-антигеном . S. Typhi. Диагностический титр 1:40
Бактерионосителей выявляют по обнаружению Vi-антител в сыворотке крови с помощью РНГА и положительному результату бактериологического выделения возбудителя.
Лечение. Для лечения используют хлорамфеникол и другие антибиотики, действующие на грамотрицательные бактерии.
Специфическая профилактика. Существует брюшнотифозная химическая и брюшнотифозная спиртовая вакцина, обогащенная Vi-антигеном. Вакцинация проводится по эпидпоказаниям. Для экстренной профилактики брюшного тифа возможно использование брюшнотифозного бактериофага.
Сальмонелла в продуктах животного происхождения является предметом пристального внимания на протяжении многих лет. Эта инфекция вызывает диарею, лихорадку, а в случае если человек ослаблен или стар – даже смерть. Каждый год огромное число людей страдает от сальмонеллеза, что приносит убытки в миллионы рублей.
Сальмонеллы представляют собой один из 12 родов большого семейства бактерии Enterobacteriaceae. К настоящему времени по серологической типизации систематизировано более 2000 серотипов сальмонелл [1, с. 126].
Вместе с большой общностью морфологических и культуральных характеристик сальмонелла отличается друг от друга по биохимическим и антигенным свойствам. Эти различия и положены в типизации [1, с. 128].
Обсеменение мяса сальмонеллами может происходить двумя путями: прижизненно и после убоя. Прижизненно сальмонеллы проникают в мышцы у клинически больных животных. Послеубойное обсеменение мяса сальмонеллами происходит при обработке туш больных и здоровых животных одними и теми же не продезинфицированными инструментами, при неправильной разделке туш [2, с. 155]. Инфицирование мяса сальмонеллами может произойти при перевозке на одном и том же транспорте туш или внутренних органов больных и здоровых животных. Обсеменить сальмонеллами мясо и мясопродукты может также и человек (больной или бактерионоситель) [4, с.98].
Мясо и особенно субпродукты являются хорошей средой для размножения и накопления в нем сальмонелл. Характерно, что при развитии сальмонелл в мясе или других продуктах органолептические показатели его обычно не изменяются [2, с 148].
Люди заражаются сальмонеллезом при употреблении продуктов питания, обсемененных сальмонеллами в процессе их получения, переработки, транспортировки и реализации прошедших недостаточную кулинарную обработку или хранившихся с нарушением установленных режимов. Возможно заражение через предметы бытовой и производственной обстановки, а также через воду [3, с. 129].
А так как, у крупного рогатого скота сальмонеллез вызывают Salmonella dublin, реже — S. typhimurium, у свиней — S. choleraesuis, S. typhisuis, реже — S. typhimurium, у овец — S. abortus ovis, у лошадей — S. abortusn equi, у птиц — S. gallinarum-pullorum, S. typhimurium реже — S. enteritidis, мы можем предположить первоначальную проблему инфицирования продуктов питания сальмонеллами [1, с. 127].
Актуальность данной работы состоит в том, что морфологические, культуральные, биохимические свойства и главным образом серотипирование имеют основное значение при идентификации сальмонелл, для выявления источника пищевых токсикотнфекции.
Целью нашей работы явился анализ литературных данных по изучению проблем возникновения сальмонеллеза, идентификация бактерий рода Salmonella, выделенных из пищевых продуктов животного происхождения, по биологическим свойствам.
Материалы и методы.
В работе были использованы 12 изолятов бактерий рода Salmonella, выделенные из продуктов животного происхождения.
Для определения морфологии используемых в работе бактерий применяли набор для окраски по Граму.
Для изучение культуральных свойств проводили посевы на следующие питательные среды: мясопептонный агар (МПА), мясопептонный бульон (МПБ), ксилозо-лизин-деоксихолатный агар (XLD); висмут-сульфит агар (ВСА), среду Эндо, скошенный агар. Чашки с посевами инкубировали при 370С в течение 20 часов. Подвижность микроорганизмов определяли при посеве уколом в полужидкий агар (ПЖА) через 24 часа при температуре 370С.
Биохимические свойства определяли в соответствии с наставлениями по применению систем индикаторных бумажных для идентификации микроорганизмов (СИБ), путем высева на среды Гисса и на бактериологическом анализаторе Vitek2 Compact с использованием идентификационных карт GN (для идентификации грамотрицательных микроорганизмов, не требовательных к составу среды).
Определение принадлежности к серотипам выявляли в РА на стекле с наборами сальмонеллезных поливалентных ABCDE и монорецепторных О- и Н-агглютинирующих сывороток. При агглютинации с О-сыворотками следует брать верхнюю часть выросшей культуры на скошенном агаре, а для агглютинации с Н-сыворотками – из конденсата или из самой нижней части (наиболее подвижные особи).
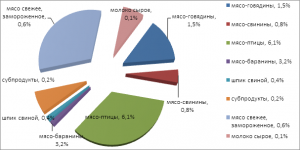
Рисунок 1. Диаграмма выделения сальмонелл из продуктов питания за исследуемый период
Как представлено на рисунке 1, наибольшее количество сальмонелл, 20 изолятов, было выделено из мяса – птицы (27,4%).
При использовании микробиологического метода, производили посев исследуемого материала на несколько питательных сред, чтобы обеспечить возможность роста максимально большему числу возможных возбудителей. Засеянные среды инкубировали в термостате в течение 20 часов при температуре 370С, после чего делали мазки и окрашивали по Граму. И в соответствии с данными бактериоскопии делали высевы на дифференциально-диагностические среды и проводили идентификацию выделенных бактерий.
а б
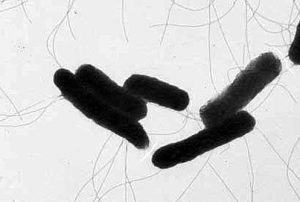
Рисунок 2. Морфология клеток сальмонелл: а – с МПБ, б – с МПА (электронная микроскопия, увеличение х25000)
Хорошо растут при температуре 370С. На МПА образуют гладкие, круглые, полупрозрачные, выпуклые, влажные колонии. На МПБ вызывают равномерное помутнение среды, на скошенном агаре растут обильно, образуя в конденсационной воде сильную муть. На XLD – черные, блестящие колонии. На ВСА – небольшие черные колонии с металлическим блеском, на Эндо – прозрачные, бесцветные, гладкие колонии (рисунок 3).
Рисунок 3. Рост бактерий рода Salmonella, на твердых питательных средах: а — XLD-arap, б – ВСА
По биохимическим свойствам все изоляты ферментировали глюкозу с образование газа, не обладали уреазной активностью, не образовывали индол и не ферментировали сахарозу и лактозу.
Ферментировали орнитиндекарбоксилазу, β-галактозидазау, маннит. Изоляты 10, 11 и 12 не утилизировали цитрат Симмонса. Арабинозу, сорбит и лизиндекарбоксилазу ферментировали более 25 % изолятов, что подтверждается литературными данными и данными Берджи (таблица 1).
Таблица 1
Биохимические свойства изолятов
| Наименование теста | Результаты постановки реакции | ||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | По данным Берджи | |
| Цитрат Симмонса | + | + | + | + | + | + | + | + | + | — | — | — | +,- |
| Мочевина (уреаза) | — | — | — | — | — | — | — | — | — | — | — | — | — |
| Сероводород | — | + | — | + | — | — | + | + | + | + | + | + | +, — |
| Подвижность | — | — | — | — | — | — | + | + | + | — | — | — | +,- |
| Индол | — | — | — | — | — | — | — | — | — | — | — | — | — |
| Глюкоза | + | + | + | + | + | + | + | + | + | + | + | + | + |
| Арабиноза | + | + | + | — | + | + | + | + | — | + | + | + | +, (+) |
| Лактоза | — | — | — | — | — | — | — | — | — | — | — | — | — |
| Маннит | + | + | + | + | + | + | + | + | + | + | + | + | + |
| Сорбит | — | + | — | + | — | — | + | + | + | + | + | — | +,- |
| Сахароза | — | — | — | — | — | — | — | — | — | — | — | — | — |
| Лизин | + | + | + | + | + | + | — | — | + | + | + | + | +,- |
| Орнитин | + | + | + | + | + | + | + | + | + | + | + | + | + |
| β-галактозидаза | + | + | + | + | + | + | + | + | + | + | + | + | + |
Представленные биохимические признаки были подтверждены на биохимическом анализаторе Vitek 2 Compact.
При исследовании с поливалентной сальмонеллезной сывороткой все изоляты показали положительную агглютинацию: капля сыворотки просветлилась и в ней образовались отчетливые белые глыбки.
Анализируя данные литературы, мы выяснили, что изоляты S. choleraesuis (свинина), S. enteritidis (свинина и птица), S. typhimurium (говядина, свинина), S. westhampton и S. dublin (молоко) выделены из продуктов питания, которые произведены из инфицированного сальмонеллами сырья.
По классификации Кауфмана-Уайта при анализе антигенной структуре 5 изолятов отнесены к группе О:4 (В), 2 изолята – О:7 (С1), 4 изолята к О:9 (Д1) и 1 – О:3,10 (Е1).
Заключение. Изучены морфологические, ростовые и биохимические свойства бактерий рода Salmonellla. При серотипировании 2 изолята отнесены к подвиду S. choleraesuis, 3 изолята – S. enteritidis, 3 — S. typhimurium, 1 — S. kisangani, 1 — S. westhampton, 1 — S. saintpaul и 1 изолят принадлежал к подвиду S. dublin. Продукты питания были произведены из инфицированного сальмонеллами сырья.
Презентация была опубликована 7 месяцев назад пользователемАлина Хупченко
Презентация на тему: " Сальмонеллы. Классификация Согласно современной таксономии род Salmonella включает в себя всего 2 вида: Salmonella bongori (бактерии, которые не представляют." — Транскрипт:
2 Классификация Согласно современной таксономии род Salmonella включает в себя всего 2 вида: Salmonella bongori (бактерии, которые не представляют опасности для человека) Salmonella enterica (патогенные для человека микроорганизмы) Частой причиной кишечных инфекций выступает сальмонелла подвида Salmonella enterika. Она является возбудителем таких патологий, как: брюшной тиф (Salmonella typhi); паратифы А, В, С (Salmonella paratyphi); сальмонеллёз (Salmonella typhimurium, newport, agona и др.
3 Морфология Клетки сальмонеллы – это подвижные (пили и джгутики) прямые палочки (0,5–1 х 1–3 мкм) с закругленными концами. Не образуют спор и капсул. Грамотрицательные, хорошо окрашиваются анилиновыми красителями. Культура Salmonella enterica, окраска по Граму.
4 Морфология S. Typhimurium S. Enteretidis
5 Культуральные свойства Факультативные аэробы. Неприхотливы, растут при температуре 2040°С и рН от 5,0 до 8,0 при оптимуме 37°С и рН 7,27,4. Хорошо растут на простых питательных средах. На жидких средах (МПБ) дают равномерное помутнение. На мясо-пептонном агаре (МПА) колонии более мелкие, чем у кишечных палочек, нежные, полупрозрачные, выпуклые, блестящие.
6 Культуральные свойства На дифференциально- диагностических средах Эндо, ЭМС, Плоскирева сальмонеллы растут в виде бесцветных колоний, так как не расщепляют лактозу, входящую в состав среды. На висмут-сульфитном агаре через 48 ч они образуют колонии черного цвета, оставляющие след после того, как их снимают петлей (кроме сальмонелл паратифа А). Колонии сальмонелл на висмут- сульфитном агаре
7 Биохимическая активность 1) ферментация глюкозы, маннита, мальтозы до кислоты и газа. Исключение: подвид S.typhi выделяет только кислоту 2) НЕТ ферментации лактозы и сахарозы 3) Реагируют с белковыми средами, продуцируют сероводород, индол. 4) Желатин не разжижают. Согласно серологической классификации подавляющее большинство патогенных для человека сероваров (серотипов) сальмонелл относится к A, B, C, D и E группам. Сальмонеллы типируют по схеме Кауффмана- Уайта в реакции агглютинации. Для ее постановки применяют гипериммунные сыворотки или моноклональные антитела к сальмонеллам. На серотипировании основаны диагностика сальмонеллеза и эпидемиологический анализ возбудителей.
8 Антигенная структура Сальмонеллы содержат два основных антигенных комплекса: О-соматический и Н-жгутиковый. О-антиген липополисахарид но-протеиновый комплекс, термостабилен, инактивируется под действием формалина, соответствует эндотоксину бактериальной клетки. Н-антиген белковой природы, термолабилен, легко разрушается спиртом и фенолом. Устойчив к действию формалина. На этом свойстве основано получение Н-диагностикумов. О- и Н-антигены у различных представителей сальмонелл неоднородны, что было положено в основу классификации этих бактерий.
10 Реакция агглютинации 12
11 Факторы патогенности У сальмонелл имеются эндотоксин, а также S. typhimurium и некоторые другие серотипы, могут синтезировать два типа экзотоксинов: 1. термолабильные и термостабильные энтеротоксины типа LT и ST; 2. шигаподобные цитотоксины. Токсин LT сальмонелл имеет структурное и функциональное сходство с LT энтеротоксигенных Е. coli и с холерогеном. Цитотоксин, продуцируемый сальмонеллами, термолабилен, его цитотоксическое действие проявляется в угнетении синтеза белка энтероцитами. Обнаружено, что отдельные штаммы сальмонелл могут одновременно синтезировать LT, ST и цитотоксин, другие - только цитотоксин.
12 Эпидемиология Источник инфекции – больные животные, птицы, человек, бактерионосители. Путь передачи – пищевой, водный, контактный, редко воздушно- капельный. Иммунитет постинфекционный. Входные ворота инфекции – преимущественно слизистая оболочка тонкого кишечника, в котором сальмонеллы способны к внутриклеточному паразитированию в макрофагах и ретикулоцитах. Инкубационный период от нескольких часов до 3 суток (чаще ч).
13 Патогенез и клиника Гастроинтестинальная форма (острый гастрит, острый гастроэнтерит или гастроэнтероколит) – начинается остро, повышается температура тела (при тяжелых формах до 39°С и выше), появляются общая слабость, головная боль, озноб, тошнота, рвота, боли в эпигастральной и пупочной областях, позднее присоединяется расстройство стула. У некоторых больных вначале отмечаются лишь лихорадка и признаки общей интоксикации, а изменения со стороны желудочно-кишечного тракта присоединяются несколько позднее. Наиболее выражены они к концу первых и на вторые и третьи сутки от начала заболевания. Выраженность и длительность проявлений болезни зависят от тяжести.
14 Микробиологическая диагностика Бактериологический метод. Культуры сальмонелл удается выделить из испражнений больных, рвотных масс и промывных вод желудка, реже из крови, мочи и желчи. У бактерионосителей сальмонеллы можно обнаружить в кале, моче, желчи. Бактериоскопический метод: окраска по Граму Серодиагностика Определение резистентности к антибиотикам
15 Профилактика Профилактика сальмонеллеза сложна. Наиболее важной мерой предупреждения распространения сальмонеллеза является организация ветеринарно- санитарного надзора на бойнях, мясо- и птицекомбинатах, а также бактериологический контроль мясной продукции, поступающей в нашу страну из-за рубежа. Важна санитарно-просветительная работа. Также нельзя забывать о соблюдении личной гигиены, тщательно выбирать и обрабатывать продукты для приготовления пищи. Восприимчивы к сальмонеллезу все возрастные группы, но особенно дети до 1 года, у которых болезнь протекает с самой высокой летальностью.
Читайте также:


