Деструктивная пневмония стафилококковой этиологии у детей
В статье говорится о легочной деструкции у детей и взрослых, рассматриваются причины патологии, описываются симптомы и методы лечения.
Деструктивная пневмония — это тяжелый вариант заболевания, который характеризуется изменением ткани легких. Данная патология составляет 10% от всех случаев воспаления легких.
Понятие о патологии
Такое заболевание, как пневмония деструктивная МКБ10 классифицируется кодом 7189. В большинстве случаев эта патология имеет инфекционную этиологию.
Заболевание может быть вызвано разными возбудителями:
вирусы гриппа и парагриппа;
Очень часто заболевание возникает, как осложнение респираторных инфекций. Предрасполагающими факторами являются:
недоношенность или родовые травмы у детей;
неграмотное лечение обычной пневмонии.
Часто у людей развивается пневмония после длительного переохлаждения. Специалисты считают, что очень важен хороший иммунитет. У детей он находится на стадии становления, поэтому пневмония регистрируется у них чаще, чем у взрослых.
Возбудитель заболевания, попадая в ослабленный организм, начинает быстро развиваться. В процессе их развития в легких образуются полости, заполненные воздухом или гноем. Нахождение очагов деструкции возле плевры приводит к развитию плеврита или пневмоторакса. Если гнойники возникают рядом с крупными кровеносными сосудами, есть риск развития сепсиса.
Деструктивные пневмониты — это осложнение течения обычной пневмонии у детей и взрослых. Часто страдают молодые мужчины.
Выделяют два вида патологии, в зависимости от способа заражения:
- Первичная — бронхогенная форма. Заражаются этой формой воздушно-капельным путем. Поражается одна доля легкого.
- Вторичная — гематогенная форма. Заражение происходит через инфицированную кровь. Характеризуется обширным поражением легочных тканей.
У этих форм имеются общие симптомы, но гематогенная пневмония протекает более остро и встречается реже.
У детей эта форма пневмонии проявляется тяжелыми симптомами из-за осложнений. Может начать формироваться парез кишечника, генерализированное поражение легочной ткани, сепсис. Деструктивная пневмония у взрослых и у детей проявляется в зависимости от формы патологии.
Симптомы первичной деструктивной пневмонии
Проявления первичной деструкции появляются на 2-3 день после проникновения возбудителя болезни и характеризуются:
повышением температуры до 38-39 градусов, которое сопровождается ознобом, лихорадкой, ломотой в суставах;
сухим, а затем влажным кашлем с гнойной мокротой;
У больного снижается работоспособность, появляется слабость, бессоница.
Симптомы вторичной деструктивной пневмонии
Вторичная деструкция проявляется еще более тяжелыми симптомами, так как возникает на фоне других инфекций:
повышение температуры до 40 градусов сопровождается рвотой;
синюшность носогубного треугольника при общей бледности кожных покровов;
сильный кашель с выделением зловонной мокроты;
суставные боли резко выражены.
У заболевшего присутствует сердечно-сосудистая недостаточность, отмечается неприятный, запах изо рта, боль при дыхании и разговоре.
Для того, чтобы выявить патологию и определить локализацию очага воспаления, врач проводит ряд исследований:
- Опрос и осмотр пациента. Специалист выслушивает жалобы, выявляет внешние признаки заболевания — бледность, цианоз, вялость, кашель, одышку. Прослушивает пациента и измеряет температуру.
- Рентген (фото). При первичной форме заболевания рентгенография показывает локализацию очагов воспаления. При вторичной форме обнаруживается множество полостей, заполненных воздухом или гноем.
- Компьютерная томография. КТ — наиболее информативный метод диагностики, позволяющий детально изучить легочные ткани, выявить локализацию очагов и степень поражения легкого. Но цена этой процедуры достаточно высока.
- Исследование мокроты. Определяется характер возбудителя.
- Анализ крови. Во всех формах деструктивной пневмонии анализ крови выявляет снижение гемоглобина, уменьшение числа лейкоцитов, высокую СОЭ.
Лечение назначается после установления окончательного диагноза.
Лечение деструктивной пневмонии проводится только в стационаре. Оно может быть консервативным и хирургическим. В любом случае назначается медикаментозная терапия и вспомогательное лечение с помощью физиопроцедур, ЛФК, диеты.
Схема лечения двух форм деструктивной пневмонии несколько различается.
Таблица №1. Лечение первичной и вторичной деструктивной пневмонии:
Форма пневмонииЛечениеПервичная деструкция
Назначают следующие препараты:
препараты, устраняющие общую интоксикацию;
препараты, способствующие нормализации кишечной микрофлоры.
препараты, устраняющие возбудителя болезни;
лекарства, восстанавливающие сердечную деятельность;
Для устранения аллергических реакций на токсины, выделяемые микроорганизмами, назначают антигистаминные средства. Также пациенту прописывают прием иммуностимуляторы и витаминные комплексы.
При необходимости лекарства можно приобрести в аптеке, цена на них является достаточно приемлемой. В каждой упаковке имеется инструкция.
В случае серьезных осложнений требуется оперативное вмешательство. Это может быть как пункция и дренаж, так и операция по удалению очага воспаления.
Пункция проводится специальной иглой, затем выполняется дренирование по Мональди и Сельдингеру. После удаления гноя выполняют промывание пораженной области антисептическими растворами. Подробнее о проведении операции расскажет специалист в видео в этой статье.
Лечение пневмонии включает в себя как медикаментозное воздействие, так и ЛФК и физиопроцедуры.
Таблица №2 Дополнительные методы лечения пневмонии:
МетодыЦели и воздействие на организм
Физические упражнения активизируют кровообращение, нормализуют вентиляцию легких,ускоряют рассасывание очага воспаления, улучшают отхождение мокроты, укрепляют дыхательную мускулатуру.
Применять лечебную физкультуру начинают на третий день после нормализации температуры
Применение физиопроцедур направлено на устранение отрицательных последствий заболевания и предупреждение развития осложнений. Правильно подобранные процедуры помогают отхождению мокроты, препятствуют образованию рубцов, улучшают кровообращение, снимают воспаление, оказывают местное лечение.
Физиотерапия назначается после устранения острых проявлений болезни и нормализацими температуры. Используют следующие методы:
Физиопроцедуры практически не имеют противопоказаний, а их разнообразие позволяет подобрать пациенту индивидуальный курс.
Деструктивная пневмония опасна своими осложнениями. Но при своевременном обращению к врачу и выполнении всех рекомендаций, организм полностью восстанавливается. Однако необходимо в течении полугода проходить профилактический осмотр.
Острые гнойные деструктивные пневмонии (ОГДП) – тяжелая гнойно-септическая патология, имеющая полиэтиологическую природу. По данным литературы, различные формы ОГДП составляют до 10-15 % от общего количества пневмоний у детей [3, 4, 9]. Легочно-плевральные формы ОГДП составляют, по данным разных авторов, до 70 % деструктивных пневмоний у детей [1, 2, 4, 5].
Возникновение плевритов, особенно у детей раннего возраста, обусловлено анатомо-физиологическими и топографическими особенностями плевры: малой подвижностью листков, широкими синусами, обильной васкуляризацией, густой сетью лимфатических сосудов, тесной связью лимфатических сосудов с лимфоузлами корня легких, средостения и органов брюшной полости [7, 8].
Диагностика плевральных осложнений не вызывает затруднений, но тактика ведения таких пациентов до сих пор обсуждается. Ранее основными хирургическими методами лечения легочно-плевральных форм деструктивных пневмоний являлись пункция и дренирование плевральной полости. В последние годы наблюдается изменение лечебной тактики с широким внедрением видеоторакоскопических санаций плевральной полости, определяются показания к их применению и анализируется накапливаемый опыт [6, 8, 9].
Поэтому ранняя диагностика, выбор рациональных методов лечения детей с пиофибринотораксом и фибринотораксом остаются актуальными проблемами детской хирургии.
Цель работы – анализ результатов лечения детей с легочно-плевральными формами ОГДП, находившихся на стационарном лечении в детском гнойном хирургическом отделении ГБУЗ СОКБ им. В.Д. Середавина г. Самары.
Материалы и методы исследования
Изучены результаты лечения 138 детей с легочно-плевральными формами ОГДП за 3 года (с 2012 по 2014 годы). Возраст пациентов – 0-14 лет включительно. Абсолютное большинство составляли дети в возрасте до 3 лет (42,4 % от общего числа больных).
Обследование больных с ОГДП было комплексным и включало: клинический осмотр, рентгенологический метод (обзорная рентгенография легких, компьютерная томография по показаниям), ультразвуковое исследование плевральных полостей, лабораторную диагностику (общий анализ крови, общий анализ мочи, биохимический анализ крови). Показанием к проведению компьютерной томографии легких являлась недостаточность имеющихся рентгенологических и ультразвуковых данных для оценки патологического очага в легких и плевральных полостях. С целью выделения микробного возбудителя заболевания бактериологическому исследованию подлежат: кровь, содержимое плевральной полости, отделяемое из трахео-бронхиального дерева. В работе использована классификация В.М. Сергеева с соавторами (1981) с единственным дополнением: экссудативный плеврит при наличии легочной формы деструкции.
Лечение детей с деструктивными пневмониями было комплексным и включало интенсивную терапию с адекватной санацией гнойного очага, рациональную антибактериальную терапию (эмпирическую, при внебольничных тяжелых пневмониях – деэскалационную). Местное лечение больных с легочно-плевральными формами деструктивной пневмонии в зависимости от патологического процесса включало плевральные пункции (однократные или повторные) и дренирование плевральной полости с активной или пассивной аспирацией содержимого. Показанием к дренированию плевральной полости является гнойный или фибринозно-гнойный характер экссудата, наличие в плевральной полости густого гноя или газа. 17 детям с пиофибринотораксом выполнена торакоскопия.
Физиотерапевтическое лечение назначали детям с фибринотораксом при стабилизации состояния, условии нормализации температуры тела (магнитотерапия, электро- или фонофорез с препаратами коллагеназы).
Результаты исследования и их обсуждение
По рентгенологическим формам отмечено следующее распределение больных с легочно-плевральными формами: пневмоторакс – у 1, пиоторакс – у 38, пиопневмоторакс – у 7, фибриноторакс – у 12, пиофибриноторакс – у 18, плеврит – у 62 (рис. 1).
Сроки поступления детей в хирургический стационар значительно колебались: до 5 суток были госпитализированы 40 (29 %) из наблюдавшихся детей, от 6 до 10 суток – 61 человек (44 %), от 10 до 20 дней – 29 (21 %) и позже 21 дня – 8 (6 %) больных.
С целью выявления этиологического агента очага воспаления исследовали как стерильный в норме (плевральная жидкость), так и контаминированный материал (мокрота, промывные воды бронхов). Следует отметить, что при посеве пунктата и бронхиального лаважа в 42,4 % наблюдений роста микроорганизмов на питательных средах не было получено. А среди верифицированных возбудителей в группе грамположительных преобладал Staphylococcus (33,3 %), грамотрицательных – Acinetobacter (7,2 %) и Klebsiella (6,8 %). Дрожжеподпбные грибы высевались в 12 % наблюдений. Необходимо отметить полиэтиологичность деструктивной пневмонии у детей и возрастающее преимущество грамотрицательной флоры. В процессе анализа результатов бактериологического исследования выявлена связь между сроком от начала заболевания, временем поступления пациентов в специализированное отделение и предшествующей антибактериальной терапии: при поступлении детей в ранние сроки из дома чаще диагностировалась грам- положительная флора; при поступлении в более поздние сроки из других ЛПУ преобладала грамотрицательная флора.
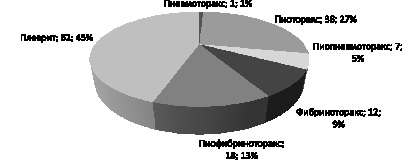
Рис. 1. Распределение больных по клинико-рентгенологическим формам заболевания
Тактику лечения определяли по результатам инструментальных методов исследования.
При фибринозно-гнойном характере выпота на рентгенограммах определялось негомогенное, с участками просветления, затемнение, тень средостения при этом занимала физиологическое положение или смещалась незначительно. Рисунок легочной ткани прослеживался только на верхушке легкого, тень купола диафрагмы и сердца была нечеткой или не дифференцировалась вовсе (рис. 2).
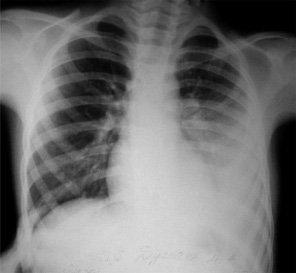
Рис. 2. Больной Д.М., 5 лет, фибринозно-гнойный выпот слева
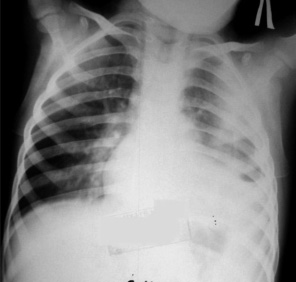
Рис. 3. Больной Б.А., 2,5 года, фибриноторакс слева
При фибринотораксе определяется уменьшение размеров пораженного гемиторакса, сужение межреберных промежутков, неоднородное затемнение, фибринозные наложения в синусе, ячеистый рисунок за счет воздуха и фибриновых шварт в плевральной полости (рис. 3). Купол диафрагмы четко не прослеживался либо был грубо деформирован плевральными спайками.
При выполнении компьютерной томографии у пациентов с фибринозно-гнойным выпотом выявлялось уменьшение в объеме пораженного гемиторакса, скопление в плевральной полости жидкости плотностью от 25 до 50 HU и коллабированные этой жидкостью участки легочной ткани с пневмонической инфильтрацией, сужеными и деформированными просветами сегментарных бронхов.
Пункционный метод лечения применен у 67 детей (48,6 %) с плевритом и пиотораксом. Дренирование плевральной полости выполнено 39 пациентам (28,3 %) с пиотораксом, пневмотораксом и пиопневмотораксом. Торакоскопическая санация плевральной полости выполнена 17 детям (12,3 %) с фибринозно-гнойным характером экссудата, у 15 из них достигнуты хорошие и удовлетворительные результаты лечения, 2 детей выписаны с фибринотораксом, осложнений не наблюдалось.
Больным с фибринотораксом (12 человек, 9 %) и легочно-плевральными спайками, сформировавшимися в подостром периоде после примененных хирургических методов лечения (47 человек, 34,1 %), применялся электрофорез или фонофорез с препаратами коллагеназы на очаг поражения после предварительной магнитотерапии, повторные курсы проводились амбулаторно после выписки пациентов. Результатом применения нового способа лечения фибриноторакса у детей с легочно-плевральными формами ОГДП стало сокращение сроков рассасывания фибринозных наложений в плевральной полости на 2,2 месяца. При оценке ближайших результатов лечения выявлено, что клинически значимый эффект (выздоровление) при применении данного способа достигнут уже через 6 месяцев у 80,7 % наблюдаемых нами детей. В ближайшем и отдаленном периоде формирования хронических форм плевральных нагноений не выявлено.
Исходы: выписано с хорошими результатами 77 детей (55,8 %), с удовлетворительными – 34 (24,3 %); образование остаточных полостей в плевре отмечено у 11 (7,8 %), фибриноторакса – у 15 (10,9 %). Летальных исходов – 2 (1,2 %), оба ребенка с тяжелой соматической патологией.
После лечения в специализированном отделении большинство больных направлялось на лечение в местный санаторий пульмонологического профиля. В дальнейшем дети, перенесшие ОГДП, находились на диспансерном наблюдении в поликлиниках по месту жительства, регулярно осматривались в нашем детском хирургическом отделении.
Проблема лечения легочно-плевральных форм острых гнойных деструктивных пневмоний у детей остается до сих пор актуальной, а наиболее часто деструкция легочной ткани при пневмонии развивается у пациентов младшего возраста.
Основными в диагностике легочно-плевральных форм ОГДП в настоящее время являются лучевые методы. По нашим данным рентгенография грудной клетки являлась достаточно информативным и наиболее доступным методом диагностики легочно-плевральных форм острых гнойных деструктивных пневмоний у детей. К недостаткам этого метода визуализации следует отнести также невозможность оценки состояния легочной ткани при наличии большого количества плеврального содержимого. Эти диагностические вопросы помогает решить другой рентгенологический метод исследования – компьютерная томография.
Отечественными и зарубежными исследователями накоплен большой опыт по использованию ультразвукового сканирования для диагностики количества, характера плеврального содержимого. Наша работа также подтверждает высокую информационную ценность этого метода.
Видеоторакоскопия является эффективным методом санации плевральных полостей при пиофибринотораксе у детей с острой гнойной деструктивной пневмонией.
Наличие у ребенка фибриноторакса в подостром периоде течения гнойной деструктивной пневмонии, при условии нормальной температуры тела, является показанием к проведению фибринолитической физиотерапии, что сокращает сроки рассасывания фибринозных наложений в плевральной полости на 2,2 месяца.
УДК: 616.2-008.64-085.816:616.24-002-091-08]-053.2
Год издания: 2016
Респираторное обеспечение дыхательной недостаточности при лечении деструктивных пневмоний у детей
Внебольничная пневмония - частая причина госпитализации в детском возрасте. Согласно данным мировой статистики не менее 50% пневмоний в детском возрасте сопровождаются различной степенью деструкции легочной ткани. В то же время развитие различной степени дыхательной недостаточности имеет место чаще, не менее чем в 12-20% всех случаев пневмонии. Морфологически при деструкции проявляется некротическим поражением части легкого, в результате как прямого воздействия токсинов и ферментов бактерий, так и вторичных сосудистых и тканевых изменений, включающих васкулит, внутрисосудистый тромбоз с разрушением альвеолярного эпителия, капиллярного эндотелия и формированием детрита.
Вариабельность течения дыхательной и полиорганной недостаточности при деструктивных пневмониях не позволяла до последнего времени сформулировать алгоритм респираторного обеспечения. В большинстве случаев по мере нарастания признаков дыхательной недостаточности принималось решение о переводе пациента на ИВЛ. Основным критерием для принятия решения о переводе на ИВЛ традиционно являлись газы крови, нарастание рСО2, снижение рО2 в большинстве случаев рассматривались как повод к переводу на ИВЛ. Перевод на ИВЛ для большинства пациентов сопровождался улучшением газового состава крови, но ухудшением локального статуса - усиливались явления деструкции в результате применения положительного давления на вдохе, при наличии пневмоторакса усиливалась интенсивность сброса по дренажной трубке. После периода наблюдения обычно выполнялась торакоскопическая операция, имеющая целью оптимизацию дренирования гнойного очага, с периодом последующей продленной искусственной вентиляции легких. В то же время известно, что, во-первых, решение о переводе на искусственную вентиляцию, ориентированное на состояние газового состава крови, часто запаздывает, так как не учитывает степень выраженности респираторного дистресса; во-вторых, более раннее назначение респираторной поддержки может не сопровождаться необходимостью использования потенциально повреждающих параметров. Широко известно, что повреждение легочной ткани, ассоциированное с ИВЛ, обусловлено как наличием положительного давления в дыхательных путях в фазе вдоха, неравномерностью распределения дыхательного объема, в результате чего часть регионов легких подвергается перерастяжению, часть - ателектазированию, так и свойствами вдыхаемой смеси, недостаточным увлажнением, токсическим действием избыточных концентраций кислорода. Очевидно, что степень выраженности последствий вентилятор-ассоциированного легочного повреждения напрямую зависит от установленных параметров и продолжительности ИВЛ. В то же время, основным критерием состоятельности ИВЛ всегда является соответствие газов крови физиологической норме, что в большинстве случаев заставляет использовать потенциально повреждающие параметры ИВЛ.
Вне зависимости от механизма развития наиболее частыми первичными этиологическими факторами деструктивных пневмоний считаются грамположительные бактерии Streptococcus pneumonia и Staphylococcus aureus. Несколько реже встречаются вирусно-бактериальные ассоциации и грибковая пневмония. Морфологически выделяют легочные и легочно-плевральные формы деструктивных пневмоний. К легочным формам относятся: инфильтративно-деструктивная (соответствует полисегментарной пневмонии), гнойный лобит (инфильтрация паренхимы доли с очагом деструкции в центре), абсцесс легкого и буллезная форма. Пиоторакс, пиопневмоторакс и пневмоторакс - легочно-плевральные формы, которые носят всегда вторичный характер, их наличие однозначно указывает на развитие некроза участка легкого. Информация об ожидаемой этиологии заболевания позволяет рассматривать определенный спектр этиотропных препаратов для лечения.
Цель - обобщить имеющийся опыт лечения при пневмонии, осложненной деструкцией легочной ткани у детей, использования неинвазивной вентиляции легких в схеме лечения деструктивной пневмонии.
Проанализировано течение, объем проводимой терапии, особенности респираторного обеспечения 28 случаев осложненной формы внебольничной пневмонии у пациентов, находившихся на лечении в отделении анестезиологии и реанимации детского хирургического центра (с января 2015 г. ГУ РНПЦ детской хирургии) в период с 2010 г. по июль 2015 г. Исследуемую группу составили пациенты в возрасте от 11 мес. до 14 лет (15 мальчиков и 13 девочек), медиана возраста - 6,4±4,3 года.
Ввиду отсутствия единого регистра детской заболеваемости пневмонией полная информация о частоте выявления деструктивных процессов при пневмонии не является в настоящее время доступной. Тем не менее, по причинам, приведенным ниже, обследованная группа пациентов является репрезентативной в отношении наиболее тяжелого течения пневмонии, а деструктивная пневмония в настоящее время является редким заболеванием. Известно, что некоторая часть пациентов с деструктивными процессами в легких не поступает в специализированную хирургическую клинику, а получает лечение в педиатрических стационарах. Поводом для перевода в хирургический стационар всегда является необходимость дренирования плевральной полости либо выполнения торакоскопической дренирующей операции.
В 82% случаев пациенты были переведены из других стационаров, где они получали лечение по поводу пневмонии. В 23 случаях из 28 основанием для госпитализации/перевода послужила дыхательная недостаточность, ассоциированная с выраженными нарушениями газового состава крови и возникшая в результате развития плеврита, плеврального выпота, абсцесса в легких, пневмоторакса. У 4 пациентов деструктивный процесс в легких возник на фоне гнойно-воспалительных заболевании иной этиологии: в 3 случаях была поражена опорно-двигательная система (реактивный артрит и остеомиелит), в одном случае имел место острый гнойный гангренозный перфоративный аппендицит. У одного из пациентов преморбидный фон был осложнен иммунодефицитным состоянием - синдром Луи-Барр (диагноз, однако, был установлен лишь во время пребывания ребенка в отделении интенсивной терапии).
Наиболее частыми симптомами при поступлении были гипертермия, тахипноэ и тахикардия, что в сочетании с нейтрофильным лейкоцитозом, нарастанием концентрации биохимических маркеров острой фазы воспаления (С-реактивный белок, фибриноген, прокальцитонин) соответствует развитию синдрома системного воспаления и сепсиса. С момента поступления у всех детей имели место признаки нарастающего респираторного дистресса с медленной трансформацией в классическую картину вентиляционной дыхательной недостаточности с первичным нарушением элиминации СО2. Первичная этиология пневмонии была определена только у 7 (25%) пациентов по данным посевов крови и плевральной жидкости. Streptococcus pneumonia был обнаружен в 4 случаях; кроме этого, обычно в более поздние сроки пребывания пациентов в стационаре, выявлялись Staphylococcus aureus и Pseudomonas aeruginosa.
Признаки легочной деструкции, включая участки консолидации легочной ткани, плевральный выпот, присутствие свободного воздуха в плевральной полости у всех пациентов, были обнаружены в результате обзорной рентгенограммы органов грудной клетки. У 14 и 7 (51 и 26%) детей деструктивный процесс был односторонним и локализовался справа и слева соответственно. В 6 (22%) случаях в патологический процесс с деструкцией были вовлечены оба легких. Гнойный плеврит (эмпиема плевры) зафиксирован у 17 (63%) пациентов, пневмоторакс - у 6 (22%). Бронхоплевральный свищ развился у 4 (14%) пациентов. У двоих пациентов проводилась интраплевральная фибринолитическая терапия. Плевральное дренирование оказалось недостаточно эффективным у 2 детей, что явилось основанием для торакоскопической санации плевральной полости. Благодаря развитию торакоскопических подходов хирургическое вмешательство в настоящее время является важной составляющей схемы лечения деструктивной пневмонии. В то же время, не менее важным компонентом диагностики динамики развития гнойных очагов и своевременного решения о хирургическом лечении являются методы визуализации, в частности компьютерная томография, не представленная в данном исследовании из-за отсутствия технических возможностей. Отсутствие положительной динамики общего и локального статуса можно рассматривать как показание к торакоскопии ввиду вероятного образования многочисленных спаек между париетальной и висцеральной плеврой.
Антибактериальная терапия у большинства пациентов (88%) инициировалась до постановки диагноза пневмонии. В качестве препаратов первой линии использовались β-лактамные антибиотики и макролиды; второй линии - цефалоспорины III поколения, антибиотики ряда карбапенемов чаще в сочетании с гликопептидами ванкомицином либо линезолидом. В схемах лечения всегда использовалось не менее двух антибактериальных препаратов. В 8 (29%) случаях ввиду наличия отрицательной динамики со стороны как признаков системного воспаления, так и локального статуса, в течение 3-6 дней ванкомицин заменялся линезолидом. Антимикробный потенциал против грамотрицательных организмов дополнялся колистином у 6 детей ввиду получения результатов высевов мультирезистентной внутригоспитальной грамотрицательной микрофлоры (Acinetobacter baumani, Pseudomonas aeruginosa).
Традиционная искусственная вентиляция легких через эндотрахеальную трубку выполнялась 5 (18%) пациентам в процессе лечения деструктивной пневмонии. Во всех случаях переводу на ИВЛ предшествовала тенденция к декомпенсации газового состава крови, нарастание работы дыхания, признаки деструкции легочной ткани. Во всех случаях на начальном этапе ИВЛ имел место продолжительный эпизод (12-24 ч) принудительной вентиляции (Pressure Control Ventilation либо DuoPAP) с использованием препаратов для выключения сознания. Параметры ИВЛ варьировали в широких пределах как у различных пациентов, так и в разные периоды проведения ИВЛ - давление вдоха 18-26 мбар, положительное давление конца выдоха 4-12 мбар, концентрация кислорода на вдохе 36-65%. Средняя продолжительность искусственной вентиляции легких составила 7±2 дня. У всех пациентов перевод на ИВЛ позволял нормализовать газовый состав крови в течение 1-2 сут. Рентгенологическая картина была непостоянной, но во всех случаях в первые дни проведения ИВЛ отмечалось усиление сброса воздуха по дренажным трубкам. У четырех из пяти пациентов в период проведения ИВЛ была выполнена торакоскопическая санация очага.
В 4 (14%) случаях применялась перемежающаяся неинвазивная респираторная поддержка. Решение о назначении неинвазивной вентиляции принималось прежде всего на основании наличия признаков избыточной работы дыхания и во всех случаях до появления точных лабораторных признаков дыхательной недостаточности. Неинвазивная вентиляция проводилась сеансами в течение 1-2 ч с последующими мероприятиями респираторного ухода (вибромассаж, санация дыхательных путей) и перерывом на 1-2 ч. Повторение цикла осуществлялось 6-8 раз в сут. Вне зависимости от используемого аппарата ИВЛ назначался режим вентиляции с поддержкой давлением, Pressure support, что позволяло в значительной степени сохранить собственное инспираторное усилие в каждом дыхательном цикле. На фоне неинвазивной ИВЛ в ранние сроки удавалось добиться аэрации коллабированных участков, что, предположительно, улучшало как состояние транспорта газов, так и биодоступность антибактериальных средств. Это, соответственно, создавало дополнительные условия для санации гнойного очага. Отсутствие достаточного числа наблюдений в настоящее время не позволяет говорить о статистической достоверности, однако у пациентов, получавших неинвазивную ИВЛ, положительная динамика со стороны гнойного очага отмечалась в более ранние сроки, отсутствовала необходимость использования снотворных препаратов и мышечных релаксантов.
Продолжительность пребывания в отделении интенсивной терапии в зависимости от варианта используемого респираторного обеспечения, частота осложнений, степень выраженности непосредственно деструктивных изменений в легких, а также необходимость выполнения хирургического вмешательства требуют дополнительного изучения.
1. Неинвазивная респираторная поддержка является перспективной методикой, позволяющей предупредить развитие тяжелой дыхательной недостаточности, предотвратить осложнения, связанные с традиционной искусственной вентиляцией легких, сократить продолжительность пребывания в отделении интенсивной терапии, и вероятно, обеспечить более раннюю санацию гнойного очага.
2. Массивное бактериальное повреждение при деструктивной пневмонии, недостаточная биодоступность очага для антимикробных средств позволяют определять возбудитель с большей частотой, чем это происходит при других гнойно-воспалительных заболеваниях. Несмотря на возможность точной этиологической диагностики и ранней этиотропной терапии динамика процесса у большинства пациентов требует ротации используемых антибактериальных средств, которая обусловлена неизбежной колонизацией гнойного очага госпитальной флорой.
Читайте также:


