Септического эндокардита у наркоманов
Полный текст:
Цель. Выявить особенности клинических проявлений инфекционного эндокардита у инъекционных наркоманов.
Результаты. Выявлен достоверно более молодой возраст больных в группе инъекционных наркоманов (р
Демко Ирина Владимировна — профессор, доктор медицинских наук, заведующий кафедрой внутренних болезней № 2 с курсом ПО.
Пелиновская Лилия Ивановна — кандидат медицинских наук, ассистент кафедры внутренних болезней № 2 с курсом ПО.
Манхаева Марина Вячеславовна — клинический ординатор кафедры внутренних болезней № 2 с курсом ПО.
Ищенко Ольга Петровна — кандидат медицинских наук, ассистент кафедры внутренних болезней № 2 с курсом ПО.
Мосина Валентина Анатольевна — кандидат медицинских наук, ассистент кафедры внутренних болезней № 2 с курсом ПО.
Крапошина Ангелина Юрьевна — кандидат медицинских наук, доцент кафедры внутренних болезней № 2 с курсом ПО.
Иваницкая Элеонора Эдуардовна — врач кардиолог кардиологического отделения № 1.
1. Tazevell B, Ross F, Nayab A. Invective endocarditis in heroin addict. Am. J. Cardiol. 2007;55:444-51.
2. Гусманов Д. С. Инфекционный эндокардит у инъекционных наркоманов. Бюллетень НЦССХ им. А.Н. Бакулева РАМН. 2013;14 (1):18-25.
3. Филипенко П. С., Драгоман Е. А. Инфекционный эндокардит у инъекционных наркоманов. Часть 1. Особенности этиологии, патогенеза и течения. Клиническая медицина. 2010;1:9-14.
4. De Rosa FG, Cicalini S, Canta F, et al. Infective endocarditis in intravenous drug users from Italy: the increasing importance in HIV-infected patients. J. Infect. 2007;35 (3):154-60.
5. Рекомендации ESC по ведению больных с инфекционным эндокардитом. Российский кардиологический журнал. 2016; (5):65—116. doi:10.15829/1560-4071-2016-5-65-116.
6. Тюрин В. П. Инфекционные эндокардиты. 2-е изд., доп. и переработанное.М.: Гэотар-Медиа; 2012.
7. Муратов Р. Н., Скопин И. И., Шамсиев Г. А. Тактика хирургического лечения активного инфекционного эндокардита трикуспидального клапана. Анналы хирургии. 2005;1:35-9.
8. Уланова В. И., Мазуров В. И., Цинзерлинг В.А. Клинико-морфологические особенности инфекционного эндокардита у ВИЧ-инфицированных инъекционных наркоманов. Клиническая медицина. 2011;3:70-4.
9. Гуревич М. А. Некоторые особенности современного инфекционного эндокардита. Российский кардиологический журнал. 2009;6:87-92. doi:10.15829/1560-4071-2009-6-87-92.
10. Столбова М. В., Лискова Ю. В., Артемова Н. Э., и др. Особенности инфекционного эндокардита у “солевых” наркоманов. Архив внутренней медицины. 2017;4:267-70.
11. Lapenna E, De Bonis M, Verzini A, et al. The clover technique for the treatment of complex tricuspid valve insufficiency: midterm clinical and cuspid valve insufficiency: midterm clinical and ehocardiographic results in 66 patients. Eur. J. Cardiothorack Surgery. 2010;37:1297-303.
12. Galai N, Vlahov D, Bareta JC. Prognostic factors for survival differ according to CD4+ cell count among HIV-infection drug users: pre-HAART and HAART ears. J. I nfect. 2005;38:74-81.
13. Приходько В. П. Особенности хирургического лечения инфекционного эндокардита у наркоманов. X Всероссийский съезд сердечно-сосудистой хирургии: тезисы докладов. 2004:48.
14. Котова E. О., Писарюк А. С., Гетия Т. С., и др. Современный инфекционный эндокардит: острое почечное повреждение как проявление кардиоренального синдрома. Клиническая фармакология и терапия. 2015;24 (2):47-53.
15. Мишнаевский А. Л. Инфекционный эндокардит трикуспидального клапана. Клиническая медицина. 2001;2:21-4.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
И. В. Демко
Красноярский государственный медицинский университет им. профессора В. Ф. Войно-Ясенецкого Минздрава России
Россия
Демко Ирина Владимировна — профессор, доктор медицинских наук, заведующий кафедрой внутренних болезней № 2 с курсом ПО.
Л. И. Пелиновская
Красноярский государственный медицинский университет им. профессора В. Ф. Войно-Ясенецкого Минздрава России
Россия
Пелиновская Лилия Ивановна — кандидат медицинских наук, ассистент кафедры внутренних болезней № 2 с курсом ПО.
М. В. Манхаева
Красноярский государственный медицинский университет им. профессора В. Ф. Войно-Ясенецкого Минздрава России
Россия
Манхаева Марина Вячеславовна — клинический ординатор кафедры внутренних болезней № 2 с курсом ПО.
О. П. Ищенко
Красноярский государственный медицинский университет им. профессора В. Ф. Войно-Ясенецкого Минздрава России
Россия
Ищенко Ольга Петровна — кандидат медицинских наук, ассистент кафедры внутренних болезней № 2 с курсом ПО.
В. А. Мосина
Красноярский государственный медицинский университет им. профессора В. Ф. Войно-Ясенецкого Минздрава России
Россия
Мосина Валентина Анатольевна — кандидат медицинских наук, ассистент кафедры внутренних болезней № 2 с курсом ПО.
А. Ю. Крапошина
Красноярский государственный медицинский университет им. профессора В. Ф. Войно-Ясенецкого Минздрава России
Россия
Крапошина Ангелина Юрьевна — кандидат медицинских наук, доцент кафедры внутренних болезней № 2 с курсом ПО.
Э. Э. Иваницкая
КрасГБУЗ Краевая клиническая больница
Россия
Иваницкая Элеонора Эдуардовна — врач кардиолог кардиологического отделения № 1.
Тип статьи: Обзоры
УДК: 616.126-022.7:616-056.83
Библиографическая ссылка: Бюллетень НЦССХ им. А.Н. Бакулева РАМН. 2013; 14 (1): 18-25
Цитировать как: Д. С. Гусманов. Инфекционный эндокардит у инъекционных наркоманов. Бюллетень НЦССХ им. А.Н. Бакулева РАМН. 2013; 14 (1): 18-25. DOI:
Добавлено в избранное 6
End Статистика по статье -->
Кардиохирург, ученый, педагог и организатор науки, доктор медицинских наук (1973 г.), профессор (1982 г.), академик РАМН (1994 г.), академик РАН (2011 г.), заслуженный деятель науки РФ (1994 г.), лауреат Ленинской премии (1976 г.), Государственной премии СССР (1986 г.), Государственной премии РФ (2002 г.), Премии Правительства РФ (2003 г.).
В 1994 г. Л.А. Бокерия избран по конкурсу на должность директора НМИЦССХ им. А.Н. Бакулева. В 1998 г. одновременно становится директором Центра хирургической и интервенционной аритмологии МЗ РФ.
С 1994 г. является заведующим кафедрой сердечно-сосудистой хирургии Российской медицинской академии последипломного образования (РМАПО) МЗ РФ. С 1995 г. заведует созданной им кафедрой сердечно-сосудистой хирургии № 2 Московской медицинской академии (ныне Первого МГМУ) им. И.М. Сеченова МЗ РФ.
С 2003 г. возглавляет кафедру сердечно-сосудистой хирургии и интервенционной кардиологии Московского государственного медико-стоматологического университета им. А.И. Евдокимова МЗ РФ.
Л.А. Бокерия выполняет весь известный арсенал операций на сердце при самой разнообразной патологии: от 3 до 6 операций в день, то есть от 700 до 900 операций с использованием искусственного кровообращения в год.
С 1996 г. он является главным кардиохирургом МЗ РФ.
Л.А. Бокерия – автор и соавтор свыше 3700 научных публикаций, в том числе более 250 книг, более 100 изобретений и полезных моделей, более 300 программ и баз данных для ЭВМ, ряд которых зарегистрированы за рубежом, по различным проблемам сердечно-сосудистой хирургии, кардиологии, медицинского образования и организации медицинской науки.
Л.А. Бокерия принадлежат уникальные работы по теоретическому обоснованию и клиническому использованию метода гипербарической оксигенации в хирургии сердца и сосудов. Он крупнейший специалист в области диагностики и хирургического лечения нарушений ритма и проводимости сердца (особенно тахиаритмий), включая различные сочетания сердечных аритмий с врожденными и приобретенными пороками и аномалиями развития сердца, коронарной болезнью.
Л.А. Бокерия является инициатором развития и другого нового раздела кардиохирургии в нашей стране – минимально инвазивной хирургии сердца. Большой вклад внес Л.А. Бокерия в решение проблемы хирургического лечения ИБС.
Велика роль Л.А. Бокерия в разработке новых подходов к хирургическому лечению терминальной сердечной недостаточности. Его заслугой является разработка новых операций у тяжелой категории кардиохирургических больных с различными формами кардиомиопатий. Он первым развил концепцию динамической кардиомиопластики, в том числе и у детей. Л.А. Бокерия выполнил первую в нашей стране имплантацию искусственного желудочка сердца и после большого перерыва инициировал возобновление в Центре выполнения операций по трансплантации сердца.
По инициативе Л.А. Бокерия в клиническую практику внедрены передовые технологии диагностики и реконструктивной хирургии заболеваний восходящего отдела и дуги аорты.
Он генерировал развитие и другого направления современной медицинской науки – креативной кардиологии, которая определяет необходимость созидательного сотрудничества врачей разных специальностей: кардиологов, кардиохирургов, специалистов по функциональной диагностике, фундаментальным и прикладным дисциплинам.
Под руководством Л.А. Бокерия в Центре разрабатываются и внедряются в клиническую практику новые высокотехнологичные принципы профилактики и лечения больных с сердечно-сосудистой патологией – использование методов генной и клеточной терапии.
Л.А. Бокерия активно занимается методологией медицинской науки и педагогической деятельностью. Он является создателем крупнейшей в стране кардиохирургической школы, воспитавшим не одно поколение врачей – кардиохирургов, кардиологов, реаниматологов и специалистов других смежных специальностей.
Л.А. Бокерия – действительный член Американской ассоциации торакальных хирургов (1991 г.), член правления (1992 г.) и член Президиума (с 2003 г., консул) Европейского общества грудных и сердечно-сосудистых хирургов, член правления Европейского общества сердечно-сосудистых хирургов, член научного правления Международного кардиоторакального центра Монако (1992 г.), член Сербской академии наук (1997 г.), почетный член Американского колледжа хирургов (1998 г.), академик АМН Украины, почетный профессор МГУ им. М.В. Ломоносова (2011 г.), иностранный член Национальной Академии наук Грузии (2012 г.).
Актуальность проблемы объясняется и тем, что для этой группы пациентов характерна высокая летальность (33,7%), в то время как в среднем по России летальность от пневмонии у пациентов молодого и среднего возраста составляет 1-3% [5].
У всех поступивших больных была ВИЧ-инфекция: 19 человек с IVA стадией, 31 человека с IVБ стадией, причем специфическую антиретровирусную терапию получали только 5 человек (10%). Остальные пациенты за медицинской помощью в СПИД-центр не обращались или самостоятельно прервали назначенный им курс специфической терапии. Вирусные гепатиты В, С наблюдались у 86% пациентов. Для верификации диагноза использовалось общеклиническое, лабораторно-инструментальное исследование, посев мокроты и крови на микрофлору и чувствительность к антибиотикам; проводилось рентгенографическое исследование грудной клетки в динамике, трансторакальное ЭХОКГ, УЗИ внутренних органов, по показаниям –диагностическая фибробронхоскопия и компьютерная томография легких. При необходимости больные консультировались инфекционистом, невропатологом, кардиохирургом.
Результаты исследования. Все больные поступили в стационар в поздние сроки от начала заболевания (через 1-1.5 месяца от появления первой симптоматики) и до госпитализации лечения антибиотиками не получали. При поступлении в стационар у всех больных была лихорадка (температура тела повышалась до фебрильных цифр). Также наблюдалась выраженная одышка при незначительной физической нагрузке, тахикардия, кашель чаще со скудной мокротой, боли в грудной клетке у 15 больных (30%), у 18 больных (36%) отмечалось кровохарканье. Большинство больных (92%) при поступлении имели I-II степень дыхательной недостаточности, определяемую с помощью пульсоксиметрии (SaO2 в %), 8% имели III степень дыхательной недостаточности. У 28 больных (56%) наблюдался лейкоцитоз до 19,0 х109 /л. со сдвигом лейкоформулы влево (палочкоядерные до 54%), значительное ускорение СОЭ. Лейкопения наблюдалась у 3 больных (6%) до 2,5 х109 /л.
По данным объективного исследования укорочение перкуторного тона наблюдалось у 16% больных, появление тупого перкуторного звука над областью инфильтрации у 74%. При аускультации чаще определялись мелкопузырчатые хрипы на вдохе или крепитация над местом поражения.
Посев мокроты на флору и чувствительность к антибиотикам удалось взять у 14 больных (28%), остальные больные поступили с сухим, малопродуктивным кашлем либо в крайне тяжелом состоянии. Анализ показал наличие бактериальной микрофлоры (St.Haemolyticus, M.catarrhalis), часто выявлялись грибки рода Candida.
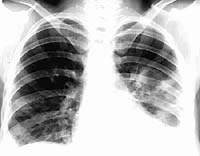
При рентгенологическом исследовании инфильтрация легочной ткани с одной стороны отмечалась у 24 больных (48%), в остальных случаях отмечалась двусторонняя локализация процесса. У 5 больных (10%) пневмония осложнилась пневмотораксом, у 2 больных – экссудативный плеврит (4%). Деструктивные изменения в легких отмечались у 14 больных (28%). Подобное осложнение в виде множественных полостей распада у наркоманов с пневмонией, обнаруживалось и другими исследователями [1]. Нетипичное течение пневмонии (рецидивирующие множественные очаги деструкции с незначительной перифокальной реакцией (рис.1), несмотря на массивную антибиотикотерапию, а также появление клиники сердечно-сосудистой и легочной недостаточности) позволило заподозрить инфекционный эндокардит, который был выявлен у 18 больных (36%).
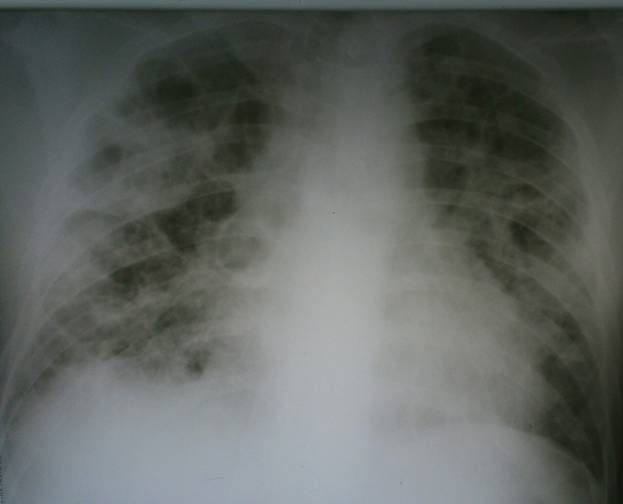
Рис. 1. Рентгенограмма органов грудной клетки:септическая пневмония - множественные очаги деструкции с обеих сторон
По данным ряда авторов, диагностика инфекционного эндокардита во многих случаях запаздывает, поскольку наркоманы поздно обращаются за медицинской помощью[4]. Трудности в диагностике инфекционного эндокардита объясняются еще и тем, что разрушение трехстворчатого клапана может долго не сопровождаться шумами в сердце и недостаточностью кровообращения (впервые шумы в области сердца могут появиться через 2-3 недели от начала терапии).
При проведении ЭХОКГ у наблюдаемых пациентов вегетации на трикуспидальном клапане с различной степенью регургитации обнаружены у 8 больных (44,4%) от всех случаев выявленного бактериального эндокардита), вегетации на митральном клапане у 5 больных (27,8%), вегетации на аортальном клапане у 2 больных (11,1%) и вегетации на всех клапанах у 3 больных.
Все больные с инфекционным эндокардитом были проконсультированы кардиохирургом, для определения дальнейшей тактики лечения. Помимо высокой стоимости лечения инфекционного эндокардита, другой проблемой для инъекционных наркоманов является необходимость протезирования клапанов. По данным статистики, даже при проведении оперативного лечения у этой категории больных сохраняется неблагоприятный прогноз. Через год после оперативного лечения погибают 55% наркоманов, через 3 года – 89%, поскольку при продолжающейся наркомании (и даже при ее прекращении) возникает новая проблема – инфекционный эндокардит протезированных клапанов [4].
У большинства больных помимо поражения легких, наблюдаются изменения внутренних органов [2]. Поражение печени наблюдалось у 12 больных, которое проявлялось гепатоспленомегалией (24%) по данным УЗИ и повышением уровня аминотрансфераз у 50% больных, у 3 больных (6%) обнаружены признаки цирроза печени. Признаки хронического панкреатита обнаружены у 46%больных.
Признаки токсической почки по данным УЗИ и изменению мочевого осадка отмечались у 9 больных (18%). Максимальный подъем уровня креатинина у этих пациентов составил 146мкмоль/л. Признаки ХПН диагносцированы у 2 пациентов (4%) и у 4 пациентов (8%) был диагностирован пиелонефрит с лейкоцитурией.
Явления хронической сердечной недостаточности определялись у больных с бактериальным эндокардитом: СН I стадии у 4 больных , СН II А стадии – 8 больных и CHII Б – 6 больных.
Поражение ротовой полости в виде орофарингеального кандидоза и микоза пищевода наблюдалось у 7 больных (14%). Анемия различной степени тяжести при поступлении выявлена у 24 больных (48%). У 6 пациентов (12%) наблюдался постинъекционный тромбофлебит различной локализации на фоне самостоятельного введения наркотических средств, требующий хирургического лечения.
Летальность в наблюдаемой группе составила 16 % (умерли 8 пациентов). У 5 человек смерть наступила от тяжелой (деструктивной, абсцедирующей пневмонии) на фоне ВИЧ- инфекции. Трое больных умерли в результате септического эндокардита трехстворчатого клапана и множественных септических инфарктов в легких.
Как известно, на выбор антибиотиков при лечении внебольничной пневмонии оказывают влияние три основных фактора: наиболее вероятный возбудитель заболевания, резистентность наиболее вероятных возбудителей к антибиотикам и спектр антибиотиков, реально доступных для пациента [6].
После установления возбудителя выбор адекватной терапии значительно упрощается. Однако у ряда больных установление возбудителя невозможно из-за отсутствия мокроты.
В лечении пациентов использовали комбинации антибиотиков, преимущественно бактерицидного действия, вводимые парентерально. При неустановленной этиологии использовали цефалоспорины, преимущественно III поколения в комбинации с макролидами или фторхинолонами. При установлении возбудителя лечение корректировали в соответствии с чувствительностью к антибиотикам. В случаях неэффективности терапии использовались антибиотики резерва: меропенем по 1г 2 раза в сутки в/в капельно, сульперацеф по 2г 2 раза в сутки в/в капельно. При бактериальном эндокардите использовали комбинацию цефалоспоринов I-III поколения с аминогликозидами (цефазолин +гентамицин, цефтриаксон +гентамицин). В случае неэффективности этой комбинации, при подозрении на MRSA инфекцию (метициллин-резистентный стафилококк), использовался ванкомицин в дозе 0,5 г 3-4 раза в сутки в/в капельно. Суточную дозу препаратов корректировали с учетом недостаточности функции почек и печени.
Всем больным, помимо антибактериальной терапии проводили симптоматическое лечение: дезинтоксикационную терапию, назначение гепатопротекторов, нестероидных противовоспалительных средств, ферментов, препаратов железа, мочегонных, иАПФ, антикоагулянтов и антиагрегантов.
Антибактериальную терапию можно считать эффективной у 84% больных. Клиническое улучшение у пациентов наступало, как правило, в конце 1 недели лечения, однако у многих больных наблюдалось медленное разрешение очагово-инфильтративных изменений на рентгенограмме. По мнению ряда авторов, пневмония у лиц с иммунодефицитом, практически всегда сопровождается синдромом затяжного рентгенологического разрешения [3]. Рентгенологически, первое улучшение, в среднем, наступало на 14 день лечения. По окончанию лечения у многих больных (42%) наблюдалось формирование фиброзных изменений в легких.
Сроки пребывания больного в стационаре составили от 2 до 42 дня, в среднем 22 к/дня. Причем 8 больных (16%) полный курс лечения не прошли, самостоятельно покинув отделение, или были выписаны за нарушение режима (употребление очередной дозы наркотика в стационаре).
Данные нашей работы показывают, что для получения благоприятного исхода заболевания и сокращения сроков госпитализации необходимо своевременное применение комбинации современных антибиотиков. Успешное лечение пациентов в стационаре позволяет перейти к следующему этапу – психологической и социальной реабилитации.
Рецензенты:
Сайфутдинов Р.И., д.м.н., профессор, заведующий кафедрой факультетской терапии и эндокринологии ГБОУ ВПО ОрГМУ Минздрава России, г. Оренбург;
Иванов К.М., д.м.н., профессор, заведующий кафедрой пропедевтики внутренних болезней ГБОУ ВПО ОрГМУ Минздрава России, г. Оренбург.
Д. Б. Утешев А. А. Карабиненко Е. Н. Филатова Г. И. Сторожаков, член-корр. РАМН, доктор медицинских наук, профессор РГМУ НО МФ МСЧ № 1 АМО ЗиЛ, Москва По официальным данным
РГМУ НО МФ
МСЧ № 1 АМО ЗиЛ, Москва
 |
| Рисунок 3. ЭхоКГ больной Л., 22 года |
 |
| Рисунок 4. Рентгенограмма больной Л., 22 года |
Как показывают наши примеры, встречаемость инфекционного эндокардита среди наркоманов увеличивается в связи с широким распространением внутривенного употребления наркотиков. Наиболее часто поражается трикуспидальный клапан. По данным литературы, в процесс могут также вовлекаться и другие клапаны [3]. В кантональном госпитале Цюриха было проведено проспективное исследование 22 пациентов с инфекционным эндокардитом (средний возраст 23 года). Период наблюдения составил три года [3]. Трикуспидальный клапан был поражен у 13 человек, митральный клапан — у четырех, комбинированное трикуспидально-митральное поражение наблюдалось у пяти пациентов и аортальный клапан был поражен у одного больного. Золотистый стафилококк оказался наиболее частым возбудителем (у 15 человек). Потенциальными факторами его патогенности, определяющими клиническую картину септического процесса, являются следующие энтеротоксины: SEA, SEB, SEC, SED и токсин синдрома токсического шока (TSST-1). Эти вещества связываются белками интерстицильного матрикса: фибронектином, колллагеном I и II типа и костным сиалопротеином (BSP). Однако эти факторы не являются преобладающими среди больных с инфекционным эндокардитом, вызванным Staphylococcus aureus [2]. BSP преобладает у больных с кожными поражениями, в то время, как у больных с эндокардитом чаще всего выделяются штаммы микроорганизмов, не вырабатывающие энтеротоксины. На наш взгляд, исходя из такой особенности выработки патогенов, можно предположить, что клинические проявления септического процесса, связанные с первичным очагом инфекции в коже (например, фурункулез), являются по своей картине однородными, в то время как при стафилококковом эндокардите факторы патогенности разнородны или вообще отсутствуют. Это может быть причиной отрицательного результата посевов крови.
Streptococci, по данным швейцарских врачей, являлись причиной бактериального эндокардита у четыреx пациентов, Corynebacteria — у двуx и в одном случае имелась смешанная инфекция [3]. Шесть пациентов были ВИЧ-инфицированы и 17 имели хронический вирусный гепатит. Десять пациентов (трое из них ВИЧ-инфицированные) подверглись хирургическому лечению. При кардиохирургическом лечении было проведено: рассечение трикуспидального клапана с заменой (у одного больного) или без замены (у четыреx больных) клапана, удаление вегетаций и замена клапана (у двух больных), замена митрального клапана (у двуx больных), протезирование аортального клапана (у одного больного). В случае эндокардита трехстворчатого клапана тактика оперативного вмешательства (выполнить резекцию, удалить вегетации или осуществить замену клапана) была выбрана с учетом тяжести поражения клапана и состояния психосоциального статуса пациента. В случае если вегетации присутствуют только на одной створке клапана и могут быть легко удалены, используется вегетоэктомия с аннулопластикой аутологичным перикардом. Удаление клапана без его протезирования является средством выбора среди тех пациентов, у которых нельзя исключить употребление наркотиков в будущем. Протезирование биопротезом используется в том случае, когда налицо полное разрушение клапана и доказано, что пациент воздерживался от употребления наркотиков в течение длительного времени до операции.
1. Медицинская микробиология / Гл. ред. В. И. Покровский, О. К. Поздеев. М.: Гэотар Медицина, 1999. 1200 с.
2. Carrel T., Schaffner A., Pasic M. et al. Surgery of endocarditis in the drug dependent and HIV patient. A prospective comparison with conservative treatment // Helv. Chir. Acta. 1993. Vol. 60. №3. Р. 439-445.
3. Hogevik H., Soderquist B., Tung H. S. et al. Virulence factors of Staphylococcus aureus strains causing infective endocarditis a comparison with strains from skin infections // APMIS. 1998. Vol. 106. № 9. P. 901-908.
, MD, North Shore Hospital, Auckland
Last full review/revision September 2017 by Guy P. Armstrong, MD







Эндокардит обычно означает инфекцию эндокарда (то есть инфекционный эндокардит). Термин эндокардит также может включать неинфекционный эндокардит, при котором стерильные тромбоциты и фибриновые тромбы фиксируются на клапанах сердца и прилегающем эндокарде. Неинфекционный эндокардит иногда может приводить к инфекционному эндокардиту. Оба могут привести к эмболизации и нарушению функции сердца.
Диагноз инфекционного эндокардита обычно устанавливается с учетом совокупности всех клинических данных, а не результата одного исследования.
Инфекционный эндокардит может возникнуть в любом возрасте. Мужчины заболевают в два раза чаще, чем женщины. Лица, употребляющие внутривенные наркотики, пациенты с ослабленным иммунитетом и пациенты с искусственными клапанами сердца и другими внутрисердечными устройствами имеют наибольший риск.
Этиология
Здоровое сердце относительно устойчиво к инфекции. Бактерии и грибы не легко адгезируются к поверхности эндокарда, и постоянный ток крови помогает предотвратить их оседание на эндокард. Таким образом, для развития эндокардита требуются, как правило, 2 условия:
Предшествующая аномалия эндокарда
Присутствие микроорганизмов в кровотоке (бактериемия)
Реже, массивная бактериемия или особо вирулентные микроорганизмы поражают нормальные клапаны.
Эндокардит часто поражает клапаны сердца. Основными предрасполагающими факторами ИЭ являются врожденные пороки сердца, ревматическое поражение клапанов, бикуспидальный или кальцинированный аортальный клапан, пролапс митрального клапана, гипертрофическая кардиомиопатия и предшествующий эндокардит. Протезирование клапанов и других внутрисердечных устройств представляет особый риск. Иногда пристеночные тромбы, дефекты межжелудочковой перегородки и область открытого аортального протока подвергаются инфицированию. Ядром инфекции является стерильная фибринозно-тромбоцитарная вегетация, формирующаяся при высвобождении поврежденными эндотелиальными клетками тканевых факторов.
Инфекционный эндокардит чаще всего поражает левые отделы сердца (например, митральный или аортальный клапаны). Примерно в 10–20% случаев поражаются правые отделы (трикуспидальный или пульмональный клапаны). Внутривенные наркоманы имеют более высокий риск развития правостороннего эндокардита (около 30–70%).
Микроорганизмы, поражающие эндокард, могут попадать из отдаленных очагов инфекции (например, кожный абсцесс, воспаленные или инфицированные десны, инфекция мочевыводящих путей) или через очевидные входные ворота, такие как центральный венозный катетер или места инъекций препаратов. Практически любой чужеродный имплантированный материал (например, желудочковый или перитонеальный шунт, протез) подвергается риску бактериальной колонизации, тем самым становясь источником бактериемии и, следовательно, эндокардита. Эндокардит может быть результатом асимптомной бактериемии, которая, как правило, возникает во время инвазивных стоматологических, медицинских или хирургических вмешательств. Даже чистка зубов и жевание могут приводить к бактериемии (обычно зеленящим стрептококком) у пациентов с гингивитом.
Возбудители различаются в зависимости от места инфекции, источника бактериемии и факторов риска пациента (например, внутривенные наркоманы), но в 80–90% случаев стрептококки и Staphylococcus aureus являются причиной ИЭ. Энтерококки, грам-отрицательные бациллы, микроорганизмы группы HACEK (Haemophilus, гемофильные бактерии, Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens и Kingella kingae) и грибки являются причиной большинства других случаев.
Болезнь протекает в трех стадиях:
Бактериемия: микроорганизмы присутствуют в крови
Адгезия: микроорганизм присоединяется к аномальному или поврежденному эндотелию с помощью поверхностных адгезинов
Колонизация: пролиферация организма вместе с развитием воспаления, что приводит к образованию зрелых вегетаций
Многие из возбудителей образовывают полисахаридные биопленки, которые защищают их от иммунной защиты хозяина и препятствуют проникновению антибиотиков
Патофизиология
Эндокардит имеет локальные и системные осложнения.
Местные последствия инфекционного эндокардита включают:
Абсцессы миокарда с деструкцией тканей, а иногда и с нарушением проводимости (чаще при нижне-перегородочных абсцессах).
Внезапная, тяжелая клапанная регургитация может привести к сердечной недостаточности и смерти (чаще из-за поражения митрального или аортального клапана).
Аортит в связи с распространением инфекции из прилегающих структур.
Для больных с протезированными клапанами характерно развитие абсцессов клапанного кольца, обструктивных вегетаций, абсцессов миокарда и грибковых аневризм, что проявляется клапанной обструкцией, дисфункцией клапана и нарушением проводимости.
Системные осложнения в первую очередь обусловлены
Эмболизация инфицированным материалом из сердечного клапана
Иммуно-опосредованные явления (в основном при хронической инфекции)
Поражение правых камер сердца характеризуется развитием септических эмболий легочной артерии, которые могут привести к инфаркту легкого, пневмонии или эмпиеме. Поражение левых камер сердца может приводить к эмболиям любых органов, особенно часто почек, селезенки и центральной нервной системы. Микотические аневризмы могут формироваться в любых крупных сосудах. Часто развиваются эмболии кожи и сетчатки. Вследствие отложения иммунных комплексов развивается диффузный гломерулонефрит.
Классификация
Инфекционный эндокардит может иметь вялотекущее, подострое течение или более острое, молниеносное течение с высокой опасностью развития быстрой декомпенсации.
Подострый бактериальный эндокардит (ПБЭ), несмотря на агрессивность, обычно развивается незаметно и прогрессирует медленно (т.е от нескольких недель до месяцев). Источник инфекции или входные ворота часто не выявляются. Возбудителями ПСЭ чаще всего являются стрептококки (особенно зеленящий, микроаэрофильный, анаэробный, стрептококки группы D и энтерококки), реже причиной могут быть золотистый и эпидермальный стафилококки - S. aureus, Staphylococcus epidermidis, стрептококки Gemella morbillorum, Abiotrophia defectiva (ранее, Streptococcus defectivus), Granulicatella и требовательный к питательным средам Haemophilus. Стрептококковый подострый эндокардит часто развивается на пораженных клапанах после асимптомной бактериемии, вследствие инфекций периодонта, гастроинтестинальных и урогенитальных инфекций.
Острый бактериальный эндокардит (ОБЭ) обычно развивается внезапно и прогрессирует быстро (т.е. в течение дней). Источник инфекции или входные ворота часто легко выявляются. Когда инфекция высоко вирулентна или бактериальное воздействие массивно, острый бактериальных эндокардит может поражать нормальные клапаны сердца. Он обычно вызван золотистым стрептококком S. aureus, гемолитическим стрептококком группы А, пневмококком или гонококком.
Эндокардит протезированного клапана (ЭПК) развивается у 2–3% пациентов в течение первого года после протезирования клапана и в 0,5% в последующие годы. Чаще развивается после замены аортального клапана, нежели митрального и в одинаковой степени поражает как механические, так и биологические протезы. Раннее начало инфекции ( 2 мес. после хирургического лечения) вызвано главным образом инфицированием в ходе операции бактериями, резистентными к противомикробным препаратам (S. epidermidis, дифтероиды, колиформные бациллы, Candida, Aspergillus). Позднее начало инфекции происходит в основном в результате контаминации низко-вирулентными организмами во время оперативного вмешательства или при транзиторных бессимптомных бактериемиях, чаще всего благодаря попаданию стрептококка; S. epidermidis; дифтероидов; и требовательной к средам грамотрицательной палочки Haemophilus, Actinobacillus actinomycetemcomitans, и Cardiobacterium hominis.
Клинические проявления
Клиническая картина зависит от классификации, но она неспецифична.
Первоначально симптомы подострого бактериального эндокардита смазанные: субфебрильная лихорадка ( 39 ° С), ночные поты, утомляемость, недомогание и потеря веса. Возможны озноб и артралгии. Симптомы клапанной недостаточности могут быть первым признаком, ведущим к постановке диагноза. Первоначально менее чем ( ≤ ) у 15% пациентов наблюдается лихорадка или шумы в сердце, но со временем оба эти симптома развиваются практически у всех больных. Объективное исследование может выявлять бледность, лихорадку, изменение ранее существовавшего шума или появление шума новой регугитации и тахикардию.

Этот пациент с инфекционным эндокардитом имеет множественные узелки Ослера (болезненные, эритематозные узелки на пальцах ног).
У данного пациента с инфекционным эндокардитом на ладонях видны множественные язвочки Джейнвея (безболезненные эритематозные папулы). На пальцах пациента также наблюдаются своеобразные узлы Ослера (болезненные, эритематозные узелки на пальцах).
На изображении слева показан узелок Ослера (мягкий эритематозный узелок) на большом пальце. На изображении справа показаны язвочки Джейнвея (безболезненные эритематозные пятна на ладони).
Точечные кровоизлияния представляют собой небольшие линейные кровоизлияния под ногтевыми пластинами.

На данной фотографии показаны конъюнктивальные петехии у пациента с инфекционным перикардитом.
На данной фотографии показано конъюктивальное кровоизлияние у пациента с инфекционным перикардитом.
На изображении слева показаны множественные пятна Рота или ретинальные кровоизлияния. Изображение справа – увеличенный снимок пятен Рота с бледной зоной в центре.
Клиническая картина острого бактериального эндокардита и эндокардита искусственного клапана подобна картине подострого бактериального эндокардита, но течение более быстрое. Лихорадка почти всегда выявляется в начале заболевания, у пациентов имеются симптомы интоксикации; иногда развивается септический шок. Сердечные шумы выявляются первоначально примерно у 50–80% пациентов и со временем у > 90%. Редко развивается гнойный менингит.
Септическая эмболия легочной артерии может вызывать кашель, плевральные боли в грудной клетке и иногда кровохарканье. Характерно наличие шума трикуспидальной регургитации.
Диагностика
Эхокардиография, иногда – другие методы получения изображения
Так как клиническая картина неспецифична, вариабельна и может развиться незаметно, диагностика требует высокой настороженности. Эндокардит следует подозревать у пациентов с лихорадкой без явных причин инфекции, особенно если есть шум в сердце. Настороженность в плане ИЭ должна быть очень велика в том случае, если имеются положительные результаты посева крови у пациентов с патологией клапанов сердца, у пациентов, которым недавно выполнялись инвазивные процедуры или у внутривенных наркоманов. Пациенты с доказанной бактериемией должны быть тщательно и многократно обследованы на предмет новых клапанных шумов и признаков эмболии.
Кроме позитивных посевов крови, других специфических лабораторных изменений нет. Установленные инфекционные поражения эндокарда часто приводят к нормохромной нормоцитарной анемии, лейкоцитозу, повышению СОЭ, увеличению уровня иммуноглобулинов, появлению циркулирующих иммунных комплексов и положительному ревматоидному фактору, но эти изменения не помогают в постановке диагноза. В общем анализе мочи часто выявляется микрогематурия, иногда эритроцитарные цилиндры, пиурия или бактериурия.
Идентификация возбудителя и определение его чувствительности к антибиотикам жизненно необходимы для определения тактики лечения.
Если заподозрен эндокардит, должно быть выполнено 3 забора крови на посев (20 мл каждый) в течение 24 ч (если клиническая картина представлена острым бактериальным эндокардитом, то 2 забора крови с интервалом между 1-м и 2-м в 1 час). Каждый новый забор крови должен быть произведен путем отдельной венепункции (т.е. не из ранее установленных внутрисосудистых катетеров). Забор крови не должен производиться во время наличия у пациента лихорадки или озноба, поскольку у большинства пациентов бактериемия носит постоянный характер. При эндокардите и в отсутствие предшествовавшей антибиотикотерапии все 3 посева образцов крови положительны, поскольку бактериемия продолжается; по крайней мере, 1 посев крови положительный в 99% случаев. Необходимо избегать преждевременного использования эмпирической антибактериальной терапии у пациентов с приобретенными или врожденными пороками во избежание эндокардитов с негативными посевами крови. Если ранее проводили антибактериальную терапию, следует также получить результаты гемокультуры, однако они могут быть отрицательными.
Посевы крови требуют 3–4-недельной инкубации для определенных микроорганизмов; однако некоторые запатентованные автоматически мониторирующие культуральные системы могут идентифицировать позитивные культуры в течение недели. Другие микроорганизмы (например, Aspergillus sp) могут не выявляться при посевах крови. Некоторые микроорганизмы (например, Coxiella burnetii, Bartonella sp, Chlamydia psittaci, Brucella sp) требуют серологической диагностики; другие микроорганизмы (например, Legionella pneumophila) требуют специальную культуральную среду или ПЦР (например, Tropheryma whippelii). Негативные результаты посевов крови могут быть следствием первичной антибактериальной терапии, инфицированности микроорганизмами, которые не растут на стандартных питательных средах, или указывать на другой диагноз (например, неинфекционный эндокардит, миксома предсердия с эмболиями, васкулит).
На начальном этапе необходимо выполнение эхокардиаграфии, обычно трансторакальной (ТТЭ), а не трансэзофагеальной (ТЭЭ). ТЭЭ является более чувствительной (т.е. способна выявлять вегетации маленького размера, невидимые при ТТЭ),
Чреспищеводную эхокардиографию следует проводить при таких случаях:
Пациенты имеют искусственный клапан
Трансторакальная эхокардиография не является диагностической
Диагноз инфекционного эндокардита был установлен клинически (проводится для выявления перфораций, абсцессов и свищей)
Иногда используется КТ, если при ЧПЭ не возможно точно определить околоклапанные абсцессы, а также для обнаружения микотических аневризм. ПЭТ является новым инструментом для диагностики эндокардита, который возникает в простетических и внутрисердечных устройствах. В настоящее время патологии, выявленные при КТ и ПЭТ включены в Европейские рекомендации в качестве основных критериев.
Инфекционный эндокардит достоверно диагностируется, когда микроорганизмы выявляются гистологически (или культурально) в эндокардиальных вегетациях, полученных в ходе операции на сердце, эмболэктомии или аутопсии. Так как вегетации обычно недоступны для исследования, существуют разнообразные клинические критерии для установления диагноза. К ним относятся пересмотренные критерии Дюка (с чувствительностью и специфичностью > 90%— Диагностические требования к диагнозу инфекционного эндокардита в соответствии с пересмотренными критериями Дюка а также Пересмотренные клинические критерии Дюка для диагностики инфекционного эндокардита) и модифицированные критерии Европейского общества кардиологии (ESC) 2015 года (1).
Критерии ESC аналогичны модифицированным критериям Дюка, но в качестве основных критериев включают результаты расширенной визуализации как указано далее:
Вегетации, абсцесс, псевдоаневризма, внутрисердечная фистула, клапанная перфорация или аневризма или новое частичное раскрывание створок искуссвенного клапана, которые выявлены при эхокардиографии
Аномальная активность вокруг искусственного клапана (имплантированного > 3 мес раньше), обнаруженная при ПЭТ/КТ или ОФЭКТ/КТ с лейкоцитами, меченными радиоактивными изотопами
Околоклапанные поражения, выявленные при КТ сердца
Критерии ESC также отличаются от малых модифицированных критериев Дюка, детализируя, что только лишь выявление бессимптомных сосудистых явлений при визуализации является достаточным.
Читайте также:


