Отек легких при сепсисе
9.1. Отек легких: патогенетические разновидности
Отек легких – это патологическое состояние, характеризующееся усиленной транссудацией жидкости из сосудов микроциркуляторного русла легких в интерстициальную ткань или альвеолы.
Как известно, основными механизмами, препятствующими развитию отека легких, являются, прежде всего, сохранность структуры альвеолярно-капиллярной мембраны, а также преобладание внутрисосудистого онкотического давления над гидродинамическим давлением составляющим в среднем 5 – 12 мм рт. ст.в сосудах микроциркуляторного русла.
По этиологии и патогенезу отеки могут быть гемодинамическими, мембранозными, лимфодинамическими, вследствие гипопротеинемии.
Гемодинамический отек легких возникает при повышении гидростатического давления в легочных капиллярах. При возникновении легочной гипертензии, величина гидродинамического давления возрастает и как только давление превышает 25 – 30 мм рт. ст. начинается развитие отека легких. В соответствии с механизмами развития различают три формы легочной гипертензии: гипердинамическую, застойную и сосудистую.
Гипердинамическая форма наблюдается при увеличении притока крови в сосуды малого круга кровообращения (например, при почечной недостаточности, избытке альдостерона и АДГ, избыточной трансфузии жидкости, дефиците предсердного натрий-уретического фактора, перерезке блуждающего нерва или повреждении его центров, избыточной продукции катехоламинов).
Развитие отека легких может иметь место и при застойной форме гипертензии, т.е. в случаях затруднения оттока крови из сосудов малого круга кровообращения (при левожелудочковой сердечной недостаточности, развивающейся вследствие митрального и аортального стеноза, инфаркте миокарда, постинфарктном кардиосклерозе).
В основе так называемой сосудистой гипертензии, приводящей к развитию отека легких, лежит увеличение сосудистого сопротивления разнообразного генеза. При альвеолярной гиповентиляции рефлекторно возникает спазм легочных артериол, ограничивающий кровоток через плохо вентилируемые альвеолы и препятствующий сбросу венозной крови в большой круг кровообращения. И, наоборот, в участках со сниженным кровотоком (например, при тромбозе, эмболии легочных сосудов ) под влиянием механизмов ауторегуляции наблюдаются бронхоконстрикция и уменьшение легочной вентиляции.
Мембранозный отек легких возникает при повышении проницаемости сосудистой стенки под влиянием БАВ, ионов водорода, лизосомальных ферментов, эндотоксинов, белков, освобождающихся из тканей при сепсисе, травмах, кровопотерях, при аутоиммунных процессах, образовании комплексов антиген-антитело и т.д.. Через поврежденный эндотелий и базальную мембрану легочных сосудов вода, электролиты, белки плазмы, форменные элементы крови перемещаются в интерстиций легочной ткани.
Лимфодинамический отек наблюдается при блокаде лимфатического дренажа. У здорового человека отток лимфы составляет 15 – 20 мл/ч, по мере необходимости он может увеличиваться в 15 раз. При врожденном дефекте развития лимфатических сосудов, формировании лимфоэктазий, воспалении лимфатических сосудов или их компрессии затрудняется лимфоотток, и жидкость накапливается в легочной ткани.
Гипопротеинемия также способствует возникновению отека легких, так как нарушается равновесие Старлинга и жидкость устремляется в ткани.
9.2. Стадии развития отека легких: интрамуральная, интерстициальная и альвеолярная
1. Интрамуральная стадия характеризуется разрыхлением аргирофильного и эластического каркаса легочной ткани, утолщением альвеолярно-капиллярных мембран.
2. Интерстициальная – сопровождается отеком межальвеолярных перегородок, периваскулярных перибронхиальных пространств. Эта стадия возникает при накоплении в легочной ткани БАВ (клеточного и гуморального происхождения), вызывающих массивное повреждение эндотелия микроциркуляторного русла и увеличение проницаемости сосудистой стенки. Через поврежденную стенку плазма выходит в интерстиций легочной ткани. На первых этапах жидкость не попадает в альвеолы, вследствие работы компенсаторных механизмов: так, повышение интерстициального гидростатического давления увеличивает скорость тока жидкости от малорастяжимого перимикроваскулярного к более растяжимому бронховаскулярному интерстицию, в котором находятся терминальные лимфатические сосуды, впадающие в конечном итоге в центральную вену. По мере накопления отечной жидкости вокруг терминальных лимфатических сосудов ток легочной лимфы может возрастать в 15 раз, поддерживая тем самым баланс жидкости в легких (рис.13).
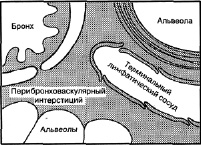
Рис.13. Схема путей транспорта экссудата в паренхиме легких
Отек легких возникает только тогда, когда резервные дренажные возможности лимфатических сосудов первоначально недостаточны или исчерпываются. Накопление жидкости в интерстиции ведет к набуханию волокон коллагена и эластина и снижению растяжимости легочной ткани. Происходит компрессия бронхиол, кровеносных и лимфатических сосудов “водными манжетами”. После достижения критического уровня жидкость устремляется в альвеолы и начинается альвеолярный отек.
3. Альвеолярная стадия характеризуется накоплением жидкости в альвеолах. Жидкость из интерстиция фильтруется в альвеолы, проходя между эпителиальными клетками, вымывает сурфактант, заполняет альвеолы и воздухоносные пути. Поступление жидкости в альвеолы усугубляет гипоксемию. Альвеолы заполняются транссудатом, богатым фибриногеном. Образующаяся фибриновая выстилка создает условия для формирования гиалиновых мембран. Под влиянием транссудата сурфактант смывается с поверхности альвеол и вызывает вспенивание транссудата в процессе вдыхания воздуха. Последнее приводит к эмболии воздухоносных путей, дальнейшему подавлению синтеза сурфактанта, развитию ателектазов. Снижается объем оксигенированной крови из-за перфузии невентилируемых альвеол. Кровь, проходя через эти альвеолы, остается венозной и смешивается с кровью, прошедшей мимо альвеол с нормальной оксигенацией; развивается циркуляторная гипоксия.
Отек легких - клинический синдром, обусловленный пропотеванием тканевой жидкости сначала в интерстициальную ткань легких, а затем и в альвеолы.
Отек легких обычно связан с левосторонней застойной недостаточностью. Несмотря на то, что чаще она является причиной данного заболевания, отек легких может вызываться и другими некардиогенными причинами.
Отек легких может вызывать также тяжелая закупорка верхних дыхательных путей, возникающая у кошек с явно выраженными анатомическими деформациями.
Снижение онкотического давления плазмы при гипоальбуминемии обычно приводит к истечению в плевральную полость и асциту, однако жидкость может также истекать в область легочного интерстиция и альвеолярную ткань.
После нескольких подобных эпилепсии припадков и черепной травмы может возникать неврогенный отек.
Таблица 1.Патогенетическая классификация отека легких
I. Нарушение равновесия между гидростатическими и онкотическими давлениями
A. Повышение гидростатического давления в легочных капиллярах
1. Повышение давления в легочных венах в отсутствие левожелудочковой недостаточности (например, при митральном стенозе)
2. Повышение давления в легочных венах вследствие левожелудочковой недостаточности
3. Повышение давления в легочных артериях (отек легких при избыточной перфузии)
Б. Уменьшение онкотического давления крови
1. Гипоальбуминемия
B. Снижение гидростатического давления в интерстициальной ткани
1. Быстрая эвакуация воздуха с применением большого отрицательного давления при пневмотораксе (односторонний отек легких)
2. Большое отрицательное давление в плевральной полости вследствие острой обструкции дыхательных путей с увеличением ФОЕ (бронхиальная астма)
II. Нарушение проницаемости аэрогематического барьера (РДСВ)
A. Пневмония — бактериальная, вирусная, паразитарная
Б. Ингаляция токсических веществ (фосген, озон, хлор, пары тефлона, двуокись азота, дым)
B. Попадание токсинов в кровоток (змеиный яд, бактериальные эндотоксины)
Г. Аспирация кислого желудочного содержимого
Д. Лучевой пневмонит
Е. Эндогенные вазоактивные вещества (гистамин, кинины)
Ж. ДВС-синдром
3. Иммунные реакции — экзогенный аллергический альвеолит, лекарственные средства (нитрофурантоин), лейкоагглютинины
И. Травмы, не затрагивающие грудную клетку
К. Панкреонекроз
III. Недостаточность лимфатического оттока
A. После трансплантации легких
Б. Раковый лимфангиит
B. Фиброзирующий лимфангиит (например, при силикозе)
IV Механизм неизвестен или раскрыт частично
A. Высокогорный отек легких
Б. Нейрогенный отек легких
B. Передозировка наркотиков
Г. ТЭЛА
Д. Эклампсия
Е. После кардиоверсии
Ж. После общей анестезии
3. После искусственного кровообращения
Braunwald E. et al., 1997.
Скапливание жидкости вначале в интерстиции, а затем в альвеолах приводит к различной степени расстройства дыхания.
У животного могут наблюдаться тахипноэ, диспноэ или ортопноэ, отсутствие физической выносливости или кашель, может наблюдаться цианоз.
При значительном альвеолярном кровотечении из ноздрей и рта может появляться пенистая отечная жидкость кровавого оттенка.
При выслушивании пораженных в умеренной до тяжелой степени животных обычно отмечаются потрескивающие и пузырчатые хрипы.
Возможны и другие клинические признаки, обусловленные лежащими в основе данного заболевания факторами.
На рентгенограмме наблюдается картина в различной степени повышенной плотности интерстициальной и (или) альвеолярной ткани с наличием воздушных бронхограа или без них, однако эти изменения в легких не поддаются дифференциации от других происходящих там инфильтративных процессов.
Диагноз застойной сердечной недостаточности может подтверждаться рентгенографическими данными, свидетельствующими о кардиомегалии.
Перегрузка сосудов, на которые указывает выступающие расширенные легочные сосуды, так же могут свидетельствовать о левосторонней сердечной недостаточности.
Снижение уровня сывороточного альбумина до уровня ниже 10-15 г/л (среднее значение альбумина для собак-22,0-39,0 г/л; для кошек-25,0-37,0 г/л) понижает онкотическое давление в достаточной степени, чтобы вызывать истечение жидкости.Необходимо выявить причину гипоальбуминемии. Наиболее шороко распространенными ее причинами является нарушение нормальной деятельности печени и вызывающие потерю белка гломерулонефропатии и энтеропатии.При постановке диагноза могут помочь данные, указывающие на наличие травмы, вдыхание дыма(например, подпаленная шерсть, сажа на морде) или заглатывание токсинов.
Отек легких кардиогенный
Увеличение давления в легочных венах, приводящее к застою, - наиболее частая причина одышки при сердечной недостаточности . Податливость легких уменьшается, и сопротивление мелких дыхательных путей увеличивается; однако при этом возрастает лимфоток, что препятствует повышению внесосудистого объема жидкости. Возникает небольшое тахипноэ . При длительном и выраженном повышении давления в легочных венах жидкость все же накапливается во внесосудистом пространстве - возникает интерстициальный отек легких . Состояние больного ухудшается, нарастает тахипноэ, еще больше нарушается газообмен, появляются рентгенологические изменения, такие, как линии Керли в реберно-диафрагмальных углах и нечеткость сосудистого рисунка. На этой стадии расстояние между эндотелиальными клетками в местах контакта увеличивается, и крупномолекулярные вещества плазмы проникают в интерстициальную ткань.
Дальнейшее повышение давления ведет к разрыву плотных контактов между альвеолоцитами и выходу в альвеолы жидкости, содержащей эритроциты и крупномолекулярные вещества. Это - альвеолярный отек легких . При еще более грубом нарушении целости аэрогематического барьера отечная жидкость заполняет альвеолы и дыхательные пути. Эта стадия характеризуется развернутой клинической картиной отека: при аускультации выявляются двусторонние влажные хрипы , при рентгенографии грудной клетки - диффузное уменьшение прозрачности легочных полей, наиболее выраженное в прикорневых отделах. Отмечаются беспокойство , обильное потоотделение , пенистая розоватая мокрота . Тяжелое нарушение газообмена ведет к усилению гипоксии . В отсутствие лечения ацидоз и гиперкапния прогрессируют, и наступает остановка дыхания.
Факторы, способствующие развитию отеков, видны из уравнения фильтрационно-реабсорбционного равновесия в капиллярах ( модель Старлинга ):
Накопление жидкости = К[(Рк - Ри) - сигма[(пи к) - (пи и)]] - Qл,
где К - коэффициент фильтрации (прямо пропорционален площади поверхности мембраны и обратно пропорционален ее толщине), Рк - среднее гидростатическое давление в капилляре, Ри - среднее гидростатическое давление в интерстициальной ткани, сигма - коэффициент отражения для крупномолекулярных веществ, (пи к) - онкотическое давление крови, (пи и) - онкотическое давление интерстициальной жидкости, Qл - лимфоток.
Рк и (пи и) способствуют выходу жидкости в интерстициальную ткань (фильтрации), а Ри и (пи к) - препятствуют. При повышении выхода жидкости Qл может увеличиваться, и тогда накопления жидкости в интерстициальной ткани не происходит. Дальнейшее увеличение Рк не только усиливает фильтрацию, но и приводит к открыванию нефункционирующих капилляров, что, в свою очередь, увеличивает К. В результате фильтрация превосходит Qл и жидкость накапливается в рыхлой интерстициальной ткани легких. При еще большем увеличении Рк вначале открываются неплотные контакты между клетками эндотелия, затем - плотные контакты между альвеолоцитами, и увеличивается проницаемость для крупномолекулярных веществ. Все это приводит к заполнению альвеол отечной жидкостью.
Отек легких некардиогенный: общие сведения
При некоторых состояниях отек легких обусловлен не повышением гидростатического давления в легочных капиллярах, а другими факторами.
Уменьшение онкотического давления крови при гипоальбуминемии (тяжелые заболевания печени , нефротический синдром , экссудативная энтеропатия ) должно было бы привести к отеку легких, однако соотношение гидростатических и онкотических давлений обычно таково, что реабсорбция компенсирует фильтрацию, и для возникновения интерстициального отека легких все же необходимо повышение гидростатического давления в капиллярах.
Односторонний отек легкого может возникнуть после быстрой эвакуации воздуха из плевральной полости при пневмотораксе , когда создается значительное отрицательное гидростатическое давление в интерстициальной ткани. При этом отек чаще выявляют только с помощью рентгенографии, реже возникают одышка и физикальные признаки отека легких на стороне поражения.
Возможно, интерстициальный отек легких при тяжелом приступе бронхиальной астмы также обусловлен повышением (по абсолютной величине) отрицательного давления в плевральной полости из-за увеличения ФОЕ . К интерстициальному отеку легких при пневмосклерозе , воспалительных заболеваниях легких и раковом лимфангиите может приводить блокада лимфатического оттока. В этих случаях в клинической и рентгенологической картине преобладают проявления основного заболевания.
Другие состояния, связанные с накоплением жидкости в интерстициальной ткани, главным образом обусловлены первичным повреждением аэрогематического барьера. Разнообразные повреждающие воздействия - вредные факторы окружающей среды , интерстициальная пневмония , аспирация желудочного содержимого и шок (особенно при сепсисе , панкреонекрозе и после искусственного кровообращения ) вызывают отек легких, не связанный с нарушениями гемодинамики. Эти состояния могут служить причиной РДСВ .
Особые виды отека легких. Выделяют три вида отека легких, которые не удалось четко связать с повышением проницаемости мембран, недостаточным лимфатическим оттоком или нарушением соотношения гидростатического и онкотического давления; точный механизм отека в этих случаях остается неизвестным. К этим видам относятся
Нейрогенный отек легких
Нейрогенный отек легких описан при заболеваниях ЦНС у лиц без предшествующих нарушений функции левого желудочка. Экспериментально доказано, что в возникновении отека легких важную роль играет повышение симпатического тонуса, однако точные механизмы не выяснены. Известно, что возбуждение симпатических нервов вызывает спазм артериол , повышение АД и централизацию гемодинамики ; кроме того, возможно уменьшение податливости левого желудочка. Все это ведет к повышению давления в левом предсердии и отеку легких, в основе которого лежат нарушения гемодинамики. Имеются экспериментальные данные о том, что стимуляция адренорецепторов непосредственно повышает проницаемость капилляров, но этот эффект имеет меньшее значение, чем нарушение равновесия между гидростатическим и онкотическим давлением.
Отек легких высокогорный
Хорошо известно, что пребывание на высоте в сочетании с тяжелой физической нагрузкой способствует развитию отека легких у здоровых, но не акклиматизировавшихся людей. Проведенные исследования показали, что этот синдром возникает и у постоянных жителей высокогорья при возвращении домой даже после относительно короткого пребывания на равнине. Чаще всего высокогорный отек легких возникает у людей моложе 25 лет. Его механизм остается непонятым; по одним данным, в его основе лежит спазм легочных вен, по другим - спазм легочных артериол. Роль гипоксии подтверждается тем, что ингаляция кислорода и снижение высоты способствуют уменьшению отека.
Гипоксия сама по себе не нарушает проницаемости альвеолярно- капиллярной мембраны. Физическая нагрузка приводит к увеличению сердечного выброса и повышению давления в легочных артериях, гипоксия - к спазму артериол. Оба фактора особенно выражены у молодых, и их сочетание может вызвать преартериолярный гипертензионный отек легких .
Отек легких при сердечной недостаточности: лечение
Как и при хронической сердечной недостаточности , в первую очередь следует выявить и устранить провоцирующие факторы, в частности аритмии и инфекцию . Если позволяет время, желательно установить катетер Свана- Ганца для мониторинга давления в легочной артерии и ДЗЛА и артериальный катетер для прямого измерения АД. Медлить с лечением, однако, нельзя: все перечисленные ниже мероприятия проводят почти одновременно:
На случай угнетения дыхания держат наготове налоксон .
- Дают 100% кислород, желательно под давлением, поскольку при альвеолярном отеке легких нарушается диффузия кислорода и возникает гипоксемия . Повышенное давление в дыхательных путях передается в альвеолы и уменьшает выход в них жидкости из капилляров. Кроме того, оно затрудняет венозный возврат к органам грудной полости, что снижает давление в легочных капиллярах.
-Необходимо уменьшить венозный возврат., опустив конечности животного
- Внутривенно вводят петлевые диуретики , такие, как фуросемид , этакриновая кислота (40-100 мг) или буметанид (1 мг), чтобы добиться быстрого диуреза и снизить ОЦК . Кроме того, фуросемид при в/в введении оказывает сосудорасширяющее действие , уменьшает венозный возврат и может улучшить состояние еще до начала мочегонного действия.
- Если систолическое АД в/в вводят нитропруссид натрия (начинают с 20-30 мкг/мин), чтобы уменьшить посленагрузку .
- Внутривенно вводят инотропные средства : дофамин или добутамин . Больным с систолической сердечной недостаточностью , не получающим сердечные гликозиды , вводят дигоксин , 1 мг в/в.
- Иногда показан аминофиллин , 240-480 мг в/в. Эти препараты уменьшают бронхоспазм , увеличивают почечный кровоток и экскрецию натрия , повышают сократимость миокарда .
- При неэффективности описанных выше мер накладывают резиновые жгуты на конечности, периодически освобождая одну из них.
После купирования отека легких и устранения провоцирующих его факторов необходимо заняться выявлением основного заболевания, если оно еще не диагностировано. Затем назначают постоянное лечение, чтобы предупредить повторный отек легких. Иногда может потребоваться кардиохирургическая операция.
При отеке легких кардиогенного характера при выборе методов лечения следует отдавать предпочтение диуретикам в сочетании с венорасширяющим нитроглицерином,- при условии, что животное не страдает обезвоживанием,однако в случае с отеком легких некардиогенной этиологии эффективность указанного лечения сомнительная. Тяжелые легочные отеки требуют энергичного лечения. Быстрое наступление диуреза вызывает внутривенное введение фуросемида в дозе 4 мг/кг.( выпускается в ампулах 1% раствор)
Диурез должен сопровождаться другими поддерживающими мерами, в зависимости от причины отека. При застойной сердечной недостаточности используют инотропные препараты положительного действия и сбалансированные сосудорасширяющие средства, тогда как при повреждении дыхательных путей необходимо противобактериальное защитное покрытие.
Могут оказаться достаточными дополнительная кислородная терапия, седативные средства и клеточное содержание, - в особенности это касается отека легких некардиогенного характера, когда возможно спонтанное исчезновение отека.
В случае обезвоженности животных с недостатком белка в организме для улучшения онкотического давления бывает необходима плазма. В основном требуются кормовые белковые добавки с высокой усвояемостью и применение анаболических стероидов.
В дополнение к поддерживающему уходу при легочной шоке с умеренным или тяжелым отеком применяют глюкокортикостероиды, однако прогноз в таких случаях сдержанный.
Список используемой литературы:
М. Мартин Б. Коркорэн
Кардиореспираторные заболевания собак и кошек
Клиническая лабораторная диагностика.Основные исследования и показатели.
, MD, MBA, Stanford University Medical Center
Last full review/revision February 2018 by Paul M. Maggio, MD, MBA

Сепсис представляет собой спектр заболеваний с риском смерти, колеблющимся от умеренного (например, 10%) до значительного (например, > 40%) в зависимости от различных возбудителей и факторов со стороны хозяина, наряду со своевременностью выявления и предоставления соответствующего лечения.
Септический шок является разновидностью сепсиса со значительно повышенным уровнем смертности в связи с серьезными нарушениями кровообращения и/или клеточного метаболизма. Септический шок предполагает наличие персистирующей гипотонии (определяется как потребность в вазопрессорах для поддержания среднего артериального давления ≥ 65 мм рт. ст., и уровень сывороточного лактата > 18 мг/дл [2 ммоль/л], несмотря на реанимационные мероприятия, проведенные в достаточном объеме [1]).
Понятие синдрома системного воспалительного ответа (ССВО), которое определяется специфическими нарушениями жизненно важных функций и результами лабораторных исследований, уже давно используется для выявления сепсиса на ранних стадиях. Однако было обнаружено, что критерии ССВО имеют недостаточную чувствительность и специфичность при повышенном риске смерти, что является основным аспектом использования такой концептуальной модели. Отсутствие специфичности может быть обусловлено тем, что ССВО чаще является адаптивным, а не патологическим ответом.
Справочные материалы
1. Singer M, Deutschman CS, Seymour CW, et al: The third international consensus definitions for sepsis and septic shock (sepsis-3). JAMA 315:801–810, 2016.
Этиология
Большинство случаев септического шока вызвано внутрибольничными грамотрицательными бактериями или грамположительными кокками и часто возникает у пациентов с ослабленным иммунитетом и у пациентов с хроническими заболеваниями. Реже возбудителями являются грибы рода Candida. Следует заподозрить послеоперационную инфекцию (глубокую или поверхностную) в качестве причины септического шока у пациентов, которые недавно перенесли операцию. Неспецифическая, редкая форма шока, вызванная токсинами стафилококков и стрептококков называется синдромом токсического шока.
Септический шок встречается чаще у новорожденных ( Неонатальный сепсис), у пожилых людей и беременных женщин. Предрасполагающие факторы включают:
Лейкопению (особенно, связанную с раком или лечением цитотоксическими лекарственными средствами)
Наличие инвазивных устройств (в том числе эндотрахеальных трубок, сосудистых или мочевых катетеров, дренажей и других инородных материалов)
Первоочередным лечением являются антибиотики или кортикостероиды
К наиболее распространенным локализациям инфекции относятся легкие, мочевые и желчные пути и ЖКТ.
Патофизиология
Патогенез септического шока полностью не изучен. Воспалительные агенты (например, бактериальный токсин) провоцируют выработку провоспалительных медиаторов, включая ФНО и ИЛ-1. Эти цитокины вызывают нейтрофильно-эндотелиальную клеточную адгезию, активируют механизмы свертывания крови и обуславливают образование микротромбов. Они также способствуют высвобождению других медиаторов, включая лейкотриены, липоксигеназу, гистамин, брадикинин, серотонин и IL-2. Им противостоят противовоспалительные медиаторы, такие как IL-4 и IL-10, в результате механизма обратной отрицательной связи.
Сначала артерии и артериолы расширяются, уменьшается периферическое артериальное сопротивление; сердечный выброс, как правило, увеличивается. Этот этап называется тепловым шоком. Позже, сердечный выброс может уменьшиться, падает АД (с или без увеличения периферического сопротивления), и появляются типичные признаки шока.
Даже на стадии увеличенного сердечного выброса, вазоактивные медиаторы приводят к тому, что кровоток минует капилляры (распределительный дефект). Ослабленный капиллярный ток из этого шунтирования наряду с капиллярной обструкцией микротромбами уменьшают доставку кислорода и снижают выведение углекислого газа и других продуктов распада. Гипоперфузия приводит к дисфункции, а иногда и к недостаточности одного или более органов, включая почки, легкие, печень, мозг и сердце.
Коагулопатия может развиться из-за внутрисосудистой коагуляции с участием основных факторов свертывания крови, усиленного фибринолиза, и чаще комбинации обоих.
Клинические проявления
Симптомы и признаки сепсиса могут быть малозаметными и часто легко принимаются за проявления других заболеваний (например, белая горячка, первичная дисфункция сердца, эмболия легочной артерии), особенно у послеоперационных больных. У пациентов с сепсисом, как правило, отмечаются: лихорадка, тахикардия, обильное потоотделение и тахипноэ; АД остается в норме. Также могут присутствовать другие признаки инфекции, являющейся ричиной сепсиса. По мере ухудшения состояния больного с сепсисом или при развитии септического шока ранним симптомом, особенно у пожилых людей и маленьких детей, может быть спутанность сознания или снижение активности. АД снижается, однако кожа остается парадоксально теплой. Позже, конечности становятся прохладными и бледными с периферическим цианозом. Дисфункция органов приводит к появлению дополнительных симптомов и признаков в зависимости от пораженного органа (например, олигурия, одышка).
Диагностика
АД, частота сердечных сокращений и мониторинг кислородного статуса
Общий анализ крови с лейкоцитарной формулой, уровень электролитов, креатинина и лактата
Показания инвазивного центрального венозного давления (ЦВД), Pa O 2 и сатурации кислорода в центральной вене (ScvO2)
Бактериологический посев крови, мочи и других потенциальных очагов инфекции, в том числе из ран у пациентов после операции
Сепсис подозревают, когда у пациента с известной инфекцией развиваются системные симптомы воспаления или органной дисфункции. Аналогичным образом, у пациентов с необъяснимыми признаками системного воспаления необходимо изучить наличие инфекционных заболеваний в анамнезе, провести медицинский осмотр и лабораторные исследования, которые включают общий анализ мочи и бактериологический посев мочи (особенно у пациентов с постоянными катетерами), бактериологический посев крови и посевы других подозрительных жидкостей организма. Пациентам с подозрением на хирургическую или скрытую причину сепсиса может потребоваться УЗИ, КТ или МРТ в зависимости от предполагаемого источника. При тяжелом сепсисе уровни C- реактивного белка и прокальцитонина в крови часто повышены и могут облегчить постановку диагноза, но эти показатели не являются специфичными. Диагноз основывается прежде всего на клинических проявлениях.
Другие причины шока (например, гиповолемия, инфаркт миокарда) должны быть исключены с помощью анамнеза, медицинского осмотра, электрокардиограммы и анализа кардиомаркеров в сыворотке крови. Даже в отсутствие ИМ гипоперфузия, обусловленная сепсисом, может привести к появлению признаков ишемии на электрокардиограмме, включая неспецифические отклонения ST-T, инверсии зубца T, наджелудочковые и желудочковые экстрасистолии.
Важно выявить дисфункцию органа как можно раньше. Был разработан ряд систем оценки, но шкала динамической оценки органной недостаточности (шкала SOFA) и шкала quick SOFA (qSOFA) были одобрены в отношении риска смерти и являются относительно простыми в использовании.
С помощью критериев шкалы qSOFA выявляют пациентов, которым необходимо провести дальнейшие клинические и лабораторные исследования (должны присутствовать все 3 критерия):
Частота дыхания ≥ 22/мин
Систолическое АД ≤ 100 мм рт. ст.
Оценка по шкале SOFA является более надежной, но требует проведения лабораторных исследований ( Шкала динамической оценки органной недостаточности (SOFA)).
≥ 400 мм рт. ст. (53,3 кПа)
12,0 мг/дл (204 мкмоль/л)
САД ≥ 70 мм рт. ст.
САД 15 мкг/кг/мин в течение ≥ 1 ч
Эпинефрин > 0,1 мкг/кг/мин в течение ≥ 1 ч
Норэпинефрин > 0,1 мкг/кг/мин в течение ≥ 1 ч
5,0 мг/дл (440 мкмоль/л)
* Более высокий балл указывает на лучшее состояние неврологических функций.
F IO 2 = фракция вдыхаемого O2; кПа = килопаскали; САД = среднее артериальное давление; Pao2 = парциальное давление кислорода артериальной крови.
По материалам Singer M, Deutschman CS, Seymour CW, et al: The third international consensus definitions for sepsis and septic shock (sepsis-3). JAMA 315:801-810, 2016.
Проводят ОАК, ГСАК, рентгенологическое исследование органов грудной клетки, анализ уровней электролитов в сыворотке, азота, мочевины крови и креатинина, P co 2 и проб печени. Измерение уровня лактата в сыворотке или сатурации кислорода в центральной вене (ScvO2) (или сразу оба анализа) могут помочь в определении лечения. Количество лейкоцитов может быть уменьшено ( 4 000/мкл) или увеличено (> 15 000/ мкл ), а количество ПМЯ-клеток может снизиться до 20%. В ходе развития сепсиса количество лейкоцитов может увеличиваться или уменьшаться в зависимости от тяжести сепсиса или шока, иммунологического статуса пациента и этиологии инфекции. Одновременное использование кортикостероидов может увеличить количество лейкоцитов и, таким образом, маскировать изменения в анализах, связанные с проявлениями болезни.
Гипервентиляция с дыхательным алкалозом (низкий Pa co 2 и повышенный pH крови) появляется рано, как реакция компенсации метаболического ацидоза. Уровень сывороточного бикарбоната обычно низкий, а уровни лактата в сыворотке и крови повышаются. Шок прогрессирует, метаболический ацидоз ухудшается, и снижается pH крови. Раннее развитие гипоксемической дыхательной недостаточности приводит к снижению соотношения PaO2:F IO 2, а иногда и к выраженной гипоксемии с Pa o 2 70 мм рт. ст. Диффузные инфильтраты на рентгенограмме грудной клетки могут появляться вследствие развития острого респираторного дистресс-синдрома (ОРДС). Уровень мочевины и креатинина обычно прогрессивно возрастают в результате почечной недостаточности. Значения билирубина и трансаминазы могут повыситься, хотя клинически выраженная печеночная недостаточность редко встречается у пациентов с нормальными исходными функциональными пробами печени.
У большинства пациентов с тяжелым сепсисом развивается относительная недостаточность коры надпочечников (т. е. нормальный или немного повышенный исходный уровень кортизола, который не увеличивается в значительной степени в ответ на дальнейший стресс или экзогенный АКТГ). Функция надпочечников может быть проверена путем измерения сывороточного кортизола в 8 часов утра , уровень 5 мг/дл считается неадекватным. При другом подходе уровень кортизола можно измерять до и после введения 250 мкг синтетического AКТГ; повышение уровня 9 мкг/дл считают недостаточным. Тем не менее, при резистентном септическом шоке проведение анализов на кортизол не требуется перед началом кортикостероидной терапии.
Измерения гемодинамики с помощью центрально-венозного или легочно-артериального катетера ( Мониторинг и обследование тяжелобольных пациентов : Методика) могут использоваться, когда неясен тип шока или необходимы большие объемы жидкости (например, > 4–5 литров 0,9% физиологического раствора в течение более, чем 6–8 ч). Эхокардиография, проведенная у постели больного в ОИТ, является практичным и неинвазивным альтернативным методом контроля гемодинамики. При септическом шоке сердечный выброс увеличивается, а периферическое сосудистое сопротивление уменьшается, в то время как при других формах шока сердечный выброс, как правило, снижается, а периферическое сосудистое сопротивление увеличивается. Показатели ЦВД и давления заклинивания в лёгочной артерии (ДЗЛА) вероятнее всего будут в норме при септическом шоке, в отличие от гиповолемического, обструктивного или кардиогенного шока.
Читайте также:


