Факторы патогенности бактероидов и патогенез заболеваний
Бактероиды играют важную роль в физиологии толстого кишечника. Они, например, метаболизируют желчные кислоты, готовя их к кишечно-печеночному циклу. Это может иметь и негативные последствия, так как в ходе микробзависимой трансформации желчных кислот образуются канцерогенные метаболиты (циклопентанфенантрены). Замечено, что вероятность рака толстой кишки связана с типом питания и процентным содержанием грамотрицательных анаэробов в фекалиях.
Влагалище. У большинства женщин в цервикальном отделе влагалища присутствуют бактероиды группы melaninogenicus-oralis (Previtella). Преобладающим видом является P. bivius; достаточно типичны P. disiens, P. intermedius и P. melaninogenicus. Из бактероидов асахаролитической группы встречается Porphyromonas asaccharоlytica. Бактероиды fragilis-группы и фузобактерии выделяются редко. Повышение количества бактероидов fragilis-группы, особенно B. fragilis, говорит о патологии генитального тракта.
Представления о болезнетворности бактероидов возникли в конце ХIХ в. после выделения от людей и животных с деструктивными гнилостными процессами. Картина уточнялась по мере совершенствования техники изучения облигатных анаэробов и утверждения принципов их классификации. Сегодня бактероидная патология признается одной из важных проблем клинической микробиологии. Чаще это эндогенная инфекция, связанная с повреждением слизистых оболочек, где в изобилии вегетируют различные бактероиды. Они атакуют глубокие ткани, вызывая более или менее обширные гангренозные поражения, которым сопутствует гнилостный запах, а иногда газообразование. Развитию процесса благоприятствует гипоксия из-за недостаточного кровоснабжения. Поэтому бактероиды особенно активно размножаются в поврежденных и некротизированных тканях, а также в зонах ишемии, например при нарушении периферийного кровообращения. Тканевая деструкция, нарастающая по мере инфекции, усиливает недостаток кислорода, стимулируя размножение анаэробов. Этому способствуют инородные тела, а также то, что в очагах поражения бактероиды обычно соседствуют с аэробными и факультативно-анаэробными бактериями, которые, поглощая кислород, усиливают анаэробиоз. Чувствительность к бактероидам повышается при смешанном инфицировании животных, например, при совместном заражении бактероидами и кишечной палочкой. Смешанный характер клинических инфекций объясняется тем, что при повреждении слизистых оболочек в ткани попадают все бактерии, населяющие данный участок тела. При углублении гипоксии анаэробы становятся ведущим фактором деструктивного (некротического) процесса.
К счастью, лишь немногие бактероиды обладают патогенностью. Из них только один вид, B. fragilis, способен вызывать моноинфекции; остальные встречаются в ассоциациях между собой и с другими бактериями. Болезнетворность бактероидов и фузобактерий (лептотрихии, по-видимому, безвредны) напрямую не связана с их количественным содержанием в нормальной микрофлоре, т.е. с вероятностью массивного обсеменения тканей. Более того, их лидер, B. fragilis, значительно уступает по численности более безобидным видам. Это означает, что патогенные (точнее условно-патогенные) бактероиды наделены особыми свойствами, которые обеспечивают их агрессивность. Учитывая смешанный характер большинства инфекций, когда в очаге поражения одновременно присутствуют различные бактероиды и/или фузобактерии, можно говорить об их интегративном патогенетическом потенциале, который складывается из суммы факторов нескольких видов бактерий. При моноинфекции агрессивности часто не хватает, и процесс не получает развития.
Как уже говорилось, бактероидная инфекция обычно начинается с повреждения слизистых оболочек, когда нормальная микрофлора получает доступ в глубжележащие ткани. Яркий пример — перфорация кишечника, ведущая к перитониту. Это результат совместной аэробной (факультативно-анаэробной) и анаэробной инфекции, где бактероидам (прежде всего B. fragilis) принадлежит главная роль. Первым негативным для себя фактором, с которым анаэробы сталкиваются в новой среде обитания, яв-ляется кислород. Большинство бактероидов достаточно терпимы к кислороду и по крайней мере несколько часов выживают в обычной атмосфере. Мы уже говорили о ситуациях, которые ведут к местной гипоксии, способствуя стабилизации анаэробного инфекта. Но ускользание от кислорода может быть и активным. Некоторые бактероиды располагают ферментами, которые разрушают высокотоксичные метаболиты кислорода. Такой способностью обладает, в частности, B. fragilis, продуцирующий каталазу и супероксиддисмутазу. Поэтому уже на первом этапе (сразу после пассивной инвазии в ткани) происходит селекция бактерий по устойчивости к кислороду. Вероятность продолжения процесса наиболее реальна для аэротолерантных штаммов.
Для отражения фагоцитарной атаки некоторые из бактероидов располагают полисахаридной капсулой, которая защищает их от фагоцитоза, способствуя абсцедированию и системной инвазии. Этот признак опять-таки лучше всего выражен у B. fragilis, подчеркивая патогенетическое лидерство данного вида среди бактероидов. Впрочем, и авирулентные штаммы могут обретать способность к капсулообразованию и индуцировать абсцессы при смешанной инфекции с другими аэробными и анаэробными бактериями.
Еще один антифагоцитарный фактор — низкомолекулярные жирные кислоты. Они продуцируются бактероидами и фузобактериями и отрицательно влияют на функции многих клеток, в том числе фагоцитов. Так, бактероиды fragilis-группы накапливают значительное количество сукциновой (янтарной) кислоты, которая подавляет кислородзависимую бактерицидность и хемотаксис нейтрофилов.
Наконец, бактероиды располагают протеолитическими ферментами, разрушающими иммуноглобулины и факторы комплемента. Это помогает им и соседствующим с ними бактериям противостоять опсонофагоцитозу, который и без того ослаблен из-за низкого притока крови в зоны ишемии.
Прямой некротизирующий эффект, столь типичный для бактероидов и фузобактерий, связан с действием их гистолитических ферментов. Они расщепляют тканевые структуры, способствуя бактериальной инвазии и превращая ее в расползающуюся или абсцедирующую зону гангренозного распада. К таким ферментам относятся разнообразные протеиназы (коллагеназа, фибринолизин и др.), липазы, нейраминидаза, гиалуронидаза, нуклеазы, хондроитинсульфатаза и пр. Некоторые из бактероидов продуцируют гепариназу — фермент, который, расщепляя гепарин, способствует тромбообразованию, усиливая тканевую ишемию и, следовательно, анаэробиоз.
Подобно всем грамотрицательным бактериям, бактероиды содержат липополисахаридный эндотоксин. Его биологическая активность неодинакова у разных видов, а в ряде случаев близка к нулю. Инертным липополисахаридом располагает, в частности, B. fragilis, что, однако, не мешает ему лидировать по патогенности. Дело в том, что основные эффекты эндотоксина проявляются после проникновения в кровь и опосредованы через систему эндогенных медиаторов воспаления. Он не токсичен в зоне локального поражения и в этом отношении принципиально отличается от агентов с прямым повреждающим эффектом, которые доминируют при анаэробной инфекции.
В табл. 4 суммированы факторы, с которыми связана болезнетворность бактероидов. Повторим, что они неодинаково выражены у разных видов и даже штаммов, но благодаря смешанному характеру инфекций могут присутствовать в очаге поражения. Эталоном является B. fragilis, на изучении которого базируются основные представления о механизмах патогенности бактероидов.
Факторы патогенности бактероидов
| Факторы | Патогенетический эффект |
| Гистолитические ферменты (протеиназы, галуронидаза, липазы, нуклеазы и пр.) | Деструкция тканей, матриксных белков (коллагена, фибронектина, ламинина), фибрина Подавление иммунитета (деструкция иммуноглобулинов, комплемента) |
| Ферменты, инактивирующие кислород (каталаза, супероксиддисмутаза) | Выживание в аэробных условиях (аэротолерантность) |
| Капсульный полисахарид | Подавление фагоцитоза Абсцедирование |
| Лектиноподобные поверхностные белки, фимбрии (?) | Адгезия (мезотелиальные, эпителиальные клетки) |
| Липополисахаридный эндотоксин | Синдром эндотоксинемии |
| Гепариназа | Локальные тромбозы и тканевая ишемия |
| Жирные кислоты | Антифагоцитарный эффект |
| IgA-протеаза | Подавление иммунитета слизистых оболочек (разрушение секреторных антител) |
| Бета-лактамазы | Устойчивость к антибиотикам |
Большинство инфекций начинается в тканях, прилегающих к зонам естественного обитания бактероидов, т.е. к слизистым оболочкам ротовой полости, кишечника и полового тракта (у женщин). Отсюда следует, что видовой спектр возбудителей в очагах поражения должен быть неодинаковым, отражая особенности микрофлоры соответствующих участков тела. Так, абдоминальные и перинеальные инфекции обычно связаны с fragilis-группой и асахаролитическими разновидностями (Porphyromonas asaccharоlytica), причем в 60—70% случаев выделяется B. fragilis. В патологии женских гениталий наряду с B. fragilis существенную роль играют B. bivius, P. disiens, P. melaninogenica. В оральной патологии преобладают бактероиды родов Previtella, Porphyromonas и фузобактерии. Впрочем, к бактероидной и фузобактериальной инфекциям чувствительны любые ткани, и благодаря контактному, лимфогенному и гематогенному метастазированию очаги деструктивного поражения могут возникать в различных органах.
1. Краткая характеристика инфекции. Основные клинические симптомы.
Бактероиды относятся к условно-патогенным бактериям.
По классификации Берджи род Bacteroides отнесен к двум группам.
Группа 4. Грамотрицательные аэробные/микроаэрофильные палочки и кокки. В эту группу входят такие виды как B.urealyticusиB.gracilis.B.urealyticusможет вызывать инфекции дыхательных путей, кишечного тракта, мочеполовых путей,B.gracilis– анаэробные плевро-легочные инфекции, инфекции головы и шеи.
Группа 6. Грамотрицательные анаэробные прямые, изогнутые и спиральные бактерии. Наиболее этиологически значимыми в патологии человека являются B. fragilis и B. melaninogenicus. Это строгие анаэробы, которые могут вызывать гнойно-воспалительные заболевания различной локализации, чаще - у лиц с иммунодефицитами.
2.Характеристика возбудителя
Классификация (см. п. 1)
Морфологические и тинкториальные свойства
Бактероиды – полиморфные средних размеров палочки, располагающиеся поодиночке или парами, неподвижны, (2 вида – перитрихи), не образуют спор, некоторые штаммы образуют капсулу (B.fragilis).
Бактероиды требуют специальных сред, присутствия 10% СО2и витамина К. Для их культивирования используют КАБ-среду, среды с гемином, пептонный бульон с дрожжевым экстрактом и глюкозой. Растут на средах с желчью. Размножение медленное, посевы инкубируют 5 дней. Бактероиды образуют на кровяной среде небольшие выпуклые непигментированные колонии, B.melaninogenicus дает колонии черного или темно-коричневого цвета. В жидких средах образуют помутнение с выпадением осадка.

Экзотоксинов не образуют. ЛПС наружной мембраны клеточной стенки - эндотоксин.
Антигенная структура по О – антигену вариабельна, мало изучена.
Во внешней среде малоустойчивы. Чувствительны к различным дезрастворам.
Патогенность для животных
Около 15 видов бактероидов могут вызывать различные заболевания у животных. Вышеперечисленные 4 вида для них непатогенны.
Патогенез и эпидемиология инфекций, вызванных бактероидами
Бактероиды являются обитателями толстого кишечника человека и некоторых животных, значительно реже их обнаруживают в микрофлоре в респираторном и мочеполовом тракте. Вызывают гнойно-воспалительные заболевания, возникающие, в основном, как эндогенная инфекция. В ассоциациях с другими микроорганизмами встречаются при перитонитах, абсцессах брюшной полости, легких, циститах, инфекционных поражениях клапанов сердца.
Факторами патогенности являются капсула, пили, белки наружной мембраны, которые участвуют в адгезии. Капсульный полисахарид защищает от фагоцитоза. Продуцируют ряд ферментов: нейраминидазу, фибринолизин, гепариназу, ДНК-азу. При гибели выделяют эндотоксин.
При некоторых формах инфекционного процесса, вызываемого бактероидами (сепсис, воспаление урогенитальной сферы), обнаруживаются антитела, титр которых значительно выше, чем у здоровых людей. После перенесенного заболевания титр антител постепенно снижается в течение нескольких месяцев. Значение выявляемых антител в создании невосприимчивости неизвестно.
Исследуемый материал– кровь, гной и др. в зависимости от локализации.
Грамотрицательные полиморфные палочки, располагающиеся поодиночке или парами.
2. Бактериологический метод
Выделение чистой культуры проводится в анаэробных или микроаэрофильных условиях. Посев проводится на плотную или жидкую среду КАБ, на тиогликолевые среды с гемином и витамином К. Учитывают культуральные, морфологические и тинкториальные свойства (см. выше). Производят пересев из подозрительных колоний на плотную среду КАБ для выделения чистой культуры. Идентифицируют по биохимическим свойствам, используя специальные тест-системы. Определяют чувствительность к антибиотикам.
Специфическая профилактика и лечение не разработаны.

Статья просмотрена: 4142 раза
Заболевание пародонта занимает одно из первых мест по частоте и распространенности среди стоматологических заболеваний. По данным ВОЗ, основанным по статистике 53 стран мира, в различных возрастных группах заболеваемость гингивитом и пародонтитом достигает 80-100% [1].
Современная отечественная классификация, принятая на заседании Президиума секции пародонтологии Стоматологической Ассоциации России (СТАР) в 2001 г., дает следующие определения и характеристики заболеваний пародонта:
- гингивит-воспаление десны - обусловленное неблагоприятным воздействием местных и общих факторов, которое протекает без нарушения целостности зубодесневого прикрепления и проявления деструктивных изменений в других отделах пародонта.
Формы: катаральный, язвенный, гипертрофический.
Течение: острое, хроническое.
Фазы процесса: обострение, ремиссия.
Распространенность процесса: локализованный (очаговый), генерализованный.
- пародонтит - воспаление тканей пародонта, характеризующееся деструкцией связочного аппарата периодонта и альвеолярной кости.
Течение: хроническое, агрессивное.
Фазы процесса: обострение (абсцедирование), ремиссия.
Степень тяжести определяется по клинико-рентгенологической картине. Основным ее критерием является степень деструкции костной ткани альвеолярного отростка (на практике она определяется по глубине пародонтальных карманов (ПК) в миллиметрах).
Степень тяжести: легкая (ПК не более 4 мм), средняя (ПК 4-6мм), тяжелая (ПК более 6 мм).
Распространенность процесса: локализованный (очаговый), генерализованный.
- пародонтоз - дистрофический процесс, распространяющийся на все структуры пародонта. Его отличительной чертой является отсутствие пародонтальных карманов и воспалительных явлений в десневом крае.
Степень тяжести: легкая, средняя, тяжелая (в зависимости от степени обнажения корней зубов-до 4 мм, 4-6 мм, более 6 мм).
Распространенность процесса: только генерализованный.
- синдромы, проявляющиеся в тканях пародонта - эта группа обозначалась ранее как идиопатические заболевания пародонта с прогрессирующим лизисом кости ( синдром Иценко-Кушинга, Элерса-анлоса, Шедиака-игаши, Дауна, болезнях крови и др.)
Пародонтомы- опухолеподобные процессы в пародонте (фиброматоз десен, пародонтальная киста, эпулис, эозофильная гранулема) [2].
Ранние проявления заболеваний пародонта воспалительного характера регистрируются в возрасте от 10-20 лет, 80% детей страдает гингивитом.
Эпидемиологические исследования населения различных регионов нашей страны свидетельствуют о высокой распространенности воспалительных изменений пародонта в различных возрастных группах (80-100%), например, среди школьников Москвы в возрасте 10 лет гингивит выявлен у 69%, 12 лет - у 77%, 15 лет – у 87% обследованных. Пародонтит средней тяжести выявлен в возрасте 12 лет – у 3%, в 15 лет - у 12%, в 16 лет - у 18% обследованных [3]. При обследовании 4947 детей Риги и других городов Латвии в возрасте от 7 до 14 лет Г.И. Кадникова выявила гингивит. Распределение по нозологическим формам представлено на диаграмме [4].
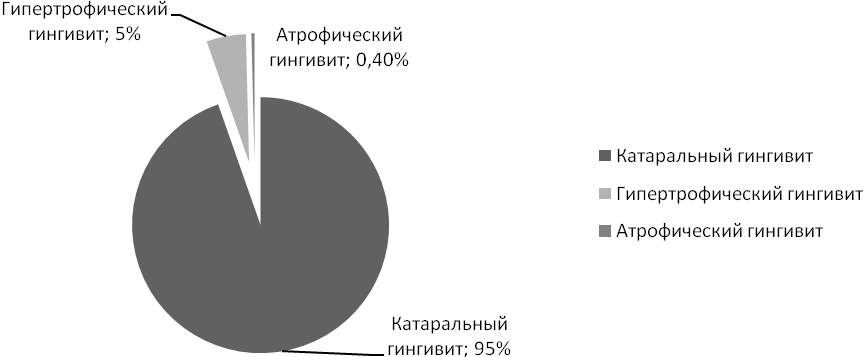
Диаграмма. Распределение гингивита по нозологическим формам
Выраженные деструктивные изменения в пародонте с вовлечением в процесс костной ткани наиболее часто выявляются у лиц старше 40 лет.
Многими исследователями показана полиэтиологическая природа заболеваний пародонта, причем большая роль в их развитии принадлежит воспалительным реакциям, спровоцированным микрофлорой ротовой полости. В связи с этим исследование микробиологических факторов патогенеза заболеваний пародонта следует признать одной из актуальных проблем современной стоматологии [1].
В состав постоянной микрофлоры полости рта входят представители нескольких групп микроорганизмов: бактерии, грибы, спирохеты, простейшие, вирусы.
Количество бактерий в полости рта по числу видов и содержанию в единицы материала конкурирует с составом желудочно-кишечного тракта. Бактерии в полости рта представлены разнообразными видами кокков, палочек и извитых форм. Содержание микроорганизмов в смешанной слюне составляет от 4 млн. до 5 млрд., в зубном налете – от 10 до 1000 млрд. в 1 г. сухого остатка. Видовой состав микрофлоры полости рта представлен аэробными и анаэробными микроорганизмами. Относительная концентрация аэробных аэробных и факультативных бактерий в 1мл. слюны составляет 10 7 , анаэробных – 10 8 [5].
Среди разных видов бактерий существует метаболизм, способствующий тому, что микроорганизмы на поверхности зуба образуют многокомпонентную биопленку (Рис.1) [6].

Рис. 1. Метабиоз бактерий поддесневого участка
Мюллер указал на то, что огромное значение для колонизации микробного пейзажа поддесневого пространства имеют синергизм и антогонизм между пародонтальными патогенами и другими бактериями полости рта. Микрофлора начинает обладать особыми патогенными свойствами, когда действует в ассоциациях. Большинство инфекционных процессов, возникающих в челюстно-лицевой области, носят эндогенный характер. Сам факт возникновения эндогенных инфекций отражает нарушение эволюционно сложившегося баланса между организмом и его микрофлорой, с одной стороны, и нарушением равновесия внутри микробных ассоциаций, с другой.
Т.к. большинство бактерий во всех природных экосистемах существуют в биопленках, сообщества микрооранизмов отличаются особым характером взаимодействия. В частности, они могут быть особо устойчивы к защитной реакции макроорганизма, резистентны к антибиотикам и выносливы в стрессовых для микроорганизмов ситуациях- повышение температуры, кислотности, обезвоживания. Неспорообразующие анаэробы зубодесневых карманов отличаются полиморфизмом, обладаютразличной степенью ферментативной активности. Факторами их патогенности являются: способность к колонизации, наличие капсулы, инактивирующих ферментов, инвазивность, токсигенность, способность к длительному выживанию в организме. Эти факторы способствуют, с одной стороны, проникновению в зараженный организм, а с другой стороны, противодействуют его защитным реакциям [7] .
Анаэробные инфекции развиваются в некротизированной ткани в условиях нарушения кровоснабжения, а также при снижении окислительно-восстановительного потенциала, возникающего вследствие жизнидеятельности аэробов и факультативных анаэробов [8] .
Опираясь на данные проведенных исследований появились основания к использованию на практике противомикробных препаратов местного и общего назначения. Например, препараты группы детергенты: этоний, хлоргексидина биглюконат, роккал, декаметоксин. Они устойчивы в водных растворах, обладают низким поверхностным натяжением. Вследствие денатурации белковых фракций бактерий они оказывают антисептическое, бактерицидное и фунгицидное действие даже на антибиотикорезестентные штаммы микроорганизмов [9].
Биглюконат хлоргексидина (ХГБ) - используют 0,05% раствор, оказывает быстрое и сильное антибактериальное действие в отношении большинства (до 99%) грамположительных и грамотрицательных аэробов и анаэробов, в т.ч. спирохет, спороцидное в отношении спор бактерий (только при высокой температуре), противогрибковое (фунгицидное), в т.ч. в отношении C . albicans , противопротозойное в отношении трихомонад, прочно связывается с поверхностными слоями слизистой оболочкой, поверхностью зубов, антисептический эффект сохраняется в течении 12 часов, не вызывает развития устойчивых штаммов микроорганизмов; сохраняет активность в присутствии крови, физиологических жидкостей и органических жидкостей [10]. Также применяют группу галоидов (хлорамин Б, йодинол, хлорид йода), кислоты и щелочи (натрия тетраборат, натрия гидрокарбонат), производные хиноксалина (диоксидин), производные фторхинолона (пефлоксацин, офлоксацин, ципрофлоксацин, норфлоксацин).
По мере развития воспаления в пародонте происходят глубокие расстройства механизмов регуляции и снижение компенсаторно-приспособительных возможностей системы микроциркуляции. Вслед за сосудистой реакцией активизируется неспецифическая защита: система комплемента и фагоцитоз; в зоне повреждения увеличивается количество нейтрофилов и эозинофилов. Однако возбудители инфекционного воспаления противодействуют защитным механизмам организма хозяина. Происходят разнообразные мутации, чтобы избежать фагоцитоза. Все эти эффекты затягивают течение воспаления, способствует его хронизации и не позволяют уничтожить флогогенный агент. На повреждающее действие микробов организм также отвечает комплексом реакций защиты и поддержания гомеостаза. Иммунная защита в тканях пародонта не ограничивается врожденными механизмами иммунитета, а переходит к адаптивным иммунным реакциями с участием антител и экспансией клонально-специфических лимфоцитов. Однако именно система иммунобиологического надзора является одним из ключевых звеньев патогенеза хронического воспалительного процесса в пародонте [2]. Обладая свойствами антигенов, микроорганизмы при участии местных антигенов, представляющих макрофагальные клетки полости рта, сенсебилизируют лимфоциты MALT -системы. Клоны, специфичные по отношению к антигенам микробов, экспансируют и осуществляют в полости рта иммунный ответ против возбудителей. Но усиленная альтерация пародонта ведет к образованию тканевых неоантигенов, образуются иммунные комплексы. В свою очередь, эти иммунные комплексы и неоантигенов, образуются иммунные комплексы и неоантигены также становятся объектами иммунной атаки. Все это приводит к присоединению аутоаллергического компонента к антимикробному иммунному ответу и способствует самоповреждению тканей пародонта. Иммунологические исследования в пародонтологии напрямую связаны с микробиологическими, а точнее с невозможностью во многих случаях объяснить разнообразие ответной реакции тканей пародонта на действие идентичных микроорганизмов или их скоплений [9]. По мере развития заболевания, иммунная система и ее эффекторы оказывают на тканевые структуры все более повреждающее действие, эффекты которого, в том числе разрушение зубодесневого соединения и периодонтальной связки, резорбция альвеолярной кости, становятся основой грубых функциональных нарушений. В связи с этим ключевую роль в развитии типичных клинических проявлений пародонтита играют разрушение зубодесневого соединения и формирование пародонтальных карманов. Это сопровождается образованием в их стенках очагов гранулематоза, деструкцией круговой связки и проникновением воспалительного инфильтрата вглубь с развитием и нарастанием резорбтивных изменений в альвеолярной кости [2].
Генерализованный пародонтит сопровождается ослаблением клеточного звена иммунитета: уменьшается число Т-лимфоцитов и угнетается их функциональная активность. Нарушается хемотаксис гранулоцитов, ослабевает их способность к фагоцитозу. Гранулоциты при генерализованном пародонтите тяжелой степени имеют низкую активность ферментов гликолиза и тканевого дыхания. Способность фибробластов к пролиферации при прогрессировании пародонтита снижается, волокнистый компонент соединительной ткани образуется ими в недостаточном количестве. Эти изменения расцениваются как недостаточность репаративного компонента воспалительной реакции.

Статья просмотрена: 4142 раза
Заболевание пародонта занимает одно из первых мест по частоте и распространенности среди стоматологических заболеваний. По данным ВОЗ, основанным по статистике 53 стран мира, в различных возрастных группах заболеваемость гингивитом и пародонтитом достигает 80-100% [1].
Современная отечественная классификация, принятая на заседании Президиума секции пародонтологии Стоматологической Ассоциации России (СТАР) в 2001 г., дает следующие определения и характеристики заболеваний пародонта:
- гингивит-воспаление десны - обусловленное неблагоприятным воздействием местных и общих факторов, которое протекает без нарушения целостности зубодесневого прикрепления и проявления деструктивных изменений в других отделах пародонта.
Формы: катаральный, язвенный, гипертрофический.
Течение: острое, хроническое.
Фазы процесса: обострение, ремиссия.
Распространенность процесса: локализованный (очаговый), генерализованный.
- пародонтит - воспаление тканей пародонта, характеризующееся деструкцией связочного аппарата периодонта и альвеолярной кости.
Течение: хроническое, агрессивное.
Фазы процесса: обострение (абсцедирование), ремиссия.
Степень тяжести определяется по клинико-рентгенологической картине. Основным ее критерием является степень деструкции костной ткани альвеолярного отростка (на практике она определяется по глубине пародонтальных карманов (ПК) в миллиметрах).
Степень тяжести: легкая (ПК не более 4 мм), средняя (ПК 4-6мм), тяжелая (ПК более 6 мм).
Распространенность процесса: локализованный (очаговый), генерализованный.
- пародонтоз - дистрофический процесс, распространяющийся на все структуры пародонта. Его отличительной чертой является отсутствие пародонтальных карманов и воспалительных явлений в десневом крае.
Степень тяжести: легкая, средняя, тяжелая (в зависимости от степени обнажения корней зубов-до 4 мм, 4-6 мм, более 6 мм).
Распространенность процесса: только генерализованный.
- синдромы, проявляющиеся в тканях пародонта - эта группа обозначалась ранее как идиопатические заболевания пародонта с прогрессирующим лизисом кости ( синдром Иценко-Кушинга, Элерса-анлоса, Шедиака-игаши, Дауна, болезнях крови и др.)
Пародонтомы- опухолеподобные процессы в пародонте (фиброматоз десен, пародонтальная киста, эпулис, эозофильная гранулема) [2].
Ранние проявления заболеваний пародонта воспалительного характера регистрируются в возрасте от 10-20 лет, 80% детей страдает гингивитом.
Эпидемиологические исследования населения различных регионов нашей страны свидетельствуют о высокой распространенности воспалительных изменений пародонта в различных возрастных группах (80-100%), например, среди школьников Москвы в возрасте 10 лет гингивит выявлен у 69%, 12 лет - у 77%, 15 лет – у 87% обследованных. Пародонтит средней тяжести выявлен в возрасте 12 лет – у 3%, в 15 лет - у 12%, в 16 лет - у 18% обследованных [3]. При обследовании 4947 детей Риги и других городов Латвии в возрасте от 7 до 14 лет Г.И. Кадникова выявила гингивит. Распределение по нозологическим формам представлено на диаграмме [4].
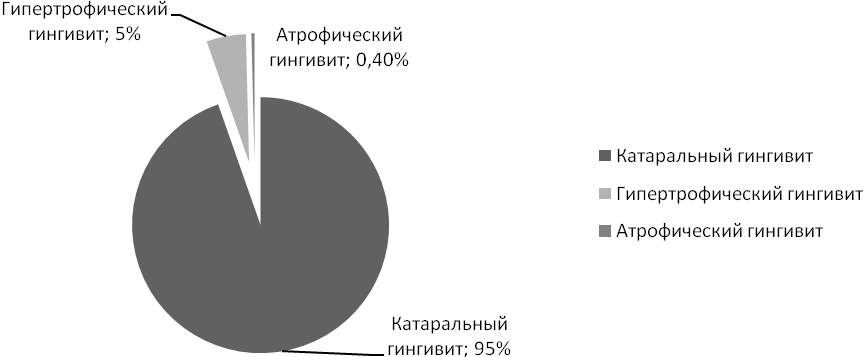
Диаграмма. Распределение гингивита по нозологическим формам
Выраженные деструктивные изменения в пародонте с вовлечением в процесс костной ткани наиболее часто выявляются у лиц старше 40 лет.
Многими исследователями показана полиэтиологическая природа заболеваний пародонта, причем большая роль в их развитии принадлежит воспалительным реакциям, спровоцированным микрофлорой ротовой полости. В связи с этим исследование микробиологических факторов патогенеза заболеваний пародонта следует признать одной из актуальных проблем современной стоматологии [1].
В состав постоянной микрофлоры полости рта входят представители нескольких групп микроорганизмов: бактерии, грибы, спирохеты, простейшие, вирусы.
Количество бактерий в полости рта по числу видов и содержанию в единицы материала конкурирует с составом желудочно-кишечного тракта. Бактерии в полости рта представлены разнообразными видами кокков, палочек и извитых форм. Содержание микроорганизмов в смешанной слюне составляет от 4 млн. до 5 млрд., в зубном налете – от 10 до 1000 млрд. в 1 г. сухого остатка. Видовой состав микрофлоры полости рта представлен аэробными и анаэробными микроорганизмами. Относительная концентрация аэробных аэробных и факультативных бактерий в 1мл. слюны составляет 10 7 , анаэробных – 10 8 [5].
Среди разных видов бактерий существует метаболизм, способствующий тому, что микроорганизмы на поверхности зуба образуют многокомпонентную биопленку (Рис.1) [6].

Рис. 1. Метабиоз бактерий поддесневого участка
Мюллер указал на то, что огромное значение для колонизации микробного пейзажа поддесневого пространства имеют синергизм и антогонизм между пародонтальными патогенами и другими бактериями полости рта. Микрофлора начинает обладать особыми патогенными свойствами, когда действует в ассоциациях. Большинство инфекционных процессов, возникающих в челюстно-лицевой области, носят эндогенный характер. Сам факт возникновения эндогенных инфекций отражает нарушение эволюционно сложившегося баланса между организмом и его микрофлорой, с одной стороны, и нарушением равновесия внутри микробных ассоциаций, с другой.
Т.к. большинство бактерий во всех природных экосистемах существуют в биопленках, сообщества микрооранизмов отличаются особым характером взаимодействия. В частности, они могут быть особо устойчивы к защитной реакции макроорганизма, резистентны к антибиотикам и выносливы в стрессовых для микроорганизмов ситуациях- повышение температуры, кислотности, обезвоживания. Неспорообразующие анаэробы зубодесневых карманов отличаются полиморфизмом, обладаютразличной степенью ферментативной активности. Факторами их патогенности являются: способность к колонизации, наличие капсулы, инактивирующих ферментов, инвазивность, токсигенность, способность к длительному выживанию в организме. Эти факторы способствуют, с одной стороны, проникновению в зараженный организм, а с другой стороны, противодействуют его защитным реакциям [7] .
Анаэробные инфекции развиваются в некротизированной ткани в условиях нарушения кровоснабжения, а также при снижении окислительно-восстановительного потенциала, возникающего вследствие жизнидеятельности аэробов и факультативных анаэробов [8] .
Опираясь на данные проведенных исследований появились основания к использованию на практике противомикробных препаратов местного и общего назначения. Например, препараты группы детергенты: этоний, хлоргексидина биглюконат, роккал, декаметоксин. Они устойчивы в водных растворах, обладают низким поверхностным натяжением. Вследствие денатурации белковых фракций бактерий они оказывают антисептическое, бактерицидное и фунгицидное действие даже на антибиотикорезестентные штаммы микроорганизмов [9].
Биглюконат хлоргексидина (ХГБ) - используют 0,05% раствор, оказывает быстрое и сильное антибактериальное действие в отношении большинства (до 99%) грамположительных и грамотрицательных аэробов и анаэробов, в т.ч. спирохет, спороцидное в отношении спор бактерий (только при высокой температуре), противогрибковое (фунгицидное), в т.ч. в отношении C . albicans , противопротозойное в отношении трихомонад, прочно связывается с поверхностными слоями слизистой оболочкой, поверхностью зубов, антисептический эффект сохраняется в течении 12 часов, не вызывает развития устойчивых штаммов микроорганизмов; сохраняет активность в присутствии крови, физиологических жидкостей и органических жидкостей [10]. Также применяют группу галоидов (хлорамин Б, йодинол, хлорид йода), кислоты и щелочи (натрия тетраборат, натрия гидрокарбонат), производные хиноксалина (диоксидин), производные фторхинолона (пефлоксацин, офлоксацин, ципрофлоксацин, норфлоксацин).
По мере развития воспаления в пародонте происходят глубокие расстройства механизмов регуляции и снижение компенсаторно-приспособительных возможностей системы микроциркуляции. Вслед за сосудистой реакцией активизируется неспецифическая защита: система комплемента и фагоцитоз; в зоне повреждения увеличивается количество нейтрофилов и эозинофилов. Однако возбудители инфекционного воспаления противодействуют защитным механизмам организма хозяина. Происходят разнообразные мутации, чтобы избежать фагоцитоза. Все эти эффекты затягивают течение воспаления, способствует его хронизации и не позволяют уничтожить флогогенный агент. На повреждающее действие микробов организм также отвечает комплексом реакций защиты и поддержания гомеостаза. Иммунная защита в тканях пародонта не ограничивается врожденными механизмами иммунитета, а переходит к адаптивным иммунным реакциями с участием антител и экспансией клонально-специфических лимфоцитов. Однако именно система иммунобиологического надзора является одним из ключевых звеньев патогенеза хронического воспалительного процесса в пародонте [2]. Обладая свойствами антигенов, микроорганизмы при участии местных антигенов, представляющих макрофагальные клетки полости рта, сенсебилизируют лимфоциты MALT -системы. Клоны, специфичные по отношению к антигенам микробов, экспансируют и осуществляют в полости рта иммунный ответ против возбудителей. Но усиленная альтерация пародонта ведет к образованию тканевых неоантигенов, образуются иммунные комплексы. В свою очередь, эти иммунные комплексы и неоантигенов, образуются иммунные комплексы и неоантигены также становятся объектами иммунной атаки. Все это приводит к присоединению аутоаллергического компонента к антимикробному иммунному ответу и способствует самоповреждению тканей пародонта. Иммунологические исследования в пародонтологии напрямую связаны с микробиологическими, а точнее с невозможностью во многих случаях объяснить разнообразие ответной реакции тканей пародонта на действие идентичных микроорганизмов или их скоплений [9]. По мере развития заболевания, иммунная система и ее эффекторы оказывают на тканевые структуры все более повреждающее действие, эффекты которого, в том числе разрушение зубодесневого соединения и периодонтальной связки, резорбция альвеолярной кости, становятся основой грубых функциональных нарушений. В связи с этим ключевую роль в развитии типичных клинических проявлений пародонтита играют разрушение зубодесневого соединения и формирование пародонтальных карманов. Это сопровождается образованием в их стенках очагов гранулематоза, деструкцией круговой связки и проникновением воспалительного инфильтрата вглубь с развитием и нарастанием резорбтивных изменений в альвеолярной кости [2].
Генерализованный пародонтит сопровождается ослаблением клеточного звена иммунитета: уменьшается число Т-лимфоцитов и угнетается их функциональная активность. Нарушается хемотаксис гранулоцитов, ослабевает их способность к фагоцитозу. Гранулоциты при генерализованном пародонтите тяжелой степени имеют низкую активность ферментов гликолиза и тканевого дыхания. Способность фибробластов к пролиферации при прогрессировании пародонтита снижается, волокнистый компонент соединительной ткани образуется ими в недостаточном количестве. Эти изменения расцениваются как недостаточность репаративного компонента воспалительной реакции.
Читайте также:


