Выявление днк возбудителей бактериальных инфекций не может свидетельствовать об их жизнеспособности
Место ПЦР в диагностике урогенитальных инфекций.
В настоящее время в клинической картине многих заболеваний, передающихся половым путем, отмечаются малосимптомность, отсутствие характерных проявлений, наклонность к латентному течению. В связи с этим все большее значение приобретают лабораторные методы их диагностики. Последнее десятилетие характеризуется стремительным внедрением в практическое здравоохранение новых молекулярно- биологических методов исследования на фоне постоянного совершенствования уже ставших традиционными (микробиологические, серологические, иммунохимические). Многие методы требуют высокой квалификации персонала, значительных материальных затрат. В связи с этим в последние годы имеет место благоприятная тенденция к созданию крупных специализированных диагностических центров, предлагающих дерматовенерологической службе весь комплекс современных лабораторных методик на достаточно высоком уровне и в сжатые сроки. Поэтому возрастает ответственность клиницистов при назначении того или иного лабораторного исследования и его интерпретации. В настоящей работе сделана попытка определить место молекулярно-биологических методов исследования (полимеразная цепная реакция) в клинико-лабораторном алгоритме диагностики инфекций, передающихся половым путем.
ХЛАМИДИОЗ
Хламидийной инфекции свойственны отсутствие патогномоничных клинических симптомов, наклонность к затяжному, рецидивирующему течению, cочетание с другими инфекционными агентами (микоплазмы, уреаплазмы), поэтому установление этиологического диагноза без лабораторного подтверждения представляется невозможным.
Цитоскопический метод диагностики основан на выявлении цитоплазматических клеток-включений Провачека, широко доступен, но эффективен лишь при острых формах заболевания. При урогенитальном хламидиозе частота их обнаружения не превышает 10-12%.
Метод прямой иммунофлюоресценции (ПИФ) прямое выявление как корпускулярных, так и растворимых антигенов хламидий при люминесцентной микроскопии. Метод является скрининговым и основными показаниями к его применению являются острая, хроническая формы заболевания, необходимость установления хламидийной этиологии инфекционного процесса урогенитального тракта. Его чувствительность и специфичность при использовании моноклональных антител, содержащихся в качественных импортных наборах, могут составлять 60% и 80% соответственно. Методика требует ее исполнения опытным лабораторным работником, высококвалифицированная экспертная оценка методом ПИФ редко бывает доступной, в частности, оценка эффективности лечения. ПИФ недостаточно чувствительна для определения малых количеств элементарных телец – возможны ложноотрицательные результаты.
Методы иммуноферментного анализа (ИФА) основаны на обнаружении растворимого антигена хламидий в цервикальных и уретральных мазках с детекцией результатов исследования на ИФА-анализаторе. Чувствительность и специфичность при использовании качественных импортных тест-систем приближается к 65-70% и 80-90% соответственно.
Показания к применению такие же, как и для метода ПИФ
На основании изложенного можно предложить клиницистам лабораторный диагностический алгоритм хламидийной инфекции:
- первоначально применение ПЦР с целью выявления ДНК C.trachomatis и определение титра антител классов IgМ, IgA, IgG к C.trachomatis (для характеристики стадии заболевания);
- в ходе лечения возможно повторное определение титра антител классов IgA, IgG с целью мониторинга эффективности лечения;
- по окончания курса лечения оценка его эффективности культуральным методом или спустя 4 недели (полное обновление эпителия мочеполовых путей) с применением ПЦР;
- через 3-6 месяцев после курса лечения определение титров антител IgA, IgG в качестве отдаленной оценки его эффективности.
ГОНОРЕЯ
МИКОПЛАЗМОЗ И УРЕАПЛАЗМОЗ
Несмотря на внедрение высокочувствительных генодиагностических технологий остается открытым вопрос о патогенности микоплазм, поскольку отсуствует четкая корреляция между их титром и выраженностью патологии урогенитального тракта. При диагностике микоуреаплазмоза не следует опираться исключительно на результаты ПЦР- исследования. В данном случае предпочтительным сочетанием методов являются микробиологический (посев в селективную среду и в среду с антибиотиками) и ПЦР.
Микробиологический метод позволяет провести детекцию микоплазм в количествах, достаточных для развития патологии, а также назначить лечение с учетом антибиотикорезистентности данного клинического изолята. В свою очередь метод ПЦР позволяет определять наличие незначительного количества микоплазм, которые в дальнейшем, на фоне подавленного иммунитета, могут вызывать те или иные клинические проявления.
В то же время метод ПЦР должен является скрининговым при обследовании на уреа микоплазмы беременных женщин. На фоне ослабленного иммунитета даже их носительство в ходе беременности может привести к неблагоприятному ее течению и патологии плода. Таким образом, сочетанное применение микробиологического метода и ПЦР позволяет при диагностике микоуреаплазмоза получить наиболее полную информацию:
- обнаружение микоплазм в количествах, достаточных для развития патологического
процесса;
- определение антибиотикорезистентности микоплазм ;
- обнаружение микоплазм в минимальном количестве, имеющем клиническое значение
для прогнозирования беременности.
ГЕРПЕС
При заборе биопроб на ПЦР-анализ следует учитывать, что наиболее информативным будет являться исследование мочи, слюны, в меньшей степени уретрального и цервикального мазков. Качественное определение ДНК вируса герпеса I-II типа наиболее эффективно при латентной форме заболевания, отсутствии выраженных клинических проявлений, микст-инфекции. ПЦР-исследованию на герпес в обязательном порядке должны подвергаться беременные, поскольку персистирование вируса герпеса в половых путях даже у серопозитивных лиц резко повышает риск инфицирования плода. При проведении противовирусной терапии определение титров антител класса IgG к герпетическому антигену методом ИФА является показателем эффективности лечения.
ГАРДНЕРЕЛЕЗ
Gardnerella vaginalis является наиболее значимым этиопатологическим компонентом бактериального вагиноза. В то же время наличие G. vaginalis не всегда сопровождается клинической картиной вагиноза. Частота ее обнаружения у здоровых женщин составляет от 12% до 47% в титре до 106 КОЕ/ мл вагинального отделяемого, и только при определенных условиях, приводящих к изменению соотношения анаэробных и аэробных бактерий, обнаружение G. vaginalis свидетельствует о развитии вагиноза. Он характеризуется резким снижением титра лактобацилл и значительным увеличением количества анаэробных микроорганизмов, концентрация которых достигает 109-1011 КОЕ/ мл вагинального отделяемого. В настоящее время основным методом диагностики бактериального вагиноза является культуральный.
Качественная детекция G. vaginalis методом ПЦР, применяемая во многих коммерческих лабораториях, является малоинформативным исследованием, поскольку ее выявление должно носить количественный или полуколичественный характер.
Не является также клинически значимым факт единичиного выявления G. Vaginalis методом ПЦР в уретральном отделяемом у мужчин. Это может свидетельствовать лишь о наличии гарднерелл у полового партнера обследованного. В настоящее время в ряде лабораторий ведется интенсивная работа по созданию ПЦР- тест-систем с применением высокоспецифичных праймеров, позволяющих определять концентрацию G. vaginalis в клиническом материале.
ЗАКЛЮЧЕНИЕ
Период экстенсивного применения качественной детекции ДНК инфекционных агентов, в целом, определил место ПЦР в структуре клинико-лабораторного диагноза ИППП. Несомненно преимущество ПЦР в диагностике таких латентных инфекций, как хламидиоз, герпес, позволяющее исключить применение дорогостоящих и трудоемких культуральных методов.
Сочетанное применение микробиологического метода и ПЦР позволяет выявлять микоплазмы в минимальном количестве, достаточном для развития патологического процесса с определением их антибиотикорезистентности.
Применение ПЦР необходимо при выявлении трихомонад и гонококков в случае латентного течения заболевания, наличия микст-инфекции, проведения контроля эффективности антибактериального лечения (наряду с культуральным методом).
При диагностике бактериального вагиноза ПЦР не имеет в настоящий момент преимуществ перед культуральными методами.
Применение ПЦР при диагностике всех инфекций, передаваемых половым путем, позволяет исключить субъективизм микроскопического исследования.
Хламидийная инфекция вызывается Chlamydia trachomatis – грамотрицательной бактерией, принадлежащей семейству Chlamydiaceae. Вид Chlamydia trachomatis включает различные серовары, которые вызывают отдельные нозологические формы заболеваний. Сероваровы A, B, C вызывают трахому, L1, L2, L3 – венерическую лимфогранулему. Наибольшее распространение в странах Европы, Южной и Северной Америки и в России получили серовары D–K, которые передаются при половых контактах и вызывают урогенитальную хламидийную инфекцию (УХИ). Возможна перинатальная передача с развитием у новорожденных конъюнктивита или пневмонии. C.trachomatis имеет уникальный среди других возбудителей ИППП жизненный цикл. Инфицирование эпителиальных клеток происходит метаболически неактивными формами хламидий – элементарными тельцами (ЭТ). Внутри клеток ЭТ трансформирутся в ретикулярные тельца (РТ) – метаболически активные, делящиеся формы. Накопление внутри эпителиальных клеток новых генераций РТ и их параллельная трансформация обратно в ЭТ истощает ресурсы клеток хозяина, приводя их к гибели, высвобождению ЭТ и новому циклу инфицирования. Неосложненная хламидийная инфекция протекает у мужчин чаще всего в форме уретрита, у женщин – в форме слизисто-гнойного цервицита. Симптомы и проявления УХИ неспецифичны, для постановки диагноза УХИ необходимы лабораторные исследования для выявления возбудителя или его маркеров. Значительная часть случаев УХИ – от 40 до 60% протекает в бессимптомной или малосимптомной форме и проявляется уже на стадии осложнений. Основными осложнениями УХИ являются: эпидидимит, эндометрит, сальпингит, сальпингоофорит, внематочная беременность, трубное бесплодие, болезнь Рейтера.
Показания к назначению лабораторных исследований. У мужчин: наличие симптомов и клинических проявлений уретрита, эпидидимита или эпидидимоорхита; у лиц, практикующих аногенитальные контакты – проктита; при физикальном осмотре – наличие выделений из уретры.
У женщин: наличие симптомов воспалительного процесса в нижних отделах урогенитального тракта и органах малого таза, боли в низу живота, патологические выделения из влагалища; наличие слизистых или слизисто-гнойных выделений из цервикального канала, нарушение менструального цикла, болезненность при половых контактах; подготовка к хирургическому вмешательству на органах малого таза; подготовка к беременности, отягощенный акушерско-гинекологический анамнез, связанный с инфекционной патологией.
У лиц обоего пола без симптомов и признаков воспалительного процесса урогенитального тракта: наличие перечисленных выше симптомов и признаков или установленная УХИ у полового партнера; в возрастной группе до 25 лет – многочисленные половые партнеры или половые контакты с новым половым партнером без барьерной контрацепции.
Дифференциальная диагностика. Гонорея, урогенитальный трихомониаз, инфекция, вызванная M.genitalium.
Этиологическая диагностика включает визуальное обнаружение C.trachomatis, выделение культуры C.trachomatis, выявление АГ, ДНК и РНК C.trachomatis и АТ к микроорганизму.
Материал для исследований
- Мазки/соскобы со слизистых оболочек цервикального канала и уретры женщин – микроскопические исследования, культуральные исследования, выявление АГ, обнаружение ДНК, РНК;
- мазки/соскобы со слизистой влагалища, мазки (соскобы) со слизистой прямой кишки – выявление ДНК, РНК;
- мазки/соскобы с конъюнктивы глаз – культуральные исследования, выявление ДНК;
- моча (у мужчин) – выявление ДНК;
- сыворотка крови – выявление АТ.
Сравнительная характеристика методов лабораторной диагностики. Для визуального выявления C.trachomatis возможно применение световой или люминесцентной микроскопии. При применении световой микроскопии используется фиксированный препарат биологического материала, окрашенный по Романовскому- Гимзе, в котором выявляют измененные клетки цилиндрического эпителия, содержащие ЭТ и РТ C.trachomatis, получившие название телец ГальберштедтераПровачека. Диагностическая чувствительность исследования не превышает 10%. Распространенным приемом выявления хламидий является определение АГ микроорганизма методом ПИФ. С помощью люминесцентной микроскопии в препарате, обработанном флуоресцентно-меченными АТ к хламидиям, по характерному свечению обнаруживаются ЭТ C.trachomatis. Микроскопические исследования, в первую очередь ПИФ, достаточно просты в исполнении и не требует дорогостоящего оборудования, однако весьма требовательны к качеству полученного биологического материала, технике нанесения препарата на стекло и специфичности используемых АТ. Материал для выполнения ПИФ должен содержать достаточное количество клеток цилиндрического эпителия, его получают из цервикального канала (по показаниям – из уретры) и у мужчин из передней уретры. Для интерпретации результата необходимо наличие в препарате не менее 5–10 клеток цилиндрического эпителия (отражает качество получения биоматериала) в поле зрения и не менее 10 флуоресцирующих ЭТ. Диагностическая чувствительность метода ПИФ варьирует в широких пределах – от 10 до 65%. Максимальная чувствительность и специфичность метода отмечена у пациентов с клиническими проявлениями инфекции и высокой бактериальной нагрузкой, минимальная – при бессимптомных или малосимптомных формах.
Для выявления АГ C.trachomatis за рубежом был разработан ряд тестов на основе ИФА. Диагностическая чувствительность выявления АГ C.trachomatis находится в пределах 55–78%. Указанные тесты получили широкое распространение в зарубежной лабораторной практике, однако в РФ не применяются.
Для выявления ДНК C.trachomatis в РФ используют преимущественно ПЦР с различными вариантами детекции продуктов реакции и метод выявления РНК C.trachomatis на основе НАСБА. Диагностическая чувствительность метода ПЦР для диагностики УХИ находится в пределах от 90 до 98%, специфичность достигает 96–98%. Диагностическая чувствительность метода НАСБА достигает 98%, диагностическая специфичность – до 100%.
Показания к применению различных лабораторных исследований. Микроскопическое исследование препаратов с окраской по Романовскому-Гимзе в настоящее время не используется и не рекомендуется для диагностики УХИ. В то же время, всем пациентам с симптомами и клиническими проявлениями урогенитальной инфекции показано микроскопическое исследование с окраской по Граму для установления лабораторных признаков воспаления (повышенное содержание ПМЯЛ).
Применение метода ПИФ целесообразно в качестве метода быстрой диагностики при наличии у пациентов выраженных проявлений инфекционно-воспалительного процесса в урогенитальном тракте при условии соблюдения всех требований получения биологического материала. Метод не подходит для скрининга, диагностики хронических форм хламидийной инфекции, контроля лечения и исследования образцов мочи и слизистой влагалища, прямой кишки, ротоглотки.
С учетом того, что для проведения культурального исследования необходима технология ведения эукариотических клеточных линий и соответствующие для этого лабораторные условия, то применение метода в рутинной лабораторной практике ограничено. Метод в первую очередь имеет большое значение в научных исследованиях, когда требуется выделить живой возбудитель для его дальнейшего изучения.
Определение АТ к C.trachomatis может быть использовано для эпидемиологических исследований, с целью интегральной оценки доли лиц в популяции, контактировавшей с C.trachomatis. В клинической практике определение АТ показано при ретроспективном анализе возможной хламидийной этиологии при бесплодии, длительных хронических воспалительных процессах урогенитального тракта. Однако и в этом случае положительные результаты обнаружения АТ должны рассматриваться в контексте других клинических, анамнестических и лабораторных данных.
В настоящее время выявление ДНК методом ПЦР считаются основой лабораторной диагностики УХИ. Исследование показано и для контроля результатов лечения. При использовании метода ПЦР с учетом скорости элиминации ДНК C.trachomatis контроль лечения необходимо проводить не ранее 3–4 недель. РНК возбудителя является более ранним маркером ответа на терапию, поэтому с помощью метода НАСБА можно оценивать эффективность лечения через 1–2 недели после окончания курса.
Особенности интерпретация результатов лабораторных исследований. Результаты, полученные методом ПИФ, рекомендуется подтверждать с помощью культурального или молекулярно-биологических методов.
Положительные результаты культурального исследования не требуют дополнительного подтверждения и означают наличие инфекции. Отрицательный результат означает как отсутствие возбудителя, так и может свидетельствовать о неоптимальных условиях для его культивирования.
При обнаружении ДНК C.trachomatis у пациентов с клинической симптоматикой урогенитальной инфекции или наличии факторов, способствующих инфицированию, дополнительного исследования не требуется, диагноз урогенитальной инфекции считается установленным. У пациентов, у которых обнаружена ДНК C.trachomatis, но отсутствуют субъективные и объективные признаки инфекционно- воспалительного заболевания и факторы риска, для подтверждения диагноза рекомендуется провести исследование для выявления РНК C.trachomatis методом НАСБА. Наличие ДНК и РНК патогена является объективным лабораторным признаком инфекции.
При оценке результатов выявления АТ следует учитывать, что их наличие или отсутствие не отражает наличие или отсутствие инфекции в данный момент времени.
Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
Copyright ФБУН Центральный НИИ Эпидемиологии Роспотребнадзора, 1998 - 2020

! Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
Бюджетное учреждение Удмуртской Республики
С 18.08.14 по 22.08.14г. в серологический отдел для исследования поступило 1676 проб сыворотки крови, из них происследовано 1412 проб, в том числе на бруцеллез – 949 проб, на лептоспироз – 172 пробы, на хламидиоз – 11 проб, на листериоз – 11 проб. Из 172 проб, происследованных на лептоспироз, выявлено 3 пробы, положительно реагирующих в РМА животных. Также поступило 269 проб мочи на лептоспироз, лептоспиры в моче не обнаружены.
Во всех случаях, при выявлении положительно реагирующих животных даны рекомендации для постановки окончательного диагноза согласно действующих нормативных документов.

Болезнь Ньюкасла – острое инфекционное вирусное заболевание птиц – главным образом, куриных, характеризующееся пневмонией, энцефалитом и множественными точечными геморрагическими поражениями внутренних органов.
Возбудитель болезни Ньюкасла – РНК-содержащий вирус, относящийся к роду парамиксовирусов семейства Paramyxoviridae.
Источник возбудителя инфекции – больные птицы, а также дикие птицы и человек. Болезнь Ньюкасла распространяется аэрогенно, заражение происходит через дыхательную систему, слизистые оболочки глаз, гортани и желудочно-кишечного тракта.
Инкубационный период 2-7 суток, реже 9-12. Течение болезни молниеносное, острое, подострое и хроническое. При молниеносном течении птица погибает внезапно без выраженных клинических признаков. При остром течении аппетит у птиц резко падает, температура повышается до 44 º С. Появляется угнетение, малоподвижность, симптомы поражения дыхательной и нервной систем, конъюктивит. В ротовой и носовой полостях скапливается много слизи. Птицы кашляют, чихают, издают каркающие звуки и дышат с открытым клювом. Частый признак – понос, иногда с примесью крови. При поражении центральной нервной системы походка становится шаткой, птицы совершают круговые движения, появляются параличи шеи, крыльев, ног. При подостром течении и хроническом течении наблюдают повышенную возбудимость птиц, судороги, парезы и параличи конечностей, дрожание головы, перекручивание шеи, сильное истощение.
Диагноз устанавливают на основании эпизоотологических, клинических и патологоанатомических данных и результатов лабораторного исследования, проводимого УВДЦ и включающего: обнаружение антител в сыворотке крови методом РТГА, а также исследование патологического материала заражением куриных эмбрионов.
В сезон уборки плодов и овощей становится актуальной проблема определения содержания нитратов в них. Нитраты – это соли азотной кислоты. Они имеются во всех овощах и фруктах, но в разных количествах.
Нитраты – довольно опасные химические вещества, но без них никак нельзя обойтись: они входят в состав многих минеральных удобрений, без применения которых невозможно достичь высокого урожая и ускоренного созревания овощей на полях. Иногда вносятся завышенные дозы нитратосодержащих удобрений и подкормок, что приводит к накоплению химических веществ в растениях. При использовании минеральных удобрений должна строго соблюдаться технология применения.
По допустимому содержанию нитратов плодоовощную продукцию можно условно разделить на четыре группы:
— с малым содержанием нитратов: до 300 мг/кг (лук репчатый, арбузы, дыни, фрукты, томаты);
— со средним содержанием нитратов: от 300 до 600 мг/кг (тепличные огурцы и томаты, морковь, капуста белокочанная);
— с высоким содержанием нитратов: от 600 до 1000 мг/кг (ранняя белокочанная капуста, лук перо);
— с очень высоким содержанием нитратов: выше 1000 мг/кг (листовые овощи, свекла столовая).
Нужно помнить, что в незрелых овощах и фруктах нитратов больше, чем в спелых.
Наша лаборатория проводит исследования плодов и овощей на содержание нитратов, тем самым контролируя поставляемую потребителям продукцию.

Парагемолитические вибрионы – условно патогенные микроорганизмы семейства Vibrionaceae, обитающие в соленых водоемах. V.parahaemolitycus выделяют из морской воды, свежей, охлажденной, мороженой, соленой, пряной, маринованной, сушеной, вяленой, копченой рыбы, креветок, мидий, устриц, омаров, крабов, икры. Максимальная зараженность рыб, моллюсков и других гидробионтов отмечена в августе. Вибрионов обнаруживают в вяленой, соленой, мороженой, размороженной, холодного копчения рыбе. Опасность заражения существует везде, где население использует в пищу продукты моря.
Острые кишечные заболевания, вызываемые V.parahaemolitycus относят к пищевым токсикоинфекциям. Основные источники инфекции – блюда из морских продуктов, приготовленные с нарушениями технологического процесса. Возбудитель синтезирует энтеротоксин , вызывающий энтерит. Клинические проявления наблюдают у 50% инфицированных лиц. Характерны сильные боли в животе, водянистая обильная диарея.
В бактериологический отдел из испытательного центра поступило 15 проб рыбы на наличие парагемолитического вибриона. Все пробы дали отрицательные результаты.

С 04.08.2014 г. по 18.08.2014 г. в отдел ветеринарно- санитарной экспертизы на испытания поступила 221 проба пищевой продукции, 125 проб смывов с производственных поверхностей перерабатывающих предприятий пищевой промышленности УР, 9 проб водопроводной питьевой воды. Проведены микробиологические испытания 71 пробы пищевой продукции, 105 проб смывов и 9 проб воды.
По результатам микробиологических испытаний пищевой продукции не соответствовали требованиям нормативных документов (НД):
— 11 проб пищевых продуктов (молоко сырое, мясные продукты) – по количеству мезофильных аэробных и факультативно – анаэробных микроорганизмов (КМАФАнМ);
— в 16 пробах пищевых продуктов (мясные продукты, молочные продукты) обнаружены бактерии группы кишечной палочки (БГКП).
В одной пробе воды обнаружены общие колиформные и термотолерантные колиформные бактерии. (ОКБ и ТКБ).

За 7 месяцев 2014 года в отдел ветеринарно-санитарной экспертизы на микробиологические исследования поступило 3800 проб пищевых продуктов и сырья. По результатам исследований в 262 пробах (7 %) было выявлено превышение по количеству мезофильных аэробных и факультативно – анаэробных микроорганизмов (КМАФАнМ).
КМАФАнМ – наиболее распространенный тест на микробную безопасность. Данный показатель применяется повсеместно для оценки качества продуктов, за исключением тех, в производстве которых используются специальные микробные культуры (например, кисломолочные продукты и т.п.).
Величина показателя КМАФАнМ зависит от многих факторов. Наиболее важные – режим термической обработки продукта, температурный режим в период его транспортировки, хранения и реализации, влажность продукта и относительная влажность воздуха, наличие кислорода, кислотность продукта и т.д. Увеличение КМАФАнМ свидетельствует о размножении микроорганизмов, в числе которых могут оказаться патогены и микроорганизмы, вызывающие порчу продукта (например, плесени).
Хотя общее количество бактерий КМАФАнМ не может непосредственно свидетельствовать о наличии или отсутствии патогенных бактерий в пищевых продуктах, этот показатель довольно широко используют в пищевой промышленности. Показатель КМАФАнМ (ОМЧ) характеризует санитарно-гигиенические режимы производства и условия хранения изготавливаемой продукции и ее транспортировки.
Продукты, содержащие большое количество бактерий, даже непатогенных и не изменяющих их органолептические показатели, нельзя считать полноценными. Значительное содержание жизнеспособных бактериальных клеток в пищевых продуктах (за исключением тех, при производстве которых применяют закваски) свидетельствует либо о недостаточно эффективной термической обработке сырья, либо о плохой мойке оборудования, либо о неудовлетворительных условиях хранения продукта. Повышенная бактериальная обсемененность продукта свидетельствует также о его возможной порче.
Для потребителя показатель КМАФАнМ характеризует качество, свежесть и безопасность продуктов питания.
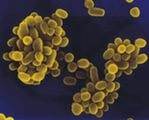
Бруцеллез (brucellessis) – хроническая инфекционная болезнь животных и человека. У многих животных проявляется абортами и задержанием последа, орхитами, рождением нежизнеспособного молодняка и бесплодием. В связи с социальной опасностью бруцеллез включен в список карантинных болезней.
Бруцеллез распространен во многих странах мира – в Африке, Центральной и Южной Америке, в некоторых странах Азии и Европы. В настоящее время встречается и в России.
Возбудитель бруцеллеза бактерии из рода Brucella подразделяют на 6 видов Br . abortus (возбудитель бруцеллеза крупного рогатого скота); Br . M elitensis (овец и коз; особенно восприимчив человек); Br . suis (свиней); Br . neotomae (крыс); Br . ovis (инфекционного эпидидимита баранов); Br . canis (бруцеллез собак). Определенное эпизоотологическое значение имеет возможность миграции различных видов бруцелл от одних животных к другим. Доказана миграция Br. melitensis от коз и овец на коров и свиней. Br. suis – от свиней на коз и овец.
К бруцеллезу восприимчивы крупный рогатый скот, овцы, козы, свиньи, олени, маралы, яки, буйволы, лошади, верблюды, собаки, кошки, зайцы, сайгаки, лисицы, грызуны, дикие кабаны.
Источником возбудителя инфекции являются больные бруцеллезом животные. Особенно опасны они в период выраженных клинических признаков. Чрезвычайно большое количество возбудителя выделяют животные с околоплодными водами, плодными оболочками, абортированным плодом, истечениями из половых органов. Выделяется возбудитель также с молоком, спермой, мочой, калом. У коров бруцеллы могут сохраняться в вымени до 7-9 лет, у овец – до 2-3 лет, периодически выделяясь с молоком.
Продукты, инфицированные бруцеллами, и сырье животного происхождения, предметы ухода, корма, подстилка, вода, почва, одежда людей относятся к ведущим факторам передачи возбудителя. Молодняк животных в основном заражается бруцеллезом алиментарно, взрослые – алиментарно и контактно половым путем, через слизистые оболочки и кожу.
Болезнь в хозяйстве может возникать после ввода в стадо животных из других хозяйств, при несоблюдении основных правил карантинирования поголовья; при совместном выпасе здоровых и больных животных, использовании для поения скота инфицированных водоисточников, скотопрогонных трасс. Возбудитель может быть занесен в хозяйства собаками, грызунами, крысами, особенно если они имели доступ к последам и абортированным плодам, а также с молодняком из неблагополучных стад, где нет клинического проявления болезни.
Инкубационный период длится 2 — 4 недели. Если среди восприимчивого поголовья нет беременных животных, заболевание протекает бессимптомно (латентная форма). Распознать болезнь, таких животных можно лишь с помощью серологического или аллергического методов исследования.
У беременных животных всех видов бруцеллез характеризуется абортами во второй половине беременности. Коровы абортируют чаще на 5-8 месяце, овцы и козы – на 3-5 месяце беременности. Свиноматки могут абортировать как в первой, так и во второй половине супоросности, собаки – на 40-50-й день. У крупного рогатого скота и овец повторные аборты наблюдают редко. За 1 — 2 дня до аборта у самки набухает вымя, припухают наружные половые органы, отмечают незначительное выделение из влагалища буровато-красной слизистой жидкости.
Аборты, как правило, сопровождаются задержанием последа и развитием слизисто-гнойного, а позже – гнойно-фибринозного эндометрита. У отдельных животных на фоне выраженного эндометрита нередко появляются мастит, поражения яичников и фаллопиевых труб. При тяжело протекающих процессах у животных поднимается температура, снижаются удои, они теряют массу. Поражение половых путей влечет за собой нарушение воспроизводительной функции, что приводит к яловости, а порой и к бесплодию.
Заболевание бруцеллезом у отдельных особей может сопровождаться серозными бурситами, гигромами, артритами, тендовагинитами, и у мужских особей – орхитами и эпидидимитами со значительным увеличением семенников и опуханием мошонки. У свиней бруцеллез, кроме того, характеризуется появлением абсцессов в подкожной клетчатке в паренхиматозных органах, параличами мышц таза и конечностей, у лошадей – бурситами в области затылка и холки. У собак и кошек заболевание протекает бессимптомно и выявляется только серологическим методом. Птицы устойчивы к бруцеллезу даже при экспериментальном заражении.
Диагностика бруцеллеза включает лабораторные (бактериологическое, серологическое и молекулярно-генетическое) исследования материала и аллергическое исследование свиней в хозяйствах.
Молекулярно-генетическое исследования (ПЦР) проводят в случае аборта и при появлении у животных других клинических признаков, вызывающих подозрение на бруцеллез, а также при получении положительных и сомнительных результатов серологического исследования на бруцеллез животных, не иммунизированных противобруцеллезными вакцинами, из хозяйств, благополучных по данному заболеванию.
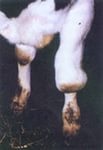
Каротин является основным источником витамина А. Уровень каротина в сыворотке крови зависит от вида и возраста животного. Система биотрансформации β-каротина отсутствует в первые дни после рождения и появляется у большинства животных в месячном возрасте.
У свиней, овец, коз, собак, кроликов, котов и пушных зверей каротин всасывается в пищеварительном тракте только в транформированной форме витамина А — каротиноиды не проникают через стенку тонкого кишечника. В крови, печени и в молоке этих животных каротин не обнаруживают или находят следовые концентрации. Исходя из этого, определение содержания каротина у животных этих видов диагностического значения не имеет. Аналогичные результаты анализа сыворотки крови у новорожденных телят (0,1-0,5 мг%) и телят месячного возраста (до 0,20 мг%). В дальнейшем происходит беспрерывное увеличение уровня каротина до 0,25-0,80 мг% у молодняка 3-6 месячного возраста и 0,45-2,0 мг% у коров и молодняка старше 6-месячного возраста. В пастбищный летне-осенний период содержание каротина в сыворотке крови коров должно быть не менее 0,9 мг%.
Низкий уровень каротина в сыворотке крови коров – гипокаротинемия (меньше 0,45 мг%) является недостаточного поступления провитамина А в составе кормов рациона, разрушение его антивитаминами в преджелудках и кишечнике, нарушение усвоения в тонком кишечнике при их воспалении или патологии печени, при недостатке в рационах белка и легкоусвояемых углеводов, витамина В12, разрушении каротиноидов вследствие порчи, при различных токсикозах, включая нитратные.
При недостатке в организме коров наблюдаются такие нарушении репродуктивной функции, как слабовыраженная охота, тихая охота, затяжная овуляция, недостаточно развитое тело яичника, что влечет к повышению уровня эмбриональной смертности, сбою полового цикла, увеличению. абортов на 18-20 недели стельности, рождению слабого нежизнеспособного молодняка. У новорожденных телят отмечаются отставание в росте, гнойные истечения из глаз и носа, вялость движений, поносы, затем бронхопневмонии.
Проведённые исследования свидетельствуют о глубоком дефиците каротина в кормах и его низкой биологической доступности. Данная проблема наносит большой экономический ущерб хозяйствам, который складывается из потерь десятков тысяч тонн мяса и молока, рождения нежизнеспособного молодняка и повышенного отхода животных.
Решить эту проблему необходимо за счёт введения в рационы животных богатых каротином кормов и применения каротинсодержащих препаратов.
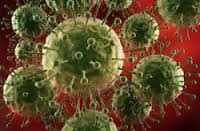
Лейкоз крупного рогатого скота – хроническая инфекционная болезнь опухолевой природы. Возбудителем заболевания является РНК-содержащий вирус семейства Retroviridae . Данное семейство подразделено на 7 родов, к одному из которых относятся вирус лейкоза крупного рогатого скота и вирус Т-клеточного лейкоза человека.
Особенностью возбудителя является его способность проникать в организм хозяина и присутствовать в нем пожизненно.
Вирус лейкоза является экзогенным, в естественных условиях вызывает заболевание только у крупного рогатого скота. Он не способен самостоятельно размножаться, для этого использует клетки хозяина. Вирион, преодолев иммунный барьер животного с иммунным дефектом, проникает в клетку крови (лимфоцит), перестраивает их обмен таким образом, что клетки начинают синтезировать необходимые вирусу вещества.
Вирус лейкоза является лимфотропным. Поэтому выделение возбудителя во внешнюю среду возможно только с кровью или с любым секретом, содержащим лимфоциты: молоком, слюной, слизистыми секретами, фекалиями, мочой.
С 11.08.14 г. по 15.08.14 г. серологическим отделом происследовано сыворотки крови на бруцеллез – 558 проб, на хламидиоз – 94, на листериоз – 220, на сап, случную болезнь, ИНАН – 10 проб с отрицательным результатом. На лептоспироз в РМА исследовано 158 проб, выявлено 3 положительно реагирующих животных – даны рекомендации согласно утвержденных ветеринарно-санитарных правил от 18.06.1986 г. Происследовано микроскопически 15 проб свиней на лептоспироносительство с отрицательным результатом.
Читайте также:


