Мазь для лечения ожоговых и инфекционных ран
Алексеев А.А.
Бобровников А.Э.
Акименко А. Б.
Кафедра термических поражений, ран и раневой инфекции РМАПО, Москва.
Известно, что в процессах метаболизма и обмена веществ в клетках эпидермиса активное участие принимает коэнзим А, незаменимым компонентом которого является пантотеновая кислота (витамин В5). Коэнзим А участвует в процессах ацетилирования и является одним из важнейших коферментов сложных ферментных систем, под влиянием которых улучшается обеспечение клеток энергией и питательными веществами, увеличивается прочность коллагеновых волокон, стимулируется рост и восстановление клеток. Местное применение пантотеновой кислоты оказывает положительное влияние на процессы заживления поврежденной различными агентами кожи.
Спектр применения препарата Пантодерм очень широк. Он используется в дерматологической практике при сухости кожи, контактных дерматитах, пролежнях, опрелости, пиодермиях. Одним из возможных показаний к его использованию является лечение ран и ожогов, при этом препарат может быть особенно эффективен при длительно существующих ранах. В то же время особенности применения данного препарата потребовали проведения комплексных исследований для определения возможности, показаний и методики его применений у обожженных.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Всего в исследовании приняли участие 50 больных с ожоговыми ранами II-IIIАБ-IV степени. Причиной травмы у всех обожженных явилось пламя. В основную группу вошло 30 пациентов, у которых лечение ожоговых ран проведено мазью Пантодерм. Все обследованные больные в зависимости от степени ожога и показаний к назначению мази Пантодерм разделены на 2 подгруппы:
1. Больные основной группы с ожогами II-IIIА степени
В исследуемую группу были включены 15 больных (3 женщины, 12 мужчин) в возрасте от 21 до 60 лет (средний возраст – 39±5,8 лет) с общей площадью ожогового поражения от 10 до 50% поверхности тела (в среднем 36,4±5,2%), при этом глубокие ожоги составляли от 2 до 15% поверхности тела (в среднем 7,7±1,8%). Мазь Пантодерм применяли для лечения только ожоговых ран II-IIIА степени на площади от 1% до 4% поверхности тела (в среднем 2,2±0,3%). Лечение начинали на 2-10 сутки после травмы (в среднем 6,5±1,05 сутки). Продолжительность лечения составляла от 7 до 19 суток (в среднем 15±1,5 суток).
2. Больные основной группы с ожогами IIIАБ-IV степени
В исследуемую группу были включены 15 больных (4 женщины, 11 мужчин) в возрасте от 17 до 60 лет (в среднем 37±3,6 лет) с общей площадью ожогового поражения от 6 до 50% поверхности тела (в среднем 33,7±3,3%). При этом площадь глубокого ожога составляла от 4 до 40% поверхности тела (в среднем, 16,1±2,9%). В зависимости от характера раневого процесса и показаний пациентов распределяли по трем подгруппам 2а, 2б и2в.
При этом из 15 обследованных больных у 10 обожженных(подгруппа 2а) мазь Пантодерм использовали после хирургической некрэктомии ожогов IIIБ-IV степени. Мазь применяли на площади от 2 до 3% поверхности тела (в среднем 2,4±0,2%). Лечение начинали на 2-13 сутки после травмы (в среднем 7,4±1,8 сутки), продолжительность лечения составляла от 5 до 30 суток (в среднем 20,8±4,6 сутки).
Всем больным 2а подгруппы была проведена операция аутодермопластика, при этом мазь Пантодерм использовали на пересаженные расщепленные лоскуты аутокожи (подгруппа 2б). Мазь применяли на площади 1-2% поверхности тела (в среднем, 1,6±0,1%). Лечение начинали на 21-42 сутки после травмы (в среднем, 31,5±2,7 сутки), продолжительность лечения составляла от 3 до 13 суток (в среднем, 9,5±1,1 сутки).
Еще у 5 больных (подгруппа 2в) мазь Пантодерм применяли для лечения длительно существующих остаточных ожоговых ран. Мазь применяли на площади от 0,5 до 1,5% поверхности тела (в среднем, 1±0,2%). Лечение начинали на 50-150 сутки после травмы (в среднем, 104±29,1 сутки), продолжительность лечения составляла от 7 до 24 суток (в среднем, 12,6±5,6 сутки).
Методика применения мази Пантодерм для лечения ожоговых ран II-IIIА степени заключался в проведении стандартного туалета ожоговых ран с использованием растворов антисептиков. На подготовленную таким образом раневую поверхность помещались марлевые салфетки с нанесенной на них мазью Пантодерм. При ожогах в области лица лечение велось открытым (бесповязочным) методом — мазь Пантодерм наносилась на раневую поверхность шпателем или стерильной перчаткой слоем толщиной в 1-2 мм. У части больных на мазь помещались также окклюзирующие пленочные повязки.
При лечении глубоких ожоговых ран IIIБ-IV степени после проведения хирургической некрэктомии и гемостаза на раневую поверхность помещались марлевые повязки с мазью Пантодерм. После аутодермопластики на пересаженные расщепленные лоскуты аутокожи накладывали марлевые салфетки с раствором фурацилина, а сверхупомещали марлевые салфетки с нанесенной на них мазью Пантодерм.
Повязки фиксировались несколькими турами бинта или пластырем. Перевязки при использовании марлевых салфеток проводились 1 раз в 2-3 дня, при пленочных повязках и бесповязочном методе лечения – ежедневно. Перед повторной аппликацией мази предыдущий слой препарата удаляли марлевыми салфетками с растворами антисептиков.
Группу сравнения составили 20 обожженных (по 10 человек в каждой из подгрупп больных) с аналогичной тяжестью травмы, у которых лечение ожоговых ран проводилось традиционным способом с использованием марлевых повязок с мазью на водорастворимой основе Левомеколь (в обеих исследуемых группа) и фурацилиновой мазью, начиная со второй стадии раневого процесса, в т.ч. после хирургической некрэктомии и при аппликации на пересаженные лоскуты аутокожи.
Все больные обеих сравниваемых групп получали стандартную общую терапию по поводу ожоговой болезни в виде системных антибактериальных препаратов, инфузионную, десенсибилизирующую и витаминотерапию. Кроме того, при наличии сопутствующей патологии пациенты получали соответствующее лечение.
Клиническую оценку результатов лечения проводили на основе визуального контроля над течением раневого процесса, оценки количества и характера отделяемого, кровоточивости ран, сроков перехода в другую фазу раневого процесса, сроки эпителизации (для ожогов II-IIIА степени, аутолоскутов кожи и остаточных ран) или готовности ран к аутодермопластике (для ожогов III-IV степени). Болевую реакцию как непосредственно на перевязке, так и в течение 1 часа после перевязки оценивали субъективно по силе болевых ощущений по десятибалльной шкале, где 1 – отсутствие ощущений, а 10 — максимальная по силе выраженность болей.
Лабораторная оценка результатов проведена на основании данных, полученных в ходе цитологического и микробиологического исследований ран в динамике.
Обработка полученных данных проводилась на компьютере IntelPentium IV c использованием набора стандартных статистических программExcel, где M±m – среднее и ее стандартная ошибка.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ КЛИНИЧЕСКАЯ ОЦЕНКА
Мазь Пантодерм при лечении больных с ожогами II-IIIА степени.
Мазь Пантодерм у 9 больных с ожогами II-IIIА степени применяли под марлевые повязки, перевязки осуществляли 1 раз в 2-3 дня. У 3 обожженных с локализацией ожогов на лице мазь наносили на пораженную поверхность 1 раз в день без повязки. Еще у 3 обожженных мазь наносили на ожоговую рану и закрывали пленочными покрытиями, не содержащими никаких лекарственных препаратов.
У 6 больных Пантодерм начинали применять в ранние сроки после травмы в первую стадию раневого процесса. Уже ко 2-3 перевязке купировались явления перифокального воспаления. При этом сухой струп не формировался, отмечено его расплавление с увеличением количества отделяемого, в тоже время на ранах дольше оставался налет фибрина.
У остальных больных в первую стадию раневого процесса лечение проводили повязками с мазью Левомеколь, а Пантодерм начинали использовать при переходе во вторую стадию раневого процесса. У этих больных в области ожоговых ран IIIА степени уже имелся ожоговый струп, представленный инфицированными корками, с участками его расплавления. После нанесения на такие корки мази Пантодерм они в течение 1-2 суток размягчались и легко удалялись с раневой поверхности, что на начальном этапе также приводило к увеличению количества раневого отделяемого. Однако признаков усиления воспаления не было отмечено (рис. 1, 2, 3).
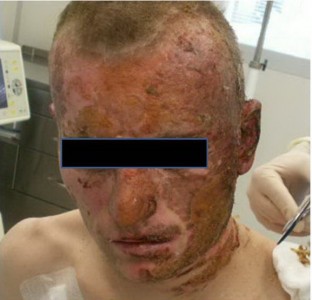
Рисунок 1. До начала лечения Пантодермом.
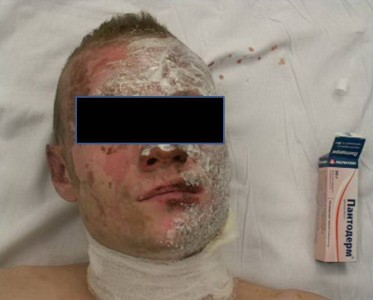
Рисунок 2. Использование мази Пантодерм.
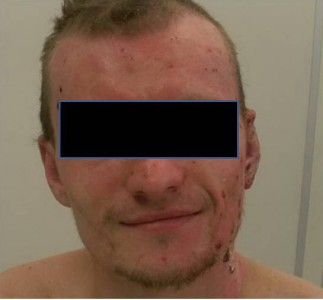
Рисунок 3. Через 7 дней после начала лечения Пантодермом.
Эффективным было применение мази Пантодерм в сочетании с окклюзирующими пленочными покрытиями. Такое применение предотвращало быстрое высыхание мази, позволяло быстро растворить засохший фибрин и очистить раневую поверхность. При этом при ожогахIIIА степени отмечено увеличение количества раневого отделяемого, а на ранах оставался фибринозный налет. Сами перевязки были практически безболезненны, однако из-за скопления отделяемого требовалось выполнять их ежедневно с заменой повязок. В дальнейшем количество экссудата уменьшалось, наблюдалась активная краевая и островковая эпителизация.
При применении марлевых повязок с мазью Пантодерм в третей стадии раневого процесса у четырех больных отмечена фиксации повязок к ране, при этом удаление повязок приводило к травматизации молодого эпителия и капиллярному кровотечению, в связи с чем фиксированные повязки оставляли на ране до их самостоятельного отделения после эпителизации (побочный эффект 2 степени).
Эпителизация участков ожога II степени происходила в течение 6-13 суток после травмы (в среднем, 9,8±1,2 сут.). Сроки полной эпителизации ожогов IIIА степени составляли 15-23 суток после травмы (в среднем 19,2±1,06 сут.). При этом меньшие сроки эпителизации ожоговых ран были у больных, которым лечение в первую стадию раневого процесса проводилось повязками с мазью Левомеколь, а в дальнейшем проведено лечение с использованием Пантодерма.
В сравниваемой группе на фоне применения марлевых повязок с мазью Левомеколь или Фурацилиновой мазью сроки эпителизации ожоговых ран II-IIIА степени у больных сравниваемой группы были сопоставимы с основной группой (табл. 1).
Сравнительная оценка эффективности препарата Пантодерм и мази Левомеколь при лечении больных с ожогами II-IIIА степени
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
НИИ скорой помощи имени Н.В. Склифосовского, Москва
В Московском ожоговом центре НИИ скорой помощи им. Н.В. Склифосовского (руководитель – профессор С.В. Смирнов) накоплен значительный опыт лечения обожженных. Ежегодно около тысячи пострадавших госпитализируется, еще двум тысячам оказывается квалифицированная амбулаторная помощь.
Ожоговая травма является самой тяжелой из всех видов травматизма, вызывая множественные и длительные нарушения гомеостаза, приводящие к дисфункции органов и систем. Основными задачами лечения обожженных является сохранение жизни пациентов и восстановление целостности кожного покрова. Начиная со стадии шока и до стадии реконвалесценции, больной нуждается в интенсивном комплексном лечении, включающем инфузионно–трансфузионную терапию, коррекцию катаболических процессов и иммунодепрессии, профилактику инфекционных осложнений и генерализации инфекции. Эти проблемы требуют специального обсуждения, но они тесно связаны с вопросами местного лечения ожоговых ран, являющихся важнейшим источником инфекционных осложнений, прежде всего пневмонии и сепсиса, которые наиболее часто приводят к летальным исходам.
При поверхностных ожогах II степени (эпидермальных), IIIА степени (субдермальных) и IIIБ степени (дермальных) восстановление кожных покровов и хороший функциональный результат в первую очередь зависят от своевременно начатого и патогенетически обоснованного лечения. Лечебные мероприятия включают:
• восстановление микроциркуляции для сохранения тканей паранекротической зоны;
• защиту от инфицирования и подавление роста микрофлоры;
• возможно раннее иссечение некротических тканей;
• стимуляцию процессов регенерации (эпителизации или развития грануляционной ткани);
• при дермальных ожогах оперативное восстановление кожного покрова.
Для лечения ожоговых ран в амбулаторных и стационарных условиях методом выбора является повязочный метод. При этом повязка в известной мере предохраняет ожоговую раневую поверхность от инфицирования, удерживает на ране лекарственные препараты, способна всасывать раневое отделяемое. Выбор лекарственных средств определяется глубиной ожога, стадией течения раневого процесса, характером инфицированности раны.
Каждая лекарственная форма (мази, растворы) имеет свои показания к применению. По воздействию на раневой процесс при ожогах монокомпонентные препараты можно разделить на следующие группы:
• противомикробного действия, содержащие антибиотики, антисептики, сульфаниламиды (мази линкомициновая, тетрациклиновая, синтомициновая, фурацилиновая, диоксидиновая, дермазин и т.д.; растворы хлоргексидина, фурацилина, йодопирона, борной кислоты, калия перманганата, натрия гипохлорита);
• противовоспалительного действия, содержащие гормональные препараты (мази фторокорт, локакортен, преднизолон и др.);
• протеолитического и кератолитического действия (салициловая мазь, профезим, ируксол и др.);
• стимулирующие регенерацию (мази метилурациловая, солкосерил);
• местные обезболивающие средства (тримекаин, лидокаин).
Важнейшим звеном местного лечения является воздействие на микрофлору. Ожоговая рана нуждается в антибактериальной терапии с момента возникновения до полного ее закрытия, поскольку колонизация микроорганизмами с развитием гнойного воспаления приводит к тяжелой интоксикации, препятствует заживлению эпидермальных и субдермальных ожогов, ведет к углублению ожоговых ран, лизису и отторжению аутодермотрансплантатов, служит источником генерализации инфекции.
По данным лаборатории бактериологии, эпидемиологии и антибиотикотерапии НИИ СП им. Н.В. Склифосовского (рук. – д.м.н. Д.Д. Меньшиков), отделяемое ожоговых ран наиболее часто содержит стафилококки (почти в 75% случаев), несколько реже – синегнойную палочку (около 50%) и значительно реже другие микроорганизмы (рис. 1). Формирование в ранах ассоциаций микроорганизмов, обладающих различной чувствительностью или резистентностью к антибактериальным препаратам, значительно затрудняет выбор лекарственных средств для местного лечения ожоговых ран.
Рис. 1. Микроорганизмы, высеваемые из ожоговых ран
Ошибочным является наложение повязок на жировой основе в дегенеративной, дегенеративно–воспалительной и воспалительной фазах течения при обильном раневом отделяемом. Это приводит к нарушению оттока, вызывает усиление всех признаков интоксикации, ухудшает общее состояние больного.
В настоящее время широкое распространение получили мази на полиэтиленгликолевой (ПЭГ) основе, которая обладает высокой осмотической активностью, хорошо высвобождает антибактериальные препараты, адсорбирует микробные и тканевые токсины, не присыхает к ране. Мази на ПЭГ выгодно применять при наличии остатков некротических тканей и обильном раневом отделяемом, т.е. в дегенеративной, дегенеративно–воспалительной, воспалительной и даже воспалительно–регенераторной фазах течения раневого процесса. Одним из таких препаратов является отечественная поликомпонентная мазь Левосин, которая обеспечивает разностороннее воздействие на раневой процесс. Входящие в состав мази антибиотик широкого спектра действия левомицетин, нарушающий синтез белков микробных клеток, и сульфаниламидный препарат длительного действия сульфадиметоксин подавляют рост значительной части спектра бактерий, колонизирующих ожоговые раны. Содержащийся в мази анестетик тримекаин вызывает продолжительную анестезию, что выгодно отличает Левосин от большинства других мазей, в том числе от мази Левомеколь, также содержащей левомицетин. Кроме того, в состав мази Левосин входит метилурацил, который обладает анаболической активностью, ускоряет клеточную регенерацию и заживление ран, стимулирует клеточные и гуморальные факторы защиты, оказывает противовоспалительное действие. Наконец, водорастворимая основа мази – полиэтиленоксид, обладая осмотическим эффектом, адсорбирует микробные и тканевые токсины. Эффективны также диоксидиновая и хинозолоновая мази, мафенид.
Мази на эмульсионной основе (линименты синтомицина и стрептоцида, кремы дермазин, фламазин и др.) содержат значительное количество воды и не обладают сорбционной способностью. Их целесообразно применять при ожогах II степени во всех фазах течения раневого процесса, при ожогах IIIА степени – в регенераторной фазе. Суммируя вышеизложенное, приводим алгоритм местного лечения ожогов (табл. 1).
Консервативный повязочный метод лечения при ожогах II– IIIА степени является основным, при этом сроки эпителизации составляют в среднем 14–21 сут. При ожогах IIIБ степени повязочный метод является вспомогательным, обеспечивая подготовку к оперативному лечению – некрэктомии и аутодермопластике. В этих случаях сроки лечения и восстановления кожного покрова зависят от общей площади поражения и площади глубоких ожогов и, как правило, превышают 30 сут.
Данная повязка обладает очень высокой впитывающей способностью, а ее поверхность позволяет протекать регенераторным процессам нормально.
Воскопран – современные стерильные перевязочные средства с пчелиным воском.
Фармакологическое действие Воскопрана
Перевязочные средства Воскопран (салфетки и повязки)с содержанием пчелиного воска изготовлены с учетом современного подхода к терапии ран, а именно их вида и стадии раневого процесса. Так, Воскопран в начальной фазе способствует активизации физиологических механизмов очистки, при грануляции – стимулированию ангиогенеза и заполнения коллагеновыми волокнами дефекта, при эпителизации – ускорению клеточного деления.
Большое количество аминокислот, содержащееся в пчелином воске, способствует более интенсивному заживлению, включая очищение и эпителизацию. Еще одним достоинством повязок Воскопран, по отзывам, является то, что на всех стадиях процесса они не прилипают к ране.
Кроме того, применение перевязочных средств способствует:
Обеспечению в травмированных тканях необходимого для регенерации свободного газообмена;
Быстрому очищению раны от смешанного или гнойного экссудата;
Эффективной защите от высыхания и дальнейшего инфицирования.
Повязки хорошо моделируются на раневой поверхности, что защищает ее от механических воздействий, трения, удара и загрязнения. После полного заживления раны Воскопран, по отзывам, от нее отходит естественно и обычно не оставляет рубцов.
Форма выпуска и состав повязок Воскопран
В состав Воскопрана входят:
Пчелиный воск (до 97%);
Витамин Е;
Прополис.
Защищенные с двух сторон полипропиленовыми пленками марлевые повязки выпускают различных размеров: 10х10 см, 5х7,5 см, 7,5х10 см, 10х50 см, 10х200 см и 10х15 см.
Показания к применению перевязочных средств Воскопран
По инструкции Воскопран эффективен при:
Оказании первой медицинской помощи при травмах и ожогах;
Терапии гранулирующих ран, включая лечение вяло гранулирующих ран.
Способ применения повязок Воскопран
После вскрытия повязку Воскопран следует накладывать так, чтобы она полностью накрывала поврежденную поверхность и выступала за ее края на 0,5 см. Через несколько минут необходимо снять второй защитный слой. Если воспалительные очаги отсутствуют, повязку можно оставить до полного заживления.
При лечении чистых ран, а также ран в стадии грануляции рекомендуется применять повязки Воскопран без мазей. Это относится не только к травмированным кожным покровам, но и к обморожениям, ожогам, трофическим язвам. Возможно сочетание повязок с различными мазями, что обеспечит проникновение лекарственного средства в глубокие слои раневой поверхности.
По показаниям врач может порекомендовать использование готовых повязок с мазями:
Воскопран с левомеколем – комбинированным наружным средством с противовоспалительным и противомикробным действием. Мазь, легко проникая вглубь тканей без повреждения биологических мембран, проявляет активность в отношении многих грамотрицательных и грамположительных микроорганизмов и стимулирует процессы регенерации. Воскопран с левомеколем применяют при лечении гнойно-воспалительных болезней кожи, гнойных и инфицированных ран, трофических язв, обморожений, пролежней, опрелостей, а также различных видов ожогов – термических, химических и радиационных;
Воскопран с диоксидином – антибактериальным средством широкого спектра действия (группа производных хиноксалина) с химиотерапевтической активностью на фоне инфекций, вызванных стрептококками, дизентерийной палочкой, вульгарным протеем, синегнойной палочкой, клебсиеллой, сальмонеллами, стафилококками, патогенными анаэробами. Диоксидин активен в отношении штаммов бактерий, проявляющих устойчивость к другим медикаментам, включая антибиотики. Воскопран с 5% мазью диоксидин обычно применяется при лечении поверхностных и глубоких гнойных, инфицированных и продолжительно незаживающих ран;
Воскопран с метилурацилом – лекарственным средством с гемопоэтическим, лейкопоэтическим, иммуностимулирующим и противовоспалительным действием. Медикаментспособствует ускорению процессов регенерации в ранах, роста и грануляционного созревания тканей и эпителизации. Воскопран с метилурацилом (10% метилурациловой мазью) обычно применяют для стимулирования процесса регенерации при гранулирующих, чистых и вялозаживающих ранах, включая фурункулы, дерматиты, ожоги, фотодерматозы и послеоперационные швы.
Противопоказанием к использованию Воскопрана на всех стадиях раневого процесса является индивидуальная чувствительность к веществам, входящим в состав покрытия, особенно на фоне гиперчувствительности к продуктам пчеловодства. Кормящим и беременным женщинам, а также при недостаточной функции надпочечников не следует применять Воскопран с диоксидином.
Негативные эффекты при применении Воскопрана в инструкции не описаны.
Перевязочные средства Воскопран можно приобрести в аптеке без рецепта, срок годности повязок – 1,5 года при условии соблюдения рекомендаций производителя по их хранению.
В зависимости от вида используемой мази, повязки выпускаются в 9-ти исполнениях:
ПОКРЫТИЕ ПОКАЗАНИЯ ПРОТИВОПОКАЗАНИЯ
Диоксидин 5%, мазь Раневые и ожоговые инфекции, поверхностные и глубокие гнойные раны, трофические язвы, гнойные раны при остеомиелите, послеоперационные раны Индивидуальная непереносимость, недостаточность функции надпочечников в анамнезе; беременность, кормление грудью
Диоксиколь, мазь Гнойные раны в первой (гнойно- некротической) фазе раневого процесса Индивидуальная повышенная чувствительность к компонентам препарата, недостаточность функции надпочечников, беременность, лактация
Левосин, мазь Инфицированные кожные раны различной этиологии Индивидуальная непереносимость препарат или его компонентов
Левомеколь, мазь Гнойные раны, инфицированные смешанной флорой в первой (гнойно- некротической) фазе раневого процесса Повышенная индивидуальная чувствительность к левомицетину
Синтомицин, линимент 10% Гнойные раны, гнойно- воспалительные заболевания кожи, фурункулы, длительно незаживающие трофические язвы, ожоги II- III степени Индивидуальная непереносимость препарата
Гентамицин 0,1%, мазь Заболевания кожи, вызываемые стафилококками и стрептококками, вторичном бактериальном инфицировании при грибковых и вирусных инфекциях кожи, инфицированных кожных ранах различной этиологии, инфицированных варикозных язвах Повышенная чувствительность к антибиотикам - аминогликозидам. При применении препарата в течение длительного времени на больших поверхностях кожи необходимо учитывать возможность резорбтивного действия, особенно у пациентов с хронической почечной недостаточностью. С осторожностью назначать больным с невритом слухового нерва и беременным
Гиоксизон, мазь Гнойничковые заболевания кожи, экзема Кожные заболевания вирусной, туберкулезной и грибковой природы
Метилурацил, мазь 10% Раны, ожоги, трофические язвы в качестве средства, ускоряющего заживление поврежденных тканей Индивидуальная непереносимость препарата
Без мазевого покрытия Возможно нанесение любой мази самостоятельно
Островский Н.В., Никитюк С.М., Киричук В.Ф., Бецкий О.В., Креницкий А.П.,
Майбородин А.В., Тупикин В.Д., Шуб Г.М., Лунева И.О.
Резюме
Впервые исследована возможность использования электромагнитного излучения (ЭМИ) терагерцового диапазона на частотах молекулярного спектра излучения и поглощения оксида азота (150,176 – 150,664 ГГц) для местного комплексного лечения ожоговых ран с ограниченной площадью. Обсуждены некоторые результаты воздействия электромагнитного излучения на раневой процесс. Обоснована перспектива использования терагерцовых волн (ТГВ) в комбустиологии.
Ключевые слова
Статья
Ожоговый травматизм является важной медицинской и социальной проблемой. По данным отечественных авторов [1], общая летальность от ожогов в целом по России, колеблется от 2,3 до 3,6%, при этом 85 – 90% - это люди трудоспособного возраста и дети. Ежегодно регистрируется около 600 тыс. случаев ожоговой травмы. Около 70% больных получают ограниченные по площади и неглубокие ожоги [2].
Раны, возникшие вследствие глубоких ожогов (IIIб и IV степени) самостоятельно не эпителизируются, поэтому лечение направлено на возможно более быстрое удаление омертвевших тканей и на подготовку ран к пластическому закрытию аутокожей [2,3,4,6]. В ранние сроки после получения травмы целесообразно добиваться высушивания ожогового струпа. На следующем этапе традиционно выполняется либо химическая некрэктомия посредством аппликации 40% мази салициловой кислоты, либо острая хирургическая некрэктомия. После этого осуществляется подготовка ран к аутодермопластике на раны, выполненные молодыми яркими однородными мелкозернистыми грануляциями. Отторжение некротических тканей при глубоких ожогах и формирование грануляций всегда сопровождается гнойно–воспалительными явлениями в ране. Развитие обильной патогенной микрофлоры в ране ведет к изъязвлению грануляций, извращает раневой процесс, затрудняет подготовку больного к аутодермопластике [5,6].
КВЧ-терапия достаточно широко вошла в медицинскую практику и доказала свою эффективность в лечении широкого ряда заболеваний, оказывая восстанавливающее действие на механизмы развития общепатологических процессов, лежащих в основе заболеваний [7,14,15,16,27,28,29].
На сегодняшний день установлено, что терапевтический эффект ЭМИ КВЧ проявляется в анальгезирующем, противовоспалительном, иммуномодулирующем, антистрессорном действии [11,12,13,14,15,16,17,27,28], а также в стабилизации системы гемостаза, улучшении реологических свойств крови, процесса микроциркуляции [8,18]. Изучен бактерицидный эффект миллиметровых волн. В экспериментах на лабораторных животных показано ускорение процесса регенерации гнойных ран, приживления кожного лоскута, достижения абактериального состояния ран под влиянием ЭМИ терагерцового диапазона. [19,20].
Лечебный эффект и возможность управления клеточным метаболизмом получены на частотах 41 – 240 ГГц и выше в процессе КВЧ-терапии и биомедицинских исследований [30]. В этом диапазоне существует очень частый спектр поглощения основных метаболитов, причем количество спектральных линий на каждые 10 ГГц увеличивается. В спектре одного из активных метаболитов - оксида азота (NO) в терагерцовом диапазоне от 100 ГГц до 300 ГГц содержится 8 линий поглощения в атмосферном воздухе [30].
Применение электромагнитного излучения (ЭМИ) терагерцового диапазона на частотах молекулярного спектра излучения и поглощения оксида азота является естественным физиологическим регулятором эндогенного оксида азота в живом организме [7,8].
В настоящее время большой интерес вызывает изучение свойств оксида азота (NO) как универсального регулятора физиологических и метаболических процессов в отдельной клетке и организме в целом [9,10,21-26]. Оксид азота, функционируя как сигнальная молекула практически во всех органах и тканях человека и животных, благодаря высокой проникающей способности влияет на внутриклеточные процессы, не взаимодействуя с клеточными рецепторами, поскольку он способен диффундировать сквозь клеточную мембрану и взаимодействовать с мишенями непосредственно внутри клетки.
Эндогенный оксид азота существует и непрерывно синтезируется в органах, тканях и клетках ферментативным путем при участии NO-синтаз – ферментов, использующих в качестве единственного субстрата аминокислоту L-аргинин [9].
Следует отметить, что на процесс заживления влияет также и экзогенный NO [10], содержащийся в атмосферном воздухе. Термодинамика и кинетика образования атмосферного NO достаточно изучена и связана не только с природными процессами преобразования газов атмосферы, но и с промышленными выбросами NO в атмосферу.
Так как фармакологическая регуляция синтеза NO в живом организме может сопровождаться возникновением побочных эффектов, возникает необходимость изыскания новых неинвазивных физических регуляторов оксида азота на основе естественного физиологического регулирования.
Перспективным с точки зрения поставленной задачи является использование низкоинтенсивного электромагнитного излучения терагерцовой частоты (ЭМИ ТГЧ).
Вероятно, молекулярное возбуждение молекул NO, как находящихся в атмосферном воздухе, так и возникающих ферментативным путем в сохранившихся клетках раневой поверхности, электромагнитным излучением на частоте его вращательно-колебательных спектров поглощения и излучения существенно повышают его диффузионную и реакционную способность, что способствует улучшению микроциркуляции и санации раневой поверхности.
Из-за малой энергии ЭМИ миллиметровых волн не оказывает разрушающего действия на структуру клеток, не обладает побочным действием, хорошо переносится больными [11,16,27,28].
Целью настоящего исследования явилось изучение влияния ЭМИ терагерцового диапазона на раневой процесс в комплексном лечении ожоговых ран для достижения в кратчайшие сроки самостоятельного заживления раны и в подготовке ожоговой раневой поверхности к аутодермопластике.
Объекты и методы исследования
Нами была использована комплексная терагерцовая спектрально – молекулярная терапия для лечения 8 больных с поверхностными ожогами II – IIIа степени и 12 больных с глубокими ожогами. В группе сравнения было 10 больных с поверхностными ожогами и 10 пациентов с глубокими ожогами.
Для повышения эффективности воздействия на раневую поверхность экзогенного NO в ОАО ЦНИИИА (г.Саратов) разработан квазиоптический терагерцовый генератор спектров поглощения и излучения оксида азота, работающего на частоте 150,176-150,664 ГГц. В отличие от экзогенной NO-терапии, предложенной профессором Кабисовым Р.К., генератор обеспечивает молекулярное возбуждение атмосферного NO в потоке воздуха, проходящего через скрещенные магнитное и электрическое поля. При этом создаются условия максимального взаимодействия между СВЧ полем, атмосферным NO и раневой поверхностью, т.к. дипольные молекулы NO в скрещенных полях движутся по циклоиде. Таким образом создаются условия максимальной диффузии оксида азота в рану.
Сеансы облучения осуществляли на частотах 150,176-150,664 ГГц, при плотности потока мощности 0,02-0,03 мВт/см 2 . Использовали режим амплитудной модуляции. Расстояние между излучающей апертурой аппарата и раневой поверхностью равнялось 15 – 20 см. Продолжительность сеанса составляла 15 минут. Курс лечения предусматривал 7 – 10 ежедневных процедур. При отсутствии через 2 – 3 дня эффекта продолжительность сеанса увеличивали до 30 минут, при этом режим излучения изменяли на непрерывную генерацию.
При лечении поверхностных ожогов терагерцовую терапию назначали на 9 – 10 сутки с момента получения травмы после начала отторжения ожогового струпа.
При лечении глубоких ожогов применяли следующую схему лечения. Первый сеанс ТГЧ-терапии проводили после выполнения химической некрэктомии на 8 – 9 сутки с момента травмы. На следующие сутки после второго сеанса ТГЧ-терапии при наличии умеренного гнойного отделяемого проводили аутодермопластику на незрелые гранулирующие раны. В случае обильного гнойного отделяемого аутодермопластику выполняли после 4 – 6 сеанса. В контрольной группе аутодермопластика выполнялась в среднем через 21 день с момента травмы.
Результаты
Впервые установлено, что на фоне общепринятой терапии при применении терагерцовых молекулярных спектров излучения и поглощения NO отмечается благоприятное течение ожогового раневого процесса. Так, при лечении поверхностных ожогов через 2 – 3 сеанса у всех больных появлялись островки активной эпителизации, а через 5 – 7 сеансов наступала полная эпителизация ожоговой раны. В контрольной группе лишь к исходу второй недели заболевания наблюдали полное отторжение омертвевших тканей, а на 14 – 16 сутки появлялись островки эпителизации. Полная эпителизация ожоговой раны наступала только через 20 - 23 суток.
При комплексной ТГЧ-терапии глубоких ожогов после 4 – 6 сеансов отмечали значительное уменьшение экссудации, раневая поверхность была представлена молодой грануляционной тканью. После аутодермопластики проводили еще 4 – 5 ежедневных процедур. Приживление трансплантатов достигало 80 – 90%. В контрольной группе наиболее полное приживление трансплантатов происходило при кожной пластике ярких гранулирующих ран в сроки от 18 до 26 суток с момента травмы.
После первого сеанса терагерцовой терапии микробная обсемененность ожогового отделяемого снизилась в сотни раз. После 2-3 сеанса практически у всех пациентов снижалась выраженность болевого синдрома, улучшалось общее самочувствие, нормализовался режим сна. После 5-7 сеанса раны в большинстве случаев характеризовались низкой микробной обсемененностью. Побочных явлений не выявили.
Представленные данные свидетельствуют о том, что при использовании метода комбинированной ТГЧ-терапии ожоговых ран наблюдаются:
- отсутствие нагноения ожоговых ран и углубления пограничных ожогов III а степени;
- сокращение сроков эпителизации пограничных ожогов III а степени на 5 – 6 дней;
- сокращение сроков подготовки ран к аутодермопластике при ожогах III б степени на 4 – 7 дней.
С целью иллюстрации вышеизложенного приводим выписки из историй болезни.
1. Больной П., 44 лет, история болезни №394, поступил в Саратовский Ожоговый Центр 17.05.2004 г. с диагнозом: Ожог кипятком II - III а,б степени бедер, левого предплечья площадью 5% от поверхности тела через 4 суток с момента получения травмы. Площадь глубоких ожогов составила 3%. Больному назначили симптоматическую терапию, перевязки с растворами антисептиков, подсушивание ожоговых ран. 21.05 на раны бедер нанесли 40% салициловую мазь. 23.05 под внутривенной анестезией выполнили химическую некрэктомию. Рана была выполнена незрелыми грануляциями, характеризовалась умеренным гнойным отделяемым. Ожоги II степени на левом предплечье к этому моменту эпителизировались полностью. Назначили 5 ежедневных сеансов КВЧ-терапии на раны бедер продолжительностью 15 минут на частотах 150,176 – 150,664 ГГц в режиме амплитудной модуляции. Начали антибактериальную терапию оксампицином по 1,0 х 4 раза в сутки. Результаты бактериологического исследования ожогового отделяемого от 24.05.2004 г.: микробная обсемененность раны составляла 10 4 КОЕ/мл. Выделена ассоциация гемолитического штамма S.aureus и негемолитического штамма S.epidermidis. После КВЧ – сеанса микробная обсемененность раны S.aureus снизилась в 1000 раз, S.epidermidis в 100 раз. 25.05.2004 года выполнили аутодермопластику на раны бедер площадью 3 % от поверхности тела. На перевязке 28.05.2004 г. приживление трансплантатов составило 90%, трансплантаты розовые, жизнеспособные. Результаты бактериологического исследования от 28.05.2004 г.: микробная обсемененность раны 5х10 2 КОЕ/мл при соотношении S.aureus/S.epidermidis=1/9. После ТГЧ-сеанса снижение микробной обсемененности S.aureus в 10 раз, S.epidermidis в 100 раз. Раны характеризовались низкой микробной обсемененностью. 4.06.2004 г. больной выписан из стационара с остаточными мозаичными ранами на бедрах S=6 см 2 на амбулаторное долечивание у хирурга в поликлинике по месту жительства. Срок лечения составил 18 койко-дней.
2. Больной Б., 48 лет, история болезни № 389, поступил в Саратовский Ожоговый Центр 14.05.2004 в 01 ч. 15 мин. с диагнозом: Ожог пламенем II – III а,б степени шеи, груди, кистей площадью 10% от поверхности тела через 1 час с момента получения травмы. Площадь глубоких ожогов составила 7%, раны локализовались на шее, туловище. С целью превентивной терапии ожогового шока больному назначили инфузионную терапию в объеме 1200 мл, а также симптоматическую, антибактериальную терапию оксампицином 1,0 х 4 раза в сутки, местное лечение ран с растворами антисептиков, подсушивание ожоговых ран. 22.05.2004 г. на рану шеи, туловища площадью 7 % от поверхности тела, представленную сухим ожоговым струпом, нанесли 40% мазь салициловой кислоты. 24.05.2004 г. под внутривенной анестезией выполнили химическую некрэктомию. Раны характеризовались обильным гнойным отделяемым. Назначили 10 ежедневных сеансов ТГЧ-терапии на раны шеи, туловища продолжительностью 20 минут на частотах 150,176 – 150,664 ГГц в режиме амплитудной модуляции. Результаты бактериологического исследования отделяемого ожоговой раны от 24.05.2004 г.: микробная обсемененность раны составляла 10 5 КОЕ/мл. Выделена ассоциация гемолитического штамма S.aureus и негемолитического штамма S.epidermidis, оба штамма высокочувствительны к цефтриаксону. После КВЧ-сеанса отмечалось снижение микробной обсемененности S.aureus в 1000 раз, S.epidermidis в 100раз. Больному проводились ежедневные перевязки с растворами антисептиков, назначен цефтриаксон в дозе 2,0 г в сутки. 31.05.2004 г. отмечалось умеренное гнойное отделяемое ожоговой раны, рана была представлена ярко-розовыми мелкозернистыми грануляциями. Результаты бактериологического исследования отделяемого ожоговой раны от 31.05.2004 г.: исходная микробная обсемененность раны равна 10 4 КОЕ/мл, после ТГЧ-сеанса – стократное снижение. Микрофлора была представлена S.aureus. 1.06.2004 г. больному выполнена аутодермопластика площадью 7% от поверхности тела. На перевязке 4.06.2004 г. приживление трансплантатов составило 85%, трансплантаты жизнеспособны. Результаты бактериологического исследования от 4.06.2004 г.: исходная микробная обсемененность ожоговой раны составляла 10 3 КОЕ/мл, после сеанса КВЧ-терапии – стократное снижение (штамм S.aureus). Больной выписан из стационара 9.06.2004 г. с полностью эпителизированными ожоговыми ранами. Срок лечения составил 26 койко-дней.
3. Больная Б., 58 лет, история болезни № 334, поступила в Саратовский Ожоговый Центр 5.04.2004 года с диагнозом: Ожог пламенем II-III а степени обоих предплечий, кистей площадью 7% от поверхности тела через 6 часов с момента получения травмы. В течение первых 9 дней больная получала традиционную медикаментозную терапию. На 9-е сутки после частичного удаления тонкого ожогового струпа назначили 7 ежедневных сеансов ТГЧ-терапии на предплечья, кисти продолжительностью 15 минут на частотах 150,176 – 150,664 ГГц в режиме амплитудной модуляции. После 2 сеанса отмечено появление первых островков активной эпителизации на обоих предплечьях. 21.04.2004 г. на фоне проводимой терапии ожоговая рана эпителизирована полностью. Больная в удовлетворительном состоянии выписана из стационара. Продолжительность госпитализации составила 16 койко-дней.
4. Больной Н., 47 лет, история болезни № 361, поступил в Саратовский Ожоговый Центр 28.04.2004 г. с диагнозом: Ожог кипятком II – IIIа,б степени нижних конечностей площадью 8% от поверхности тела. Площадь глубоких ожогов составила 4%. Больному назначена антибактериальная, симптоматическая терапия, местное лечение ожоговых ран растворами антисептиков, подсушивание ран. 6.05.2004 г. на сухой ожоговый струп обоих голеней наложена 40% салициловая мазь. 8.05.2004 выполнена химическая некрэктомия. Рана характеризовалась обильным гнойным отделяемым. Больному продолжена антибактериальная (оксампицин 1,0 х 4 р/день, гентамицин 80 мг х 3 р/день), симптоматическая терапия, местное лечение ран ежедневными перевязками с растворами антисептиков, водорастворимыми мазями. 19.05.2004 г. раны выполнены розовыми, мелкозернистыми грануляциями. 20.05.2004 года под внутривенной анестезией выполнена аутодермопластика. 24.05.2004 на перевязке отмечен частичный лизис трансплантатов. На перевязке 31.05.2004 г. в верхней трети обеих голеней остаточные мозаичные раны площадью 0,5% от поверхности тела. 1.06.2004 выполнена операция аутодермопластика. 4.06.2004 г. на перевязке трансплантаты жизнеспособны. 9.06.2004 г. больной в удовлетворительном состоянии выписан из стационара. Ожоговые раны эпителизированы полностью. Срок пребывания в стационаре составил 42 койко-дня.
5. Больная Б., 59 лет, история болезни № 402, поступила в Саратовский Ожоговый Центр 20.05.2004 г. через двое суток с момента получения травмы с диагнозом: Ожог кипятком I – II – IIIа степени левой нижней конечности, правого бедра площадью 8 % от поверхности тела. Больной назначена антибактериальная, симптоматическая терапия, местное лечение ожоговых ран. На 9-е сутки начата поэтапная некрэктомия тонкого ожогового струпа. Ожоговая рана характеризовалась умеренным гнойным отделяемым. 4.06.2004 г. появились единичные островки активной эпителизации. 11.06.2004 ожоговая рана эпителизировалась полностью. Больная в удовлетворительном состоянии выписана из стационара. Срок пребывания в стационаре составил 22 койко-дня.
Заключение
Предложен новый метод – терагерцовая терапия ожоговых ран воздействием эндогенного и экзогенного NO, возбуждаемого электромагнитным излучением на частотах молекулярного спектра излучения и поглощения оксида азота. Показано более эффективное воздействие терагерцовых электромагнитных волн на ожоговые раны по сравнению с больными, у которых не был применен указанный метод.
Показано, что ЭМИ ТГЧ является фактором, под влиянием которого осуществляется воздействие экзогенного атмосферного NO, а также синтез эндогенного оксида азота в различных биологических средах и клетках организма, а также регуляция биохимических реакций, способствующих взаимодействию оксида азота с продуктами метаболических процессов [7,8]. Предложенный метод ТГЧ-терапии дает возможность осуществить местное лечение, воздействуя непосредственно на раневую поверхность. Это позволяет создать оптимальное локальное воздействие и избежать нежелательных общих эффектов.
Положительный эффект комбинированной терагерцовой терапии на частотах молекулярного спектра излучения и поглощения оксида азота поверхностных и глубоких ожоговых ран может быть обусловлен как повышением реакционной способности экзогенного атмосферного оксида азота, так и усилением синтеза эндогенного NO сохранившимися клетками ожоговой раневой поверхности за счет повышения в них активности NO-синтазы [21,22,24,25].
Механизм комбинированного действия NO на раневой процесс заключается в вазодилатации и нормализации микроциркуляторных нарушений [8,23,24,26], улучшении сосудистой трофики и тканевого обмена; прямом бактерицидном влиянии; усилении фагоцитоза бактерий нейтрофилами и макрофагами; ингибиции свободных кислородных радикалов, прямым воздействием на пролиферацию фибробластов [10].
Представленные данные позволяют надеяться что использование ТГЧ-терапии на частотах молекулярного спектра излучения и поглощения оксида азота займет достойное место в комплексном лечении ожоговых ран.
Читайте также:


