Лимфоидная ткань при инфекции

Першение и сухость в горле, боль при глотании, слабость, повышенная температура сигнализируют о заболевании глотки. Ниже в статье вы найдете причины заболевания; врачей, которые его лечат; необходимые лечебные процедуры для лечения; а также общую информацию о заболевании его локализации, особенностях диагностики заболеваний и лечения их. Тем не менее, советуем проконсультироваться с врачом, ибо самолечение в 90% чревато переходом болезни в хроническую стадию с крайне неприятными осложнениями

Фарингит. Общая информация
Фарингит – воспаление слизистой оболочки и лимфоидной ткани глотки, которое сопровождается болями, першением или дискомфортом в горле.. Различается острая и хроническая формы заболевания.
В нашей клинике работают лучшие врачи в Москве, имеющие большой опыт в лечении Фарингита
КОГДА СТОИТ ЗАБИТЬ ТРЕВОГУ, ПЕРВЫЕ СИМПТОМЫ ФАРИНГИТА
Для фарингита характерны:
- першение в горле, саднение, затрудненное дыхание
- сухость в горле при глотании,
- дискомфорт и боли в горле при глотании (особенно при пустом глотке),
- общее недомогание с появлением боли в затылочной части головы
- подъем температуры (37,5-38)
- скопление трудноотделяемой с глотки гнойной слизы
- появление на задней стенке глотки фоликулы в виде красных зерен
- отченый язычок
ОСЛОЖНЕНИЯ ФАРИНГИТА
ИЛИ ЧТО БУДЕТ, ЕСЛИ ЕГО НЕ ЛЕЧИТЬ ИЛИ ЛЕЧИТЬ НЕПРАВИЛЬНО
Наиболее грозные осложнения фарингита представлены аутоиммунными заболеваниями, которые возникают вследствие повышения чувствительности организма по отношению к микробам, вызвавшим болезнь… Что это значит? Это означает, что сам по себе фарингит не представляет большой угрозы, НО может приводить к очень серьезным последствиям, если оставить его нелеченным. В этом отношении особенно опасны стрептококковые фарингиты, в результате которых могут развиться гнойные и негнойные осложнения…
Гнойные осложнения:
- Перитонзиллярный абсцесс – это воспаление в околоминдалиновой клетчатке (область, которая находится вокруг миндалин), где и образуется гнойник.
- Заглоточный абсцесс - образуется в результате нагноений лимфатических узлов и клетчатки заглоточного пространства.
Негнойные осложнения:
- Воспаление почек (постстрептококковый гломерулонефрит).
- Ревматизм.
При ревматизме в различных тканях организма образуются воспалительные узелки. К примеру, если они образуются в сердечной мышце, на внутренней поверхности сердца или, в самом тяжелом случае, на клапанах, они могут вызывать нарушение прохождения крови через сердце, что может привести к нежелательным последствиям вплоть до формирования порока сердца… Также воспалительные узелки способны откладываться в коже, мышцах, суставах, вследствие чего могут появляться отеки и болевые ощущения…l
ДИАГНОСТИКА ФАРИНГИТА
Для диагностики фарингита ЛОР-врач осматривает полость рта и глотку больного, если этого недостаточно – проводится фарингоскопия.
Врач назначит анализ мазка из зева, который будет направлен на вирусологическое или бактериологическое исследование.
ЛЕЧЕНИЕ ФАРИНГИТА
Прежде всего при фарингите, необходимо исключить из рациона раздражающую пищу (горячую, холодную, кислую, острую, соленую), а также отказаться от курения и употребления алкоголя. Нужно много пить (1,5–2 литра в день), лучше, если это будут витаминизированные напитки (например, ягодные морсы или отвар шиповника). Выполнять полоскание теплыми антисептическими растворами (фурациллин, йодинол и др.), смазывание (раствор Люголя в глицерине) или орошение (например, Ингалипт, Тантум Верде, Каметон) глотки. Облегчить состояние также помогает полоскание теплым солевым раствором (1 чайная ложка на стакан воды), ингаляции раствором соды с растительным маслом или закапывание в нос теплого раствора соды с добавлением глицерина. Для снижения температуры тела можно принимать жаропонижающие средства (препараты парацетамола, аспирин – за исключением детей). Также врач может назначить лекарственные препараты с интерфероном и лизоцимом, антигистаминные средства и витаминно-минеральные комплексы.
Если установлено, что фарингит имеет бактериальное происхождение (возбудителем чаще всего является гемолитический стрептококк), то, скорее всего, не удастся обойтись без антибиотиков. Назначать их должен врач, самолечение недопустимо. Препаратами выбора являются пенициллины, а при их непереносимости цефалоспорины первого поколения и макролиды.
Лечение хронического фарингита всегда длительное, оно предусматривает помимо устранения очага хронической инфекции в носоглотке, лечение сопутствующих заболеваний желудочно-кишечного тракта, эндокринных нарушений и др. При гипертрофическом фарингите разросшуюся лимфоидную ткань прижигают, воздействуя на нее электрическим током или холодом (электрокоагуляция или криотерапия). При атрофическом фарингите, наоборот, терапия направлена на увеличение секреции слизи и уменьшение такого симптома фарингита как сухость (смазывание глотки раствором Люголя в глицерине) и стимуляцию регенераторных процессов в слизистой (препараты витамина А, АТФ).
В лечении хронического фарингита широко используют физиотерапию:
ПРИЧИНЫ ФАРИНГИТА
Основная причина фарингита - это вдыхание холодного или загрязненного воздуха, влияние химических раздражений (спирт, табак). Инфекционный фарингит может быть спровоцирован различными микробами (стрепто-, стафило-, пневмококки, а также вирусами (гриппа, аденовирусы) и грибками (кандида). Нередко фарингит развивается вследствие распространения инфекции из какого-либо очага воспаления, прилежащего к глотке. Так развивается фарингит при синусите, рините, кариесе зубов.
По этиологическому фактору острые фарингиты можно разделить на вирусные, бактериальные, грибковые, аллергические, травматические (следствие попадания инородного тела или хирургического вмешательства) и вызванные воздействием раздражающих факторов (горячей жидкости или пара, кислот, щелочей, облучения и др.).
Хронические фарингиты обычно классифицируют не по этиологическому признаку, а по характеру развивающихся в слизистой оболочке изменений: катаральный (простой), атрофический (субатрофический) и гипертрофический. Указанные формы хронического воспаления часто сочетаются.
Так, наличие диффузных атрофических изменений в слизистой оболочке может сочетаться с очаговой гиперплазией лимфоидной ткани задней стенки глотки или тубофарингеальных валиков.
ПРОФИЛАКТИКА ФАРИНГИТА
Закаливание организма, исключение вредных факторов (курение, употребление алкоголя), восстановление нарушенного носового дыхания, повышение защитных сил организма (применение препаратов-иммунокорректоров, ИРС-19).
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
В настоящее время острые респираторные инфекции (ОРВИ), включая грипп, представляют собой одну из самых актуальных медицинских и социально-экономических проблем. Терапия острых респираторных инфекций (ОРИ) у детей остается важной задачей практического здравоохранения. В статье приведены данные по эпидемиологии, этиологии ОРИ, представлена клиническая картина ОРИ. Подробно описаны факторы и механизмы взаимодействия иммунной системы слизистой оболочки пищеварительного и респираторного трактов. Показано, что кишечная микробиота оказывает непосредственно модулирующее действие на иммунный ответ по отношению к патогенам, поражающим дыхательные пути. В статье рассмотрены результаты исследований по изучению эффективности влияния пробиотических микроорганизмов на состояние мукозального иммунитета, а также продемонстрированы клинические эффекты. Приведены результаты ряда исследований, демонстрирующих клиническую эффективность пробиотического штамма бифидобактерий Bifidobacterium animalis subsp. lactis ВВ-12. Описаны пробиотические продукты, содержащие живые микробные культуры с доказанными пробиотическими свойствами, целесообразность их включения в рацион питания детей.
Ключевые слова: острые респираторные инфекции, мукоза-ассоциированная лимфоидная ткань, микробиота, Bifidobacterium lactis ВВ-12, пробиотик.
Для цитирования: Каннер Е.В., Максимов М.Л., Ермолаева А.С., Горелов А.В. Острые респираторные инфекции у детей: особенности иммунного ответа и пути коррекции. РМЖ. Медицинское обозрение. 2018;8(II):74-78.
Acute respiratory infections in children: features of the immune response and ways of correction
E. V. Kanner 1 , M.L. Maximov 2 , A.S. Ermolaeva 3 , A.V. Gorelov 1,3
1 Central Research Institute of Epidemiology, Moscow
2 Kazan State Medical Academy — Russian Medical Academy of Continuing Professional Education
3 Sechenov University, Moscow
Nowadays, acute respiratory infections (ARI), including influenza, are one of the most pressing medical and socio-economic problems. Therapy of acute respiratory infections (ARI) in children remains an important task of practical health care. The article presents data on the epidemiology, etiology and clinical picture of ARI. Interaction factors and mechanisms of a mucous membrane immune system of digestive and respiratory tracts are described in detail. It has been shown that an intestinal microbiota has a directly modulating effect on the immune response in relation to pathogens affecting the respiratory tract. The article discusses the results of studies on the effectiveness of probiotic microorganisms on the state of mucosal immunity and demonstrates clinical effects. The results of a number of studies demonstrating the clinical efficacy of the probiotic strain of bifidobacteria Bifidobacterium animalis subsp. lactis BB-12 are given. Probiotic products containing live microbial cultures with proven probiotic properties, the expediency of their inclusion in children diet are described.
Key words: acute respiratory infections, mucosal-associated lymphoid tissue, microbiota, Bifidobacterium lactis BB-12, probiotic.
For citation: Kanner E. V., Maximov M.L., Ermolaeva A.S., Gorelov A.V. Acute respiratory infections in children: features of the immune response and ways of correction // RMJ. Medical Review. 2018. № 8(II). P. 74–78.
В статье приведены данные по эпидемиологии, этиологии острых респираторных инфекций, представлена их клиническая картина. Подробно описаны факторы и механизмы взаимодействия иммунной системы слизистой оболочки пищеварительного и респираторного трактов. Приведены результаты ряда исследований, демонстрирующих клиническую эффективность пробиотического штамма бифидобактерий Bifidobacterium animalis subsp. lactis ВВ-12.
Иммунная система СО организма играет огромную роль в развитии, поддержании и регуляции иммунного гомеостаза, являясь важной составляющей многокомпонентной системы иммунитета, осуществляя защиту организма от генетически чуждых ему экзогенных и эндогенных элементов [10].
Структурной основой местного иммунитета является лимфоидная ткань, ассоциированная с СО (mucosal-associated lymphoid tissue (MALT)). В MALT принято выделять несколько отделов (рис. 1): TALT (носоглотка, евстахиева труба, ухо; NALT (носовая полость, рот и ротоглотка, конъюнктивы), BALT (трахея, бронхи, легкие, грудные железы у женщин), GALT (пищевод, желудок, кишечник и урогенитальный тракт), SALT (дерма) [11]. 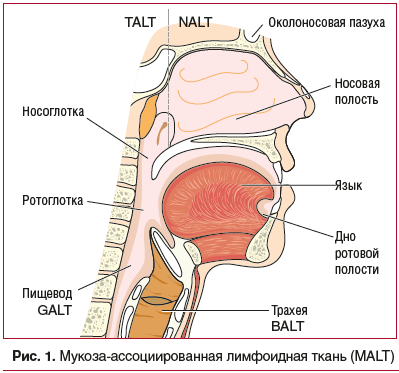
К факторам мукозальной иммунной системы относят сапрофитную микрофлору, защитный эпителий, слизеобразование, кератинизацию и слюнообразование, антимикробные пептиды (лизоцим, дефензины, лактоферрин, интерфероны, пропердин), фагоциты, комплемент, секреторный иммуноглобулин А (sIgA), IgG, врожденные лимфоидные клетки (ILC), включая NK-клетки, CD4+ и CD8+ Т-лимфоциты [10].
Несмотря на то, что в иммунной системе СО выделяют эффекторный и индуктивный отделы, это деление условно, потому что MALT-лимфоциты постоянно мигрируют, заселяя при этом характерные для каждой популяции зоны обитания. Такая закономерность получила название хоминг-эффекта [12]. Следствием этого является одновременное включение иммунного ответа во всех СО, вне зависимости от очага антигенного стимула.
В индуктивных зонах, к которым относят прежде всего пейеровы бляшки, происходит презентация антигена; антигенпрезентирующие клетки и антигенреактивные Т- и В-лимфоциты поступают в лимфу, затем в кровь, а оттуда мигрируют в собственную пластинку СО (эффекторный отдел). Направленная миграция осуществляется с помощью гуморальных факторов (интегрин α4b7, хемокиновый рецептор CCR9 и др.), а точками прикрепления являются хоминг-рецепторы клеток тканей [13]. В норме при отсутствии воспаления лимфоциты мигрируют предпочтительно в ту ткань, где они впервые обнаружили антиген, и поэтому их хоминг-рецепторы специфичны к лигандам, находящимся на клетках этих тканей [14]. Подобное взаимодействие именно между дыхательной и пищеварительной системами специфично, т. к. в экспериментах показано отсутствие такой взаимосвязи между другими органами [15].
Плазматические клетки собственной пластинки и пейеровых бляшек синтезируют димерную молекулу IgA, которая связывается на базальной поверхности эпителиальной клетки со специализированным трансмембранным белком, имеющим в своем составе гликопротеид — секреторный компонент. Пройдя с помощью трансцитоза эпителиальную клетку, димерная молекула IgA присоединяет секреторный компонент, превращается в sIgA, причем секреторный компонент делает молекулу иммуноглобулина устойчивой к протеолизу [16]; sIgA препятствует адгезии микроорганизмов, их токсинов, пищевых аллергенов на эпителии СО и тем блокирует их проникновение во внутреннюю среду организма. Адаптивный иммунитет СО обеспечивается главным образом антителами класса sIgA, в меньшей мере — IgM и IgG [17].
В настоящее время накоплены научные данные, свидетельствующие о том, что отделы СО различных систем организма тесно взаимодействуют между собой, подчиняясь единым регулирующим влияниям. Существует перекрестная регуляция иммунитета легких и кишечника, показано, что кишечная микробиота оказывает непосредственно модулирующее действие на иммунный ответ по отношению к патогенам, поражающим дыхательные пути [18, 19].
Теория единства иммунной системы анатомически не взаимодействующих СО была сформулирована J. Bienenstock около 40 лет назад [20]. Эта концепция предполагает, что различные отделы СО организма функционируют вместе как один системный орган, защищающий организм хозяина от чужеродных организмов. Стимуляция либо поражение слизистой одной системы в значительной мере влияет на СО другой системы. Подход к изучению иммунной системы слизистых как объединенного глобального органа является определяющим для дальнейших достижений в понимании иммунологии слизистых и в лечении многих заболеваний [21].
Особенно тесно такая взаимосвязь осуществляется между пищеварительным и респираторным трактом, т. к. они имеют общее эмбриональное происхождение, функционально сходны — их слизистые имеют контакт с внешней средой и осуществляют функцию первичной защиты от чужеродных патогенов, играя ключевую роль во врожденном и приобретенном иммунитете. В исследованиях было продемонстрировано, что вакцинация слизистой одного отдела ведет к повышению защитной функции слизистой другого отдела, инфицирование вирусом ведет к появлению вирусоспецифичных концентраций иммуноглобулинов в секрете слизистых другого отдела [19]. Также показано, что Т-клетки кишечника, зараженные ротавирусом, осуществляют защиту дыхательного тракта от ротавирусной инфекции [22].
Сообщается об увеличении числа нейтрофилов, эозинофилов и Т-клеток в мокроте пациентов с воспалительными заболеваниями кишечника (ВЗК) [23]. Микробиота ЖКТ играет защитную роль в отношении пневмококковой пневмонии [18].
На сегодняшний день нет точных доказательств существования единого медиатора, который выполнял бы роль связующего звена между кишечником и легкими, однако одним из кандидатов на эту роль является тимический стромальный лимфопоэтин (TSLP). TSLP является главным регулятором воспалительных процессов кожи и дыхательных путей, решающим фактором, регулирующим Th2-воспалительный ответ [24, 25]. Повышенная продукция TSLP в кератоцитах кожи ведет к появлению атопического дерматита с сопутствующим аллергическим воспалением в легких мышей [26].
Интерфероны (ИФН) I и III типа связываются с различными рецепторами на клеточной поверхности, но индуцируют сигналы сходной направленности, что приводит к экспрессии антивирусных эффекторных молекул-хозяев. Хотя было показано, что ИФН III типа (ИФН-λ) преимущественно воздействует на органы СО кишечника, в то же время отмечается и роль ИФН I типа (α), что сопровождается экспрессией рецепторов к нему на эпителиальных клетках, прежде всего дыхательной системы. ИФН-α оказывает влияние на дендритные клетки в лимфоэпителиальном глоточном кольце Пирогова — Вальдейера, активируя созревание незрелых дендритных клеток, стимулирующих, в свою очередь, созревание и пролиферацию В-клеток, а также способствует пролиферации СD4+ и CD8+ Т-23 клеток, усиливает цитотоксические свойства CD8+, макрофагов и NK-клеток [27].
Клетки эпителия кишечника, которые являются основными мишенями для ротавирусной инфекции, более сильно реагируют на ИФН III типа, чем на I тип. Таким образом, именно ИФН-λ (III тип) играет критическую роль в противовирусной защите эпителиальных клеток [28].
Сапрофитная микрофлора (в кишечнике и урогенитальном тракте это лактобактерии и бифидобактерии, в ротовой полости — сапрофитные нейссерии, в дерме — эпидермальный стафилококк) имеет определяющее значение для состояния мукозальной иммунной системы [11, 29]. Ее функции многообразны и включают антагонизм по отношению к патогенной микрофлоре за счет продукции органических кислот, перекиси водорода и бактериоцинов, синтез молочной кислоты и снижение рН, конкуренцию с патогенной флорой за адгезивные сайты (колонизационная резистентность), стимуляцию иммунных ответов за счет адъювантных свойств, стимуляцию муцинообразования [27, 30, 31].
И процессы возрастной эволюции, и закономерности реагирования на внедрение патогенов в биотопах кишечника и респираторного тракта во многом сходны. Так, количественный и качественный состав микробиоты приближается к схожему с таковым у взрослого человека в обоих биотопах к третьему году жизни. Известно, что существует перекрестная регуляция иммунитета легких и кишечника [18, 19, 32].
Это позволяет предположить, что воздействие на микробиоту кишечника может быть удобным инструментом для профилактики не только желудочно-кишечных, но и бронхолегочных заболеваний. Ряд исследований демонстрирует такой эффект при использовании диеты с высоким содержанием клетчатки, что стимулирует на реакцию дыхательных путей у мышей, или при приеме пробиотиков в дородовом или раннем послеродовом периоде для профилактики не только атопической экземы, но и бронхиальной астмы [33–36].
В биотопах человека функционируют устойчивые к инфекции молекулярно-клеточные компартменты, включающие пробиотические бактерии, синтезирующие лектиновые системы с разнообразным антипатогенным потенциалом [37]. Углубленное изучение механизмов участия микрофлоры биотопов в системе мукозального иммунитета позволило установить способность лектинов облигатных бактерий распознавать и связывать при развитии патологических состояний гликаны муцинов с остатками D-галактозамина или нейраминовой кислоты (NeuNAc, Neu5NAc) с участием системы комплемента [38, 39].
При совместном культивировании бифидобактерий и клеток кишечного мукозального барьера последние продуцируют повышенные уровни комплемента C3a, при этом бифидобактерии регулируют активность некоторых участвующих в воспалении генов. Bifidumbacterium breve IPLA20004 могут способствовать рекрутированию клеток врожденного иммунитета в мукозальную оболочку [40].
Только для зарегистрированных пользователей
Возбудители острых респираторных инфекций попадают в дыхательные пути при вдыхании мельчайших капель, содержащих вирусные или бактериальные частицы.
Источники инфекции – заболевшие или носители инфекций.
Возбудители острых респираторных инфекций, в основном, вирусы, бактерии. Определить природу инфекции и назначить адекватное лечение может только врач.
Знать причину инфекции важно для предупреждения различных осложнений, порой опасных для жизни.
Наибольшую опасность для жизни по частоте осложнений представляет вирус гриппа, но стоит помнить, что для людей с иммунодефицитными состояниями, а также новорожденных детей, беременных женщин и пожилых людей опасность может представлять даже безобидная инфекция.
Наиболее распространённые возбудители острых респираторных инфекций в осенне-зимний период – вирусы гриппа А,В,С , вирусы парагриппа, аденовирусы, коронавирусы и др.

Грипп – начинается внезапно, температура тела, как правило, высокая, осложнения развиваются часто и быстро, в некоторых случаях молниеносно. Среди осложнений чаще всего выявляются пневмония, отит, миокардит и перикардит.
Все эти осложнения опасны для жизни и требуют немедленного лечения.

Респираторно-синцитиальный вирус (Human orthopneumovirus) вызывает инфекции легких и дыхательных путей. Большинство детей хотя бы один раз были заражены вирусом к 2 годам. Респираторно-синцитиальный вирус также может инфицировать взрослых.
Симптомы заболевания у взрослых, а также детей обычно легкие и имитируют простуду, но в некоторых случаях инфицирование этим вирусом может вызвать тяжелую инфекцию. В группе риска недоношенные дети, пожилые люди, новорожденные и взрослые с заболеваниями сердца и легких, а также с иммунодефицитными состояниями.

Метапневмовирус (Human metapneumovirus) вызывает инфицирование верхних дыхательных путей у людей всех возрастов, но чаще всего встречается у детей, особенно в возрасте до 5 лет.
Симптомы включают насморк, заложенность носа, кашель, боль в горле, головную боль и лихорадку. У очень небольшого числа людей может появиться одышка.
В большинстве случаев симптомы проходят самостоятельно через несколько дней.
Риску развития пневмонии после этой инфекции, особенно подвержены лица старше 75 лет или с ослабленной иммунной системой.

Риновирус (Rhinovirus) - наиболее распространенная причина инфекции верхних дыхательных путей.
Часто как осложнение риновирусной инфекции развиваются ангины, отиты и инфекции пазух носа. Также риновирусы могут вызывать пневмонию и бронхиолит.
Осложнения риновирусной инфекции, как правило, возникают среди ослабленных лиц, особенно у пациентов с астмой, младенцев, пожилых пациентов и пациентов с ослабленным иммунитетом. В большинстве случаев риновирусная инфекция запускает обострение хронических заболеваний.

Аденовирусная инфекция (Adenoviridae) — группа острых вирусных заболеваний, проявляющихся поражением слизистых оболочек дыхательных путей, глаз, кишечника и лимфоидной ткани преимущественно у детей и лиц молодого возраста.
Дети чаще болеют аденовирусной инфекцией, чем взрослые. Большинство детей переболеют, по крайней мере, одним типом аденовирусной инфекции к тому времени, когда им исполнится 10 лет.
Аденовирусная инфекция быстро распространяется среди детей, дети часто касаются руками лица, берут пальцы в рот, игрушки.
Взрослый может заразиться во время смены подгузника ребенку. Также инфицирование аденовирусной инфекцией возможно при употреблении пищи, приготовленной кем-то, кто не вымыл руки после посещения туалета, или, плавая в воде бассейна, который плохо обрабатывается.
Аденовирусная инфекция обычно протекает без осложнений, симптомы проходят через несколько дней. Но клиническая картина может быть более серьезной у людей со слабой иммунной системой, особенно у детей.
Среди вирусных инфекций, вызывающих респираторные инфекции также выделяют коронавирусную, бокавирусную инфекцию. Все перечисленные вирусные инфекции имеют схожую клиническую картину и риск развития осложнений среди ослабленных лиц.
Среди бактериальных возбудителей острых респираторных инфекций особую эпидемическую опасность представляют следующие:


Инфекция, вызванная Сhlamydia pneumoniae - существенная причина острых респираторных заболеваний как нижних, так и верхних отделов органов дыхания, и составляет примерно 10% случаев внебольничных пневмоний.
Бактерии вызывают заболевание, повреждая слизистую оболочку дыхательных путей, включая горло, дыхательные пути и легкие.
Пожилые люди подвергаются повышенному риску тяжелого заболевания, вызванного инфекцией C. pneumoniae , включая пневмонию.
Места повышенного риска инфицирования:

Симптомы пневмококковой инфекции зависят от локализации возбудителя. Симптомы могут включать лихорадку, кашель, одышку, боль в груди, скованность шеи, спутанность сознания и дезориентацию, чувствительность к свету, боль в суставах, озноб, боль в ушах, бессонницу и раздражительность. В тяжелых случаях пневмококковая инфекция может привести к потере слуха, повреждению мозга и летальному исходу.
Большему риску инфицирования подвержены путешественники, при посещении стран, где пневмококковая вакцина не используется регулярно.
Некоторые люди чаще заболевают пневмококковой инфекцией. Это взрослые в возрасте 65 лет и старше и дети младше 2 лет. Люди с заболеваниями, которые ослабляют иммунную систему, такие как диабет, болезни сердца, заболевания легких и ВИЧ / СПИД, а также лица, которые курят или страдают астмой, также подвергаются повышенному риску заболеть пневмококковой инфекцией.

Возбудитель гемофильной инфекции - Haemophilus influenzaе.
Гемофильная инфекция характеризуется поражением
-
органов дыхания (развитие тяжелейших пневмоний);
центральной нервной системы;
развитием гнойных очагов в различных органах.
В детском возрасте гемофильная инфекция протекает часто с поражением верхних дыхательных путей, нервной системы, у взрослых чаще встречается пневмония, вызванная гемофильной палочкой.
Летальность вследствие гнойного менингита достигает 16-20% (даже при своевременной диагностике и правильном лечении!).
Профилактика острых респираторных заболеваний
Наиболее эффективным методом профилактики является специфическая профилактика, а именно введение вакцин.
Путем вакцинации возможно предупреждение пневмококковой, гемофильной инфекций, а также гриппа.
Вакцинация детей против пневмококковой инфекции проводится в плановом порядке, в соответствии с национальным календарем профилактических прививок, в возрасте 2 месяца (первая вакцинация), 4,5 месяца (вторая вакцинация), 15 месяцев – ревакцинация, а также в рамках календаря профилактических прививок по эпидемическим показаниям - детей в возрасте от 2 до 5 лет. Также вакцинация против пневмококковой инфекции показана призывникам (во время осеннего призыва).
Вакцинация против гемофильной инфекции:
Первая вакцинация детей групп риска проводится в возрасте 3 месяцев, вторая в 4,5 месяцев, третья – 6 месяцев. Ревакцинация проводится детям в возрасте 18 месяцев.
Вакцинация против гриппа проводится ежегодно в предэпидемический период.
Неспецифическая профилактика заключается в соблюдении правил личной гигиены, а также в соблюдении принципов здорового образа жизни.
Принципы здорового образа жизни:
-
здоровое (оптимальное) питание
достаточная физическая активность соответствующая возрастной группе
отсутствие вредных привычек
Для профилактики респираторных инфекций в период подъема заболеваемости целесообразно использовать барьерные средства предотвращения инфекций, а именно медицинские маски или респираторы.
В очагах инфекции необходимо проводить дезинфекционные мероприятия – влажную уборку с дезраствором.
Заболевший должен быть изолирован, контакты с заболевшим должны быть сведены к минимуму.
Правила личной гигиены
Регулярное мытье рук, особенно после посещения общественных мест, поездок в общественном транспорте, перед приемом пищи.
Если мыло и вода недоступны, необходимо использовать антибактериальные средства для рук (содержащим не менее 60% спирта) - влажные салфетки или гель.
Не следует прикасаться к глазам, носу или рту. Если в этом есть необходимость, - убедитесь, что ваши руки чисты.
При кашле или чихании важно прикрывать рот и нос одноразовой салфеткой (после чего она должна быть выброшена) или рукавом (не руками).
Важно избегать близких контактов, таких как поцелуи, объятия или совместное использование посудой и полотенцами с больными людьми.
Во избежание распространения инфекции, в случае инфицирования – вызовите врача и оставайтесь дома!
Читайте также:


