Клиника диагностика и лечение инфекционного мононуклеоза у детей
Инфекционный мононуклеоз является полиэтиологичным заболеванием и может вызываться различными лимфотропными инфекциями. В соответствии с МКБ 10 выделяют ИМ, вызванный гамма-герпесвирусом (вирусом Эпштейна-Барр (ВЭБ) или герпесвирусом 4-го типа), цитомегаловирусный ИМ, ИМ другой этиологии (на фоне аденовирусной инфекции, токсоплазмоза; инфекции, вызванной герпесвирусом 6-го или 7-го типа; в острую стадию ВИЧ-инфекции и т.д.) и ИМ неуточненной этиологии (в тех случаях, когда у пациентов с клиническими признаками ИМ не удается обнаружить ни один из известных возбудителей данного заболевания). Однако, как правило, если отдельно вопрос этиологии ИМ не оговаривается, это заболевание связывают с ВЭБ-инфекцией (ВЭБИ). Считается, что более 80-95% всех случаев типичного ИМ ассоциировано с ВЭБИ.
ВЭБ обладает тропизмом к различным клеткам, но основной мишенью для него являются В-лимфоциты и дендритные клетки, несущие на себе рецептор CD21 (или CR2 – рецептор для C3d компонента системы комплемента). Кроме В-лимфоцитов, поражается эпителий слизистой носоглотки и протоков слюнных желез. В определенных ситуациях могут инфицироваться Т-лимфоциты и NK-клетки, моноциты/макрофаги, нейтрофилы, миоэпителиальные и гладкомышечные клетки. Как и при других инфекционных заболеваниях, вызывающихся лимфотропными вирусами, исходы острой ВЭБ-инфекции (ВЭБИ) могут быть разными и являются интегративным показателем взаимодействия вируса и иммунной системы человека.
В организме человека ВЭБ может находиться в двух состояниях: в фазе активной инфекции и в латентном состоянии. Активная фаза ВЭБИ характеризуется значительным накоплением вирусных частиц, гибелью пораженных клеток, выходом вируса во внеклеточное пространство и инфицированием доступных для ВЭБ чувствительных клеток. Такой вариант развития вируса касается, в первую очередь, эпителиальных клеток ротоглотки и в значительно меньшей степени – В-лимфоцитов. Этот процесс имеет место при острой инфекции и при обострении хронической. Именно в этом цикле жизнедеятельности вируса возможно подавление его активности с помощью противовирусных препаратов, блокирующих вирусную ДНК-полимеразу и обрывающих синтез вирусной ДНК (ацикловир, валацикловир, ганцикловир, фоскарнет и др.).
При отсутствии адекватного контроля со стороны основных факторов противовирусного иммунитета (цитотоксические лимфоциты, NK-клетки, Th1-зависимые механизмы иммунного ответа) возможна неконтролируемая пролиферация ВЭБ(+) В-лимфоцитов (т.е. клеток, несущих чужеродную генетическую информацию). Потенциально это может привести к развитию В-клеточной лимфопролиферативной болезни (нередко проявляющейся малигнизацией, особенно у людей с исходным иммунодефицитом). ВЭБ-ассоциированными более чем в половине случаев являются лимфома Беркитта (в странах Африки), назофарингеальная карцинома, смешанно-клеточная лимфома Ходжкина, ряд опухолей у больных со СПИД-ом (лимфомы головного мозга, гладко-мышечная опухоль, плазмобластная лимфома, ходжкинская лимфома им др.), внеузловая NK/T-лимфома, NK-лейкемия и др.
Кроме того, ВЭБ способен вызывать поликлональную стимуляцию В-лимфоцитов, что в ряде случаев может привести к развитию аутоиммунных заболеваний (иммунные цитопении, рассеянный склероз и некоторые другие).
В тех случаях, когда происходит значительное (по экспансии и уровню вирусной нагрузки) инфицирование клеток, участвующих в защите от вируса, развиваются тяжелые, угрожающие жизни человека варианты течения ВЭБИ. Преимущественное инфицирование CD8+ лимфоцитов приводит к развитию гемофагоцитарного синдрома. В основе формирования двух вариантов хронической активной ВЭБИ лежит поражение соответственно CD4+ лимфоцитов или NK- клеток. Значительно более редкими формами хронической ВЭБИ (ХВЭБИ) являются интерстициальная пневмония, поражения ЦНС, аневризмы коронарных артерий (как при болезни Кавасаки). Одним из необычных проявлений хронической ВЭБИ является гиперчувствительность к укусам комаров.
Хорошо известно, что у детей раннего возраста острая ВЭБИ в большинстве случаев протекает субклинически или в стертой форме, без развития клиники ИМ. По некоторым данным, наиболее распространенной формой первичной ВЭБИ у детей является ОРИ, на долю которой приходится более 40 % всех случаев. Однако этот вариант течения острой ВЭБИ не имеет каких-либо специфических проявлений и обычно не верифицируется. Наиболее известным вариантом острой ВЭБИ и вторым по частоте (около 18 % всех случаев инфекции) является ИМ, имеющий очень специфические клинические проявления. Эта форма острой ВЭБИ считается характерной, в первую очередь, для подростков и молодых людей.
Таким образом, главное, что следует помнить про патогенез ИМ – в основе развития заболевания лежит индуцированное вирусом иммунное воспаление (иммуно-патологический процесс), протекающее с поражением ВЭБ-инфицированных клеток, в первую очередь В-лимфоцитов и эпителиоцитов слизистой небных миндалин. В период разгара ИМ около 10-20 % всех циркулирующих в периферической крови В-лимфоцитов. С учетом того, что в периферической крови в каждый момент времени находится всего 0,2-2% всех лимфоцитов организма человека, основным местом поражающего действия вируса являются лимфоидные органы, а в них — В-зоны (где находятся В-лимфоциты) и дендритные клетки.
По мере выздоровления количество ВЭБ(+) В-лимфоцитов уменьшается до определенного стабильного минимального уровня и в последующем сохраняется пожизненно. В крови здоровых людей содержится от 1 до 50 инфицированных ВЭБ-ом клеток на один миллион В-лимфоцитов. При этом у здоровых носителей около 5% периферических мононуклеарных клеток (в первую очередь, Т-лимфоцитов) направлены против ВЭБ, что говорит о значимости для организма человека постоянного контроля над этой инфекцией.
При благоприятном течении острой ВЭБИ по мере снижения вирусной и антигенной нагрузки параллельно с этим основная часть активированных Т-лимфоцитов, выполнивших свою функцию, погибает по механизму апоптоза, а остальные превращаются в клетки памяти.
Клинические проявления ИМ складываются из признаков синдрома системного воспалительного ответа (ССВО), поражений лимфоидных органов и ангины. Манифестация происходит, как правило, бурно с резкого повышения температуры, появления признаков интоксикации (чаще умеренно выраженных), болей в горле, заложенности носа без насморка (вследствие аденоидита) и храпа во сне. Увеличиваются шейные (прежде всего, заднешейные) и подчелюстные лимфоузлы, и нередко может отмечаться генерализованная лимфоаденопатия. Иногда лимфоаденопатия предшествует появлению развернутой клиники ИМ, опережая ее на 5-7 дней. Часто, но не всегда, образуются налеты на миндалинах, которые могут плохо сниматься шпателем (т.к. представляют собой не только компоненты воспалительного экссудата, но и погибший эпителий слизистой). Более чем у половины больных определяется увеличение печени и/или селезенки. Важным в дифференциальной диагностике между банальной стрептококковой ангиной (требующей антибактериальной терапии) и экссудативным тонзиллитом при ИМ является отсутствие или незначительная боль в горле. Т.е. когда налетына миндалинах – большие, а горло не болит, это должно заставить задуматься врача о ИМ.
Развитие всех клинических проявлений ИМ происходит в течение нескольких суток. В эти сроки симптоматика может нарастать и дополняться. Важно помнить, что развернутая клиника ИМ, все перечисленные симптомы у одного больного встречают редко. Обычно один или несколько симптомом отсутствуют. И в этом случае следует подтверждать диагноз лабораторно.
Как правило, большинство врачей ориентируется на наличие в общем анализе крови (ОАК) атипичных мононуклеаров (АМ) в количестве >10%. Это действительно позволяет констатировать ИМ. Однако, следует помнить, что АМ появляются в крови не сразу, часто с 4-5-го дня болезни, а иногда только на второй неделе заболевания. Кроме того, примерно у 5% пациентов они могут вовсе отсутствовать. В этом случае следует ориентироваться на клинические проявления и наличие в ОАК преобладания лимфоцитов и моноцитов: наличие у ребенка ангины, которая сопровождается лимфоцитозом должно навести врача на мысль о том, что ангина какая-то специфическая.
Банальные стрептококковые тонзиллиты обычно вызывают выраженные воспалительные изменения в ОАК (лейкоцитоз, нейтрофилез, выраженный сдвиг лейкоцитограммы влево, когда молодые формы нейтрофилов составляют 15-20% и более). При ИМ небольшой сдвиг формулы крови влево тоже часто имеет место (обычно в пределах 6-12%, как одно из проявлений ССВО), однако при этом отмечается лимфомоноцитоз. Кроме того, некоторые инфекции, способные протекать с мононуклеозоподобным синдромом (аденовирусная, например), не сопровождаются лимфоцитозом в лейкоцитограмме, а протекают с нейтрофилезом или нормоцитозом [Melon2005].
Следует помнить, что тяжелое поражение печени с развитием желтушной формы гепатита (и иногда даже фульминантного гепатита) связано не с вирусным цитолизом гепатоцитов (ВЭБ не имеет тропизма к этим клеткам), а с инфицированием в печени местных Т- и T/NK-лимфоцитов, которые и вызывают поражение гепатоцитов (клеточно-опосредованный цитолиз).
В качестве дополнительных лабораторных тестов для доказательства ВЭБИ могут быть использованы:
- методы определения титра гетерофильных антител (у нас – это реакция Пауль-Буннеля, за рубежом – monospot test). Диагностическая значимость его невелика, но в определенных ситуациях это исследование помогает в диагностике. Основным его достоинством является то, что гетерофильные антитела обнаруживаются при первичном ВЭБ-ассоциированном ИМ и не определяются при ИМ другой этиологии. Недостатком метода является его частый ложноотрицательный ответ у дошкольников и младших школьников,
- серологические методы: обнаружение IgM к капсидному антигену (viral capsid antigen) и IgG к раннему антигену ВЭБ (Epstein-Barr early antigen), соответственно анти-VCA IgM и анти EB EA IgG,
- определение ДНК ВЭБ методом ПЦР в крови (плазме или сыворотке), что всегда свидетельствует об активной репликации вируса (в отличие от ее обнаружения в мононуклеарах – в основном, в В-лимфоцитах - периферической крови).
Показанием к назначению АБТ могут быть и некоторые осложнения ИМ. Так вследствие аденоидита повышается вероятность развития отитов и синуситов. Поэтому наряду с применением средств улучшающих носовое дыхание (об этом речь пойдет ниже) в комплексную терапию следует включать и АБ, эффективны в отношении наиболее вероятных этиологических факторов этих осложнений (пневмококк, гемофильная палочка): цефалоспорины 2-3-го поколения, при их непереносимости – азитромицин.
В ситуации, когда налеты на миндалинах есть, а воспалительные изменения в общем анализе крови отсутствуют (лимфомоноцитоз с нейтропенией и отсутствием или незначительным – до 10-12% молодых форм нейтрофилов – сдвигом лейкоцитограммы влево) и уровень СРБ невысокий (до 50-70 мг/л), боль в горле незначительная или отсутствует высока вероятность участия в воспалении нормальной анаэробной флоры , активировавшейся на фоне заболевания. В этом случае можно попытаться включить в схему терапии метронидазол 7,5-10 мг/кг 3 раза в день на 7-10 дней (с оценкой эффекта через 3-4 дня: если налеты не уменьшились или уменьшились незначительно, препарат стоит отменить).
Однако при хронических ВЭБ-ассоциированных заболеваниях, при которых вирус находится в литическом цикле развития, противовирусные препараты могут иметь эффект (волосатая лейкоплакия языка, хроническая активная ВЭБИ).
Кроме того, включение противовирусных препаратов, возможно, будет полезным при тяжелых атипичных формах острой ВЭБИ, протекающих с поражением внутренних органов (фульминантный гепатит, кардит, пульмонит) и ЦНС (энцефалит, менингоэнцефалит). По-видимому, это связано с тем, что развитие этих вариантов острой ВЭБИ обусловлено поражением вирусом нетипичных для этой инфекции клеток (CD8+ цитотоксических лимфоцитов, CD4+ клеток, NK-клеток, моноцитов/макрофагов).
Больше всего вопросов в лечении ИМ возникает в отношении применения глюкокортикостероидов (ГКС). В 50-60-х годах прошлого века эти препараты применялись широко и, как считалось, с хорошим эффектом. Затем в связи с потенциально онкогенными свойствами ВЭБ, иммуносупрессивным действием ГКС и неясными последствиями действия двух этих факторов на организм каждого конкретного больного, от применения ГКС при неосложненном течении ИМ отказались. Однако и в наше время проводятся исследования по оценке влияния ГКС на пациентов с ИМ. Существуют работы, в которых показывается как эффективность этих препаратов (по крайней мере, кратковременная и в отношении некоторых симптомов), так и отсутствие влияния ГКС на степень выраженности и продолжительность сохранения симптоматики ИМ.
Мнение автора этой статьи совпадает с мнением первой группы ученых, т.к. я неоднократно видел клинический эффект от применения ГКС у детей с ИМ. Исходя из патогенеза заболевания, такого эффекта ГКС следует ожидать. Другое дело, надо ли всем детям с ИМ назначать ГКС? Однозначно – нет! ИМ - это самолимитирующееся заболевание, которое в подавляющем большинстве случаев заканчивается выздоровлением в течение 7-14 дней (здесь речь идет об острых проявлениях инфекции, т.к. остаточные явления в виде полиаденопатии, гепатолиенального синдрома, гипертрофии миндалин могут сохраняться от нескольких недель до нескольких месяцев). Показаниями к назначению ГКС должны быть только тяжелые формы ИМ, сопровождающиеся тяжелой обструкцией верхних дыхательных путей (обычно, верхних в виде тяжелого аденоидита), различными цитопениями, поражениями нервной системы. Причем, если ГКС назначаются, это не должно быть одно-двукратное введение. Обычно рекомендуется 7-14-дневный курс терапии: в течение половины этого срока назначают ГКС из расчета 1 мг/кг/сут по преднизолону (максимум – 60 мг/сут), внутрь, а затем в течение оставшегося срока дозу постепенно снижают вплоть до отмены. В некоторых случаях при неэффективности обычных доз ГКС прибегают к пульс-терапии метилпреднизолоном (15-30 мг/кг, в/вено, в течение часа, 1 раз в день, 3 дня подряд) с последующей постепенной отменой (ежедневно доза снижается на 50% вплоть до отмены).
В русскоязычной литературе последние годы широко обсуждался вопрос о применении. Если исходить из представленных выше данных о патогенезе ИМ, становится понятным, что в острый период заболевания нет необходимости в дополнительной иммуностимуляции уже развившегося иммуноопосредованого воспаления. Такая необходимость может возникнуть в периоде поздней реконвалесценции (с 3-й недели до 3-х месяцев), т.к. в это время у людей, перенесших ИМ, развивается вторичный иммунодефицит, выраженный в разной степени. Резюмируя ту информацию, которая есть в литературе по применению иммуностимуляторов, следует сказать, что при наличии клинических признаков вторичного иммунодефицита (ребенок стал чаще и дольше болеть разными инфекционными заболеваниями после перенесенного ИМ) может возникнуть необходимость в иммунокоррекции. Но в настоящее время нет надежных и доступных методов оценки эффективности разных иммуностимуляторов у конкретного ребенка. Поэтому с учетом различной чувствительности иммунной системы ребенка к разным иммуномодуляторам, подбирать такую терапию придется эмпирически и без гарантии успеха. Успокаивает только то, что у большинства детей в течение 1,5-4 месяцев изменения в работе иммунной системы нивелируются. Хотя с учетом возможности формирования активной хронической ВЭБИ вопрос о необходимости и тактике применения иммуномодуляторов остается открытым.
Говоря о поражении печени при ИМ, нельзя обойти стороной и вопрос о правильном питании таких пациентов. Нередко в нашей литературе указывают на необходимость назначения молочно-растительной диеты. Серьезных исследований по этому вопросу не поводилось. На самом деле для этого нет никаких оснований и ориентироваться нужно только на потребности ребенка, его пищевые пристрастия, аппетит и переносимость пищи. Естественно, какие-то разумные ограничения должны быть (не запрещение, а ограничение жирных и жареных продуктов, острых блюд и т.д.), однако такой образ питания полезен не только больному, но и здоровому человеку. Таким образом, пациент с ИМ должен просто правильно питаться без больших ограничений. Только больные с тяжелыми желтушными формами ИМ будут нуждаться в более строгой диете, как и больные с аналогичными формами вирусных гепатитов.
Основное же место в лечении больных с ИМ занимает симптоматическая терапия. При высокой лихорадке назначают жаропонижающие препараты (у детей это обычно парацетамол 10-15 мг/кг до 4 раз в сутки и ли ибупрофен 5-10 мг/кг до 3 раз в сутки), лучше чередуя для сохранения эффекта. При выраженных болях в горле применяют ибупрофен в той же дозе 3 раза в день, не зависимо от температуры. Полоскать рот достаточно просто водой после каждого приема пищи (применение местных антисептиков не влияет на скорость выздоровления и выраженность клинической симптоматики). Тем пациентам, которым субъективно становится легче после соляно-содовых полосканий, не стоит запрещать это делать.
Таким образом, в основе клинической манифестации ИМ лежит иммунопатологическое воспаление, индуцированное ВЭБ-ом и опосредованное, прежде всего, факторами клеточного иммунитета. Заболевание в большинстве случаев протекает благоприятно и самостоятельно заканчивается выздоровлением. Основную роль в лечении больных с ИМ играет симптоматическая терапия, направленная на облегчение симптомов болезни. Применение антибиотиков должно быть хорошо обоснованным. Наличие налетов на миндалинах не является достаточным основанием для АБТ. В тяжелых и осложненных случаях терапия дополняется назначением короткого курса ГКС. Они показаны пациентам с обструкцией дыхательных путей, с различными цитопениями, с поражением нервной системы. Назначение Н1-блокаторов, витаминов, гепатопротекторов, местных антисептиков и т.д. в подавляющем большинстве случаев не требуется. Никакая специальная диета детям с ИМ, как правило, не нужна.
КУДИН Александр Петрович, к.м.н., доцент, зав.отделением № 5 УЗ ГДИКБ.
(Мононуклеоз)
, MD, Brigham and Women’s Hospital, Harvard Medical School
Last full review/revision February 2018 by Kenneth M. Kaye, MD


Вирус Эпштейна – Барр – герпесвирус, который заражает 50% детей до 5 лет. Более 90% взрослых являются сероположительными в отношении ВЭБ. Его хозяин – человек.
ВЭБ-инфекция обычно протекает бессимптомно.
Патофизиология
После начальной репликации в носоглотке ЭБВ инфицирует В-лимфоциты. Морфологически аномальные (нетипичные) лимфоциты развиваются в основном из CD8+ Т-клеток, которые реагируют на инфекцию.
После первичной инфекции вирус Эпштейна–Барр остается в организме-носителе, прежде всего в В-лимфоцитах, пожизненно, после чего происходит нестабильное бессимптомное вирусовыделение из клеток ротоглотки. Вирус можно обнаружить в орофарингеальных выделениях у 15–25% здоровых взрослых, серопозитивных по вирусу Эпштейна – Барр. Распространение увеличивается и растет титр у пациентов с ослабленным иммунитетом (например, реципиенты аллотрансплантата, зараженные ВИЧ).
Вирус Эпштейна – Барр не выявляется в источниках окружающей среды и не является очень контагиозным.
Передача может произойти через переливание препаратов крови, но намного более часто передача происходит при поцелуях между незараженным и серопозитивным человеком, который передает вирус Эпштейна – Барр бессимптомно. Только приблизительно 5% пациентов заражаются этим вирусом от больных с острой инфекцией.
Ранняя передача в детстве происходит более часто среди социально-экономических групп низкого уровня и при стеснённых условиях проживания.
Вирус Эпштейна–Барр статистически связан с нижеуказанными патологиями и, вероятно, выступает для них причинным фактором:
Некоторые опухоли В-клеток у пациентов с иммунодефицитом
Вирус Эпштейна – Барр не вызывает хронического синдрома усталости. Однако, он может иногда вызывать синдром лихорадки, промежуточного пневмонита, панцитопении и увеита (т.е. хронически активный вирус Эпштейна – Барр).
Клинические проявления
У большинства маленьких детей первичная инфекция Эпштейна – Барр является бессимптомной. Признаки инфекционного мононуклеоза развиваются чаще всего у детей старшего возраста и взрослых.
Инкубационный период составляет приблизительно 30–50 дней. Утомляемость может длиться в течение месяцев, но обычно максимальна во время первых 2–3 недель.
У большинства пациентов присутствует триада из
Лихорадка обычно достигает максимума днем или рано вечером, с температурой до 39,5 ° С, но может быть и выше – 40,5 ° С.
Клиническая картина фарингита может быть тяжелой с выраженным болевым и эксудативным симптомом и может напоминать стрептококовый фарингит.


Аденопатия обычно симметричная и может поражать любую группу узлов, особенно передние и задние цервикальные цепи. Aденопатия может быть единственным проявлением.
Другие симптомы и признаки включают:
Умеренная гепатомегалия и болезненность при перкуссии печени
Периорбитальный отек и палатальные петехии
Реже – макулопапулезная сыпь
Спленомегалия, которая встречается приблизительно в 50% случаев, максимальна во время 2-й и 3-й нед. и обычно проявляется только слегка пальпируемым кончиком селезенки.
Хотя восстановление обычно полное, осложнения могут быть существенными.
Неврологические осложнения редки, но могут включать энцефалит, припадки, синдром Гийена – Барре, периферическую невропатию, вирусный менингит, миелит, параличи черепных нервов и психоз. Энцефалит может проявиться мозжечковой дисфункцией, а в ряде случаев он может быть масштабным и быстро прогрессирующим, как при герпетическом энцефалите, но обычно самоограничивается.
Гематологические осложнения обычно купируются самостоятельно. Они включают:
Переходная умеренная гранулоцитопения или тромбоцитопения встречаются приблизительно у 50% пациентов; тяжелые случаи, связанные с бактериальной инфекцией или кровотечением, происходят менее часто. Гемолитическую анемию часто обуславливают специфические анти-i-антитела – холодовые агглютинины.
У разрыва селезенки могут быть серьезные последствия. Разрыв может быть результатом увеличения селезенки и опухоли капсулы, которые являются максимальными спустя 10–21 день после проявления. История травмы присутствует только приблизительно у половины больных. Разрыв является обычно болезненным, но иногда вызывает безболезненную гипотонию. Для информации о лечении, Травмы селезенки : Лечение.
Респираторные осложнения включают в себя изредка обструкцию верхних дыхательных путей из-за глоточного или паратрахеального увеличения лимфатических узлов; осложнения со стороны респираторной системы могут быть купированы кортикостероидами. Клинически невыраженные промежуточные легочные инфильтраты встречаются главным образом у детей и обычно видимы только при рентгенографии.
Осложнения со стороны печени включают повышенные уровни аминотрансферазы (приблизительно в 2–3 раза к норме, возвращаются к базовым показателям через 3–4 нед); они наблюдаются приблизительно у 95% пациентов. Если желтуха или более выраженное повышение уровня фермента обнаруживаются, то следует предположить другие причины гепатита.
Широко распространенная и при этом опасная инфекция Эпштейна–Барр возникает спорадически, но сразу по несколько случаев может регистрироваться в семьях, особенно в тех, где наблюдается X-сцепленный лимфопролиферативный синдром. Оставшиеся в живых после такой первичной инфекции вируса Эпштейна – Барр подвергаются риску заболеть агаммаглобулинемией или лимфомой.
Диагностика
Тест на гетерофильные антитела
Иногда серологический тест на наличие вируса Эпштейна-Барр
Инфекционный мононуклеоз следует предполагать у пациентов с типичными симптомами и признаками. Экссудативный фарингит, увеличение передних шейных лимфатических узлов и лихорадка могут быть клинически неотличимыми от симптомов, вызываемых бета-гемолитическими стрептококками группы А. Однако аденопатия задней части шеи или генерализованная аденопатия или гепатоспленомегалия в большей степени указывает на инфекционный мононуклеоз. Важно, что обнаружение стрептококков в ротоглотке не исключает инфекционный мононуклеоз.
Первичная ВИЧ-инфекция может манифестировать клинической картиной, напоминающей острую инфекцию Эпштейна – Барр. Если у пациентов имеются факторы риска развития ВИЧ-инфекции, необходимо выполнить следующие тесты:
Количественное определение вирусной нагрузки РНК ВИЧ в крови
Комбинированный иммуноферментный анализ на антитела и анализ на антиген р24
Иммуносорбентный анализ на ВИЧ (ELISA)/Вестерн-блоттинг обычно отрицателен во время острой инфекции и, таким образом, не должен быть использован в одиночку для диагностики ранней первичной ВИЧ-инфекции. Количественный анализ на РНК ВИЧ и определение антигена p24 являются более чувствительными методами для диагностики острой ВИЧ-инфекции, поскольку РНК ВИЧ и антиген p24 присутствуют в крови еще до того, как появляются антитела к ВИЧ
Первичная ВИЧ-инфекция может иметь сходство с острой инфекцией Эпштейна–Барр; пациентам, находящимся в группе риска ВИЧ-инфекции, следует провести количественный тест на вирусную нагрузку в крови (тест на РНК ВИЧ), комбинированный иммуноферментный анализ на антитела и анализ на антиген р24.
Цитомегаловирус может вызвать синдром, подобный инфекционному мононуклеозу, с нетипичным лимфоцитозом, а также гепатоспленомегалией и гепатитом, но обычно без тяжелого фарингита.
Токсоплазмоз может вызвать синдром, подобный инфекционному мононуклеозу, с лихорадкой и лимфаденопатией, но обычно без фарингита.
Лабораторная диагностика обычно включает общий анализ крови и серологический анализ на вирус Эпштейна – Барр. Морфологически атипичные лимфоциты составляют до 30% белых телец крови. Хотя отдельные лимфоциты могут быть подобны лейкемическим лимфоцитам, лимфоциты являются гетерогенными, что маловероятно при лейкемии. Нетипичные лимфоциты могут также присутствовать при ВИЧ или цитомегаловирусной инфекции, гепатите B, гриппе B, краснухе или других вирусных болезнях, таким образом, диагноз требует серологического анализа. Однако очень высокое количество нетипичных лимфоцитов, как правило, отмечается только при первичном вирусе Эпштейна – Барр и цитомегаловирусной инфекции.
Чтобы диагностировать острую инфекцию Эпштейна–Барр используются два серологических анализа:
Анализ на гетерофильные антитела
Тест на специфические антитела к ВЭБ
Наличие гетерофильных антител определяют с использованием различных тестов агглютинации на твердой подложке (монопятно). Однако эти антитела присутствуют только у 50% пациентов 5 лет и приблизительно у 80–90% подростков и взрослых с инфекционным мононуклеозом. Важно, что анализ на гетерофильные антитела может быть ложноположительным у некоторых пациентов с острой стадией ВИЧ-инфекции. Титр и распространенность этих антител повышаются на 2-й и 3-й неделях болезни. Таким образом, если диагноз очень вероятен, но анализ на гетерофильные антитела отрицательный, будет разумным повторить его на 7-10 день от появления симптомов.
Если анализ остается отрицательным, то нужно определить антитела к вирусу Эпштейна – Барр. Присутствие антител IgG к капсидному антигену вируса Эпштейна – Барр указывает на первичную ВЭБ-инфекцию (эти антитела исчезают в пределах 3 мес. после инфекции). Антитела IgG к капсидному антигену вируса Эпштейна – Барр (IgG к VCA ВЭБ) также появляются на ранних стадиях первичной инфекции ВЭБ, но сохраняются в течение всей жизни. Антитела к ядерному антигену вируса Эпштейна–Барр (ВЭБ-IgG) при острой инфекции вирусом Эпштейна–Барр образуются позже (приблизительно через 8 нед.) и также сохраняются в течение жизни. Если титры антитела вируса Эпштейна – Барр отрицательны или указывают на отдаленную инфекцию (т.е. положительный для антител IgG и отрицательный для антител IgM), нужно рассмотреть другие диагнозы (например, острая ВИЧ-инфекция, цитомегаловирусная инфекция).
Прогноз
Инфекционный мононуклеоз обычно проходит самостоятельно. Продолжительность болезни различна; острая фаза длится приблизительно 2 нед. В целом 20% пациентов могут вернуться в школу или на работу в пределах 1 нед, а 50% – в пределах 2 нед. Повышенная утомляемость может сохраняться в течение еще нескольких недель или, до 10% случаев, в течение многих месяцев.
Смерть наступает в 1%, главным образом из-за осложнений (например, энцефалит, разрыв селезенки, обструкция дыхательных путей).

Герпесвирусные инфекции широко распространены среди детей и взрослых. По данным ВОЗ до 90 % взрослого и детского населения планеты инфицировано герпесвирусами, причем у 50 % из них отмечают манифестное, рецидивирующее течение вызываемых ими заболеваний. Инфекционный мононуклеоз является наиболее характерным типичным клиническим проявлением герпесвирусных инфекций. В мире инфекционным мононуклеозом ежегодно заболевают от 16 до 800 лиц на 100 тыс. населения. В России ежегодно регистрируют 40–80 случаев инфекционного мононуклеоза на 100 тыс. населения [1, 2, 3, 5]. Большинство клиницистов связывают инфекционный мононуклеоз с вирусом Эпштейна – Барр, хотя в настоящее время доказана роль цитомегаловируса (5-й тип) и вируса герпеса человека 6-го типа, а также вирусов простого герпеса 1-го, 2-го типов в этиологии заболевания [5]. Установлена роль вируса Эпштейна – Барр в развитии злокачественных новообразований, аутоиммунных, неврологических заболеваний и синдрома хронической усталости [3, 8, 9, 10]. Показано, что после перенесённой инфекции новое поколение В-клеток содержит несколько генокопий вируса Эпштейна – Барр в латентной форме, в результате чего вирус может длительно персистировать в организме, вызывая иммунодефицитное состояние и повышая риск развития онкогематологических заболеваний [8, 9]. В крови у часто болеющих детей выявлена определённая концентрация цитомегаловируса и вируса Эпштейна – Барр. Вероятно, персистенция инфекции приводит к возникновению иммунной недостаточности, на фоне которой формируется частая заболеваемость [1, 4]. В последние годы доказана гепатотропность герпетических вирусов, которые могут вызывать различные поражения печени – от бессимптомного гепатита до гепатоцеллюлярной карциномы [2].
Инфекционным мононуклеозом преимущественно болеют дети: их доля в суммарной заболеваемости достигает 65–80 %. Исключение составляют дети первых 6–7 месяцев жизни, защищенные материнскими антителами [6].
Целью исследования является анализ особенностей клинического течения инфекционного мононуклеоза у детей в современных условиях.
Материал и методы исследования
Для проведения исследования была проведена экспертная оценка 32 историй болезни больных с инфекционным мононуклеозом. Под наблюдением находились дети, госпитализированные в инфекционный стационар г. Чебоксары. Лабораторная диагностика проводилась методом качественного иммунохроматографического экспресс-теста для определения специфических IgМ-антител к вирусному капсидному антигену (VCA) вируса Эпштейна–Барр в сыворотке крови, методом иммуноферментного анализа с определением в крови маркеров Эпштейн–Барр вирусной инфекции (IgM VCA), определялась ДНК-EBV методом полимеразной цепной реакции.
Для статистической обработки данных исследования использован параметрический метод с определением доверительных границ средних величин и относительных показателей генеральной совокупности. Заданная степень вероятности безошибочного прогноза Р=95 %, при этом t=2. Проводился корреляционный анализ с определением коэффициента корреляции Пирсона.
Из 32 наблюдаемых пациентов мальчики составляли 69 %, девочки – 31 % (22 и 10 детей соответственно).
Максимальная заболеваемость инфекционного мононуклеоза приходится на 4–8-летний возраст, дети первого года жизни болеют редко. В нашем исследовании большинство заболевших (44 %) составили дети дошкольного возраста, самой малочисленной группой (3 %) оказались дети грудного возраста, детей от 1 до 3 лет было 22 %, 7–12 лет – 22 %, старше 12 лет – 9 %.
Согласно данным некоторых исследований, этиология инфекционного мононуклеоза зависит от возраста [2]. Так, у детей первых 4 лет жизни чаще (37,2 %) определяется цитомегаловирусная этиология; у детей в возрасте от 4 до 7 лет чаще наблюдается Эпштейн – Барр вирусная инфекция (76,2 %) с манифестными формами заболевания с характерными клиническими симптомами и гематологическими изменениями (атипичные мононуклеары выявлены у 94,6 % пациентов); в старших возрастных группах достоверно чаще развивается микст-инфекция, тяжелая степень болезни, чаще встречается поражение печени. Риск хронизации инфекции возникает с 4-летнего возраста и более характерен для подростков и взрослых [2].
Наблюдаемые нами пациенты с инфекционным мононуклеозом были обследованы с целью выяснения этиологии заболевания. У всех больных подтверждена причастность к заболеванию вируса Эпштейна – Барр: у 19 % детей методом полимеразной цепной реакции в пробе крови, у 31 % – методом иммуноферментного анализа, у 50 % – с помощью экспресс-теста для определения специфических IgМ VCA.
У 56 % детей диагностировано заболевание средней степени тяжести, у 44 % – тяжёлой.
По данным литературы наиболее часто больными предъявляются жалобы на затруднение носового дыхания (52,3 %), боль в горле (68,5 %), недомогание (59 %), головную боль (44,5 %), боль в животе, тошноту, рвоту (15 %), озноб (10 %) [2].
У большинства обследуемых детей (47 %) наблюдались жалобы на заложенность носа, на боль в горле жаловались 19 %, недомогание – 35 %, головную боль – 10 %, боль в животе, рвоту – 7 %, кашель – 13 % детей.
Температура у больных мононуклеозом в течение первых 2–5 дней чаще бывает субфебрильной, а в период разгара поднимается выше 38 ºС в 83 % случаев и держится на протяжении первых двух недель болезни, иногда – месяц. Увеличение лимфоузлов и ангина наиболее выражены в первые две недели, наблюдаются в 98–99,3 % и 80,7–96 % соответственно, гепатоспленомегалия – на второй-третьей неделе (41–100 %) [2, 3, 5, 6]. Лимфоузлы увеличиваются симметрично, они болезненны, но подвижны, размеры их варьируются от мелкой горошины до грецкого ореха или куриного яйца. Чаще всего страдают заднешейные и затылочные лимфоузлы, но встречается и генерализованное увеличение. В клинической картине часто лидирует ангина, при этом в 85 % случаев на миндалинах появляются различные наложения. Небные миндалины отечны, налеты могут быть беловато-желтоватого или грязно-серого цвета, легко снимаются, ткань миндалины после снятия налёта обычно не кровоточит. Гиперемия ротоглотки обычно умеренно выражена, боль в горле незначительная. У 5 % больных появляется пятнисто-папулезная или папулезная сыпь, обычно на туловище и руках. Инфекционный мононуклеоз в большинстве случаев длится 2–4 нед. [3, 6, 7].
В нашем исследовании у всех детей наблюдалось повышение температуры, причём у большинства (75 %) её значение превышало 38 ºС. Увеличение лимфоузлов обнаруживалось у всех пациентов, преимущественно шейных групп. Изменения в ротоглотке характеризовались лёгкой гиперемией в 50 %, умеренной – в 22 %, яркой – в 28 % случаев. Увеличение миндалин зарегистрировано у 72 % детей, в 6 % случаев – III степени, при этом у 6 % больных наблюдался отёк нёбных дужек и миндалин. Наложения на миндалинах обнаружены у 81 % пациентов, по форме они были сплошными у 22 %, островчатыми – у 37 %, точечными – у 22 % детей, цвет их был в 19 % случаев жёлтым, в 66 % – белым. Гепатоспленомегалия выражена во всех возрастных группах, за исключением детей старшего школьного возраста, что подтверждено данными ультразвукового исследования. При проведении корреляционного анализа гепатоспленомегалии выявлена прямая высокая положительная корреляционная связь – коэффициент корреляции Пирсона 0,87 (рисунок). У 6 % детей наблюдалась экзантема. При проведении лабораторного исследования периферической крови выявлены атипичные мононуклеары у всех пациентов (таблица).
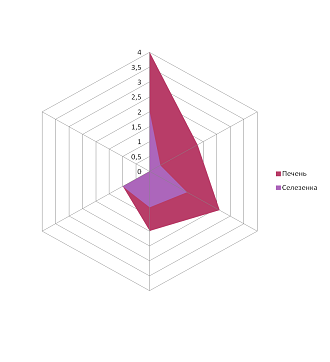
Гепатоспленомегалия при инфекционном мононуклеозе, прямая корреляционная связь
Клинические признаки и лабораторные показатели инфекционного мононуклеоза
Читайте также:


