Инфекция в печени у новорожденного

Дата публикации: 18.11.2013 2013-11-18
Статья просмотрена: 651 раз
Встатье изложены результаты органометрического исследования печени новорожденных при внутриутробно-ассоциированныхинфекциях. Макрометрические ростовые и весовые измерения органа составляют важную и неотъемлемую часть в комплексном морфологическом исследовании печени. Проведены линейные измерения: длины, высоты правой и левой долей, толщины печени новорожденных исследуемых групп при внутриутробно-ассоциированных инфекциях.
Ключевые слова: гепатометрия, внутриутробно-ассоциированные инфекции, новорожденные, печень, морфометрия.
Внутриутробные инфекционные поражения печени представляют собой важную проблему неонатологии, что прежде всего определяется существенными трудностями правильного и своевременного распознавания этой патологии [2, 4]. Изучение влияния внутриутробной инфекции на морфометрические показатели гепатобилиарной системы новорожденных позволит установить ранние морфологические критерии вовлечения в процесс печени. Поскольку характер патогенного влияния микроорганизмов на печень может быть разнообразным и сопровождаться развитием различных патоморфологических изменений от дистрофии и холестаза до фульминантного гепатита [3, 7].
Органометрические исследования печени новорожденных при действии ассоциаций микроорганизмов изучены недостаточно, а именно вопросы гепатометрии связанные с объективизацией изучения патологии печени, которая возникает при интоксикациях, фетальных гепатитах и других заболеваниях [1, 5]. Макрометрические ростовые и весовые измерения органа составляют важную и неотъемлемую часть в комплексном морфологическом исследовании печени [6, 8]. При изучении заболеваний печени, кроме регистрации качественных признаков и их изменений (состояние поверхности, форма, консистенция, цвет) необходимо проводить измерения линейных, поверхностных, объемных величин и массы печени [1, 6].
Однако, неправильная форма печени затрудняет проведение точных линейных измерений, поэтому наиболее информативным признаком патологии печени остается изменение ее массы. Колебания показателей массы печени прямопропорционально зависят от кровенаполнения этого органа [1, 5, 10].
Цель исследования: изучить влияние внутриутробно-ассоциированных инфекций на органометрические и весовые показатели печени.
Материалы и методы
Исследован аутопсийный материал (66 случаев) печени новорожденных сроком гестации 37–40 недель, умерших в неонатальном периоде вследствие внутриутробно-ассоциированных инфекций, подтвержденных серологическими, бактериологическими и иммунологическими лабораторными методами. Исследуемый материал был разделен на три группы: I группа — герпес-стафилококковая инфекция, II группа — хламидийно-герпетическая инфекция, III группа — стафилококково-хламидийная инфекция. Контрольную группу составили 22 новорожденных, умерших в результате острого нарушения маточно-плацентарного и пупочного кровообращения в раннем неонатальном периоде без инфекционного фактора.
Органометрические исследованиябыли нацелены на выявление индивидуальных и групповых анатомических особенностей печени новорожденных при внутриутробно-ассоциированных инфекциях и включали в себя определение простых (1 уровень) и расчетных (2 уровень) показателей.
Простые показатели включали массу тела и печени новорожденных, длину (расстояние между наиболее удаленными точками печени по фронтальной плоскости), толщину (наибольшее расстояние в передне-заднем направлении в правой доле), высоту правой и левой долей (по вертикальным линиям, проведенным через средины долей на уровне диафрагмальной поверхности и края печени).
Массовые показатели тела и печени новорожденных всех групп исследования определяли взвешиванием на электронных весах EK — 8013 MPM (Польша) с точностью до 0,1 г. Линейные измерения проводили сантиметровой линейкой с ценой деления 1 мм.
Расчетные показателиосновывались на вычислении коэффициента отношения массы печени к массе тела новорожденного.
Статистический анализ проводили с использованием методов вариационной статистики с определением среднего арифметического показателя и его стандартного отклонения, достоверность сравниваемых величин оценивали по критерию Стьюдента, уровень достоверности — p ≤ 0,05.
Результаты и их обсуждение
Результаты проведенных макроскопических исследований новорожденных контрольной группы показали, что печень занимала 1/3 брюшной полости, располагаясь под диафрагмой, в основном в правом подреберье. Печень красно-бурого цвета, мягкой консистенции, ее диафрагмальная поверхность не симметрично выпуклая и соответствует форме купола диафрагмы. На верхней поверхности левой доли часто наблюдается небольшое сердечное вдавление. Правая и левая доли печени спереди четко отграниченны серповидной связкой, по свободному краю которой проходит рудимент пупочной вены плода до нижней борозды, сзади — бороздой, где проходит остаток венозного протока плода, формируя венозную связку. По переднему краю печени, справа, расположена вырезка желчного пузыря. Печень покрыта соединительнотканной капсулой, с которой плотно соединен висцеральный листок брюшины (рис. 1, а). У новорожденных, умерших в раннем неонатальном периоде в результате внутриутробно-ассоциированых инфекций макроскопически печень несколько увеличена, дрябловата, часто наблюдается наличие мелкоочаговых кровоизлияний под капсулу (рис. 1, б, в, г).
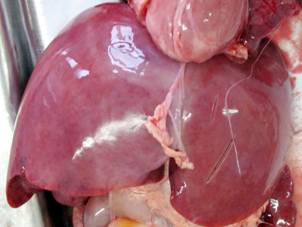
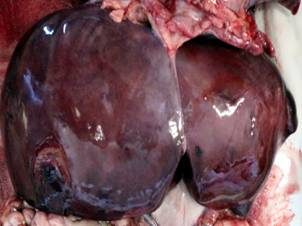
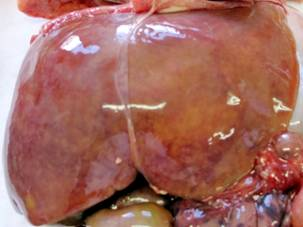
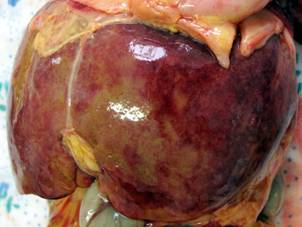
Рис. 1. Макропрепараты печени новорожденных сроком гестации 37–40 недель: а — макропрепарат печени новорожденного группы контроля; б — макропрепарат печени новорожденного при герпес-стафилококковой инфекции; в — макропрепарат печени новорожденного при хламидийно-герпетической инфекции; г — макропрепарат печени новорожденного при стафилококково-хламидийной инфекция.
Масса печени в данной группе составляет 143,32±4,53 г. Коэффициент массы печени по отношению к массе тела составляет 0,048±0,001 (табл. 1).
Показатели массы печени, массы новорожденного и коэффициент массы печени по отношению к массе тела в исследуемых групах при внутриутробно-ассоцированных инфекциях и группы контроля представлены в таблице 1.
Показатели массы печени и массы новорожденных исследуемых групп
William J. Cochran
, MD, Geisinger Clinic
Существует множество причин холестаза, в том числе инфекции, нарушение обмена веществ, генетические дефекты и препятствия оттоку желчи.
Наиболее частыми симптомами являются желтуха и темная моча.
Диагноз ставится на основании результатов анализа крови, в дальнейшем — других анализов крови, визуализирующих обследований и, в некоторых случаях, биопсии печени, которую проводят для определения специфической причины.
Лечение зависит от причины.
Билирубин — вещество желтого цвета, которое образуется при разрушении гемоглобина (входит в состав эритроцитов, переносящих кислород) в результате нормального процесса замены старых или поврежденных эритроцитов. Билирубин переносится кровью в печень, где перерабатывается таким образом, что может выделяться из печени в составе желчи (пищеварительной жидкости, которую вырабатывает печень). Желчь выделяется через желчные протоки в начальный отдел тонкого кишечника (двенадцатиперстную кишку). Если билирубин не может достаточно быстро перерабатываться печенью и выделяться через желчные протоки, он накапливается в крови (гипербилирубинемия). При избыточном количестве билирубина он накапливается в коже, белках глаз и других тканях, окрашивая их в желтый цвет (желтуха).
При холестазе клетки печени перерабатывают билирубин надлежащим образом, но в каком-то месте между клетками печени двенадцатиперстной кишкой отток желчи нарушен. Это ведет к повышению уровня билирубина в крови и уменьшению количества желчи, попадающей в тонкий кишечник.
Еще одним эффектом нарушения выделения желчи в тонкий кишечник является нарушение процесса пищеварения. Желчь имеет большое значение для процесса пищеварение, поскольку она помогает организму всасывать жиры и жирорастворимые витамины A, D, E и K. При недостаточном количестве желчи в тонком кишечнике нарушается процесс всасывания жиров, что может привести к дефициту витаминов, неадекватному питанию и неспособности расти и набирать вес.
Причины
Причинами холестаза у новорожденных могут быть:
атрезия желчных протоков (закупорка желчных протоков);
Нарушения обмена веществ
Атрезия желчных протоков — это закупорка желчных путей, которая возникает у плода приблизительно в конце беременности или на протяжении первых нескольких недель жизни. У доношенных новорожденных она встречается чаще, чем у недоношенных. У больных младенцев желтуха развивается обычно на протяжении первых нескольких недель жизни.
К холестазу у новорожденных могут привести инфекции. Некоторыми возбудителями являются:
Бактерии: В том числе инфекция кровотока (сепсис), Escherichia coli, и стрептококк
Паразиты: В том числе токсоплазмоз
Гестационное аллоиммунное поражение печени — это заболевание, которое возникает до рождения. При этом заболевании антитела матери проходят через плаценту и атакуют печень плода.
Существует большое количество нарушений обмена веществ, которые вызывают холестаз, в том числе дефицит альфа-1 антитрипсина, галактоземия, тирозинемия, дефекты образования солей желчных кислот и нарушения окисления жирных кислот. Эти заболевания возникают, когда у новорожденного отсутствует фермент, необходимый для расщепления некоторых веществ, что позволяет токсическим веществам накапливаться и поражать печень.
Холестаз у новорожденных могут вызывать генетические дефекты, например, синдром Алажиля и кистозный фиброз. Генетические дефекты и другие мутации генов могут нарушать нормальную выработку и выделение желчи, что приводит к холестазу.
Токсические поражения, в том числе использование внутривенного (парентерального) питания у новорожденных или детей первого года жизни. В последние годы некоторые крупные центры начали использовать для парентерального питания другой вид жиров, что, по-видимому, уменьшило риск холестаза.
Синдром неонатального гепатита — термин, используемый для описания воспаления печени новорожденных, причина которого не установлена. Этот диагноз ставится все реже в связи с наличием усовершенствованных анализов, которые могут установить точную причину.
Симптомы
Симптомы холестаза обычно развиваются в течение первых 2 недель жизни новорожденного. У детей первого года жизни с холестазом присутствует желтуха и, часто, темная моча, светлый кал и/или увеличение печени. Накопление билирубина в коже вызывает зуд, что способствует раздражительности детей первого года жизни. Поскольку у детей первого года жизни с холестазом может иметь место недостаточное всасывание жиров и витаминов, они могут плохо расти.
При прогрессировании заболевания печени могут развиваться другие проблемы, например, увеличение размеров живота в результате скопления жидкости в брюшной полости (асцит) и кровотечение из верхних отделов пищеварительного тракта, вызванное увеличением вен пищевода (варикозное расширение вен пищевода).
Диагностика
В некоторых случаях — биопсия печени
Избыточное количество билирубина в крови (гипербилирубинемия) в первые недели жизни присутствует практически у всех новорожденных. Эта желтуха (физиологическая желтуха) исчезает на протяжении одной или двух недель. У детей первого года жизни, у которых желтуха сохраняется в возрасте двух недель, врачи проверяют наличие холестаза с помощью анализа крови. Если результаты этого анализа указывают на наличие холестаза, детям проводят дополнительные анализы крови для выявления воспаления печени и нарушения ее функции (см. Функциональные пробы печени). Для выявления причины холестаза врачи проводят другие анализы.
Врачи проводят ультразвуковое исследование брюшной полости для оценки размера печени, а также для получения изображения желчного пузыря и общего желчного протока. При проведении другого вида визуализирующего обследования под названием холесцинтиграфия (гепатобилиарная сцинтиграфия или сканирование) врачи вводят ребенку первого года жизни в вену радиоактивное вещество. После этого они наблюдают за движением радиоактивного вещества по мере его выделения печенью и поступления в желчный пузырь, и через желчные протоки в двенадцатиперстную кишку.
Если врачи не могут установить причину, они берут образец печени ребенка для дальнейшего изучения (биопсия). Биопсия может быть проведена одновременно с интраоперационной холангиографией, которая предполагает введение вещества, видимого в рентгеновских лучах, непосредственно в желчный пузырь, что помогает более четко определить состояние желчных протоков, или без нее.
Прогноз
Прогноз может быть абсолютно разным. В зависимости от причины дети первого года жизни могут полностью выздоравливать или у них может развиваться печеночная недостаточность либо цирроз печени (рубцевание печени).
Атрезия желчных протоков может привести к прогрессирующему усугублению заболевания печени даже при надлежащей диагностике и лечении. Дети первого года жизни, не получающие лечения, часто умирают в результате печеночной недостаточности не доживая до 1 года.
Холестаз, вызванный парентеральным питанием, исчезнет сам по себе, если парентеральное питание будет прекращено до того, как у ребенка первого года жизни разовьется тяжелое заболевание печени.
При гестационном аллоиммунном поражении печени, если не начать лечение рано, прогноз, как правило, неблагоприятный.
Лечение
Лечение конкретной причины.
Поддерживающая терапия, в том числе надлежащее питание.
Некоторые нарушения обмена веществ, например, галактоземия, поддаются лечению. Лечение галактоземии проводят путем исключения из диеты ребенка первого года жизни молока и молочных продуктов (содержащих сахар галактозу). Как правило, детям дают соевую смесь.
Лечение детей с гестационным аутоиммунным поражением печени могут проводить с помощью внутривенного введения иммуноглобулинов (антител, полученных из крови людей с нормальной иммунной системой) или путем взятия большого количества крови ребенка и замены ее с помощью переливания крови (обменное переливание крови).
Важно обеспечить надлежащее питание и применять биологически активные добавки при любом дефиците витаминов A, D, E и K. У детей первого года жизни с холестазом, как правило, нарушено всасывание жиров, таким образом, использование смесей, содержащих специальный жир (среднецепочечный триглицерид), улучшает всасывание жиров и рост. Некоторые дети первого года жизни не в состоянии выпивать достаточное количество смеси для нормального роста и им может потребоваться применение концентрированной смеси, содержащей большее количество калорий на единицу объема.
Для усиления выделения желчи и улучшения состояния печени новорожденным без атрезии желчных путей можно давать урсодезоксихолевую кислоту.

Перинатальная передача вкусного гепатита А, В, С от матери к ребенку может реализоваться пренатально (трансплацетарно), интранатально (во время родов) или постнатадьно - во время ухода за новорожденным.
По данным ряда исследователей (Фарбер Н.А., Мартынов К.А.) вирусный гепатит протекает значительно тяжелее во время беременности. ГА существенного влияния на развитие плода не оказывает. ГВ протекает значительно тяжелее и представляет опасность для плода.
Заражение детей может происходить от матерей, больных как острым, так и хроническим гепатитом В, а также вирусоносителей (Шехтман М. М.). В настоящее время считается признанным положение о возможном пренатальном заражении плода гепатитом В.
Трансплацентарное заражение происходит у детей, родившихся от матерей-носителей HBsHg. Вместе с тем существует гипотеза о более частом внутриутробном заражении плода. При этом вирус ГВ инфицирует плод, однако активной рекминации вируса гепатита В в гепатоцитах не происходит (Андриуца К. А., Вязов С. Д, Блохина Н. П.). Во время родов заражение происходит через родовые пути, когда кожа ребенка значительно мацерирована водами (Шехтман М. М., Мартынов К. А.). Высказывается предположение о возможном заражений новорожденных детей в результате заглатывания или аспирации околоплодных вод, в которых имеется ВГ.
Резкое сжатие матки во время родов может привести к попаданию вируса из материнской крови в кровеносную систему плода.
Заражение после родов происходит редко, это прежде всего связано с тем, что большинство детей уже инфицированы во время родов.
Постнатальное заражение после родов при тесном контакте с матерью-носителем вируса гепатита В происходит реже, чем интранатальное; это прежде всего связано с тем, что большинство детей уже инфицированы в родах. Представляет интерес, что грудное молоко матерей-вирусоносителей не играет большой роли в инфицировании их детей.
При гепатите С роль перинатального инфицирования в распространении этой инфекции до конца не определена. Появление антител к вирусу гепатита С через 6-12 месяцев после рождения у детей, чьи матери имели антитела, может косвенно свидетельствовать о перинатальном инфицировании. Младенческая смертность зависит от степени доношенности плода. Недоношенные дети, родившиеся от матерей, больных острым вирусным ГВ, С погибают в два раза чаще.
Цель: изучение клинических проявлений и исходов перинатальной инфекции, вирусного гепатита, передачи ее младенцам и длительность циркуляции у них специфических антител.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Диагноз выставлен на основании данных анамнеза, эпидемиологических анализов, биохимических исследований крови матери и плода.
Исследование крови на маркер вирусных гепатитов, УЗИ печени, селезенки. Нами обследовано 25 детей до 1 года жизни и их матери во время беременности.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Женщины во время беременности находились в РЦИБ г. Махачкала с диагнозом вирусный гепатит. Дети от этих матерей наблюдались до одного года.
Гепатит возникает в I и II триместрах беременности, вероятность заболевания новорожденных была невелика, но в III триместре - риск заболевания для потомства составлял 25-76%. рождались чаще всего недоношенными в состоянии гипоксии. У 25% детей в дальнейшем наблюдалось отставание в общем развитии и предрасположенность к различным заболеваниям Характерным осложнением беременности явилась угроза ее прерывания (у 53%), преждевременные роды происходили у 36% рожениц. Послеродовые гнойно-септические заболевания учащены в связи с угнетением иммунного статуса не только за счет беременности, но и за счет гепатита, и активизации на этом фоне бактериальной микрофлоры.
Помимо изменений в печени при ВГ возникли в 2% - крапивница; у одного ребенка - гломерунефрит.
Предполагаем, что причина этих синдромов - циркуляция в крови иммунных компонентов.
У 12% детей был диагностирован Г. С., у 14% - Г. В., 10% - гепатиты А; D, Е не выявлены. Риск передачи НСУ от матери к плоду ниже, чем при НВУ и составляет 0,9%, особенно при высоком уровне виремии у матери.
Среди пациентов гепатит В диагностирован у 10 детей, матери б из них перенесли во время беременности острый вирусный гепатит В с исходом выздоровления, у 8 диагностированных хронический НВV, 1 ребенок, мама которого болела в III триместр беременности, был госпитализирован в реанимационное отделение РИЦ с клиникой фульминантного гепатита В с летальным исходом. Поводом направления в стационар 7% новорожденных был гепатолиенальный синдром, явления интоксикации, отставание в физическом развитии, изменения функции печени, почек, обнаружении HBsHg при обследовании в связи с наличием НВV-антигена у матери во время беременности. Желтуха выявлена у 7%, нарушение функции почек у 5%. Функциональные пробы печени изменены у 7%. При проведении УЗИ печени: у всех больных отмечено увеличение размеров, повышение эхогенности перенхимы.
Течение болезни было тяжелым у 15% новорожденных, среднетяжелым у 12%. Все новорожденные при рождении и на 5 день были обследованы биохимически и иммунологически на наличие антител НСV-вирус, НВV. 100% случаях на 5 день жизни у всех новорожденных от матерей с НСV -вирусной инфекция сохранилась. Способ родоразрешения (через естественные родовые пути или кесарево сечение) не влиял на частоту перинатального инфицирования. Сразу после родов у 14% новорожденных от инфицированных НСV матерей в сыворотке крови обнаружены материнские антитела к НСV, проникающие через плаценту. У неинфицированных детей антитела исчезли в течение 1 года жизни.
Профилактику перинатального гепатита В рекомендовали проводить с помощью вакцинации новорожденных, чьи матери имеют вирус гепатита В. Для повышения эффективности проводимой вакцинации рекомендовали вводить вакцину в сочетании с гиперимунным гаммаглобулином против гепатита В.
С целью профилактики ВГ у новорожденных им в первые часы жизни был введен гипериммунный Т-глобулин или вакцина, при распространенности вирусоносительства в популяции 2% и более. Если у матери обнаружены HBsHg. и HBеHg. нужна сочетанная активная и пассивная иммунизация, поскольку риск инфицирования ребенка значительно возрастает. В районах с низким уровнем носительства HBsHg. и HBеHg при наличии у большинства женщин носителей HBsHg. антител HBеHg применение средств специфической профилактики ВГ у новорожденных нецелесообразно в связи с редким формированием у них персистирующей Нbs-антигенемии. Отечественная плазменная вакцина против ВГ вызывает при 3-кратной аппликации образование антиHbs у 80% детей, при этом результаты исследования свидетельствуют об эффективности вакцины в отношении профилактики Hbs-антигеноносительства. Грудное вскармливание не прекращалось, поскольку практически крайне редко инфекция передается с молоком матери.
- Андриуца К. А., Вязов С. Д., Блохина Н. П. Вирусный гепатит дельта. Кишинев: Штиинца, 1993.
- Закриров И. Г., Маннанова Д. Р., Хаертынова И.М. Иммунологические показатели при хронических гепатитах, обусловленных вирусами гепатитов В и С // Тез. Докл. Пятого Российского съезда врачей инфекционистов. - М., 1998. С. 106-107
- Фарбер Н. А., Мартынов К. А., Гуртовой Б. Л. Вирусные гепатиты у беременных. М.: Медицина, 1990.
- Шехтман М. М., Мартынов К. А. Принципы ведения беременности у женщин с сами гепатита. (Пособие для врачей). М., МЗ РФ, 1998.
- Hoffman Н. Кnuuz Ch.. // International Congress of Viroky 8-th: abstracts. - Berlin 1990- P. 134
Принято считать, что патологии печени в раннем возрасте развиваются у детей из неблагополучных семей и вызваны курением, алкоголем, токсикоманией. Но благополучный ребенок тоже может заболеть, ведь печени вредят и любимые всеми снеки, и многие пищевые красители, и не по возрасту жирная пища. Поскольку детский организм еще формируется, даже незначительные на первый взгляд нагрузки могут надолго вывести печень ребенка из строя и привести к развитию хронических заболеваний.
Причины болезней печени у детей
К числу факторов риска относятся:
- нарушения санитарно-гигиенических норм во время грудного вскармливания, посещения дошкольных учреждений и занятий в школе, во время отдыха на природе и т.д.;
- неправильное питание, обилие острой, жареной, жирной пищи, консервов, солений, маринадов, непонимание родителями того, что рацион ребёнка должен отличаться от рациона взрослых;
- нарушение режима дробного питания, случайные перекусы, привычка к фаст-фуду и сладким газированным напиткам;
- контакты ребенка с домашними питомцами, переносящими простейших и паразитов, опасных для печени;
- плохая экология;
- злоупотребление нестероидными противовоспалительными средствами и антибиотиками, к которому склонна часть родителей. Детей пичкают лекарствами при малейшем недомогании;
- интоксикация плода во время беременности алкоголем или лекарственными препаратами, которые принимала будущая мать.
К сожалению, всё чаще и чаще лечение печени у детей оказывается обусловлено неблагоприятным климатом в семье или ранним попаданием ребёнка в асоциальную среду. Алкоголь, курение, наркотики разрушают детскую печень быстро и неотвратимо. Родители в неблагополучных семьях зачастую не обращают внимания на признаки болезни печени у ребёнка. В результате патологический процесс, который можно было остановить в самом начале, приобретает хроническую форму, что катастрофически сказывается на развитии молодого организма. Ребёнок отстает в физическом и умственном развитии, у него нарушен обмен веществ, наблюдается желтуха, желудочно-кишечные расстройства, головные боли и интоксикация.
К счастью, лечение печени у детей в большинстве случаев даёт положительные результаты ввиду уникальных репродуктивных способностей этого органа. До 20 лет количество клеток-гепатоцитов растёт, поэтому даже тяжелые воспалительные и дистрофические процессы могут локализоваться и проходить фактически без следа. Характерный пример – относительно лёгкая переносимость гепатита А (болезнь Боткина) у детей и весьма неблагоприятное течение инфекционной желтухи у взрослых. Детская печень успешно справляется с вирусом, в то время печени взрослого человека с агрессором справиться гораздо сложнее.
Типичные симптомы, при которых показано лечение печени у детей

Печень – самая крупная железа внешней секреции человека и самый большой паренхиматозный орган, его масса у взрослого достигает 1,5 кг. У ребенка печень меньше, однако, в процентном соотношении занимает значительную часть тела и процент от массы (у новорожденных она составляет 10% массы тела).
Ученые насчитали более 600 функций печеночной ткани, однако важнейших функций две – продукция желчи, важнейшего пищеварительного фермента, и очистка крови от токсинов, попадающих в неё из кишечника, через кровь и выделяемых тканями в процессе жизнедеятельности организма. При врожденных и приобретенных патологиях печени она не справляется с возложенными функциями, в результате чего становится невозможным нормальное пищеварение или развивается хроническая интоксикация организма внешними и внутренними ядами.
Если анализировать болезни печени у детей, симптомы их носят менее специфический характер, чем проявление патологий у взрослых. Это особенно заметно на первом году жизни. Хотя врожденные заболевания печени встречаются по статистике лишь в 1 случае на 2500 рождений, такие патологии носят очень опасный характер и нередко приводят к гибели маленьких пациентов в течение первых трех лет жизни на фоне острой печеночной недостаточности. При этом определить признаки болезни печени у ребенка без досконального аппаратного исследования сложно. Желтушность кожных покровов ни о чем не говорит, уровень билирубина у детей высокий сам по себе. Насторожить должна окраска кала. При нормальном функционировании печени и желчных протоков он через несколько дней после рождения приобретает коричневый цвет за счет производного билирубина стеркобилина. Если кал остается светлым или светло-зеленоватым, нужно бить тревогу, это верный признак билиарной атрезии – непроходимости или недостаточной проходимости желчных протоков. Она может быть вызвана пороками внутриутробного развития печеночной ткани, неонатальным гепатитом различной природы. Воспаление печени у младенцев могут вызывать вирусы гепатита А, вирус герпеса, цитомегаловирус и т.д. Лечение такой опасной патологии, как билиарная атрезия, нередко предполагает хирургическое вмешательство, в том числе даже ортотопическую трансплантацию печени.
При тяжелых поражениях и без того крупная печень малыша заметна не только при пальпации, но даже внешне. Её верхний край рельефно выступает над правой реберной дугой. На ощупь орган неровный и бугристый, а животик явно ассиметричный.
Дело может осложниться асцитом – скоплением в брюшной полости жидкости, просачивающейся сквозь стенки сосудов, в которых из-за закупорки воротной вены возникает стойкая портальная гипертензия. Вздутый живот и отеки на ножках – верный симптом болезни печени у детей. Вместе с печенью почти всегда увеличивается и селезенка. Это явление называется спленомегалия, селезенка прощупывается в левом подреберье.
Не столь опасен, но встречается намного чаще печеночный холестаз, то есть избыточное скопление желчи в желчных путях и пузыре. Он может быть связан с физической узостью протоков, наличием в них камней, образовавшихся в результате нарушения метаболизма желчных кислот, воспалительных процессов в печени и пузыре, носящих инфекционную, токсическую или аутоиммунную природу.
Защита печени у детей
Защита печени у детей в целях профилактики и лечения холестаза обычно не связана с кардинальными средствами. Достаточно эффективны щадящая медикаментозная терапия и лечение печени ребенку народными средствами. Важно лишь помнить, что любой терапии должно предшествовать профессиональное обследование и постановка точного диагноза. Болезням печени у детей присуще неспецифическое течение, кроме того, маленькие дети не могут пожаловаться на своё состояние и четко рассказать доктору о том, что их беспокоит. В основном диагностика базируется на биохимических анализах крови, исследованиях на антитела и сканировании печени и желчевыводящих путей с помощью ультразвука или магнитно-резонансного томографа. Дуоденальное зондирование ввиду его физической и моральной травматичности для маленьких пациентов применяется крайне редко.
Детям дошкольного, младшего и среднего школьного возраста острая печеночная недостаточность угрожает редко, период риска (первые три года жизни) они уже пережили. Однако ребенок в это время познает мир, находится в активном поиске приключений. К сожалению, нередко он их находит, причем на собственную печень. Одним из самых распространенных недугов у детей в возрасте 3 – 10 лет становятся лямблии – жгутиковые простейшие, в огромных количествах паразитирующие в тонком кишечнике и способные проникать в желчные ходы, поджелудочную железу, селезенку и другие органы брюшной полости. Лямблии не способны привести к фатальным последствиям для здоровья, однако сильно снижают качество жизни ребенка, делают его вялым, апатичным, капризным.
Если обнаружены лямблии в печени у детей, лечение предполагает трёхэтапный курс избавления от паразитов. Он обязательно должен проводиться под наблюдением врача, так как применение противопаразитарных препаратов чревато побочными эффектами:
- токсическим поражением печени и других органов;
- развитием дисбактериоза и активизацией микрофлоры, которая нечувствительна к антилямблиозным препаратам и очень рада изгнанию конкурентов;
- временным нарушением нормальной работы ЖКТ.
Перед началом антипаразитарной терапии необходимо устранить другие кишечные дисфункции, которые могут обостриться под влиянием курса лечения.
За 10 – 15 дней до приема антибиотиков полезно перевести ребенка на диету № 5, применяемую при болезнях печени у детей, или хотя бы ограничить употребление жирного, сладкого, копченого, соленого. Лямблии не выносят кислые фрукты и ягоды, нежирные кисломолочные продукты (простоквашу, ацидофилин). С помощью диетотерапии можно изгнать значительное количество паразитов ещё до применения лекарственных препаратов.
Второй этап – полное уничтожение колонии паразитов. Противопаразитарные препараты принимают обычно перорально, однако они действуют как непосредственно на лямблий в кишечнике, так и, всосавшись в кровь, проникают с ней к стенкам кишечника и желчных путей. Здесь нужно помнить, что враги обитают не только в тонком кишечнике, но и проникают по желчным ходам в печень. Удалить их оттуда, не важно, живых или мертвых, с помощью обычных слабительных невозможно, необходим дополнительный прием желчегонных средств – препаратов, которые либо увеличивают ферментативную способность печеночной паренхимы, либо усиливают сокращение гладкой мускулатуры желчных путей. Существуют также вещества, которые снижают вязкость желчи и способствуют её скорейшему оттоку. Все эти препараты показаны не только при лямблиозе, но и при лечении других болезней печени у детей и при такой процедуре, как чистка печени ребенку.
Чистка печени у детей – это лечение или профилактика?
Несмотря на высокие регенеративные способности печени у детей, следует отметить, что легкомысленное отношение к заболеваниям этого органа, острым и хроническим отравлениям опасно. При малейшем подозрении на неблагополучие со стороны печени необходимо срочно проводить обследование и немедленно начинать лечение. Промедление чревато необратимыми изменениями в организме малыша.
Читайте также:


