Иммунная инфекция у ребенка
Вирусные инфекции занимают первое место в структуре заболеваемости у детей младшего возраста. Данные статистики ВОЗ неутешительны: каждый год отмечается до миллиарда случаев ОРВИ. Реальное же число заболевших детей превышает статистическое в два раза.
Как протекает вирусная инфекция у детей и как лечить вирус у ребенка, расскажем в статье.
Какие бывают вирусные инфекции?
Вирусные инфекции классифицируют в соответствии с системами органов, которые они поражают:
- Респираторные. Обширная группа инфекций, включающая вирусы гриппа A и В, коронавирусы, респираторно-синцитиальный вирус и метапневмовирус, вирус парагриппа, аденовирусы и риновирусы.
- Инфекции желудочно-кишечного тракта. В эту группу входит норовирус, астровирус, аденовирус 40 и 41, ротавирус. Дети наиболее восприимчивы к последним двум.
- Другие: корь, краснуха, гепатит, герпесвирусы, в частности, вирус ветряной оспы, и так далее. Как правило, эти вирусы вызывают поражения кожи различных участков тела и передаются от человека человеку.
Самым распространенным типом были и остаются респираторные вирусные инфекции. У детей до пяти лет случаи ОРВИ отмечаются в среднем шесть раз в год, особенно высока заболеваемость в первые два года посещения детского сада.
Острые респираторные вирусные инфекции у детей имеют сезонный характер: с сентября по апрель шанс заболеть выше, в феврале и марте число болеющих достигает пика. Летом же происходит спад заболеваемости в пять раз.
В группе риска находятся часто болеющие дети, дети с ослабленным иммунитетом, аллергики, атопики. Родителям таких детей стоит принимать комплексные профилактические меры, направленные на снижение заболеваемости. Национальный календарь профилактических прививок сообщает, что лицам, входящим в группы риска, рекомендована ежегодная вакцинация.
Из-за незрелости иммунного ответа детей младшего возраста вирусная инфекция часто осложняется бактериальной. Чтобы этого не допустить, лечение вирусных инфекций у детей необходимо начинать при первых же признаках болезни. Опасно и то, что ОРВИ может быть вызвана несколькими вирусами одновременно. Течение болезни в этом случае утяжеляется, а сроки протекания значительно увеличиваются.
Первые симптомы вируса у ребенка могут проявиться уже через несколько часов после заражения. В некоторых же случаях инкубационный период вирусной инфекции у детей составляет до семи дней.
Основные признаки вирусной инфекции у детей:
Заметив симптомы инфекции у ребенка, необходимо незамедлительно обратиться к специалисту: поставить точный диагноз и назначить корректную терапию может только врач-педиатр.
Первым делом нужно уложить ребенка в постель, ограничить его активность. Рекомендуется теплое обильное питье: оно способствует выведению токсинов и восполняет водный баланс в организме.
ВОЗ не рекомендует применять жаропонижающие средства, если температура не превышает 38,5°С, так как лихорадка по своей сути является защитной реакцией организма. Повышенная температура тела препятствует размножению вирусов, кокков и других микроорганизмов [1] , [2] . Однако в некоторых случаях сбить температуру необходимо: если организм в ослабленном состоянии, а также при наличии сопутствующих заболеваний.
Вопреки сложившемуся мнению, при лихорадке у детей не рекомендуется:
- прибегать к спиртовым растиркам: такие процедуры увеличивают риск обезвоживания и гипогликемии (снижения уровня глюкозы ниже нормы) и даже могут привести к коме;
- использовать протирки и охлаждающие ванны: эффект краткосрочный, прекращается сразу после окончания непосредственного воздействия, что приводит к колебаниям температуры.
Если у ребенка насморк, используют физиологический раствор или препараты морской воды для удаления слизи из носовых пазух — промывание проводят два–три раза в день.
Правильное лечение позволяет сократить длительность заболевания, обеспечивает более легкое протекание болезни, снижает риск развития осложнений.
После постановки диагноза ОРВИ врач может назначить:
Выбирая препарат интерферона при вирусной инфекции у детей, стоит обратить внимание на удобство применения, особенно если лечение требуется маленькому ребенку. Оптимальной лекарственной формой для применения у малышей являются ректальные суппозитории. Во-первых, при введении суппозитория ребенок получает нужную дозу лекарства, тогда как сироп или таблетку малыш может выплюнуть или срыгнуть. Во-вторых, в отличие от других лекарственных форм ректальные суппозитории не оказывают негативного влияния на органы ЖКТ и печень, а само средство и его активные вещества не подвергаются риску разрушения из-за агрессивных ферментов пищеварительного тракта.
Вирусная инфекция распространяется в буквальном смысле по воздуху, кроме того, заразиться можно через прикосновения к предметам, которыми пользовался больной. Так что уберечь ребенка от ОРВИ, особенно в сезон эпидемии, непросто. Однако при своевременном лечении болезнь отступит в самые короткие сроки, главное — следовать всем рекомендациям специалиста.


Количество просмотров: 459
Ни один родитель не хочет, чтобы его ребенок часто болел, а если такое происходит, то мамы и папы тут же бросаются укреплять его иммунитет. Всегда ли это оправдано, и не лучше ли обратиться к детскому иммунологу, чтобы тот разобрался, а нужно ли вообще вашему ребенку что-то менять в его иммунной системе?
В среднем, в течение года при нормальном функционировании иммунной системы, ребенок может переболеть 1-2 раза достаточно тяжелыми вирусными инфекциями (грипп, аденовирусная инфекция); до 4-5 инфекций могут протекать легко в виде насморка, покашливания, невысокой температуры. Единственный способ полноценно защититься от инфекционных заболеваний – выработать собственный иммунитет, который формируется при встрече с микробом. В этих случаях родителям не стоит считать, что у малыша снижен иммунитет. Частые ОРВИ ни в коей мере нельзя рассматривать, как проявление несостоятельности иммунной системы ребенка и говорить об иммунодефиците. Наоборот, для иммунодефицита характерны длительные, часто повторяющиеся инфекции, возбудителями которых являются бактерии и грибки.
Конечно, дети, посещающие детские сады, первое время болеют достаточно часто, так как возможность контакта с заболевшими людьми увеличивается. Этот период обычно длится 6-12 месяцев. Причиной повышенной заболеваемости может стать и стрессовая ситуация, нежелание ребенка находиться в дошкольном учреждении, и т.п. Отмечено, что дети, не посещающие детский сад, болеют реже, но как только они начинают ходить в школу, частота вирусных заболеваний у них резко возрастает.
Известно несколько критических периодов формирования иммунитета ребенка:
Первый – период новорожденности (до 28 дней жизни). В это время иммунная защита ребенка подавлена. Поэтому младенец очень восприимчив к вирусным инфекциям и воздействию собственных условно-патогенных микробов, которые способны вызывать заболевания в условиях сниженного иммунитета.
Второй критический период – 3-6 месяцев жизни, обусловлен разрушением материнских антител в организме ребенка. Но на проникновение инфекции в организме малыша все же развивается первичный иммунный ответ. Однако в этот период дети подвержены воздействию разного рода вирусов, вызывающих ОРВИ. Также в это время отмечается высокая заболеваемость кишечными инфекциями, воспалительными заболеваниями органов дыхания. К тому же, пока у него еще не развита иммунологическая память. В этом же возрасте могут появляться пищевые аллергии.
Третий критический период – 2-3 года жизни ребенка. У малыша значительно расширяются контакты с окружающим миром. Основным в работе иммунной системы остается первичный иммунный ответ. Дети все еще очень чувствительны к вирусам и бактериальным инфекциям, причем характерны повторные заболевания.
Четвертый критический период – 6-7 лет. Именно в этом возрасте формируются многие хронические заболевания, нарастает частота аллергических заболеваний.
Пятый критический период – подростковый возраст (12-13 лет у девочек; 14-15 лет – у мальчиков). Период бурного роста и гормональной перестройки, сочетается с уменьшением лимфоидных органов. После периода спада, отмечается новый подъем частоты хронических заболеваний.
Для повышения защитных сил организма ребенка можно применять различные общеукрепляющие методики: закаливание, контрастные воздушные ванны, одевать малыша соответственно погоде, принимать поливитамины, стараться максимально ограничить контакты с другими детьми в периоды вспышек сезонных вирусных заболеваний (например, во время эпидемии гриппа не стоит водить ребенка на елки и прочие массовые мероприятия). Кроме того, можно использовать лекарственные средства, повышающие местную неспецифическую защиту слизистых оболочек верхних дыхательных путей.
Широко используется и защитное действие лимона. В этом виде цитрусовых, помимо наличия фитонцидов (в кожуре) содержится много витамина С, обладающего высокой стимулирующей активностью иммунной системы. Лимон можно добавлять в чай или воду для питья, но существуют и более интересные рецепты. К примеру, протертый через мясорубку лимон смешивается с медом и курагой (грецким орехом) в равных пропорциях, принимается по 1 чайной ложке 1-2 раза в день в течение 1 месяца. Естественно, это блюдо противопоказано детям-аллергикам, так как все его составляющие высокоаллергенны.
Существует две группы иммунодефицитов. Первичные иммунодефицитные состояния – это генетически обусловленные стойкие дефекты развития иммунной системы. Чаще всего они врожденные или проявляются в раннем детском возрасте. К счастью, эти заболевания встречаются достаточно редко.
Если у ребенка определен вторичный иммунодефицит, то это тоже не значит, что он требует немедленной коррекции иммунитета. Последний в таких случаях страдает от внешних условий: неправильное питание, инфекционное заболевание, обменное нарушение (например, диабет), психологические перегрузки, стрессы и т.п. И в этих случаях нужно не иммунитет корректировать, а устранять причину, вызвавшую его нарушение.
Своеобразный тест на провокацию иммунитета – это детский сад. Если малыш ходит в детсад, пусть даже у него иногда появляется насморк, и он болеет, то все нормально. А если вы не водите ребенка в сад потому, что он часто болеет даже дома – это повод для тревоги. Вообще, где тонко, там и рвется. Если у ребенка гастрит, а он продолжает уплетать копченую курицу с кетчупом, то нечего ослабленное здоровье сваливать на иммунитет и просить врача его исправить. Если ребенку нехорошо в домашних условиях, оглянитесь: может, стоит скатать ковры, пропылесосить или кошку отдать бабушке…
Удивление вызывают мамы, которые не следят за своим здоровьем во время беременности, позволяют себе выпивать, курить, а потом требуют от врачей исправить иммунитет своего ребенка. Не нужно думать, что болеть – это всегда плохо. Плохо болеть подолгу и с осложнениями. Как правило, к перенесенным заболеваниям организм либо совсем не возвращается, либо сталкивается с ними уже окрепшим. Дети, переболевшие разными штаммами вирусов, во взрослом возрасте практически перестают болеть.
Сегодня продается большое количество иммуномодуляторов, но пользоваться ими нужно только после консультации с педиатром, лор-врачом и иммунологом. Лор-врач нужен потому, что иммуномодуляторы не должны назначаться, если у ребенка есть непролеченный очаг хронической инфекции. Например, когда в миндалинах гнойные пробки, то, что тут можно модулировать? Сначала нужно поставить диагноз, а затем только назначать иммуномодуляторы или отказываться от них.
Дата публикации: 23 мая 2018 .
Врач лабораторной диагностики
(зав. лабораторией)
Г.Н. Полевечко
Бытовавшее ранее представления об ареактивности организма ребенка раннего возраста ныне отвергнуты, поскольку установлено, что на любом этапе развития организм обладает определенным набором иммунологических факторов, имеющих ряд особенностей, зависимых от возраста.
При этом различают процесс закладки иммунной системы,
реализацию её потенциальных возможностей в развертывании специфических реакций и достижения зрелости.
От того, как развивается иммунная система, зависит устойчивость организма ребенка или, наоборот, его подверженность различным заболеваниям бактериальной, вирусной, грибковой породы, а также иммунодефицитным состояниям и развитию аллергии.
Процесс созревания этой глобальной природной защиты длится многие годы, поскольку иммунологическая память не наследуется, а приобретается человеком.
Формирование иммунной системы у малыша начинается еще внутриутробно, когда устанавливаются сложные связи между организмом матери и плода.
Всего в организме человека вырабатывается 5 разновидностей антител (иммуноглобулинов), каждый из которых выполняет свою функцию.
Иммуноглобулин А защищает слизистые оболочки человека. Он связывает микробы и вирусы непосредственно в полости рта, в дыхательных путях, пищеварительном тракте и не дает им проникнуть во внутренние органы (легкие, сердце, печень). Однако он не запоминает вирусы и микробы, то есть не обладает иммунологической памятью, поэтому на каждое последующее поступление вирусов в организм вырабатываются свои антитела.
Иммуноглобулин М вырабатывается В-лимфоцитами в ответ на первое появление патогена и тоже не обладает иммунологической памятью. Однако при повторных встречах с одной и той же инфекцией антитела класса М способны запомнить микроб.
Иммуноглобулин G вырабатываются при появлении вирусов, микробов, аллергенов. Они запоминают эти патогены и предотвращают развитие инфекции. Причем иммуноглобулины G реагируют не только на вновь поступившие бактерии, но и на те микробы и вирусы, которые циркулируют в крови длительное время.
Иммуноглобулин Е появляются в ответ на размножение в организме паразитов (глистов) и контролируют развитие аллергических реакций.
Иммуноглобулин D участвует в синтезе В-лимфоцитов.
Первый критический период – период новорожденности (до 28 дней жизни). В это время иммунная защита ребенка подавлена. Поэтому младенец очень восприимчив к вирусным инфекциям и воздействию условно-патогенных микробов, которые способны вызывать заболевания в условиях сниженного иммунитета.
Второй критический период – 3-6 месяцев жизни – обусловлен разрушением материнских антител в организме малыша. Но на проникновение инфекции в организме ребенка все же развивается первичный иммунный ответ. Однако в этот период дети подвержены воздействию разного рода вирусов, вызывающих ОРВИ. Также в это время отмечается высокая заболеваемость кишечными инфекциями, воспалительными заболеваниями органов дыхания. Кроме того, если на первом году жизни ребенок не получил материнские антитела (мама не болела и не была привита или не кормила грудью), тяжело и нетипично протекают детские инфекции (коклюш, ветряная оспа, краснуха и др.). И, к сожалению, в дальнейшем ребенок может заболеть ими вновь, поскольку пока у него еще не развита иммунологическая память. В этом же возрасте могут появляться пищевые аллергии.
Третий критический период – 2-3 года жизни ребенка. У малыша значительно расширяются контакты с окружающим миром. Основным в работе иммунной системы остается первичный иммунный ответ, хотя уже могут образовываться иммуноглобулины G. Система местного иммунитета (иммуноглобулины А) сохраняется незрелой. Дети все еще чувствительны к вирусам и бактериальным инфекциям, причем характерны повторные заболевания.
Четвертый критический период – 6-7 лет. У ребенка в этот период уровни иммуноглобулинов М и G соответствуют параметрам взрослых, однако иммуноглобулин А имеет еще низкие значения. В это же время величина иммуноглобулина Е достигает максимального уровня. В 6-7 лет формируются многие хронические болезни, нарастает частота аллергических заболеваний.
Пятый критический период – подростковый возраст (12-13 лет у девочек и 14-15 лет у мальчиков). Период бурного роста и гормональной перестройки сочетается с уменьшением лимфоидных органов (тканевых образований, в которых образуются иммунные клетки и где они приобретают иммунную специфичность). После периода спада отмечается новый подъем частоты хронических заболеваний.
Для укрепления защитных сил организма ребенка можно применять различные общеукрепляющие методики: закаливание, контрастные воздушные ванны, одевать малыша соответственно погоде, стараться максимально ограничить контакты с другими детьми в период вспышек сезонных вирусных заболеваний (например, не водить ребенка на различные массовые мероприятия во время эпидемии гриппа).
Достаточно эффективны средства народной медицины, например, чеснок и лук. Эти растения выделяют так называемые фитонциды – вещества, уничтожающие вирусы и бактерии. Обычно их измельчают и расставляют в стеклянных блюдцах в помещении. Нанизанный на ниточку зубчик чеснока можно повесить малышу на шею.
Когда нужно обратиться к иммунологу?
По данным Всемирной Организации Здравоохранения, дети до 3 лет переносят 6-8 респираторных заболеваний в год. В среднем, в течение года при нормальном функционировании иммунной системы, ребенок может переболеть 1-2 раза достаточно тяжелыми вирусными инфекциями (грипп, аденовирусная инфекция); до 4-5 инфекций могут протекать легко, в виде насморка, покашливания, невысокой температуры.
В этих случаях родителям не стоит считать, что у малыша снижен иммунитет. Ведь единственный способ полноценно защититься от инфекционных заболеваний – выработать собственный иммунитет, который формируется при встрече с микробом. Частые ОРВИ ни в коей мере не стоит рассматривать как проявление несостоятельности иммунной системы ребенка и говорить об иммунодефиците.
- Серьезным поводом для обращения к врачу-иммунологу может послужить: частые простудные заболевания, протекающие с осложнениями (ОРВИ, переходящая в бронхит, пневмонию и т.п.);
- повторные заболевания инфекциями, к которым должен вырабатываться пожизненный иммунитет (ветряная оспа, корь, краснуха и т.д.). Однако здесь стоит учитывать, что если малыш переболел этими заболеваниями до года, то иммунитет к ним может быть не стоек, не давать пожизненной защиты;
- длительное лечение острых или хронических заболеваний ребенка антибактериальными, противогрибковыми, гормональными препаратами, ослабляющими иммунитет.
Дети, посещающие детский сад, первое время болеют достаточно часто, так как возможность контакта с заболевшими людьми увеличивается. Этот период обычно длится 6-12 месяцев. Причиной повышенной заболеваемости может стать и стрессовая ситуация, нежелание ребенка находиться в дошкольном учреждении и т.п. Однако отмечено, что дети, не посещающие детский сад, болеют реже, но как только они начинают ходить в школу, частота вирусных инфекций у них резко возрастает.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
В настоящее время острые респираторные инфекции (ОРВИ), включая грипп, представляют собой одну из самых актуальных медицинских и социально-экономических проблем. Терапия острых респираторных инфекций (ОРИ) у детей остается важной задачей практического здравоохранения. В статье приведены данные по эпидемиологии, этиологии ОРИ, представлена клиническая картина ОРИ. Подробно описаны факторы и механизмы взаимодействия иммунной системы слизистой оболочки пищеварительного и респираторного трактов. Показано, что кишечная микробиота оказывает непосредственно модулирующее действие на иммунный ответ по отношению к патогенам, поражающим дыхательные пути. В статье рассмотрены результаты исследований по изучению эффективности влияния пробиотических микроорганизмов на состояние мукозального иммунитета, а также продемонстрированы клинические эффекты. Приведены результаты ряда исследований, демонстрирующих клиническую эффективность пробиотического штамма бифидобактерий Bifidobacterium animalis subsp. lactis ВВ-12. Описаны пробиотические продукты, содержащие живые микробные культуры с доказанными пробиотическими свойствами, целесообразность их включения в рацион питания детей.
Ключевые слова: острые респираторные инфекции, мукоза-ассоциированная лимфоидная ткань, микробиота, Bifidobacterium lactis ВВ-12, пробиотик.
Для цитирования: Каннер Е.В., Максимов М.Л., Ермолаева А.С., Горелов А.В. Острые респираторные инфекции у детей: особенности иммунного ответа и пути коррекции. РМЖ. Медицинское обозрение. 2018;8(II):74-78.
Acute respiratory infections in children: features of the immune response and ways of correction
E. V. Kanner 1 , M.L. Maximov 2 , A.S. Ermolaeva 3 , A.V. Gorelov 1,3
1 Central Research Institute of Epidemiology, Moscow
2 Kazan State Medical Academy — Russian Medical Academy of Continuing Professional Education
3 Sechenov University, Moscow
Nowadays, acute respiratory infections (ARI), including influenza, are one of the most pressing medical and socio-economic problems. Therapy of acute respiratory infections (ARI) in children remains an important task of practical health care. The article presents data on the epidemiology, etiology and clinical picture of ARI. Interaction factors and mechanisms of a mucous membrane immune system of digestive and respiratory tracts are described in detail. It has been shown that an intestinal microbiota has a directly modulating effect on the immune response in relation to pathogens affecting the respiratory tract. The article discusses the results of studies on the effectiveness of probiotic microorganisms on the state of mucosal immunity and demonstrates clinical effects. The results of a number of studies demonstrating the clinical efficacy of the probiotic strain of bifidobacteria Bifidobacterium animalis subsp. lactis BB-12 are given. Probiotic products containing live microbial cultures with proven probiotic properties, the expediency of their inclusion in children diet are described.
Key words: acute respiratory infections, mucosal-associated lymphoid tissue, microbiota, Bifidobacterium lactis BB-12, probiotic.
For citation: Kanner E. V., Maximov M.L., Ermolaeva A.S., Gorelov A.V. Acute respiratory infections in children: features of the immune response and ways of correction // RMJ. Medical Review. 2018. № 8(II). P. 74–78.
В статье приведены данные по эпидемиологии, этиологии острых респираторных инфекций, представлена их клиническая картина. Подробно описаны факторы и механизмы взаимодействия иммунной системы слизистой оболочки пищеварительного и респираторного трактов. Приведены результаты ряда исследований, демонстрирующих клиническую эффективность пробиотического штамма бифидобактерий Bifidobacterium animalis subsp. lactis ВВ-12.
Иммунная система СО организма играет огромную роль в развитии, поддержании и регуляции иммунного гомеостаза, являясь важной составляющей многокомпонентной системы иммунитета, осуществляя защиту организма от генетически чуждых ему экзогенных и эндогенных элементов [10].
Структурной основой местного иммунитета является лимфоидная ткань, ассоциированная с СО (mucosal-associated lymphoid tissue (MALT)). В MALT принято выделять несколько отделов (рис. 1): TALT (носоглотка, евстахиева труба, ухо; NALT (носовая полость, рот и ротоглотка, конъюнктивы), BALT (трахея, бронхи, легкие, грудные железы у женщин), GALT (пищевод, желудок, кишечник и урогенитальный тракт), SALT (дерма) [11]. 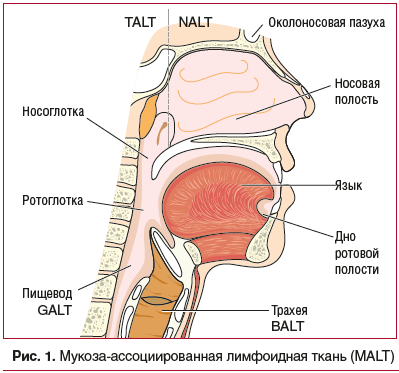
К факторам мукозальной иммунной системы относят сапрофитную микрофлору, защитный эпителий, слизеобразование, кератинизацию и слюнообразование, антимикробные пептиды (лизоцим, дефензины, лактоферрин, интерфероны, пропердин), фагоциты, комплемент, секреторный иммуноглобулин А (sIgA), IgG, врожденные лимфоидные клетки (ILC), включая NK-клетки, CD4+ и CD8+ Т-лимфоциты [10].
Несмотря на то, что в иммунной системе СО выделяют эффекторный и индуктивный отделы, это деление условно, потому что MALT-лимфоциты постоянно мигрируют, заселяя при этом характерные для каждой популяции зоны обитания. Такая закономерность получила название хоминг-эффекта [12]. Следствием этого является одновременное включение иммунного ответа во всех СО, вне зависимости от очага антигенного стимула.
В индуктивных зонах, к которым относят прежде всего пейеровы бляшки, происходит презентация антигена; антигенпрезентирующие клетки и антигенреактивные Т- и В-лимфоциты поступают в лимфу, затем в кровь, а оттуда мигрируют в собственную пластинку СО (эффекторный отдел). Направленная миграция осуществляется с помощью гуморальных факторов (интегрин α4b7, хемокиновый рецептор CCR9 и др.), а точками прикрепления являются хоминг-рецепторы клеток тканей [13]. В норме при отсутствии воспаления лимфоциты мигрируют предпочтительно в ту ткань, где они впервые обнаружили антиген, и поэтому их хоминг-рецепторы специфичны к лигандам, находящимся на клетках этих тканей [14]. Подобное взаимодействие именно между дыхательной и пищеварительной системами специфично, т. к. в экспериментах показано отсутствие такой взаимосвязи между другими органами [15].
Плазматические клетки собственной пластинки и пейеровых бляшек синтезируют димерную молекулу IgA, которая связывается на базальной поверхности эпителиальной клетки со специализированным трансмембранным белком, имеющим в своем составе гликопротеид — секреторный компонент. Пройдя с помощью трансцитоза эпителиальную клетку, димерная молекула IgA присоединяет секреторный компонент, превращается в sIgA, причем секреторный компонент делает молекулу иммуноглобулина устойчивой к протеолизу [16]; sIgA препятствует адгезии микроорганизмов, их токсинов, пищевых аллергенов на эпителии СО и тем блокирует их проникновение во внутреннюю среду организма. Адаптивный иммунитет СО обеспечивается главным образом антителами класса sIgA, в меньшей мере — IgM и IgG [17].
В настоящее время накоплены научные данные, свидетельствующие о том, что отделы СО различных систем организма тесно взаимодействуют между собой, подчиняясь единым регулирующим влияниям. Существует перекрестная регуляция иммунитета легких и кишечника, показано, что кишечная микробиота оказывает непосредственно модулирующее действие на иммунный ответ по отношению к патогенам, поражающим дыхательные пути [18, 19].
Теория единства иммунной системы анатомически не взаимодействующих СО была сформулирована J. Bienenstock около 40 лет назад [20]. Эта концепция предполагает, что различные отделы СО организма функционируют вместе как один системный орган, защищающий организм хозяина от чужеродных организмов. Стимуляция либо поражение слизистой одной системы в значительной мере влияет на СО другой системы. Подход к изучению иммунной системы слизистых как объединенного глобального органа является определяющим для дальнейших достижений в понимании иммунологии слизистых и в лечении многих заболеваний [21].
Особенно тесно такая взаимосвязь осуществляется между пищеварительным и респираторным трактом, т. к. они имеют общее эмбриональное происхождение, функционально сходны — их слизистые имеют контакт с внешней средой и осуществляют функцию первичной защиты от чужеродных патогенов, играя ключевую роль во врожденном и приобретенном иммунитете. В исследованиях было продемонстрировано, что вакцинация слизистой одного отдела ведет к повышению защитной функции слизистой другого отдела, инфицирование вирусом ведет к появлению вирусоспецифичных концентраций иммуноглобулинов в секрете слизистых другого отдела [19]. Также показано, что Т-клетки кишечника, зараженные ротавирусом, осуществляют защиту дыхательного тракта от ротавирусной инфекции [22].
Сообщается об увеличении числа нейтрофилов, эозинофилов и Т-клеток в мокроте пациентов с воспалительными заболеваниями кишечника (ВЗК) [23]. Микробиота ЖКТ играет защитную роль в отношении пневмококковой пневмонии [18].
На сегодняшний день нет точных доказательств существования единого медиатора, который выполнял бы роль связующего звена между кишечником и легкими, однако одним из кандидатов на эту роль является тимический стромальный лимфопоэтин (TSLP). TSLP является главным регулятором воспалительных процессов кожи и дыхательных путей, решающим фактором, регулирующим Th2-воспалительный ответ [24, 25]. Повышенная продукция TSLP в кератоцитах кожи ведет к появлению атопического дерматита с сопутствующим аллергическим воспалением в легких мышей [26].
Интерфероны (ИФН) I и III типа связываются с различными рецепторами на клеточной поверхности, но индуцируют сигналы сходной направленности, что приводит к экспрессии антивирусных эффекторных молекул-хозяев. Хотя было показано, что ИФН III типа (ИФН-λ) преимущественно воздействует на органы СО кишечника, в то же время отмечается и роль ИФН I типа (α), что сопровождается экспрессией рецепторов к нему на эпителиальных клетках, прежде всего дыхательной системы. ИФН-α оказывает влияние на дендритные клетки в лимфоэпителиальном глоточном кольце Пирогова — Вальдейера, активируя созревание незрелых дендритных клеток, стимулирующих, в свою очередь, созревание и пролиферацию В-клеток, а также способствует пролиферации СD4+ и CD8+ Т-23 клеток, усиливает цитотоксические свойства CD8+, макрофагов и NK-клеток [27].
Клетки эпителия кишечника, которые являются основными мишенями для ротавирусной инфекции, более сильно реагируют на ИФН III типа, чем на I тип. Таким образом, именно ИФН-λ (III тип) играет критическую роль в противовирусной защите эпителиальных клеток [28].
Сапрофитная микрофлора (в кишечнике и урогенитальном тракте это лактобактерии и бифидобактерии, в ротовой полости — сапрофитные нейссерии, в дерме — эпидермальный стафилококк) имеет определяющее значение для состояния мукозальной иммунной системы [11, 29]. Ее функции многообразны и включают антагонизм по отношению к патогенной микрофлоре за счет продукции органических кислот, перекиси водорода и бактериоцинов, синтез молочной кислоты и снижение рН, конкуренцию с патогенной флорой за адгезивные сайты (колонизационная резистентность), стимуляцию иммунных ответов за счет адъювантных свойств, стимуляцию муцинообразования [27, 30, 31].
И процессы возрастной эволюции, и закономерности реагирования на внедрение патогенов в биотопах кишечника и респираторного тракта во многом сходны. Так, количественный и качественный состав микробиоты приближается к схожему с таковым у взрослого человека в обоих биотопах к третьему году жизни. Известно, что существует перекрестная регуляция иммунитета легких и кишечника [18, 19, 32].
Это позволяет предположить, что воздействие на микробиоту кишечника может быть удобным инструментом для профилактики не только желудочно-кишечных, но и бронхолегочных заболеваний. Ряд исследований демонстрирует такой эффект при использовании диеты с высоким содержанием клетчатки, что стимулирует на реакцию дыхательных путей у мышей, или при приеме пробиотиков в дородовом или раннем послеродовом периоде для профилактики не только атопической экземы, но и бронхиальной астмы [33–36].
В биотопах человека функционируют устойчивые к инфекции молекулярно-клеточные компартменты, включающие пробиотические бактерии, синтезирующие лектиновые системы с разнообразным антипатогенным потенциалом [37]. Углубленное изучение механизмов участия микрофлоры биотопов в системе мукозального иммунитета позволило установить способность лектинов облигатных бактерий распознавать и связывать при развитии патологических состояний гликаны муцинов с остатками D-галактозамина или нейраминовой кислоты (NeuNAc, Neu5NAc) с участием системы комплемента [38, 39].
При совместном культивировании бифидобактерий и клеток кишечного мукозального барьера последние продуцируют повышенные уровни комплемента C3a, при этом бифидобактерии регулируют активность некоторых участвующих в воспалении генов. Bifidumbacterium breve IPLA20004 могут способствовать рекрутированию клеток врожденного иммунитета в мукозальную оболочку [40].
Только для зарегистрированных пользователей
Читайте также:


