Хроническая очаговая инфекция у детей
, MD, University of Rochester School of Medicine and Dentistry
Last full review/revision January 2018 by Geoffrey A. Weinberg, MD
Причины, обследование и тактика ведения возможной скрытой бактериемии варьирует в зависимости от возраста и прививочного статуса детей. См. также Лихорадка у детей грудного и младшего возраста (Fever in Infants and Children).
Дети в возрасте от 3 до 36 мес.
В период до конъюгированных вакцин, примерно от 3 до 5% детей в возрасте от 3 до 36 мес. с лихорадочным заболеванием (температура ≥ 39 ° C) и без локализации патологических изменений (то есть, лихорадка без источника) имели скрытую бактериемию. И наоборот, дети старше 36 мес. с бактериемией почти всегда выглядели больными и имели идентифицируемый (т. е. не скрытый) очаг инфекции. Большинство (80%) случаев скрытой бактериемии до начала плановой вакцинации конъюгатами, было вызвано Streptococcus pneumoniae. Меньший процент случаев (10%) был вызван Haemophilus influenzae типа b, и еще меньший процент (5%) – Neisseria meningitidis.
Скрытая бактериемия является проблемой, потому что у порядка 5-10% детей развиваются тяжелые бактериальные инфекции (ТБИ) — в большинстве случаев они определяются как сепсис, менингит, а также инфекции мочеполовых путей, но в том числе и септический артрит и остеомиелит. Такие инфекции могут быть сведены к минимуму путем раннего выявления и лечения бактериемии. Вероятность прогрессирования серьезного очагового заболевания зависит от причины: от 7 до 25% бактериемий вызваны H. influenzae типа b, и 4-6% – S. pneumoniae.
В настоящее время в США и Европе, плановая вакцинация младенцев полисахаридной конъюгированной вакциной против S. pneumoniae и H. influenzae типа b ликвидировала (> 99%) инфекции H. influenzae типа b и существенно снизила (≥ 70% совокупно и ≥90% по типу вакцины) инвазивные инфекции S. pneumoniae. Таким образом, в этой возрастной группе скрытая бактериемия стала редким исключением у детей не вакцинированных должным образом или вообще не привитых, а также у детей с иммунодефицитом.
Дети в возрасте до 3 мес.
И наоборот, лихорадящие младенцы в возрасте до 3 мес. по-прежнему имеют больший риск тяжелой бактериальной инфекции, чем груднички постарше, примерно от 8 до 10%. В прошлом ТБИ у маленьких детей до 3 мес. наиболее часто были вызваны бета-гемолитическим Streptococcus группы В, S. pneumoniae, а также H. influenzae типа b. Однако химиопрофилактика во время родов у беременных, колонизированных бета-гемолитическим Streptococcus группы В, снизила раннее начало (инфекции, возникающее в возрасте до 7 дней) стрептококковых заболевании группы В более, чем на 80%. Кроме того, плановая вакцинация конъюгатами уменьшила колонизацию среди старших братьев и сестер, привитых против S. pneumoniae и H. influenzae типа b, таким образом, что частота ТБИ, вызванных данными микроорганизмами, также снизилась (коллективный иммунитет).
Следует отметить, что на стрептококковую инфекцию группы В с поздним началом (инфицирование происходит в возрасте старше 7 дней) не влияет химиопрофилактика во время родов, а также другие тяжелые бактериальные болезни, такие как ИМВП (чаще всего вызвана Escherichia coli), и отдельные случаи бактериемии Salmonella продолжают оставаться основными причинами лихорадки без видимого источника при объективном обследовании у детей
Клинические проявления
Основным симптомом скрытой бактериемии является лихорадка — температура ≥ 39 °С ( ≥ 38°С для грудных детей до 3 мес.). По определению дети с явным локальным заболеванием (например, кашлем, одышкой и легочными хрипами, предполагающими пневмонию, эритемой кожи, указывающей на флегмону или септический артрит) исключаются (то есть, потому что их заболевание не является скрытыми). Токсические проявления (например, вялость и апатичность, заторможенность, признаки плохой перфузии, цианоз, выраженная гиповентиляция или гипервентиляция) предполагают наличие сепсиса или септического шока, бактериемия у таких детей не классифицируются как скрытая или как лихорадка без видимого очага инфекции. Однако ранние этапы сепсиса может быть трудно отличить от скрытой бактериемии.
Диагностика
Посев мочи и общий анализ мочи
Полный анализ крови и лейкоцитарная формула
Иногда другие диагностические исследования, в зависимости от возраста и клинического состояния
Для диагностики бактериемии требуется посев крови; в идеале, набирается два образца из разных мест, что позволяет свести к минимуму проблему ложноположительных результатов из-за контаминации кожи, с получением результатов в течение 24 ч.
Рекомендации по обследованию и выбору диагностических тестов варьируют в зависимости от возраста, температуры и клинических проявлений; цель состоит в том, чтобы минимизировать обследования, не пропустив при этом ТБИ. Дети, которые имеют признаки очаговой инфекции в анамнезе или при объективном обследовании, оцениваются на основе этих результатов.
Когда доступно, диагностические экспресс-тесты на энтеровирусы, респираторно-синцитиальный вирус и вирус гриппа целесообразны при обследовании детей с лихорадкой без видимого источника, потому что дети, с положительными результатами тестов на вышеуказанные вирусы, вероятно, лихорадят в результате этих возбудителей и требуют небольшого количества диагностических процедур, или вообще не нуждаются в дальнейшем обследовании на ТБИ. Существуют также экспресс-тесты для других вирусов, но они недостаточно изучены, чтобы обосновать использование их результатов для изменения обследования на ТБИ.
У младенцев с CБИ клинический анализ крови обычно показывает повышенное количество лейкоцитов, однако только у 10% детей с количеством лейкоцитов > 15 000/мкл присутствует бактериемия, поэтому специфичность этого метода низкая. Маркеры острой фазы воспаления (например, СОЭ, С-реактивный белок) используются некоторыми врачами, но дают мало информации; некоторые врачи считают, что повышенный уровень прокальцитонина может быть более специфичным для тяжелого заболевания. У детей 3 мес. число тромбоцитов > 1500/мкл и низкое ( 5000/мкл) или высокое ( > 15 000/мкл) число лейкоцитов могут указывать на бактериемию.
Важно отметить, что любой лихорадящий ребенок, независимо от прививочного анамнеза, который выглядит тяжелобольным или интоксицированным, требует комплексного клинического и лабораторного обследования (ОАК с лейкоцитарной формулой, бакпосев крови, бакпосев мочи, спинномозговая пункция, и, в большинстве случаев, госпитализация в больницу с эмпирической антимикробной терапией). Лихорадящие дети в этой возрастной группе, которые не привиты должным образом или вообще не привиты, а также с ослабленной иммунной системой, более восприимчивы к ТБИ, чем их сверстники, а также, как правило, нуждаются в вышеупомянутом полном клиническом и лабораторном обследовании на ТБИ и эмпирической антибактериальной терапии. Детям с одышкой или низкой сатурацией кислорода также необходимо провести рентген грудной клетки.
У ранее привитых лихорадящих детей в возрасте от 3 до 36 мес., которые выглядят хорошо (не имеют признаков интоксикации), риск бактериемии в настоящее время низкий и даже ниже, чем частота ложно-положительных культур крови из-за контаминации кожи, что заставляет многих специалистов отказаться от посева крови у этих детей. Тем не менее, обычно рекомендуется общий анализ мочи с микроскопией и посев мочи, но не дополнительное лабораторное обследование (например, ОАК, рентген грудной клетки). Несмотря на то, что подавляющее большинство этих детей имеют вирусную инфекцию, очень небольшое количество детей, выглядящих здоровыми, будут иметь начало ТБИ, поэтому ухаживающим лицам следует рекомендовать следить за симптомами ребенка, давать жаропонижающие и иметь обратную связь с врачом (путем посещения или в телефонном режиме, в зависимости от обстоятельств и надежности ухаживающих лиц) в течение 24 - 48 часов. Дети, которым становится хуже или продолжают лихорадить, должны пройти обследование (например, ОАК с лейкоцитарной формулой, бакпосев крови, при возможности, рентген грудной клетки или люмбальная пункция).
Младенцы, которые выглядят интоксицированными или тяжелобольными, требуют немедленного клинического обследования и забора крови, мочи, бакпосева ликвора, а также госпитализации для эмпирической антибактериальной терапии. В отличие от детей более старшего возраста, дети в возрасте до 3 мес., клиническое отсутствие признаков интоксикации обычно не позволяет отложить обследование.
Был разработан алгоритм для оказания помощи в проведении оценки младенцев в данной возрастной группе (для примера, Оценка состояния и ведение младенцев с лихорадкой в возрасте
ПЗМ = поле зрения микроскопа под большим увеличением.
Тябут Тамара Дмитриевна, профессор кафедры кардиологии и ревматологии Бел МАПО, доктор медицинских наук
Год здоровья. Прочитай и передай другому
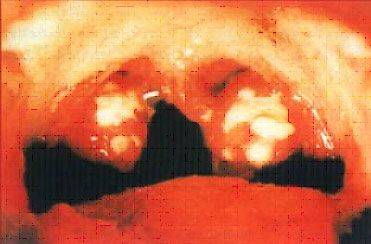
Тонзиллит, вызванный бета-гемолитическим стрептококком.
При наличии хронического тонзиллита в лакунах скапливается большое количество гноя, состоящего из погибших микробов, белых кровяных телец - лейкоцитов, других клеток (гнойно-казеозные пробки). В гнойном содержимом лакун размножаются болезнетворные микробы. Продукты жизнедеятельности микробов из миндалин попадают в кровь и приводят к развитию тонзиллогенной интоксикация, проявляющейся утомляемостью, болями в мышцах и суставах, головными болями, снижением настроения, субфебрилитетом. Миндалины превращаются в хранилище инфекционных агентов, откуда они могут распространяться по организму и быть причиной воспалительных процессов. Частые болезни еще более ослабляют иммунитет, что приводит к дальнейшему развитию тонзиллита. Так формируется порочный круг заболевания.
Хронический тонзиллит опасен осложнениями, связанными с распространением инфекции по организму. К ним относятся паратонзиллярные абсцессы, ·поражение сердца (тонзилогенная миокардиодистрофия, острая ревматическая лихорадка), сосудов, почек.
Тонзиллогенная миокардиодистрофия относится к часто развивающимся, но гораздо реже диагностируемым поражениям сердечной мышцы при хроническим тонзиллите. Она вызывается токсинами бактерий, находящихся в миндалинах, и продуктами местного воспаления и распада тканей.
Клинические признаки тонзиллогенной дистрофии миокарда обусловлены нарушением деятельности вегетативной нервной системы (вегетативной дисфункцией) и нарушением различных видов обмена в сердечной мышце (электролитного, белкового), следствием которых является нарушение образования энергии в сердечной мышце. На ранних этапах развития тонзилогенная миокардиодистрофия проявляется высокой частотой сердечных сокращений - тахикардией, перебоями в работе сердца - экстрасистолией, одышкой при интенсивных физических нагрузках, нарушением общего самочувствия больных. При поздней диагностике появляются признаки сердечной недостаточности, уменьшается объем нагрузки, вызывающей одышку, появляются более тяжелые нарушения ритма и проводимости. При своевременной диагностике и лечении внесердечного фактора - хронического тонзиллита, вызвавшего перечисленные изменения в сердечной мышце, они обратимы и постепенно структура и функции сердечной мышцы
восстанавливаются.
Наибольшую опасность для прогноза и качества жизни пациентов представляет поражение сердца при острой ревматической лихорадке.
Острая ревматическая лихорадка (ОРЛ) - постинфекционное осложнение тонзиллита (ангины) или фарингита, вызванных бета - гемолитическим стрептококком группы А, в виде системного воспалительного заболевания соединительной ткани с преимущественной локализацией патологического процесса в сердечно-сосудистой системе (кардит), суставах (мигрирующий полиартрит), мозге (хорея) и коже (кольцевидная эритема, ревматические узелки), развивающегося у предрасположенных лиц, главным образом молодого возраста (7-15 лет). В Российской Федерации и в РБ заболеваемость ревматической лихорадкой составляет от 0,2 до 0,6 случаев на 1000 детского населения. Первичная заболеваемость ОРЛ в России в начале ХХI века составила 0,027 случая на 1000 населения. Частота впервые выявленной хронической ревматической болезни сердца (ХРБС), которая включает пороки сердца и специфические изменения клапанов (краевой фиброз), выявляемые при ультразвуковом исследовании сердца - 0,097случаев на 1000 населения, в том числе ревматических пороков сердца - 0,076 случаев на 1000 взрослого населения. Имеющиеся статистические различия между частотой первичной заболеваемости острой ревматической лихорадкой и хронической ревматической болезнью сердца свидетельствует о наличии большого количества не диагностированных острых форм болезни.
Временной интервал между перенесенным острым стрептококковым тонзиллитом, фарингитом, обострением хронического тонзиллита и возникновением проявлений острой ревматической лихорадки составляет 3-4 недели. При острой ревматической лихорадке могут поражаться все структуры сердца - эндокард, миокард, перикард. Поражение миокарда (мышцы сердца) встречается всегда. Проявлениями поражения сердца могут быть сердцебиение, одышка, связанная с физической нагрузкой или в покое, боли в области сердца ноющего характера, которые в отличие о стенокардии не имеют четкой связи с физической нагрузкой и могут сохраняться длительный период времени, сердцебиение, перебои в работе сердца, приступообразные нарушения ритма - мерцательная аритмия, трепетание предсердий. Обычно поражение сердца сочетается с суставным синдромом по типу артралгий - болей в крупных суставах (коленных, плечевых, голеностопных, локтевых) или артрита (воспаления) этих же суставов. Для воспаления суставов характерны боль, изменения формы сустава, вызванные отеком, покраснение кожи в области пораженного сустава, местное повышение температуры и нарушение функции сустава в виде ограничения объема движений. Мелкие суставы поражаются гораздо реже. Воспалительный процесс в суставах носит мигрирующий характер и быстро проходит на фоне правильного лечения. Поражение сердца и суставов обычно сопровождается повышением температуры тела, слабостью потливостью, нарушением трудоспособности. У части пациентов встречаются поражения нервной системы, кожные сыпи по типу кольцевидной эритемы и подкожные ревматические узелки.
Для постановки диагноза острой ревматической лихорадки существуют диагностические критерии, которые включают клинические, лабораторные и инструментальные данные, а также информацию о перенесенной инфекции, вызванной бета-гемолитическим стрептококком группы А, его ревматогенными штаммами. Своевременно поставленный диагноз позволяет добиться выздоровления больного при проведении терапии антибиотиками, глюкокортикоидными гормонами, нестероидным противовоспалительными препаратами. Однако, при поздно начатом лечении, несоблюдении пациентами двигательного режима, наличии генетической предрасположенности, не санированной очаговой инфекции (декомпенсированный тонзиллит, кариес) исходом острой ревматической лихорадки может быть хроническая ревматическая болезнь сердца с пороком сердца или без него. Порок сердца возникает как исход воспалительного поражения клапанов сердца. Наличие порока сердца ревматической этиологии требует отнесения пациента к группе высокого риска развития инфекционного эндокардита, наиболее тяжелой формы поражения сердца, связанного с инфекционными агентами.
Острая ревматическая лихорадка относится к заболевания, при которых профилактика имеет важное значение для снижения как первичной заболеваемости, так и повторных эпизодов болезни (повторная острая ревматическая лихорадка).
Первичная профилактика имеет своей целью снижение первичной заболеваемости и включает комплекс медико-санитарных и гигиенических мероприятий, а так же адекватное лечение инфекций, вызванных бета-гемолитическим стрептококком группы А. Первое направление включает мероприятия по закаливанию, знакомство с гигиеническими навыками, санацию хронических очагов инфекции, в первую очередь - хронического тонзиллита и кариеса. Миндалины тщательно санируют повторными полосканиями и промываниями растворами антибактериальных средств, вакуум-аспирацией патологического содержимого лакун. Если это не дает желаемого результата обсуждается вопрос хирургического лечения - удаления миндалин. В каждом конкретном случае выбор тактики лечения определяет врач отоларинголог и терапевт, кардиолог или ревматолог.
Адекватное лечение ангины и фарингита направлено на подавление роста и размножения стрептококка в организме при развитии стрептококкового фарингита, ангины, тонзиллита. Основу лечения составляет антибиотикотерапия в сочетании с противовоспалительными средствами, которые должны проводиться не менее 10 дней с обязательным контролем общего анализа крови, мочи, а по показаниям биохимического анализа крови при возникновении признаков болезни, при окончании лечения и через месяц от появления первых признаков болезни. Лабораторное исследование, проведенное в эти сроки, позволяет правильно поставить диагноз, определить эффективность лечения, и что самое главное, не пропустить начало развития осложнения в виде острой ревматической лихорадки.
Вторичная профилактика имеет своей целью предупреждение развития повторной острой ревматической лихорадки и прогрессирования заболевания у лиц, перенесших ОРЛ. Она проводится у пациентов, не имеющих аллергии к препаратам пенициллинового ряда. Лекарственным средством, используемым для профилактики у взрослых является бензатинбензилпенициллин (экстенциллин, ретарпен) в дозе 2 400 000 ЕД 1 раз в 3 недели внутримышечно. Профилактические режимы зависят от возраста пациента и исхода острой ревматической лихорадки. В соответствии с рекомендациями Ассоциации ревматологов России вторичная профилактика включает следующие режимы:
Наиболее тяжелым и прогностически неблагоприятным заболеванием сердца, связанным с инфекцией считается инфекционный эндокардит - заболевание, характеризующееся развитием воспалительного процесса на клапанном или пристеночном эндокарде, включающее поражение крупных внутригрудных сосудов, отходящих от сердца, возникающее вследствие воздействия микробной инфекции. Наиболее часто это различные бактерии- стрептококки, стафилококки, энтерококки, кишечная палочка, синегнойная палочка и многие другие. Описано 119 различных возбудителей, приводящих к развитию заболевания.
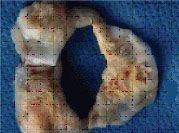
Аортальный клапан
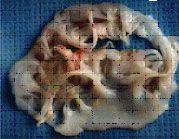
Митральный клапан
Так выглядят клапаны сердца при развитии инфекционного эндокардита.
Наложения из микробов, клеток крови нарушают их функцию,
разрушают клапан и зачастую требуют экстренного хирургического лечения.
Распространенность инфекционного эндокардита в начале 21 века составляла 2- 4 случая на 100 000 населения в год. Отмечается повсеместный рост заболеваемости, наиболее выраженный в старших возрастных группах и составляющий 14, 5 случая на 100 000 населения в возрасте 70-80 лет. Диагностика заболевания сложна. При первом обращении к врачу диагноз ставится только у 19 - 34,2% больных. Средний срок от первичного обращения до постановки диагноза составляет не менее 1,5 - 2 месяцев.
Выделяют группу больных с высоким риском развития инфекционного эндокардита, в которую входят:
- пациенты с ранее перенесенным инфекционным эндокардитом,
- пациенты с протезированными клапанами сердца,
- пациенты с синими врожденными пороками,
- пациенты после хирургических операций на аорте, легочных сосудах
- пациенты с приобретенными пороками сердца, в первую очередь ревматической этиологии (ХРБС).
Кроме этого выделена группа умеренного (промежуточного) риска, объединяющая пациентов со следующими заболеваниями:
- Пролапс митрального клапана, обусловленный миксоматозной дегенерацией или другими причинами с регургитацией 2-3 степени или пролапсы нескольких клапанов
- Нецианотичные врожденные пороки сердца (исключая вторичный ДМПП)
- Бикуспидальный (двухстворчатый)аортальный клапан
- Гипертрофическая кардиомиопатия (идиопатический гипертрофический субаортальный стеноз).
Установлено, что для развития инфекционного эндокардита необходимо попадание возбудителя в кровь. Наиболее частой причиной этого могут быть стоматологические манипуляции, сопровождающиеся повреждением десны и кровоточивостью. При наличии кариеса или заболеваний десен, бактериемия (наличие возбудителя в крови) может возникать достаточно часто.
Хронический тонзиллит у детей – симптомы, причины, профилактика, диагностика и лечение в клинике "Парацельс", Александров
Хронический тонзиллит относится к группе очень распространенных заболеваний. По данным медицинской статистики им страдают около 15% людей земного шара. Чаще это заболевание встречается у детей, у которых оно наблюдается до 30%.
Что такое хронический тонзиллит
Ротоглотка человека имеет специальные структурыー миндалины, они защищают организм от патогенных микроорганизмов. В детском возрасте эти структуры поддаются колоссальной нагрузке, ведь каждый день ребенок контактирует с новыми, еще не знакомыми ему микробами.
Когда на поверхности миндалин на задней стенке глотки, “поселяются” бактерии, а иммунитет не справляется с ними, развивается воспаление ー тонзиллит. Если это воспаление сохраняется длительно, острый тонзиллит (ангина) переходит в хронический воспалительный процесс .
Миндалины при хроническом тонзиллите не выполняют свои функции, а наоборот ー становятся источником заразы. Это приводит к осложнениям инфекционного и аутоиммунного характера.
Симптомы хронического тонзиллита
Тонзиллит сопровождается местными симптомами непосредственно в горле, и общими ー со стороны других органов и систем.
Хронический тонзиллит характеризуется неоднократным повторением ангин.
- боль и дискомфорт в горле, ребенку больно глотать твердую пищу;
- увеличение и болезненность шейных лимфоузлов;
- повышение температуры тела до 37-38 градусов;
- неприятный запах изо рта;
- признаки интоксикации – лихорадка, головная боль, слабость;
- боль в животе, тошнота и рвота;
- при осмотре покраснение зева, видны миндалины, возможно с белым налетом (в норме миндалины не выступают из-за небных дужек, их не видно).
Инфекционный процесс не ограничивается только горлом, вслед за симптомами тонзиллита появляются насморк, охриплость голоса, кашель. Возможно развитие конъюнктивита, отита, менингита.
Причины хронического тонзиллита
Тонзиллит – инфекционное заболевание. Среди возбудителей, которые могут вызвать тонзиллит, выделяют:
- бактерии (стрептококки, стафилококки, дифтерийная палочка и т.д.);
- ОРВИ (вирусы гриппа, парагриппа, аденовирусы);
- герпес-вирусы (цитомегаловирус, вирус Эпштейн-Барра);
- вирус кори;
- дрожжевые грибы (кандида).
В роли провоцирующих факторов выступают переохлаждение, употребление холодных продуктов, контакты с болеющими людьми, стрессы, нерациональное питание. Кандидозный тонзиллит может свидетельствовать об иммунодефиците.
Осложнения при неправильном самолечении и отсутствии лечения тонзиллита
Различают простую форму тонзиллита ー сопровождается только местными симптомами, и токсико-аллергическую (осложненную) ー на первый план выступают проявления интоксикации и нарушения функции всех органов и систем.
Токсико-аллергические проявления свойственны хроническому тонзиллиту стрептококкового происхождения. При этой форме в крови образовываются антитела к стрептококкам, которые также способны атаковать и собственные ткани организма. Наиболее уязвимыми к такой аутоиммунной агрессии являются почки, сердце и суставы. Поэтому хронический тонзиллит приводит к таким осложнениям:
- гломерулонефрит и впоследствии почечная недостаточность;
- эндокардит, миокардит, перикардит;
- ревматизм, ревматоидный артрит, системная красная волчанка.
Рекомендации по профилактике тонзиллита
Чтобы предотвратить развитие хронического тонзиллита, необходимо придерживаться таких рекомендаций:
- избегайте переохлаждения ребенка;
- оградите его от общения с заболевшими людьми;
- следите за полноценностью питания ребенка;
- своевременно показывайте ребенка педиатру или детскому ЛОР-врачу при появлении первых симптомов ангины;
- своевременно посещайте с ним стоматолога для удаления кариозных зубов, которые являются источником размножения бактерий во рту.
Диагностика и лечение тонзиллита
Диагностика хронического тонзиллита делается на основании симптомов и данных осмотра. Для оценки общего состояния ребенка могут быть назначены дополнительные методы обследования:
- общий анализ крови;
- общий анализ мочи;
- рентгенография грудной клетки;
- электрокардиография.
При хроническом тонзиллите у ребенка могут быть выявлены признаки поражения других органов. Поэтому при необходимости детский оториноларинголог может направить его на осмотр к узким специалистам ( нефролог, кардиолог, офтальмолог и т.д. ) .
Хронический тонзиллит подразумевает медикаментозное лечение: полоскания горла, антибактериальные, противовоспалительные препараты и физиопроцедуры.
Если консервативное лечение оказывается неэффективным, ребенку показана тонзиллэктомия (хирургическое удаление миндалин).
Хронический тонзиллит это очаговая инфекция, которую необходимо вывести из организма как можно быстрее, для сохранения здоровья ребёнка.
Преимущества диагностики и лечения хронического тонзиллита в Медицинском центре "Парацельс"
Наш медицинский центр располагает широким арсеналом методов для лечения тонзиллита, от промывания лакун миндалин до методов аппаратной физиотерапии.
Нашими детскими оториноларингологами при тонзиллите применяются следующие диагностические и лечебные процедуры:
- Эндоскопическое исследования ЛОР-органов;
- Взятие мазков из глотки
- Промывание лакун миндалин;
- Прижигание гранул задней стенки глотки;
- Пункция и вскрытие паратонзиллярного абсцесса;
- Смазывание миндалин задней стенки глотки;
- Лечение небных миндалин (ТОНЗИЛОР)
- Прижигание задней стенки глотки (фонофорез ТОНЗИЛОР)
Оснащение наших клиник позволяет проводить все виды диагностики и применять все методы лечения, существующие в международной практике. Здоровье ЛОР-органов с первых лет и на долгие годы – задача, с которой успешно справляются наши детские оториноларингологи.
В нашей клинике работают высококвалифицированные специалисты с большим опытом работы.
Записаться на приём к врачу можно каждый день, без выходных с 7.00 до 20.00, выбрав удобный для Вас способ:
Записаться к врачу по телефону:
Оставить заявку (мы перезвоним в ближайшее время)
Самостоятельно через Личный кабинет
С заботой о Вашем здоровье, Медицинский центр “Парацельс”
Полный текст:
1. Коренберг Э.И. Проблемы биомедицины на рубеже XXI века. Москва; 2000: 116 - 120.
2. Коренберг Э.И. Изучение и профилактика микст-инфекций, передающихся иксодовыми клещами. Вестник РАМН. 2001; (11): 41 - 45.
3. Коренберг Э.И., Помелова В.Г., Осин Н.С. Природно-очаговые инфекции, передающиеся иксодовыми клещами. А.Л. Гинцбурга, В.Н. Злобина, ред. Москва; 2013: 463.
4. Рудаков Н.В., Ястребов В.К. Эволюция учения о природной очаговости болезней человека. Эпидемиология и инфекционные болезни. Актуальные вопросы. 2014; 4: 4 -38.
5. Коренберг Э.И. Пути соверошенствования эпидемиологического надзора за природно-очаговыми инфекциями. Эпидемиология и Вакцинопрофилактика. 2016; 6 (91): 18 -29.
6. Козлова Н.П. Совершенствование методов диагностики и лечения при ассоциированном анаплазмозе КРС. Автореф. дис.. канд. мед. наук. Омск; 2007.
7. Кормиленко И.В. Экологические и эпидемиологические аспекты Крымской геморрагической лихорадки, лихорадки Ку и иксодовых клещевых боррелиозов в Ростовской области: дис.. канд. биол. наук. Москва; 2010.
8. Чумаков М.Э., Шкарин В.В., Ковалишена О.В. Лептоспирозная инфекция в Республике Мордовия. Актуальные аспекты инфекционной патологии и деятельности гассанэпидслужбы. Материалы международной научно-практической конференции. Омск; 2003: 394 -401.
9. Чумаков М.Э, Арзяева А.Н. Эпидемиолого-эпизоотологический надзор за природными очагами туляремии в Республике Мордовия. Инфекции в 21 веке: проблемы эпидемиологии и профилактики. Н. Новгород; 2004:145 - 153.
10. Гришечкин А.Е., Морозова О.В., Щучинова Л.Д., Исаева Е.И., Логинова Н.В., Злобин В.И. Анализ инфекций, переносимых клещами, в Республике Алтай. Эпидемиология и Вакцинопрофилактика. 2011; 2 (57): 12 -17.
11. Миноранская Н.С., Миноранская Е.Н. Клинико-эпидемиологическая характеристика микст-инфекции клещевого боррелиоза и клещевого энцефалита в Красноярском крае. Казанский медицинский журнал. 2013; (2): 211 - 214.
12. Усков А.Н., Лобзин Ю.В., Бургасова О.А. Клещевой энцефалит, эрлихиоз, бабезиоз и другие актуальные клещевые инфекции в России. Инфекционные болезни. 2010; 2: 83 - 88.
13. Скрипченко Н.В., Балинова А.А. Современные представления о патогенезе иксодовых клещевых боррелиозов. Журнал инфектологии. 2012; 2: 5 - 14.
14. Wilke M., Eiffert H., Christen H.-J., Hanefeld F. Primarily chronic and cerebrovascular course of Lyme neuroborreliosis: case reports and literature review. Arch. Dis. Child. 2000; (83); 1: 67 -71.
15. Рудакова С.А. Инфекции, передаваемые клещами в Сибирском регионе. Новосибирск: Изд-во Сибирского отделения РАН. 2011; Выпуск 30: 214 - 228.
16. Коренберг Э.И., Литвин В.Ю. Природная очаговость болезней: к 70-летию теории. Эпидемиология и Вакцинопрофилактика. 2010;1 (50): 5- 9.
17. Cimperman J., Maraspin V., Lotric-Furlan S., Ruziс-Sabljiс E., Avsic-Zupanc T., Strle F. Double infection with tick borne encephalitis virus and Borrelia burgdorferi sensu lato. Wien. Klin. Wochenschr. 2002; 114 (13 - 14): 620 - 622.
18. Васильева И.С. Новые болезни, передаваемые иксодовыми клещами (Ixodidae). Эрлихиозы и анаплазмозы человека. РЭТ-инфо. 2006; 3: 16 - 18.
19. Korenberg E.I., Gorelova N.B., Postic D., Kovalevskii I.V., Baranton G., Vorob>eva N.N. The reservoir hosts and vectors of borrelia--the causative organisms of ixodid tick-borne borrelioses in Russia. Журнал микробиологии. 1997; 6: 36- 38.
20. Красиков А.П., Рудаков Н.В. Риккетсиозы, коксиеллезы и анаплазмозы человека и животных. Омск. Издательский Центр Омский научный вестник; 2013: 230.
21. Kristoferitsch W., Stanek G., Kunz С. Doppelinfektion mit Fruhsommermeningoenzephalitis-(FSME-)Virus und B. Burgdorferi. Deutsch. Med. Wochenschr. 1986; 11: 861 - 864.
22. Коренберг Э.И., Кузнецова Р.И., Ковалевский Ю.В. и др. Выявление и первые результаты изучения болезни Лайма на северо-западе СССР. Мед. паразитология и паразитарные болезни. 1988; 1: 45 - 48.
23. Тарбеев А.К. Клинико-эпидемиологические особенности Лайм-боррелиоза в Иркутской области и оценка эффективности его лабораторной диагностики. Автореф. дисс.. канд. мед. наук. Иркутск; 2004.
24. Козлова И.В. Научное обоснование и пути совершенствования экстренной диагностики и профилактики трансмиссивных клещевых инфекций в условиях сочетанности природных очагов. Автореф. дисс. д-ра мед. наук. Иркутск; 2008.
25. Амосов М.П., Лесняк О.М., Образцова Р.Г., Мельников В.Г., Бардина Т.Г., Андреева Е.А. Клиническая характеристика клещевого энцефалита при его сочетании с Лайм-боррелиозом. Вопр. вирусологии.2000; 3: 25 - 28.
26. Степанова К.Б. Клинико-иммунологические особенности иксодового клещевого боррелиоза на фоне хронического описторхоза. Эпидемиология и инфекционные болезни. 2004; 6: 24 - 27.
27. Утенкова Е.О. Природноочаговые инфекции в Волго-Вятском районе: дис.. д-ра мед.наук. Киров; 2009.
28. Щучинова Л.Д. Эпидемиологический надзор и контроль инфекций, передающихся клещами, в Республике Алтай. Дис.. канд. мед. наук. Омск; 2009.
29. Матущенко Е.В. Совершенствование лабораторной верификации клещевых инфекций в условиях сочетанности природных очагов. Автореф. дис.. канд. мед. наук. Омск; 2006.
30. Knapp K.L., Rice N.A. Human coinfection with Borrelia burgdorferi and Babesia microti in the United States. Journal of Parasitology ResearchVolume. 2015; Article ID 587131.
31. Семенов В.А., Мальцев Б.Б. Случай одновременного заболевания клещевым энцефалитом и бабезиозом. Медицина в Кузбассе. 2004; 3: 43 - 44.
32. Алешковская Е.С., Благов Н.А., Базунова В.А. Клинико-эпидемиологические аспекты смешанных клещевых инфекций в эндемичном регионе. Журнал инфектологии. 2013; 5;1: 44 - 47.
33. Аитов К.А. Характеристика микст форм природно-очаговых трансмиссивных инфекций, передаваемых клещами в Прибайкалье. Журнал инфектологии. 2010; 2;4: 42 - 43.
34. Пиневич, О.С., Попонникова Т.В., Вахрамеева Т.Н. Бедарева Т.Ю., Галиева Г.Ю., Берданова В.С. Клинические и этиологические аспекты клещевых микст-инфекций у детей. Мать и дитя в Кузбассе.2008; 3 (34): 30 - 35.
35. Попонникова Т.В., Субботин А.В. Особенности клинических проявлений острого периода сочетанной инфекции клещевого энцефалита и иксодового клещевого боррелиоза у детей. Медицинская паразитология и паразитарные болезни. 2005; 1: 7 - 9.
36. Леонова Г.Н., Якушева С.С., Иванис В.А., Дададова О.Б., Крылова Н.В., Симакова А.И., Маистровская О.С. Диагностика клещевых микст-инфекций в Приморском крае. Эпидемиология и инфекционные болезни. 2005; 4: 25 - 31.
37. Федчук Т.Н. Клинико-неврологическая характеристика неочаговых форм клещевого энцефалита и микст-инфекции в Удмуртской республике. Дис.. канд. мед. наук. Пермь; 2008.
38. Лобзин Ю.В., Усков А.Н., Козлов С.С. Лайм-боррелиоз (иксодовые клещевые боррелиозы). Санкт-Петербург; 2000.
39. Лесняк О.М., Амосов М.Л. Лайм-боррелиоз. Екатеринбург: Изд-во Уральской гос. мед. академии; 1999.
40. Гордеец А.В., Черникова А.А. Клинико-иммунологические аспекты клещевого энцефалита, искодового клещевого боррелиоза. Детские инфекции. 2009; 4: 15 - 18.
41. Лайковская Е.Э., Лесняк О.М., Волкова Л.И. Микст-инфекция Лайм-боррелиоза и клещевого энцефалита. Проблемы клещевых боррелиозов. Сб. науч. трудов. Э.И. Коренберг, ред. Москва;1993: 93 - 99.
42. Persing D.H., Conrad PA. Babesiosis: new insights from phylogenetic analysis. Infect. Agents Dis. 1995; 4 (4): 182 - 195.
43. Алешковская Е.С., Благов Н.А., Дружинина Т.А., Шалепо Е.В. Клещевые микстинфекции (иксодовый клещевой боррелиоз и гранулоцитарный эрлихиоз человека) в Ярославской области. Эпидемиология и инфекционные болезни. 2008; 2: 6 - 8.
44. Ястребов В.К., Хазова Т.Г. Оптимизация системы эпидемиологического надзора и профилактики клещевого вирусного энцефалита. Эпидемиология и Вакцинопрофилактика. 2012; 1 (62): 19 - 25.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Читайте также:


