Факторы влияющие на снижение инфицирующей дозы
Инфекция (инфекционный процесс) (лат. infectio — заражение) — совокупность физиологических и патологических, адаптационных и репарационных процессов, которые возникают и развиваются в макроорганизме в процессе взаимодействия с патогенными микроорганизмами.
Инфекционный процесс — один из самых сложных биологических процессов в природе, включающий сложные процессы взаимодействия между патогенными микроорганизмами и продуктами их жизнедеятельности (токсинами, ферментами) с одной стороны, и клетками, тканями и органами организма хозяина с другой.
Инфекционный процесс протекает в определенных условиях внешней и социальной среды, проявляется на субмолекулярном, субклеточном, клеточном, тканевом, органном и организменном уровнях.
Возникновение, течение и исход инфекционного процесса определяются взаимодействием возбудителя и макроорганизма в определенных условиях окружающей среды.
инфицирующая доза — минимальное количество микробных клеток, способных вызвать инфекционный процесс. Если доза возбудителя мала, микроорганизм подвергается эффективной элиминации. Инфицирующая доза определяется вирулентностью возбудителя и резистентностью макроорганизма. Самая маленькая инфицирующая доза у иерсиний чумы: 6- 10 микробных клеток способны вызвать заболевание. У других микроорганизмов инфицирующая доза исчисляется десятками (шигеллы дизентерии) и даже сотнями-тысячами микробных клеток (эшерихии).
входные ворота инфекции — орган или ткань, через которую возбудитель проникает в макроорганизм и первично размножается. Входные ворота в большинстве случаев специфичны для возбудителя: для одних возбудителей это кровь (риккетсии, плазмодии, лейшмании), для других — слизистые оболочки дыхательных путей (вирусы гриппа, кори, краснухи), ЖКТ (шигеллы, сальмонеллы) или половых органов (нейссерии гонореи, бледная трепонема). Заражение через неповрежденную кожу и слизистые встречается редко (лептоспироз, туляремия).
При некоторых инфекционных заболеваниях возбудитель может проникать в организм различными путями, что определяет полиморфизм клинической картины заболевания:
стафилококковая инфекция: локальные гнойно-воспалительные заболевания кожи и подкожной клетчатки, системные заболевания (риниты, фарингиты, трахеиты, бронхиты, пневмонии, остеомиелиты, уретриты, циститы), генерализованные заболевания (сепсис);
гонококковая инфекция: половые органы, конъюнктива глаза, слизистая рта, прямая кишка;
дифтерия: зева и раневая;
чума: кожно-бубонная, легочная, кишечная, септическая формы;
туляремия: бубонная, глазо-бубонная, ангинозно-бубонная, кишечная, легочная, септическая формы;
сибирская язва: кожная, легочная, кишечная, септическая;
туберкулез: заболевание развивается в восприимчивом организме вне зависимости от пути проникновения, могут поражаться почти все органы (кроме волос и ногтей).
Попадание возбудителя в неестественный биотоп ведет к его гибели: возбудители респираторных инфекций погибают в ЖКТ под действием соляной кислоты и пищеварительных ферментов.
патогенность — потенциальная способность микроорганизма вызывать инфекционный процесс у хозяина,
вирулентность — степень патогенности.
Факторы, влияющие на восприимчивость макроорганизма:
состояние конститутивных (естественный иммунитет) и индуцибельных (приобретенный иммунитет) иммунных механизмов.
Конститутивные механизмы неспецифичны, являются природными механизмами резистентности, обеспечивают защиту на ранних этапах развития инфекции. К конститутивным механизмам относят анатомические барьеры, выделительные реакции, гистогематические барьеры, тканевую ареактивность, воспаление, микробный антагонизм, фагоцитоз, естественные киллерные клетки, систему комлемента и др..
Индуцибельные защитные механизмы высокоспецифичны, развиваются как реакция на инфекционное заболевание, играют большую роль на поздних стадиях инфекции. К индуцибельным механизмам защиты относится гуморальный и клеточный иммунный ответ организма.
Инфекционный процесс начинается, когда нарушается баланс между патогенностью бактерий и резистентностью хозяина. Патогенность микроорганизма функция не только, а иногда не столько самого микроорганизма, но и организма хозяина, состояние иммунной системы которого обуславливает тот или иной тип отношений между паразитом и хозяином, в результате чего появляется определенный тип инфекционного процесса.
При воздействии патогенного возбудителя на организм в ответных реакциях участвуют все физиологические системы макроорганизма, действие которых направлено на инактивацию, разрушение и элиминацию возбудителя и его токсинов, а также на компенсацию нарушенных функций.
состояние нервной и эндокринной системы и нейрогуморальная регуляция.
Регуляторами нейроэндокринного воздействия на иммунную систему являются адренокортикотропный гормон, соматотропный гормон, кортикостероиды, катехоламины, энкефалины, эндорфины, серотонин, ацетилхолин, другие гормоны и нейромедиаторы. На иммунокомпетентных клетках имеются рецепторы для нейроэндокринных медиаторов. Нарушения нейроэндокринной регуляции способствуют развитию инфекционных заболеваний и осложнений.
образ жизни: положительные эмоции, рациональное питание, оптимальная двигательная активность, режим труда и отдыха, закаливание, занятия физкультурой, нормальная масса тела, отказ от вредных привычек (табакокурения, злоупотребления алкоголем, употребления наркотиков), упорядоченные половые отношения, соблюдение правил личной и общественной гигиены.
Согласно определению ВОЗ, здоровье — это не только отсутствие болезней или дефектов, а полное физическое, психическое и социальное благополучие. Состояние здоровья на 50 % зависит от образа жизни человека, на 20 % — от наследственности, на 20% — от влияния факторов окружающей среды и лишь на 10 % от качества медицинского обслуживания.
перенесенные заболевания и другие факторы, подавляющие защитные функции организма.
Таким образом, состояние макроорганизма и его свойства определяют не только возможность возникновения и характер течения инфекционного процесса, но и вероятность проявления последнего в форме инфекционного заболевания. Защитные механизмы макроорганизма могут быть настолько эффективны, что полностью предотвращают инфекцию и даже в случае инфекции могут остановить процесс до того, как разовьется заболевание.
Мы посчитали, как вирус распространяется по странам; теперь нам надо понять, как он распространяется в организме человека.
Храм был небольшой, с маленьким святилищем. Располагался он в нескольких кварталах от медицинского колледжа Калькутты. Внутри находилась статуэтка богини, сидящей на осле и держащей в руках кувшин с охлаждающей жидкостью. Так Шиталу изображают вот уже тысячу лет.

Сейчас начальный этап пандемии, и мы измеряем распространение вируса среди людей. Но когда темпы пандемии возрастут, нам также придется изучать вирус внутри человеческого организма.
Такова была картина распространения вируса среди населения — этакий вид с высоты птичьего полета. Это можно рассматривать как двухпозиционное явление. Будучи врачом и исследователем (в вузе я изучал вирусную иммунологию), я хотел знать, что происходит внутри точек, сколько вирусов в той или иной красной точке. Насколько быстро они воспроизводятся в этой точке? Каково соотношение между временем контакта и шансом заразиться? Как долго красная точка остается красной, то есть как со временем меняется заразность человека? И какова тяжесть заболевания в каждом из случаев?
Еще более показательной, чем пик вирусной нагрузки, была так называемая точка остановки. Это такой уровень, на котором количество вирусов у инфицированного после начального роста стабилизируется. Эта точка представляет собой динамичное равновесие между вирусом и его носителем. Люди с высокой точкой остановки обычно быстрее заболевают СПИДом; люди с низкой точной остановки довольно часто заболевают намного медленнее. Вирусная нагрузка, являясь непрерывным процессом, а не бинарным значением, помогает спрогнозировать характер, ход и контагиозность заболевания. Конечно, у каждого вируса есть свои особенности, а у ВИЧ имеются такие черты, которые делают вирусную нагрузку особенно показательной: этот вирус вызывает хроническую инфекцию, и нацелен он конкретно на клетки иммунной системы. Но аналогичные закономерности наблюдаются и у других вирусов.
Весьма оригинальное исследование взаимосвязи между интенсивностью контакта с вирусным источником и подверженностью человеческого организма инфекции провел коллектив из Исследовательского онкологического центра им. Фреда Хатчинсона и Вашингтонского университета в Сиэтле. В 2018 году эпидемиолог и статистик по имени Брайан Мейер (Bryan Mayer) присоединился к группе врачей и биологов, исследовавших проблему, решить которую, как тогда казалось, было почти невозможно.

Не связана ли тяжесть болезни этих довольно молодых людей, которые, по идее, должны были перенести Сovid-19 в мягкой форме — как простуду — с количеством вируса, которое они получили в самом начале? В США как минимум два врача, находившиеся на передовой борьбы с пандемией, очень тяжело заболели. Одному из них, из штата Вашингтон, чуть больше сорока.
Проводившиеся на других вирусах исследования наводят на размышления. В моделях гриппа у животных можно точно количественно определить интенсивность заражения. Мыши, которым давали большие дозы определенных вирусов гриппа, болели тяжелее других. Однако в разных штаммах гриппа зависимость тяжести заболевания от дозы очень сильно различается. В связи с этим интересно одно исследование. При высокой начальной вирусной нагрузке синцитиального респираторного вируса, который способен вызывать пневмонию, особенно у грудных детей, тяжесть болезни была не очень велика. Хотя другое исследование говорит, что эта связь наглядно проявляется у детей ясельного возраста, которые в наибольшей степени подвержены этому заболеванию.
Те немногочисленные данные о коронавирусе, которые мы имеем, свидетельствуют, что эта болезнь развивается по тем же закономерностям, что и грипп. В 2004 году коллектив ученых из Гонконга исследовал коронавирус, вызывающий атипичную пневмонию и являющийся родственным коронавирусу, вызывающему Сovid-19. Они выяснили, что при более высокой первоначальной вирусной нагрузке (ее измеряли по содержанию вируса в носоглотке), респираторное заболевание протекает в более тяжелой форме. Почти все больные SARS, поступившие с низкой или с необнаруживаемой концентрацией вируса в носоглотке, через два месяца все еще были живы. Среди тех, у кого его содержание было самым высоким, смертность составила 20-40%. Такая закономерность сохраняется вне зависимости от возраста пациента, других болезней и так далее.

Поскольку вирус продолжает вихрем нестись по планете, мы будем находить все новые ответы на вопросы о том, как интенсивность заражения и последующая концентрация вируса соотносятся с течением болезни Сovid-19. Взгляд с высоты птичьего полета мы дополним взглядом изнутри. Как эти знания изменят наши методы лечения больных, работу больниц и поведение населения?
Начнем со связи между интенсивностью заражения и инфекцией. Задумайтесь на минуту о том, как мы наблюдаем за теми, кто работает с радиацией. При помощи дозиметрии мы измеряем общую дозу облучения и устанавливаем пороговые значения. Нам уже известно, насколько важно врачам и медсестрам ограничить контакт с коронавирусом с помощью средств защиты (маски, перчатки, халаты). Но что касается медработников, находящихся на переднем крае борьбы с пандемией Сovid-19, особенно там, где средств защиты не хватает, то мы можем следить за общей дозой вируса, которую они получают, создать методы вирусной дозиметрии, чтобы человек избегал многократных контактов с чрезвычайно заразными пациентами.
Если мы установим связь между дозой и тяжестью болезни, это в свою очередь повлияет на методы ухода за пациентами. Если мы научимся выявлять инфицированных, получивших большую дозу вируса из-за совместного проживания или общения с несколькими заболевшими членами семьи (вспомните семью Фуско из Нью-Джерси, в которой умерли четыре человека) или из-за общения медработника с несколькими тяжелобольными пациентами, сделав это до появления у них симптомов, мы сможем спрогнозировать тяжесть болезни и лечить таких людей в приоритетном порядке в случае дефицита медицинских средств и лекарств, чтобы они быстрее выздоравливали и не болели тяжело.
И наконец, уход за больными Сovid-19 может измениться, если мы начнем следить за количеством вируса. Эти параметры можно измерять весьма недорогими и доступными лабораторными методами. Представьте себе процесс в два этапа. Сначала мы выявляем инфицированного, а затем определяем концентрацию вируса (вирусную нагрузку) в секреции носовой полости и органов дыхания, особенно у пациентов, которые могут потребовать самого интенсивного лечения. Соотнося данные по концентрации и меры лечения с результатами, мы в итоге выработаем разные стратегии лечения, ухода или изоляции.
Такой количественный подход применим и в клинических исследованиях. Клинические испытания препаратов обычно более информативны, когда их проводят на пациентах, которые еще не в критическом состоянии. Когда испытуемый дойдет до этого, может оказаться, что лечить его слишком поздно. А если у такого пациента следить не только за симптомами, но и за вирусной нагрузкой, эффективность того или иного препарата в ходе разных испытаний будет проще сравнивать и сравнения эти будут точнее.
Нам также понадобится выявлять выздоровевших людей, у которых выработался иммунитет к sars-CoV-2 и которые больше не заразны. Такие люди должны отвечать двум требованиям: у них должна гарантированно отсутствовать контагиозность и у них в крови должны присутствовать признаки устойчивого иммунитета (это легко определить анализом на антитела). Как обнаружили китайцы, боровшиеся в XII веке с оспой, такие люди, особенно из числа медработников, особенно ценны для медицины: если у них не исчезнет иммунитет, они могут ухаживать за самыми тяжелыми больными без страха заразиться.
Но пандемия идет рука об руку с паникой. Мир охватывает хаос. Итальянские врачи дают капельницы на самодельных стойках пациентам, лежащих на импровизированных кроватях в наскоро организованных палатах. В таких обстоятельствах измерение вирусной нагрузки кажется невероятным и невозможным. Но кризис требует от нас стратификации и оценки риска, а также самого эффективного применения немногочисленных и быстро исчезающих ресурсов.
В то утро, когда я посетил в Калькутте храм Шиталы, эта богиня былых эпидемий, уничтожавших целые народы, оказывала персональные услуги матери, принесшей ребенка, у которого уже неделю не спадала температура. Чтобы одержать верх в борьбе с Сovid-19, очень важно отследить путь движения вируса среди населения. Но не менее важно изучить развитие заболевания у каждого отдельного пациента. Единица становится множеством. Считать надо и то и другое, ибо и то и другое имеет значение.
Материалы ИноСМИ содержат оценки исключительно зарубежных СМИ и не отражают позицию редакции ИноСМИ.
Инфекционный процесс. Условия развития.
Для возникновения инфекционного процесса необходимы три основных условия:
- патогенный возбудитель (инфицирующая доза)
- проникновение его во внутреннюю среду организма
- восприимчивый организм и входные ворота: слизистая МПС (ЗППП, гонорея), дых пути (корь, краснуха, грипп), ЖКТ (дизентерия, бр тиф, холера), кожа и слизистые (сиб язва, чума, бруцеллез), кровь (ВИЧ, гепатит В и С).
Активность и интенсивность этого процесса связаны с эффективностью действия всех условий и зависят от дозы и вирулентности возбудителя, от состояния естественных защитных барьеров макроорганизма и места проникновения возбудителя (входных ворот инфекции).
Любое инфекционное заболевание характеризуется своей динамикой, последовательной сменой разных периодов:
- инкубационного
- продромального
- клинического (разгар болезни)
- периода реконвалесценции (выздоровления).
Каждому периоду свойственны свои особенности: продолжительность, локализация возбудителя в организме, его распространение и выделение в окружающую среду.
Инфекционный процесс. Периоды.
Инкубационный период начинается с момента проникновения микроба до появления первых симптомов заболевания. Продолжительность его может составлять от нескольких часов до нескольких месяцев и даже лет, при отдельных инфекциях, и зависит от быстроты размножения микроба, особенностей токсических продуктов его жизнедеятельности, реактивности организма.
Продромальный период это период появления первых симптомов заболевания до развития основных клинических признаков.
Клинические проявления инфекционных заболеваний разнообразны. Основными признаками являются лихорадка, лейкоцитоз, нарушения центральной и вегетативной нервной системы, функции органов дыхания, пищеварения и др.
В период реконвалесценции постепенно восстанавливаются физиологические функции организма. Этот период, как и все остальные стадии инфекционного процесса, при различных заболеваниях имеет различную продолжительность. Исходы инфекционного заболевания могут быть от выздоровления, до бактерионосительства, смерти.
Возникновение, развитие, течение и исход инфекционной болезни в значительной степени зависят от состояния макроорганизма, в который проникли патогенные микробы. Основным фактором является восприимчивость к тому или иному микроорганизму, которая может быть видовой, присущей данному виду животного или человеку, и индивидуальной, зависящей от общего состояния организма каждого человека или животного.
Видовая восприимчивость обусловлена генетически.
Инфекционный процесс. Виды заболеваний
- Зоонозы – заболевания, которыми болеют только животные.
- Антропонозы – болезни, к возбудителям которых восприимчив только человек, называются (гонорея, сифилис, брюшной тиф, дизентерия).
- Антропозоонозы – болезни, которыми болеют животные, но может поражаться и человек, называются (чума, туляремия, бруцеллез, сибирская язва).
Индивидуальная восприимчивость человека зависит от многих факторов, но прежде всего — от особенностей возбудителя, обладающего выраженными инвазивными и агрессивными свойствами. К таким микробам, например, относится возбудитель чумы, к которому восприимчивы все люди.
Возникновение инфекционной болезни зависит также от инфицирующей дозы микроба; при малом ее количестве болезнь может не развиться.
Восприимчивость зависит от места заражения — так называемых входных ворот, т.е. от той ткани или органа, через которые проникает патогенный микроб. Большинству микробов для развития заболевания необходимо проникновение через определенные входные ворота.
Так, например, при дизентерии, брюшном тифе и других кишечных инфекциях входными воротами является пищеварительный тракт, при вирусном гриппе — верхние дыхательные пути и т. д. Однако есть такие микроорганизмы, которые способны проникать через любые входные ворота, например, возбудитель чумы, стафилококк.
Развитие инфекционного заболевания зависит от общей физиологической реактивности макроорганизма и факторов, угнетающих его резистентность (чрезмерное физическое и психическое напряжение, недостаточное питание, охлаждение, травма, возраст и т.д.). Так, нарушение питания, витаминная и белковая недостаточность снижают защитные силы организма, нарушают процесс аптителообразования.
Инфекционные болезни делятся на детские и развивающиеся в любом возрасте. Дети до 6 мес невосприимчивы к ряду инфекционных болезней (корь, дифтерия и др.). что связано с наличием у них иммунитета от матери. В то же время дети раннего возраста легко заболевают стафилококковыми, кишечными инфекциями, вызываемыми энтеропатогенными кишечными палочками.
Инфекционный процесс. Факторы, влияющие на развитие.
1. Возраст – дети до 6 месяцев невосприимчивы к кори, дифтерии, скарлатине, поскольку имеют пассивный иммунитет (плацентарный). В более старшем возрасте у детей возникают инфекционные заболевания, поскольку угасает трансплацентарный иммунитет и учитываются анатомо-физиологические особенности детского возраста (низкая кислотность желудочного сока, короткие и широкие носовые ходы, высокая проницаемость кожи и слизистых). Люди пожилого возраста более восприимчивы к инфекциям, поскольку идет возрастное угасание иммунной системы и снижение барьерных функций органов и систем.
2. Физиологическое состояние – во время беременности и менструации увеличивается восприимчивость к инфекциям. Такие болезни, как сахарный диабет, Адиссонова болезнь (недостаточность функции коры надпочечников), нарушение функции щитовидной железы также ведут к увеличению восприимчивости к инфекциям
3. Питание – при неполноценном питании увеличивается заболеваемость и смертность от туберкулеза и дизентерии. Особенно белковое голодание способствует снижению потенциала иммунной системы. При недостататке витамина А бактериальная и вирусная инфекции протекают тяжелее и происходит более частое инфицирование. При недостатке витамина В снижается устойчивость к стафилококкам и стрептококкам. При недостатке витамина D снижается фагоцитарная активность лейкоцитов. При недостатке Fe снижается функция лейкоцитов, фагоцитарная способность, лимфопения.
Инфекционный процесс. Факторы защиты организма.
- Естественные физиологические барьеры (механические) – кожа, слизистые, экскреторные и секреторные функции органов, мерцательный эпителий, рефлекторные механизмы (рвота, кашель);
- Клеточные факторы – фагоцитоз;
- Гуморальные факторы.
Кожа – прочное механическое препятствие для бактерий. Бактерицидная активность проявляется за счет секретов сальных, потовых желез (молочная кислота, жирные кислоты). Резистентность кожи зависит от возраста и общего состояния организма.
Слизистые – за счет мерцательного эпителия происходит выведение микроорганизмов.
Слизистые имеют защитные факторы:
- секреторная жидкость содержит лизоцим — естественный антисептик,
- секреторные IgA,
- пищеварительные ферменты,
- соляная кислота.
Выведение микроорганизмов происходит при экскреции с мочой, слюной, слезами, мокротой.
Гуморальные факторы
1. Нормальное содержание антител в сыворотке крови, тканевой жидкости;
2. Лизоцим (в крови, слюне, слезе, бронх секрете) – фермент ацетил-мурамидаза (мишень – муреин – пептидогликан кл стенки);
3. Комплемент – термолабильная ферментная система сыворотки крови.
Функции комплемента:
- активация клеток
- цитолиз клеток-мишеней
- опсонизация (изменение свойств объекта фагоцитоза – облегчение фагоцитоза).
- классический путь (комплекс АГ-АТ)
- альтернативный
4. Лейкины – белки, освобождаются при разрушении лейкоцитов (бактерицидное действие на Гр+ микроорганизмы);
5. Интерфероны – подавляет репродукцию вируса внутри клетки;
6. Лактоферрин – железо связывающий белок (переводит железо в трудноусвояемую для микроорганизмов форму);
7. Ферменты секретов
Нижегородская государственная медицинская академия
Знания о естественном течении хронического гепатита С (ХГС) позволяют выделить среди больных группу риска с быстрым прогрессированием заболевания. Решать вопрос о необходимости противовирусной терапии следует, учитывая предикторы прогрессирования ХГС в цирроз печени и гепатоцеллюлярную карциному (ГЦК). Процесс развития заболевания от момента инфицирования до исхода болезни может занимать несколько десятилетий [10]. Причем, в случае ХГС необходимо отказаться от представления о линейном нарастании фиброза печени: прогрессирование заболевания может ускоряться со временем [17, 24].
Все факторы, влияющие на естественное течение ХГС, можно разделить на 3 группы:
1. Особенности организма хозяина: сюда традиционно относят пол, возраст, расу, наличие ряда сопутствующих заболеваний (в том числе инфицированность ВИЧ и HBV), а также иммунологические особенности (в том числе антигены главного комплекса гистосовместимости – HLA II).
2. Вирусологические факторы: разными авторами рассматривалось значение генотипа вируса, вирусной нагрузки и квазивидов вируса.
3. Влияние окружающей среды: такие факторы как курение, злоупотребление алкоголем, употребление наркотиков, наличие загрязнения среды обитания могут в той или иной мере ускорять развитие цирроза печени и ГЦК.
Учитывая и по возможности корригируя эти факторы, можно отсрочить наступление исходов болезни.
Alter et al указывают на то, что прогрессирование заболевания происходит у меньшего числа больных, чем это принято считать. Большинство же из них умирают от причин, не связанных с HCV-инфекцией, прежде чем у них успевают развиться опасные для жизни осложнения заболевания [1]. Однако, учитывая широкую распространенность HCV-инфекции, даже при относительно низкой частоте развития тяжелой патологии печени она остается актуальной проблемой современной медицины. Поэтому прогрессирование ХГС с формированием цирроза печени остается одной из наиболее частых причин проведения трансплантации печени.
Целью настоящей работы явилась оценка прогностического значения ряда клинических и вирусологических факторов в отношении характера естественного течения ХГС.
Материалы и методы исследования. Для решения поставленных задач в исследование были включены 100 больных, наблюдавшихся в нижегородском гепатологическом центре по поводу ХГС и не получавших противовирусной терапии.
Возрастная и половая структура исследованной группы подробно представлена в табл. 1.
Таблица 1. Распределение больных ХГС по полу и возрасту
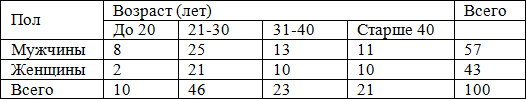
Сроки заболевания варьировали в широких пределах: от 1 года до 27 лет (в среднем 5,56 лет). Больные со стажем заболевания до 5 лет составили 68%, больные с продолжительностью инфекции более 5 лет – 30%. У 2% больных не удалось определить длительность заболевания.
На основании данных парентерального анамнеза определялась исходная доза инфекта. В группу больных с низкой исходной дозой инфекта были отнесены инфицированные при единичных медицинских манипуляциях (инъекции, операции, стоматологические или гинекологические манипуляции), половым путем или трансплацентарно. Группу больных с высокой исходной дозой инфекта составили пациенты, инфицированные при гемотрансфузиях или внутривенном введении наркотических веществ. В группу больных с высокой исходной дозой инфекта вошли 34% больных, в группу с низкой исходной дозой инфекта – 54% больных; у 13% больных определить путь инфицирования не удалось.
Репликативная активность вируса оценивалась по данным ИФА и ПЦР. Высокая репликативная активность (наличие a/HCVcor IgM и/или HCV РНК) установлена у 71% больных, низкая репликативная активность (отсутствие a/HCVcor IgM и HCV РНК) – у 29% больных.
Генотипирование HCV было проведено у 45% больных: у 20% больных был выявлен генотип 1b, у 24% больных – генотип 3а, у 1% больных генотипировать HCV не удалось (генотип не 1а, 1b, 2, 3а, 3b). Данное распределение генотипов вируса в целом характерно для нашего региона.
Для оценки иммунного ответа исследовались методом ИФА антитела к неструктурным белкам вируса: a/HCVns3 и a/HCVns5.
Оценка тяжести заболевания проводилась на основании наличия синдрома малой печеночной недостаточности (МПН), частоты повышения уровня АлАт и наличия структурных изменений печени по данным УЗИ и биопсии печени.
К синдрому МПН относились жалобы астенического характера и указывающие на патологию билиарной системы диспептические явления. Признаками структурных изменений по данным УЗИ служили повышение эхогенности и нарушение эхоструктуры печени. При анализе биоптатов печени в первую очередь оценивались наличие выраженного фиброза и величина индекса гистологической активности (ИГА).
Результаты и обсуждение. При анализе влияния пола больных на характер течения ХГС было выявлено, что МПН у мужчин регистрируется значительно чаще, чем у женщин: 91% и 60% соответственно (p
Список использованных источников:
1. Alter H.J., Seeff L.B. Recovery, persistence, and sequelae in hepatitis C virus infection: a perspective on long-term outcome// Semin Liver Dis. 2000; 20 (1): 17-35.
2. Bochud P.Y., Cai T., Overbeck K., Bochud M., Dufour J.F., Mulhaupt B., Borovicka J et al. Genotype 3 is associated with accelerated fibrosis progression in chronic hepatitis C// J of Hepatology 2009; 51 (4): 655-666.
3. Corrao G., Arico S. Independent and combined action of hepatitis C virus infection and alcohol consumption on the risk of symptomatic liver cirrhosis// Hepatology 1998; 27: 914-919.
4. Di Bisceglie A.M., Goodman Z.D., Ishak K.G., Hoofnagle J.H., Melpolder J.J., Alter H.J. Long-term clinical and histopathological follow-up of chronic posttransfusion hepatitis// Hepatology 1991; 14: 969-974.
5. Di Martino V., Lebray P., Myers R.P., Pannier E., Paradis V., Charlotte F. et al. Progression of liver fibrosis in women infected with hepatitis C: long-term benefit of estrogen exposure// Hepatology 2004; 40: 1426-1433.
6. Fontaine H., Nalpas B., Poulet B. et al. Hepatitis activity index is a key factor in determining the natural history of chronic hepatitis C// Hum Pathol 2001; 32: 904–9.
7. Friedman S.L. Liver fibrosis – from bench to bedside// Journal of Hepatology 2003; 38; S38–S53.
8. Ghany M.G., Kleiner D.E., Alter H. et al. Progression of fibrosis in chronic hepatitis C// Gastroenterology 2003; 124: 97–104.
9. Harris D.R., Gonin R., Alter H.J., Wright E.C., Buskell Z.J., Hollinger F.B. et al. The relationship of acute transfusion-associated hepatitis to the development of cirrhosis in the presence of alcohol abuse// Ann Intern Med 2001; 134: 120-124.
10. Heller T., Rehermann B. Acute hepatitis C: a multifaceted disease// Semin Liver Dis 2005; 25: 7-17.
11. Hopf U., Moller B., Kuther D., Stemerowicz R., Lobeck H., Ludtke-Handjery A. et al. Long-term follow-up of posttransfusion and sporadic chronic hepatitis non-A, non-B and frequency of circulating antibodies to hepatitis C virus (HCV)// J Hepatol 1990; 10: 69-76.
12. Kenny-Walsh E. Clinical outcomes after hepatitis C infection from contaminated anti-D immune globulin. Irish Hepatology Research Group// N Engl J Med 1999; 340: 1228-1233.
13. Koretz R.L., Abbey H., Coleman E., Gitnick G. Non-A, non-B post-transfusion hepatitis. Looking back in the second decade// Ann Intern Med 1993; 119: 110-115.
14. Kumar D., Farrell G., Fung C. et al. Hepatitis C virus genotype 3 is cytopathic to hepatocytes: reversal of hepatic steatosis after sustained therapeutic response// Hepatology 2002; 36(5): 1266-1272.
15. Minola E., Prati D., Suter F., Maggiolo F., Caprioli F., Sonzogni A. et al. Age at infection affects the long-term outcome of transfusion-associated chronic hepatitis C// Blood 2002; 99: 4588-4591.
16. Neumann A.U., Lam N.P., Dahari H. et al. Differences in viral dynamics between genotypes 1 and 2 of hepatitis C virus// J Infect Dis 2000; 182: 28–35.
17. Poynard T., Bedossa P., Opolon P. Natural history of liver fibrosis progression in patients with chronic hepatitis C. The OBSVIRC, METAVIR, CLINIVIR, and DOSVIRC groups// Lancet 1997; 349: 825-832.
18. Ryder S.D., Irving W.L., Jones D.A., Neal K.R., Underwood J.C. Progression of hepatic fibrosis in patients with hepatitis C: a prospective repeat liver biopsy study// Gut 2004; 53: 451-455.
19. Seeff L.B., Hollinger F.B., Alter H.J., Wright E.C., Cain C.M., Buskell Z.J. et al. Long-term mortality and morbidity of transfusion-associated non-A, non-B, and type C hepatitis: A National Heart, Lung, and Blood Institute collaborative study// Hepatology 2001; 33: 455-463.
20. Thabut D., Le Calvez S., Thibault V., Massard J., Munteanu M. et al. Hepatitis C in 6,865 Patients 65 yr or Older: A Severe and Neglected Curable Disease?// Am J Gastroenterology 2006; 101: 1260-1267.
21. Tillmann H.L., Manns M.P., Rudolph K.L. Merging models of hepatitis C virus pathogenesis// Semin Liver Dis 2005; 25: 84-92.
22. Tremolada F., Casarin C., Alberti A., Drago C., Tagger A., Ribero M.L. et al. Long-term follow-up of non-A, non-B (type C) post-transfusion hepatitis// J Hepatol 1992; 16: 273-281.
23. Wiese M., Berr F., Lafrenz M., Porst H., Oesen U. Low frequency of cirrhosis in a hepatitis C (genotype 1b) single-source outbreak in germany: a 20-year multicenter study// Hepatology 2000; 32: 91-96.
24. Yano M., Kumada H., Kage M. et al. The long-term pathological evolution of chronic hepatitis C// Hepatology 1996; 23:1334–40.
Читайте также:


