Что такое послеоперационная инфекция
Пробиотик с уникальным спектром подавления стафилококков, стрептококков, сальмонелл, дизентерийной палочки, в том числе антибиотикоустойчивых. Не влияет на представителей нормальной микрофлоры, безвреден, безопасен.
![]()
Это эффективная альтернатива плазмолифтингу без побочных действий и повреждения кожи. Высокая концентрация натурального фактора роста фибробластов обеспечивает быструю регенерацию тканей.
.jpg)
![]()
Лечит кожные трещины, ожоги, ссадины, опрелости, повышенную сухость и шелушение кожи.
![]()
Гигиеническое средство для профилактики и лечения грибковых и паразитарных заболеваний.
Спрашивайте Споробактерин в аптеках вашего города!
Крем "Фанивир", гель "Фанивир" и "Антискабин" эксклюзивно представлены в аптеках сети Самсон-Фарма
Аптека №48
г. Москва, Ленинградский проспект, д. 69, стр. 1
Добавочный: 247
Ближайшее метро: Сокол, Аэропорт
Аптека №35
г. Москва, ул. Смольная, д. 35
Добавочный: 233
Ближайшее метро: Речной вокзал, Водный стадион
Аптека №63
г. Москва, ул. Ленинградский проспект, д. 4/2
Добавочный: 204
Ближайшее метро: Белорусская
г. Оренбург аптека "Ореол", г. Оренбург, ул. Пролетарская, 273.
Лечение послеоперационных раневых инфекций в хирургической практике
Н.И. Слепых Кафедра хирургии ФППС Оренбургской государственной медицинской академии. Журнал "Анналы травматологии и ортопедии", №2, 2001г.
В эксперименте ни животных-крысах определена целесообразность применения споробактерина в качестве антагониста гноеродной инфекции. В клинике исследовано 82 пациента обоего пола в возрасте 20-77 лет с послеоперационными гнойно-воспалительными раневыми осложнениями. Из них 45 пациентов наряду с традиционным лечением, вместо антибиотиков получали споробактерин, 37 - лечились традиционно. Доказана клиническая эффективность споробактерина. Предложено внести препарат в медико-экономический стандарт лечения послеоперационных инфекций.
Лечение послеоперационных раневых инфекций в хирургической практике.
Проблема лечения послеоперационных гнойно-воспалительных раневых осложнений при хирургической патологии сохраняет свою актуальность, что определяется их увеличением и значительными социальными, моральными и экономическими потерями [3].
По сведениям разных авторов, частота возникновения раневой инфекции зависит от типа хирургических вмешательств и колеблется от 1,5% до 40% [2, 9]. Очевидна также роль индивидуального состояния местной и общей реактивности организма пациента. Неудовлетворительные результаты профилактики и лечения послеоперационных раневых инфекций объясняются в определенной мере и низкой эффективностью существующих способов преодоления негативных влияний факторов риска [2].
Экспериментальными и клиническими исследованиями, посвященными патогенезу раневого процесса, установлены основные закономерности патоморфологических изменений в ранах при неосложненном течении при развитии послеоперационных раневых инфекций, открыта общность биологических законов заживления ран любого генеза и локализации [5].
В настоящее время достигнут определенный прогресс в лечебной тактике и технике оперативных вмешательств при гнойно-воспалительных послеоперационных осложнениях. В практику внедряются новые антисептики, дезинфектанты и антибактериальные химиотерапевтические и иммунотропные лекарственные средства, многокомпонентные мази на гидрофильной и гидрофобной основе, протеолитические ферменты, различные варианты иммобилизации антибактериальных средств в структуру перевязочных, шовных и пластических материалов, методы физического и электрохимического воздействия на рану [1, 2]. Однако результаты лечения гнойных осложнений ран в широкой хирургической практике заметно не улучшаются, что является основанием для дальнейшего поиска новых эффективных лекарственных препаратов и методов лечения. Целью настоящего исследования явилось изучение влияния пробиотика споробактерина на течение раневого процесса.
Механизм влияния препарата споробактерина изучен в серии опытов на животных-крысах: в эксперименте определены проникновение живых бактерий Bac. Subtillis 534 в структуры брюшной стенки и целесообразность применения живого бактериального препарата в качестве антагониста гноеродной инфекции при нагноении послеоперационных ран. Результаты эксперимента позволили осуществить клинический раздел работы. Использован феномен транслокации живого бактериального препарата из просвета желудочно-кишечного тракта к очагу инфекции [6]. В исследование включено 82 пациента обоих полов в возрасте 20-77 лет с раневыми инфекционными осложнениями после экстренных операций по поводу хирургических заболеваний органов брюшной полости (острого аппендицита, холецистита, кишечной непроходимости, прободной язве) и плановых оперативных вмешательств при наличии у больных факторов риска развития воспалительных осложнений послеоперационных ран (сахарного диабета, избыточной подкожной жировой клетчатки, пожилого и старческого возраста, высокой травматичности операций и др.). В состав испытуемой и контрольной групп включены пациенты с локальными гнойными процессами (4) и нагноением раны по всему оперативному доступу, включая кожу, подкожную клетчатку, фасции и мышцы, брюшину, а также с распространением инфекции на органы и полости, что соответствует рекомендациям авторов по методологическому подходу в оценке послеоперационных раневых инфекций [10].
В испытуемой группе лечение споробактерином проведено в комплексе с традиционными мероприятиями: разведением краев раны, ревизией ее и перевязкой с удалением некротизированных тканей физическими, химическими и биологическими методами и местным медикаментозным лечением в соответствии с фазой раневого процесса. Живой бактериальный препарат назначался уже в первой фазе раневого процесса по одной дозе (5 млрд/м тел) три раза в день до еды в течение 7-18 суток. В это время антибиотики не применялись. В контрольной группе лечение пациентов осуществлялось традиционными методами, в том числе с антибиотикотерапией.
Динамика течения раневого процесса в обеих группах оценивалась по клиническим и параклиническим показателям, лабораторным тестам: общему анализу крови, лейкоцитарному индексу интоксикации (ЛИИ) [4], нейтрофильно-лимфоцитарному коэффициенту (НЛК). Этот показатель отражает напряжение функций нейроэндокринной системы и представляет собой отношение процентного числа лейкоцитов нейтрофильного ряда к процентному числу лимфоцитов [11]. Прогнозирование гнойно-воспалительных осложнений при острых хирургических заболеваниях проводили по разработанному нами способу [8]. В течение всего периода лечения выполнялись цитологические исследования отпечатков из ран по М.П.Покровской и М.С.Макарову (1942г.) через 3-4 дня и бактериологические исследования отделяемого из ран через 4-5 дней. Скорость заживления изучалась измерением периметра раны при помощи курвиметра и расчетом ее площади [5]. Достоверность результатов оценивалась определением критерия t, критерия х2 и вероятности ошибки (р).
Анализ состава больных в основной и контрольной группах свидетельствует об отсутствии в них существенных различий по половому признаку и возрасту (таблица 1).
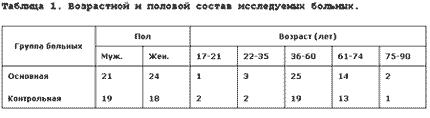
Лица пожилого и старческого возраста в основной группе составили 35,5%, а в контрольной - 37,8%. Операции в сравниваемых группах относятся к "чистым" типам хирургических вмешательств в 17,1% и к "условно чистым" и "загрязненным" (контаминированным) - в 83%.
При развитии инфекции в операционной ране в ранние сроки (3-6 суток) воспалительные изменения в структурах брюшной стенки носят более распространенный выраженный характер, чем при возникновении нагноения на второй неделе послеоперационного периода, за исключением случаев просмотра развивающегося осложнения и запоздалой ревизии раны, которые имели место у 3 пациентов.
Своевременная диагностика раневых осложнений была затруднительна в раннем послеоперационном периоде, когда на фоне основного заболевания и оперативного вмешательства и, нередко, пониженной общей реактивности организма, локальные признаки инфекции слабо манифестировались. В этот период и более поздние сроки после операции достаточно убедительным в прогностическом плане явилось изучение динамики ЛИИ и НЛК. Путем сравнения с прогностическими таблицами ЛИИ и НЛК при различных нозологиях предполагалась вероятность развития неблагоприятных отклонениях в физиологическом течении раневого процесса. Эти показатели применены для оценки течения раневого процесса в испытуемой и контрольной группах. Установлено, что по мере увеличения срока послеоперационного периода показатели ЛИИ и НЛК независимо от основного заболевания и характера оперативного вмешательства приходят к норме. Однако при развитии инфекционного осложнения в ране они вновь увеличиваются или остаются на прежнем уровне. При лечении споробактерином наблюдается более ранняя нормализация показателя ЛИИ и НЛК, чем при традиционном лечении (таблица 2).
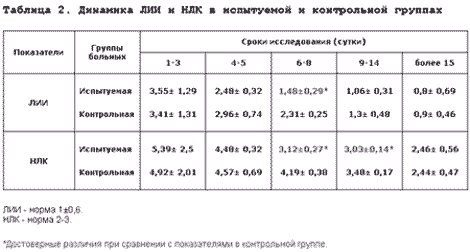
Однако эти различия для ЛИИ статистически достоверны лишь на 6-8 сутки, а для НЛК - на 6-14 сутки. Хотя по оценке общего состояния пациентов, местным изменениям в ране и температуре тела на 4-5 сутки лечения послеоперационных осложнений, часто видимых различий не было. В более поздние сроки показатели ЛИИ и НЛК в обеих группах были на уровне физиологической нормы.
Следует отметить, что местные признаки воспалительного процесса: инфильтрация и гиперемия краев раны, характер раневого отделяемого и другие нередко оцениваются неверно, т.к. "клинические признаки течения раневого процесса всегда носят субъективный характер и являются поздними симптомами изменений в ране" [7]. Наиболее информативным в оценке динамики раневого процесса явилось изучение цитологических отпечатков из ран, что согласуется с исследованиями других авторов [5, 7]. В первые трое суток после разведения краев, ревизии, удаления некротизированных тканей и дренирования раны в исследуемых (в испытуемой и контрольной) группах цитологическая картина характеризуется деструкцией нейтрофилов, наличием детрита, отсутствием фагоцитоза. На 4-6 сутки лечения дегенеративно-воспалительный тип цитограммы переходил в воспалительный. В поле зрения микроскопа регистрируются нейтрофилы от 73% до 94% в начале в состоянии дегенерации и деструкции, а затем с сохранением структуры и появлением полибластов, лимфоцитов и макрофагов. Отмечается нарастание признаков фагоцитоза: от незавершенного к выраженной фагоцитарной активности нейтрофильных лейкоцитов. Процессы развития воспаления в ране, ее очищение, как правило, осуществляются неравномерно. При лечении споробактерином смена типов цитограмм наблюдалась в более ранние сроки - положительное влияние препарата регистрируется уже в первой фазе раневого процесса. Более продолжительный период по времени от 6 до 14 суток характеризуется воспалительно-регенераторным и в большей степени регенераторным типом цитограмм, когда наряду с еще сохраняющейся деструкцией лейкоцитов наблюдается активный фагоцитоз (р < 0,05), уменьшение количества нейтрофилов до 51±4,36; р < 0,05) и увеличение их сохранности. Отмечается значительное увеличение полибластов, макрофагов, лимфоцитов и др. клеток, что свидетельствует об активном регенераторном процессе в ране. В испытуемой группе при успешном некролизе, переход фазы воспаления в регенераторную протекал более активно - на 2-3 дня раньше (р < 0,05), чем при традиционном лечении, в более быстрые сроки появлялась краевая эпителизация. Кроме этого, наряду с общими местными клиническими проявлениями воспаления, оценка цитограмм использовалась для решения вопроса об оперативном лечении раны.
Бактериологические исследования отделяемого из ран, проводимые одновременно с цитологическим изучением мазков-отпечатков, позволяли установить, что чаще всего причиной послеоперационных нагноений были золотистый (32,9%) и эпидермальный (29,9%) стафилококки, грамотрицательная микрокультура - кишечная палочка выявлена в 12,4%, протей - в 7,3%, клебсиелла - в 5,1%, синегнойная палочка - у 3,9% пациентов. Другие виды возбудителей наблюдались гораздо реже. Причем, при первичных исследованиях гноя, взятого из раны при ее вскрытии, в основном выявлялась монокультура возбудителя. В процессе лечения в обеих группах наблюдается смена спектра микрофлоры или снижение высеваемости стафилококка и редко исчезновение микробов при удовлетворительном течении раневого процесса, или появление ассоциаций микробов при неблагоприятном заживлении раны. Кроме этого, в испытуемой группе в 21% (р < 0,01) наблюдений на 6-7, а иногда на 12 сутки в ране выявлялась спороносная культура микробов, что также свидетельствовало о благоприятном регенераторно-репаративном процессе в ране.
Скорость заживления ран в исследуемых группах в первой фазе раневого процесса была идентичной. В то же время в фазе регенерации и эпителизации в испытуемой группе отмечено возрастании скорости заживления на 15-18% (р < 0,05).
Таким образом, оценка местных клинических проявлений в области послеоперационных ран, осложнившихся инфекцией, изучение динамики ЛИИ и НЛК, цитологические и бактериологические исследования отпечатков и отделяемого из ран, и определение скорости заживления позволяют уточнить положительное влияние живого бактериального препарата на течение раневого процесса. Применение споробактерина позволило сократить сроки стационарного лечения в испытуемой группе на 3-5 дней по сравнению с контрольной группой.
Вышеизложенное является важным аргументом для включения споробактерина в медико-экономический стандарт лечения послеоперационных раневых инфекций.
Полный текст:
Большой удельный вес послеоперационных инфекционных осложнений в урологических стационарах делает проблему борьбы с ними чрезвычайно актуальной. Высокий уровень возникновения данных осложнений в послеоперационном периоде у больных с мочекаменной болезнью обусловлен различными эндо- и экзогенными факторами.
Цель исследования. Определить частоту, структуру, а также особенности возникновения послеоперационных инфекционных осложнений у больных с мочекаменной болезнью в урологических стационарах.
Материалы и методы. В качестве объекта исследования использовались медицинские карты 232 прооперированных пациентов с мочекаменной болезнью, которые были выкопированы в индивидуальные регистрационные карты. Из 232 больных с мочекаменной болезнью 48,3% составляли мужчины, их средний возраст — 44,5 ± 9,4 лет. Пациенток женского пола было несколько больше (51,7%), соответственно средний возраст составлял 44,9 ± 8,1 лет.
Результаты. Наиболее часто встречающимися послеоперационными инфекционными осложнениями при мочекаменной болезни были инфекции в области хирургического вмешательства (36,2%), острый уретрит (20,7%), острый пиелонефрит (14,7%), паранефрит (9,5%), острый орхоэпидидимит (7,8%), острый цистит (6%), пионефроз (3,4%), уросепсис (1,7%). В этиологической структуре возбудителей инфекций, связанных с медицинской помощью, с наибольшей частотой выделялись микроорганизмы родов Escherichia coli (43%), Proteus (9,5%), Staphylococcus spp. (8,3%) и Staphylococcus aureus (8,3%), а также в 11,9% случаев — ассоциация микроорганизмов. Анализ этиологической структуры родов семейства Enterobacteriaceae, устойчивых к β-лактамным антибиотикам, показал, что 63,2% составляют род Esсherichia, 21% — Proteus и 15,8% — Klebsiella.
Заключение. Полученные данные свидетельствуют о необходимости проведения исследований по изучению распространенности устойчивых штаммов микроорганизмов, внедрения более специфичных, чувствительных методов и мониторинга. Это позволит повысить эффективность лечения, снизить риск распространения устойчивых штаммов и рост нозокомиальных инфекций.
Усупбаев Акылбек Чолпонкулович - доктор медицинских наук, профессор, заведующий кафедрой урологии и андрологии до- и последипломного обучения.
720020, Бишкек, ул. Ахунбаева, д. 92
Кабаев Бакберди Арстанбекович – аспирант.
720020, Бишкек, ул. Тоголок–Молдо, д. 1
Иманкулова Асель Сансызбаевна - кандидат медицинских наук, врач отделения гнойной хирургии.
720020, Бишкек, ул. Тоголок–Молдо, д. 1
Садырбеков Нурбек Женишбекович - доктор медицинских наук, заведующий отделением общей урологии.
720020, Бишкек, ул. Тоголок–Молдо, д. 1
Чолпонбаев Космосбек Сариевич - доктор медицинских наук, профессор, заведующий кафедрой управления и экономики фармации, технологии лекарственных средств.
720020, Бишкек, ул. Ахунбаева, д. 92
Усупбаева Алина Акылбековна - аспирант кафедры управления и экономики фармации, технологии лекарственных средств.
720020, Бишкек, ул. Ахунбаева, д. 92
1. Marschang S, Bernardo G. Prevention and control of healthcare-associated infection in Europe: a review of patients’ perspectives and existing diff erences. J Hosp Infect. 2015 Apr;89 (4):357–62. DOI: 10.1016/j.jhin.2015.01.017
2. Nicolle Urinary tract in geriatric and institutionalized patients. Current Opinion in Urology. Curr Opin Urol. 2002 Jan;12 (1):51–5.
3. Naber KG, Bergman B, Bishop MC, Bjerklund-Johansen TE, Bo™ o H, Lobel B, et al. Guidelines on urinary and male genital tract infections. Eur Urol. 2001 Nov;40 (5):576–88.
5. Liselo™ e Diaz Hogberg, Klaus Weist, Carl Suetens, Jolanta Griskeviciene DM, O. H. ECDC Surveillance Report. Annual epidemiological report Antimicrobial resistance and healthcare-associated infections. 2014, p. 1–23.
6. Акилов Ф. А. Мухтаров Ш. Т., Гиясов Ш. И., Мирхамидов Д. Х., Насиров Ф. Р., Муратова Н. Б. Послеоперационные инфекционно-воспалительные осложнения эндоскопических операций по поводу уролитиаза. Урология. 2013;1:89–91.
8. Loveday HP, Wilson JA, Pratt RJ, Golsorkhi M, Tingle A, Bak A, et al. National evidence-based guidelines for preventing healthcare-associated infections in NHS hospitals in England. J Hosp Infect. 2014 Jan;86 Suppl 1: S1–70. DOI: 10.1016/S0195–6701(13)60012–2.
9. Дзеранов Н. К. Инфекция мочевыводящих путей у пациентов с крупными и коралловидными камнями. Материалы XII съезда Российского общества урологов. М., 2012, с. 130–131.
10. Усупбаев, А. Ч., Маматбеков Р. А., Исаев Н. А. Современное состояние проблем мочекаменной болезни в Кыргызской Республике. Вестник КГМА им. И. К. Ахунбаева. 2017;3:101–111.
11. Дабуров К. Н., Саъдуллоев Ф. С., Нусратуллоев И. Н. Особенности микробного обсеменения в отделениях урологического стационара с совершенствованием мер по их снижению. Сборник трудов ХI конференции молодых ученых-медиков стран СНГ. Алматы, 2011, с. 20–23.
12. Шулутко Б. И. Нефрология 2002. Современное состояние проблемы. СПб.: Ренкор, 2002.
13. Дабуров К. Н., Саъдуллоев Ф. С., Нусратуллоев И. Н. Эпидемиология внутрибольничных инфекций в урологическом стационаре. Материалы съезда урологов Казахстана и Евразийского андрологического конгресса. Алматы, 2010, с. 88–89.
15. Kalsi J, Arya M, Wilson P, Mundy A. Hospital-acquired urinary tract infection. Int J Clin Pract. 2003 Jun;57 (5):388–91.
16. Пушкарев A. M. Факторы развития госпитальной инфекции мочевых путей в послеоперационном периоде. Здравоохранение Башкортостана. 2001;5:118–22.
17. Усупбаев А. Ч., Кабаев Б. А., Усупбаева А. А., Иманкулова А. С., Садырбеков Н. Ж. Периоперационная антибиотикопрофилактика в урологической практике. Вестник КГМА Вестник КГМА им. И. К. Ахунбаева. 2017;3:172–6.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Реферат по общей хирургии
Исполнитель: студ. III курса Селявко Юрий Александрович
Московский Государственный Университет имени М.В. Ломоносова
Несмотря на достижения современной медицины, частота послеоперационных инфекционных осложнений в нейрохирургии, челюстно-лицевой, торакальной, абдоминальной и сосудистой хирургии, травматологии и ортопедии, акушерстве и гинекологии остается высокой.
Остро стоит и сама проблема послеоперационных инфекционных осложнений, развитие которых заметно отягощает основное заболевание, удлиняет время пребывания больного в стационаре, увеличивает стоимость лечения, нередко служит причиной летальных исходов и негативно сказывается на сроках восстановления трудоспособности оперированных больных.
Поэтому изучение этиологической структуры, патогенетических аспектов, клинических проявлений, совершенствование методов диагностики, а также организация рациональной профилактики и лечения послеоперационных инфекционных осложнений являются актуальными на сегодняшний день задачами для всех областей хирургии.
Часть 1. Общие аспекты послеоперационных инфекционных осложнений.
Хирургические гнойно-септические послеоперационные осложнения входят в группу внутрибольничных инфекций. К этой группе, на долю которой приходится 15–25% от всех инфекций в стационаре, относятся инфекции хирургических, ожоговых и травматических ран. Частота их развития зависит от типа оперативного вмешательства: при чистых ранах – 1,5–6,9%, условно чистых – 7,8–11,7%, контаминированных – 12,9–17%, грязных – 10–40%.1
В многочисленных публикациях, посвященных проблеме нозокомиальных инфекций в хирургии, было убедительно доказано, что послеоперационные инфекционные осложнения:
ухудшают результат хирургического лечения;
увеличивают длительность госпитализации;
увеличивают стоимость стационарного лечения.
1.1. Послеоперационные инфекционные осложнения как особая категория внутрибольничных инфекций.
Несомненно, что четкое определение какого-либо понятия исключает его неоднозначное толкование. Это правомерно и в отношении определения такого явления, как "внутрибольничные инфекции" (ВБИ). Наиболее удачным и достаточно полным следует считать определение ВБИ, предложенное Европейским региональным бюро ВОЗ в 1979 г.: внутрибольничная инфекция (больничная, госпитальная, внутригоспитальная, нозокомиальная) - любое клинически распознаваемое инфекционное заболевание, которое поражает больного в результате его поступления в больницу или обращения в нее за лечебной помощью, или инфекционное заболевание сотрудника больницы вследствие его работы в данном учреждении вне зависимости от появления симптомов заболевания до или во время пребывания в больнице.
Естественно, что наиболее значительная часть ВБИ приходится на заражение пациентов в стационарах. Частота ВБИ составляет не менее 5%.2 Официальные отчеты отражают лишь небольшую часть хирургических ВБИ, а по данным, приведенным зарубежными исследователями, на долю хирургических инфекций приходится 16,3-22%.2
История сохранила высказывания и наблюдения известных врачей о значении проблемы внутрибольничного заражения. Среди них слова Н.И.Пирогова: "Если я оглянусь на кладбище, где схоронены зараженные в госпиталях, то не знаю, чему больше удивляться: стоицизму ли хирургов или доверию, которым продолжают пользоваться госпитали у правительства и общества. Можно ли ожидать истинного прогресса, пока врачи и правительства не выступят на новый путь и не примутся общими силами уничтожать источники госпитальных миазм".
Или ставшее классическим наблюдение I. Semmelweis, установившего связь высокой заболеваемости "родильной горячкой" в акушерских палатах Венской больницы во второй половине XIX века с несоблюдением врачами правил гигиены.
Такие примеры в полном смысле слова внутрибольничного заражения можно найти и в более позднее время. В 1959 г. мы описали вспышки гнойных послеродовых маститов у женщин, рожавших в родильном отделении одной из крупных московских больниц.2 Большинство из заболевших обращались и лечились затем в хирургическом отделении поликлиники при той же больнице. Во всех случаях возбудителем был белый стафилококк, выделенный из абсцессов молочной железы. Характерно, что аналогичный стафилококк был выделен при систематических бактериологических исследованиях, осуществляемых в родильном отделении. После проводимых в отделении плановых санитарных мероприятий число больных маститом уменьшалось, а по мере бактериального загрязнения помещений родильного отделения вновь увеличивалось. В настоящее время не вызывает сомнений тот факт, что нарушение санитарно-гигиенического режима в лечебных учреждениях приводит к росту заболеваемости и возникновению вспышек ВБИ. Это наиболее характерно для возникновения респираторных и кишечных инфекций.
Однако существует особая категория ВБИ, которая привлекает внимание различных специалистов, прежде всего хирургов, и не имеет однозначного решения. Речь идет о послеоперационных осложнениях в хирургических отделениях больниц различного профиля и мощности коечного фонда, удельный вес которых достаточно велик.
Некоторые авторы считают, что послеоперационные осложнения составляют от 0,29 до 30%2, но большинство приводят более однородные данные - 2-10%.2 Чаще всего речь идет о нагноениях послеоперационной раны,2 однако после операций, выполненных в связи с острыми заболеваниями, сопровождающимися диффузным перитонитом, довольно часто (1,8-7,6%) развиваются абсцессы брюшной полости.2
По данным Н.Н.Филатова и соавторов,2 частота гнойно-септических осложнений у оперированных в стационарах хирургического профиля Москвы составляет 7,1%. Более высокую частоту хирургических раневых инфекций (от 11,5% до 27,8%) приводят М.Г.Аверьянов и В.Т.Соколовский,2 причем осуществленный ими мониторинг выявил высокий уровень гнойных осложнений (9,7%-9,8%) при I-II классах операционных ран, при которых практически не должно быть осложнений, а при допустимом варианте - не более 1%. На более чем 53 тыс. операций частота гнойно-септических послеоперационных осложнений составляет только 1,51%.2
Противоречивость приведенных данных не снижает значимость проблемы послеоперационных раневых осложнений, развитие которых заметно отягощает развитие основного заболевания, удлиняет время пребывания больного в стационаре, увеличивает стоимость лечения, нередко служит причиной летальных исходов и негативно сказывается на сроках восстановления трудоспособности оперированных больных.
1.2. Классификация хирургической инфекции.
1. Первичные хирургические инфекции, возникающие самопроизвольно.
2. Вторичные, развивающиеся как осложнения после травм и операций.
Хирургические инфекции (в том числе и вторичные) также классифицируют3:
I. В зависимости от вида микрофлоры:
1. Острая хирургическая инфекция: а) гнойная; б) гнилостная; в) анаэробная: г) специфическая (столбняк, сибирская язва и др.).
2. Хроническая хирургическая инфекция: а) неспецифическая (гноеродная):
б) специфическая (туберкулез, сифилис; актиномикоз и др.).
II. В зависимости от этиологии: а) стафилококковая; б) стрептококковая:
в) пневмококковая; г) колибациллярная; д) гонококковая; е) анаэробная неспо-рообразующая; ж) клостридиальная анаэробная; з) смешанная и др.
III. С учетом структуры патологии: а) инфекционные хирургические болезни: б) инфекционные осложнения хирургических болезней; в) послеоперационные инфекционные осложнения; г) инфекционные осложнения закрытых и открытых травм.
IV. По локализации: а) поражения кожи и подкожной клетчатки; б) поражения покровов черепа, мозга и его оболочек; в) поражения шеи; г) поражения грудной клетки, плевральной полости, легких; д) поражения средостения (медиастинит. перикардит); е) поражения брюшины и органов брюшной полости; ж) поражения органов таза; з) поражения костей и суставов.
V. В зависимости от клинического течения:
1. Острая гнойная инфекция: а) общая; б) местная.
2. Хроническая гнойная инфекция.
1.3. Этиология послеоперационных инфекционных осложнений.
Гнойно-воспалительные заболевания имеют инфекционную природу, они вызываются различными видами возбудителей: грамположительными и грамотрицательными, аэробными и анаэробными, спорообразующими и неспорообразующими и другими микроорганизмами, а также патогенными грибами. При определенных, благоприятных для развития микроорганизмов условиях воспалительный процесс может быть вызван условно-патогенными микробами: Klebsiella pneumoniae, Enterobacrer aemgenes, сапрофитами — Proteus vulgaris и др. Заболевание может быть вызвано одним возбудителем (моноинфекция) или несколькими (смешанная инфекция). Группа микробов, вызвавших воспалительный процесс, называется микробной ассоциацией. Микроорганизмы могут проникать в рану, в зону повреждения тканей из внешней среды (экзогенное инфицирование) или из очагов скопления микрофлоры в самом организме человека (эндогенное инфицирование).
Этиологическая структура госпитальных инфекций в хирургии имеет определенные различия в зависимости от профиля стационара и типа оперативного вмешательства (Табл. 1). Ведущим возбудителем раневых инфекций в отделениях общего профиля остается золотистый стафилококк; коагулазонегативные стафилококки наиболее часто вызывают посттрансплантационные инфекции; кишечная палочка и другие представители семейства Enterobacteriaceae являются доминирующими возбудителями в абдоминальной хирургии и инфекций в акушерстве и гинекологии (Табл. 2). Однако разные авторы отмечают высокий уровень P.aeruginosa (18,1%) и E.coli (26,9%)2, обращают внимание на преобладание энтеробактерий (42,2%) и золотистого стафилококка (18,1%)2; стафилококк был выделен в 36,6% случаев, E.coli - в 13,6, P.aeruginosa - в 5,1%.2
Для выделенных госпитальных штаммов характерна высокая устойчивость к антибиотикам;2 устойчивость к наиболее применяемым антибиотикам может достигать 70-90%2. Отмечена высокая резистентность к пенициллинам и хорошая чувствительность к фторхинолонам.2
Область операционного вмешательства
Золотистый и эпидермальный стафилококки, дифтероиды, грамотрицательные энтеробактерии
Аэробы и анаэробы полости рта, золотистый стафилококк, стрептококки, грамотрицательные энтеробактерии
Анаэробы полости рта, золотистый стафилококк, стрептококки, грамотрицательные энтеробактерии
Верхние отделы желудочно-кишечного тракта
Золотистый стафилококк, флора полости рта и глотки, грамотрицательные энтеробактерии
Грамотрицательные энтеробактерии, золотистый стафилококк, энтерококки, клостридии, иногда синегнойная палочка
Нижние отделы желудочно-кишечного тракта
Аэробы и анаэробы кишечника, грибы
Таблица 1. Основные возбудители инфекционных осложнений после различных оперативных вмешательств.1
Читайте также:


