Выявление антител к вирусу болезни ауески
РАЗРАБОТКА ДИАГНОСТИКУМА НА ОСНОВЕ МАРКИРОВАННОГО ШТАММА "ВК" ВИРУСА БОЛЕЗНИ АУЕСКИ
Мифтахов Н.Р., аспирант, Чернов А.Н., научный руководитель, кандидат ветеринарных наук Федеральный центр токсикологической и радиационной безопасности животных, г. Казань
Постоянный контроль эффективности вакцинопрофилактики при инфекционных заболеваниях, в том числе и при болезни Ауески (БА) свиней, требует наличия современных тест-систем, т.к. идет постепенный переход при иммунизации к вакцинам нового поколения. К вакцинам нового поколения можно отнести вакцину против болезни Ауески из штамма ВК, делеционного по гликопротеину gE. Целью данной работы явилась разработка эритроцитарной тест-системы на основе вируса, делеционного по гликопротеину gE, для дифференциального выявления инфекционных и вакцинальных антител к вирусу БА.
Материалы и методы. Оценка эффективности вакцинопрофи-лактики при данном заболевании основана на определении уровня антител в сыворотке крови вакцинированных животных.
Исследования проводили на подсвинках, разделенных по принципу аналогов на 3 группы по 15 голов в каждой. Первая группа животных была вакцинирована против болезни Ауески маркированной вакциной, делеционный по гликопротеину gE, штамм "ВК" вируса болезни Ауески; 2-я группа - вирусвакциной ВГНКИ производства ФГУП "Покровский завод биопрепаратов"; 3-я группа служила контролем.
Результаты исследований. Использование эритроцитарного диа-гностикума, изготовленного нами на основе делеционного по гли-копротеину gЕ антигена вируса болезни Ауески, позволило определять гомологичные антитела в сыворотке крови животных, иммунизированных аналогичным антигеном вируса болезни Ауески (делеционным по гликопротеину gЕ). При этом титр специфических антител в сыворотках крови животных, иммунизированных вакциной "ВК", достигал на 14 день после первого введения вакцины значений 1:17,9±4,1, а на 14-й день после 2-ой иммунизации 1:29,8±4,3.
При исследовании сывороток крови подсвинков, иммунизированных против БА вакциной ВГНКИ, специфические антитела выявлялись лишь в титрах 1:2-1:4, т.е. в пределах значения, которые считаются отрицательными или сомнительными в РНГА.
Одновременно сыворотки крови обеих групп животных исследовали на наличие специфических антител с применением эритроцитарного диагностикума (Регистрационный N° ПВР-1-1.8/02106), изготавливаемого нами на основе вакцины ВГНКИ. Установлено, что в сыворотках крови первой группы подсвинков,, иммунизированных вакциной из штамма "ВК", специфические антитела не выявлялись. В то время как в сыворотке крови второй группы подсвинков специфические антитела обнаруживались в титрах 1:128-1:256.
При исследовании сывороток крови интактных подсвинков двумя диагностикумами результаты были отрицательными.
Это позволило нам заключить, что изготовленный эритроцитарный реагент активен, высокочувствителен и выявляет гомологичные антитела в высоких титрах.
Заключение. Таким образом, в результате проведенных исследований было установлено, что изготовленный нами эритроцитарный диагностикум на основе делеционного по гликопротеину gE антигена вируса БА, позволяет дифференцировать группы животных, иммунизированных против БА различными вакцинами, посредством определения в сыворотке крови наличия или отсутствия gЕ-специфических антител.
Литература
- Моренков О.С. Болезнь Ауески: иммунологическая характеристика гликопротеинов gЕ и gВ вируса и разработка методов серологической диагностики болезни и контроля "маркированных" вакцин : Автореф. дисс. докт.биол.наук. - М., 2000. -48с.
- Юсупов Р.Х., Ильясова Г.Х., Кузнецова Е.А., Никонова О.Г. Новое в технологии изготовления антигенного эритроцитарного диа-гностикума при болезни Ауески // Материалы Международной научно-практической конференции, посвященные 40-летию ВНИИВВиМ. - Покров.-1998.-С.61-62.
- Яснева Е.А. Тест-системы на основе иммуноферментного анализа для определения антител к вирусу болезни Ауески: Автореф. дисс..канд.вет.наук. - Владимир, 2008. -23с
Разработана тест-система эритроцитарного носителя делеционного по гликопротеину gE вируса болезни Ауески (БА) для дифференциации поствакцинальных и постинфекционных антител.
Ключевые слова: болезнь Ауески, антитела, дифференциация.
Test - system erithrocytic of carrier on glicoprotein gE of Aujeszky,s Disiase virus for differentiation of vaccination and infectious antibodies is determined.
Key words: Aujeszky,s Disiase, antibodies, differentiation. Сведения об авторах
Мифтахов Нияз Рафисович ФГУ "ФЦТРБ-ВНИВИ" (Федеральный центр токсикологической и радиационной безопасности животных), аспирант, тел.8(843) 239 53 42, Республика Татарстан, г. Казань, Научный городок 2, ФГУ "ФЦТРБ-ВНИВИ", 420075.
Ответственный за переписку с редакцией: Чернов Альберт Николаевич ФГУ "ФЦТРБ-ВНИВИ" (Федеральный центр токсикологической и радиационной безопасности животных), к.в.н., с.н.с., Республика Татарстан, г. Казань, Научный городок 2, ФГУ "ФЦТРБ-ВНИВИ", 420075.
Вид животного: Свиньи
Тип оборудования: Тесты
Производитель: НИИ ДПБ
Оставить заявку
или проконсультироваться по телефону:
Бесплатное обучение Использованию прибора
Сервисное обслуживание Диагностика, калибровка, поверка, расходные материалы
Доставка по РФ Транспортная компания, самовывоз, транспорт нашей компании
Наглядные пособия:
Видео обзор:
Описание
Оплата
Доставка
Сервис
Набор рассчитан на проведение на одном планшете одновременного анализа 46 исследуемых проб сыворотки крови и двух контрольных проб (в 2-х повторах). Компоновка набора допускает возможность дробного использования компонентов для проведения нескольких серий анализов по мере поступления биоматериала.
- 2 планшета для иммуноферментного анализа с адсорбированным в лунках гликопротеином gE ВБА;
- положительный и отрицательный контроли;
- Моноклональные антитела к антигену gE вируса болезни Ауески, меченные пероксидазой хрена (Конъюгат);
- неспецифические химические компоненты.
Метод основан на конкурентном взаимодействии конъюгированных с пероксидазой моноклональных антител к эпитопу gE гликопротеина ВБА и сывороточных специфических антител с иммобилизованным на поверхности иммунологического планшета гликопротеином gE.
При отсутствии в исследуемой сыворотке специфических антител, моноклональный конъюгат свободно взаимодействует с иммобилизованным gE и после добавления субстрата и хромогена в лунке развивается окраска. Если исследуемая сыворотка содержит специфические антитела, то происходит их взаимодействие с иммобилизованным gE, его частичная или полная блокировка, в результате чего связывание антител конъюгата с антигеном не происходит, или происходит частично и, соответственно, окрашивание отсутствует или интенсивность окраски снижается. Таким образом, интенсивность окраски обратно пропорциональна количеству антител в исследуемой сыворотке.
Набор хранят в защищенном от света месте при температуре от 2 до 8°С.Замораживание реагентов набора не допускается.
Мы работаем как с физическими, так и с юридическими лицами, в том числе бюджетными организациями. Принимаем участие в тендерах и государственных закупках.
Для всех наших клиентов предусмотрена гибкая система скидок. Условия предоставления скидок и их размер вы можете уточнить у наших менеджеров.
| Контрагент | Способы оплаты | Комиссия | Комментарий |
| Юридические лица и ИП | Безналичный расчет | Не взимается | Оплата производится путем предоплаты. Для получения счета необходимы реквизиты организации |
| Бюджетные организации | Безналичный расчет | Не взимается | Предусмотрены следующие формы оплаты: предоплата 30%, остаток 70% по факту поставки; отсрочка платежа в течение 15-30 календарных дней согласно договору поставки. Для получения счета необходимы реквизиты организации |
| Физические лица | Наличными в магазине, расположенном по адресу: г. Воронеж, Пирогова 87Б | Не взимается | При условия самовывоза и наличие товара на складе. |
| Оплатой банковской картой в магазине, расположенном по адресу: г. Воронеж, Пирогова 87Б | Не взимается | При условия самовывоза и наличие товара на складе. Мы принимаем пластиковые карты международных платежных систем МИР, VISA, MasterCard и т.д. | |
| Безналичный расчет | Сбербанк – 3% |
Другой банк – ставка за перевод уточняйте в банке
Отправка заказа при безналичной оплате производится после поступления денег на наш расчетный счет, о чем мы известим вас по e-mail или по телефону.
1. Выберите товар в ассортименте на нашем сайте.
2. Закажите счет у менеджера, предварительно предоставив ему реквизиты Вашей компании.
Для выставления счета необходимы:
Юридическим лицам/ИП: Точное наименование организации, ИНН, КПП, банковские реквизиты.
Физ. лицо: ФИО, адрес, телефон и e-mail, скан паспорта РФ.
3. Счет обязательно подписывается главным бухгалтером и генеральным директором и передается покупателю в электронном виде. Счета могут быть выставлены как с НДС, так и без НДС.
4. Получив счет, проверьте, пожалуйста, нужный ли Вам товар отражен в счете и реквизиты Вашей компании.
Счет действителен в течение 5-х банковских дней. Если в течение этого времени вы не направили средства в оплату счета, он становится недействительным и Вам необходимо получить новый счет. Датой оплаты заказа считается дата зачисления средств на банковский счет компании.
6. Для оперативной отгрузки заказа рекомендуем сразу после оплаты выслать по электронной почте копию платежного поручения, либо позвонить и проинформировать об оплате, сообщив дату и номер оплаченного счета, сумму оплаты.
Все платежные документы необходимо сохранять до момента получения товара.
Получение заказа производится после оплаты счета при наличии:
Для юридических лиц и ИП: оригинал доверенности с синей печатью или печать. Генеральный директор (руководитель) может получить груз без доверенности при наличии печати организации, паспорта и документа, подтверждающего его полномочия (приказ о назначении на должность, решение учредителя или участников общества).
Если индивидуальный предприниматель работает без печати, доверенность должна быть заверена нотариально. При условии предоставления заранее письма с образцом подписи ИП, доверенность заверяется личной подписью Индивидуального предпринимателя.
Физ.лицо: паспорт РФ, платежное поручение
В случае, если плательщик и получатель разные лица необходимо предоставить копию паспорта плательщика и заполненную доверенность на получение заказа с данными получателя. При получении заказа получателю необходимо предъявить паспорт.
- – оригинал счёта,
- – товарная накладная,
- – счет–фактура при расчете в НДС
- – гарантийный талон,
- – инструкция по применению.
Доставка заказа осуществляется со склада в Воронеже. Оплата стоимости доставки осуществляется в ТК по факту получения товара. Отгрузка товара для физ. лиц осуществляется на условиях 100% оплаты, для юр. лиц согласно условиям договора.
Отправка со склада осуществляется 2 раза в неделю ВТ и ЧТ
Успешное выполнение намеченной ХХVII съездом КПСС широкой программы развития в нашей стране агропромышленного комплекса в немалой степени зависит от хорошей организации ветеринарного обслуживания животноводства, четко налаженной работы ветеринарных диагностических лабораторий. Проводимые в лабораториях исследования позволяют правильно организовать мероприятия по предупреждению инфекционных и инвазионных болезней, а в случаях возникновения заболевания своевременно поставить диагноз и принять целенаправленные меры по его быстрейшей ликвидации.
В работе ветеринарных лабораторий все большее применение находят современные методы исследований, одновременно идет совершенствование диагностики многих заболеваний, предлагаются новые более чувствительные и достоверные методы, позволяющие полнее и на ранних стадиях выявлять заболевших животных и тем самым способствовать быстрейшему оздоровлению хозяйств.
Специалисты лабораторий постоянно расширяют перечень показателей и болезней, на которые проводятся исследования.
За последнее время утверждено значительное количество инструктивных документов по проведению лабораторных исследований, что позволило более четко организовать работу специалистов, улучшить качество исследований, получать сопоставимые результаты.
Оснащение лабораторий современным оборудованием позволяет внедрять в работу более точные инструментальные методы.
В своей работе ветеринарные лаборатории не могут использовать всего многообразия предлагаемых методов исследования из-за того, что они или недостаточно апробированы, или из-за сложности используемого оборудования. Имеют место случаи, когда предлагаемые различными авторами методы при определении одних и тех же показателей дают несовпадающие результаты. Поэтому в настоящий справочник включены методы лабораторных исследований патологического материала, полученного от больных, убитых или павших сельскохозяйственных животных, апробированные Центральной ветеринарной лабораторией и утвержденные в разные годы бывшим Министерством сельского хозяйства СССР.
Книга содержит методические указания по диагностике вирусных, риккетсиозных, хламидиозных болезней, а также методические указания по лабораторной диагностике паразитарных болезней животных и пчел.
Методики излагаются по единой схеме: взятие и пересылка патологического материала, методы его обработки, микроскопические исследования, включая световую и люминесцентную микроскопию, выделение возбудителей на куриных эмбрионах и культурах клеток, заражение лабораторных животных, гистологические исследования, идентификация и дифференциация возбудителей с использованием различных методов, определение биологической активности вакцин и исследования на напряженность иммунитета.
Методы лабораторных исследований, представленные в справочнике, унифицированы и стандартизированы, что создает возможность для стандартизации аппаратов, приборов, инструментов, посуды, реактивов, биопрепаратов и другого специального имущества, определения объема подготовки специалистов и степень оснащения ветеринарных диагностических лабораторий. Таким образом, стандартизация методов исследования является способом наведения строгого порядка в ветеринарной лабораторной работе.
Методические указания по лабораторной диагностике
болезни Ауески животных
(Рекомендованы 18 мая 1978 г.)
обнаружении и идентификации вируса этой болезни в патологическом материале методами непрямой гемагглютинации (РНГА) или иммуноосмофореза;
выявлении специфических антител в сыворотке крови больных и переболевших животных в РНГА или в реакции нейтрализации (PH) на культуре клеток (ретроспективная диагностика);
постановке биологической пробы.
1.2. РНГА, реакцию иммуноосмофореза и PH применяют для исследования патологического материала и сывороток крови только от невакцинированных против болезни Ауески животных.
1.3. Лабораторный диагноз на болезнь Ауески ставят при получении положительного результата хотя бы по одному из методов исследования, указанных в п. 1.1.
Окончательный диагноз на болезнь Ауески устанавливают на основании эпизоотологических, клинических и патологоанатомических данных с учетом результатов лабораторного исследования.
2.1. В качестве исследуемого материала отбирают пробы патологического материала из разных участков головного мозга (полушарий, мозжечка, продолговатого мозга), заглоточных и бронхиальных лимфоузлов, легких, печени, селезенки, почек свиней, павших или вынужденно убитых в агональном состоянии.
Патологический материал измельчают, растирают в ступке и готовят суспензию (1:5) на физиологическом растворе для РНГА и суспензию (1:5) на веронал-мединаловом буферном растворе (pH 8,6) для метода иммуноосмофореза.
2.2.1. Компоненты реакции:
эритроцитарный диагностикум (эритроциты барана, сенсибилизированные антителами к вирусу болезни Ауески);
контрольный положительный антиген (вакцинный штамм вируса болезни Ауески) в рабочем разведении;
контрольный отрицательный антиген в рабочем разведении;
нормальная лошадиная сыворотка.
2.2.2. Подготовка исследуемого материала. Суспензию из органов (1:5) выдерживают одни сутки при температуре минус 20 °С в холодильнике, затем центрифугируют при 4 тыс. об/мин в течение 20 мин. Надосадочную жидкость очищают хлороформом, добавляя его в количестве 1/4 части объема жидкости, затем вновь центрифугируют при 4 тыс. об/мин в течение 20 мин.
Надосадочную жидкость используют в РНГА в качестве испытуемого антигена.
Испытуемые и контрольные антигены разводят 1:2 и выше в объеме 0,05 мл 1 %-ным раствором нормальной лошадиной сыворотки. Затем добавляют по 0,025 мл эритроцитарного диагностикума. Смесь встряхивают и выдерживают при комнатной температуре в течение 2 - 3 ч.
контрольный положительный антиген + эритроцитарный диагностикум;
контрольный отрицательный антиген + эритроцитарный диагностикум;
эритроцитарный диагностикум + 1 %-ный раствор нормальной лошадиной сыворотки.
2.2.4. Учет реакции. Учет РНГА проводят при полном оседании эритроцитов в контроле с отрицательным антигеном. Положительными считают те пробы антигенов, которые в разведении 1:8 и выше вызывают агглютинацию эритроцитов при положительном результате в контроле со специфическим антигеном и отрицательном результате с контрольным отрицательным антигеном.
2.3. Реакция иммуноосмофореза.
2.3.1. Компоненты реакции:
специфическая к вирусу болезни Ауески иммуноасцитическая жидкость белых крыс (ИАЖ);
контрольный положительный антиген;
контрольный отрицательный антиген;
Для постановки реакции необходимо иметь камеру из плексигласа для электрофореза, универсальный источник питания УИП-1, агар Дифко, веронал-мединаловый буфер с pH 8,6, стекла обезжиренные (9×12), металлический штамп, пробирки, центрифугу.
2.3.2. Подготовка исследуемого материала. Суспензию из органов (1:5) подвергают однократному замораживанию (при минус 15 - 20 °С) с последующим оттаиванием. Затем суспензию центрифугируют при 4 тыс. об/мин в течение 20 мин. Надосадочную жидкость используют в качестве испытуемого антигена.
2.3.3. Приготовление агаровой среды. Для постановки реакции готовят 1,5 %-ный гель из агара Дифко на веронал-мединаловом буфере с pH 8,6. Пропись буфера: веронал - 1,66 г, мединал - 10,51, молочнокислый кальций - 1,536 г, дистиллированная (слегка подогретая) вода - 1 л. В качестве антибактериального средства в агаровую среду вносят мертиолят из расчета 1:10000 и хранят в холодильнике.
Для постановки реакции агар, расплавленный и остуженный до 50 - 56 °С, наносят пастеровской пипеткой на стекла размером 9×12 см. Толщина агаровой пластинки 4 - 5 мм. Расход агара около 15 мл. В затвердевшем агаре выштамповывают лунки диаметром 5 мм, с расстоянием между лунками 5 мм.
2.3.4. Постановка реакции. В лунки, которые расположены ближе к катоду, вносят исследуемые антигены; в лунки, расположенные ближе к аноду, вносят специфическую асцитическую жидкость в рабочем разведении. Иммуноосмофорез проводят в камере для электрофореза на бумаге при напряжении тока 200 - 220 В в течение 1 - 2 ч. В качестве контроля используют положительный антиген со специфической асцитической жидкостью.
2.3.5. Учет реакции. Результаты иммуноосмофореза учитывают через 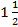
- 2 ч с момента включения камеры в сеть.
Реакция считается положительной при образовании линии преципитации между лунками с исследуемыми антигенами и специфической асцитической жидкостью при положительном результате в положительном контроле (контрольный положительный антиген + ИАЖ) и отрицательном результате в отрицательном контроле (контрольный отрицательный антиген + ИАЖ).
3.1. Ретроспективная диагностика основана на обнаружении специфических к вирусу болезни Ауески антител в сыворотке крови больных и переболевших животных в реакции непрямой гемагглютинации, а также в реакции нейтрализации на культуре клеток.
3.2. Реакция непрямой гемагглютинации.
3.2.1. Компоненты реакции:
эритроцитарный диагностикум (эритроциты барана, сенсибилизированные вакцинным штаммом вируса болезни Ауески);
контрольная положительная иммуноасцитическая жидкость;
3.2.2. Подготовка исследуемых и контрольных сывороток. Перед постановкой РНГА исследуемые и контрольные сыворотки разводят 1:2 забуференным раствором, инактивируют в водяной бане при температуре 56 °С в течение 30 мин и истощают эритроцитами барана.
В 1 мл сыворотки вносят 0,1 мл 5 %-ной взвеси отмытых эритроцитов барана, выдерживают в термостате при температуре 37 °С в течение 30 - 40 мин и удаляют эритроциты центрифугированием. При массовых исследованиях сыворотки после истощения можно выдерживать в течение 12 - 24 ч при 4 °С, затем их исследуют в РНГА в разведении 1:2 и выше.
3.2.3. РНГА проводят по методике, описанной в п. 2.2.
3.2.4. Учет реакции. Результаты реакции учитывают при полном оседании эритроцитов в контроле с отрицательной асцитической жидкостью.
Положительными к вирусу болезни Ауески считают те пробы сывороток, в которых при разведении 1:8 и выше наблюдают агглютинацию эритроцитов.
3.3. Реакция нейтрализации.
3.3.1. Реакцию нейтрализации проводят на культуре клеток ПП, СПЭВ и первично-трипсинизированной культуре куриных фибробластов.
3.3.2. Компоненты реакции:
вирус болезни Ауески (вакцинный штамм);
исследуемые сыворотки крови (инактивированные);
контрольная положительная сыворотка.
3.3.3. Для постановки реакции необходимо предварительно провести пассаж вакцинного штамма вируса болезни Ауески на культуре клеток и определить его титр.
3.3.4. Чтобы провести пассаж вакцинного штамма вируса, содержимое ампулы разводят до нативного состояния (1:1), затем готовят разведение вируса 1:10 на питательной среде. Разведенный вирус в дозе 1 мл вносят в культуру клеток, выращенную в пенициллиновых флаконах, и инкубируют при температуре 37 °С. Через 24 ч клетки сморщиваются, округляются, монослой нарушается и образуются островки клеток. Через 72 ч монослой полностью нарушается и на стекле остаются единичные клетки.
Культуральный (вакцинный) штамм вируса хранят в холодильнике при температуре 4 °С и освежают один раз в 3 мес.
3.3.5. Для титрования вируса готовят десятикратные разведения вируса (от 10 -1 до 10 -8 ) на питательной среде без сыворотки. Каждым разведением в объеме 1 мл заражают отмытую раствором Хенкса культуру клеток (по 4 пенициллиновых флакона). Культуру клеток инкубируют при 37 °С, ежедневно просматривая ее под микроскопом. Окончательный учет результатов проводят через 72 ч.
Титром вируса считают наибольшее его разведение, вызывающее цитопатическое действие (ЦПД) в 50 % культур клеток. Титр вычисляют по методу Рида и Менча и выражают количество ЦПД в 1 мл.
3.3.6. Постановка реакции нейтрализации. PH ставят с дозой вируса, равной 100 ТЦД50 в 0,1 мл. Исследуемые сыворотки разводят 1:2 и выше в объеме 0,5 мл. К каждому разведению сыворотки добавляют равный объем (0,5 мл) вируссодержащей культуральной жидкости. Пробирки со смесью встряхивают и оставляют при температуре 37 °С в течение 60 мин. После инкубации смесь вируса с сывороткой вводят во флаконы с культурой клеток и результаты учитывают через 72 ч.
Для контроля заражают культуру клеток смесью вируса с контрольной положительной сывороткой, вирусом без сыворотки и одновременно в одном флаконе с культурой клеток сменяют питательную среду (контроль культуры клеток).
3.3.7. Учет реакции нейтрализации. Подавление цитопатического действия вируса специфической (контрольной) сывороткой и исследуемыми сыворотками при наличии ЦПД в контроле (культура клеток, зараженная вирусом без сыворотки) указывает на наличие специфических антител к вирусу болезни Ауески в сыворотке крови свиней.
4.1. Для постановки биопробы патологический материал (селезенку, печень, головной мозг, легкие) растирают в ступке с физиологическим раствором в соотношении 1:10. Полученную суспензию вводят внутримышечно кролику или кошке в дозе 1 мл. Через 2 - 3 сут после заражения при наличии вируса в патологическом материале животное заболевает.
Болезнь характеризуется беспокойством, зудом, расчесами на месте инъекции. Если зараженные животные погибают на 3 - 6-й день, но у них не наблюдалось зуда и расчесов, то патологический материал от павшего кролика (или кошки) пассируют еще раз на таких же животных.
Цибезов В.В., Терехова Ю.О., Баландина М.В., Латышев О. Е.,
Гребенникова Т. В., Верховский О.А. АНО "Научно-исследовательский
институт диагностики и профилактики болезней человека и животных"
Алипер Т.И. НПО "НАРВАК"
Шевкопляс В.Н. Кубанский госагроуниверситет
Африканская чума свиней (АЧС) - вирусная болезнь свиней, характеризующаяся высокой контагиозностью. Возбудителем заболевания является ДНК-содержащий вирус семейства Asfarviridae с размером вириона 175—215 нм [8]. В естественных условиях к АЧС восприимчивы домашние и дикие свиньи всех возрастов. Скорость распространения и степень патогенности вируса АЧС таковы, что эта инфекция способна в короткие сроки (3-5 месяцев) привести к огромным экономическим потерям или даже полной утрате поголовья свиней [1, 6].
Эпизоотологическая особенность АЧС заключается в чрезвычайно быстром изменении форм течения инфекции среди домашних свиней от острого со 100%-ной летальностью до хронического и бессимптомного носительства и непредсказуемого распространения.
Для эффективного использования различных методов диагностики АЧС. направленных на выявление возбудителя или специфических антител, следует учитывать особенности протекания болезни и ее формы. При сверхострой и острой формах выявление вирусоспецифических антител возможно только в пробах селезенки, так как специфические антителопродуцирующие клетки и. следовательно, антитела появляются там на 2-3 сутки после инфицирования, в то время как животные гибнут уже на 3-7 сутки [5]. При подостром и хроническом течении болезни виру-соспецифические антитела в крови появляются на 7-10 сутки, до этого времени целесообразно проводить выявление вирусного антигена или генома в крови, так как данный период течения АЧС характеризуется виремией [7] .
В более поздний срок прижизненная идентификация вирусного антигена возможны только при наличии устойчивой ви-ремии. которая характерна для циркуляции высокопатогенных штаммов и изолятов. Вирус умеренно вирулентных изолятов вызывает перемежающуюся виремию. невысокий уровень смертности при высоком уровне заболеваемости, поэтому в этом случае диагностика АЧС. в основном, базируется на обнаружении антител в сыворотке крови [5. 7]. Таким образом, для эффективной диагностики АЧС необходимы методы специфического определения, как возбудителя, так и антител, образующихся после заражения вирусом.
Одним из перспективных методов определения вирусных антигенов и антител к ним является иммуноферментный анализ (ИФА). Преимущества ИФА заключаются в высокой специфичности, скорости и простоте постановки реакции, сравнительна невысокой стоимости и универсальности применяемого оборудования, возможности автоматизации процедуры анализа. За последнее десятилетие произошли значительные изменения в технологии производства ИФА-наборов. обусловленные результатами научно-практических разработок, связанных с применением моноклональных антител (МкА). которые практически полностью вытеснили поликлональные не только в "сэндвич"-вариантах ИФА. предназначенных для обнаружения антигена, но и в большинстве тест-систем, направленных на выявление антител, где они используются либо в качестве конъюгатов или для адсорбции антигена [9. 10]. Помимо этого, в качестве компонентов ИФА эффективно используются рекомбинантные антигены, обладающие иммунохимическими свойствами нативных белков и представляющие собой хорошо охарактеризованные и стандартизированные препараты [2. 3. 4].
Целью настоящей работы являлась разработка современных иммуноферментных тест-систем для выявления как антител к вирусу АЧС. так и самого вируса АЧС в биологическом материале.
Материалы и методы исследования. Для создания высокоспецифичных иммуноферментных тест-систем необходимо было разработать методику синтеза рекомбинантного белка vp73 вируса АЧС. а также, используя в качестве антигена полученный рекомбинантный белок, получить и охарактеризовать специфические моноклональные антитела к вирусу АЧС. Часть работы была проведена в сотрудничестве с сотрудниками фирмы INGENASA (Испания).
Получение рекомбинантного белка vp73. Для получения рекомбинантного белка фрагмент гена B646L размером 485 п.о., кодирующий конформационный эпитоп белка vp73. был амплифицирован с рекомбинантной плазмидной ДНК pSG72a, несущей полную последовательность этого гена. Экспрессию рекомбинантного белка проводили в клетках E.coli штамма BL21(DE3)pLysS (Novagen). Белок очищали из микробной массы Е. coli BL21(DE3)pLysS на NI-NTA агарозе (Qiagen. USA).
Идентификацию и степень чистоты полученного препарата проверяли методом SDS- электрофореза в 12% полиакриламид-ном геле, его активность и специфичность - в непрямом ИФА и иммуноблоттинге с использованием МкА и референтных положительных и отрицательных сывороток крови свиней.
Получение МкА к рекомбинантному белку vp73. Для получения МкА мышей линии BALB/c 3 раза иммунизировали ре-комбинантным белком vp73 (200 мкг/мышь) с двухнедельным интервалом между иммунизациями. Бустерную дозу (200 мкг/ мышь) вводили за 3 дня до выделения селезенки.
Гибридомные клеточные линии получали путем слияния спленоцитов с перевиваемой клеточной линией миеломы Sp2/0.
Скрининг и оценку иммунологической активности МкА в сыворотке крови или культуральной жидкости проводили методом непрямого ИФА. Позитивные гибридомы реклонировали и наращивали в культуральных флаконах, увеличивая объем (Greiner. Германия). Асцитные жидкости, содержащие МкА, получали после введения гибридомных клеток в брюшную полость праймированных пристаном мышей линии BALB/c. Очистку МкА из асцитных жидкостей осуществляли методом аффинной хроматографии с использованием Белок-А-агарозы (Sigma. США).
Конъюгаты МкА с пероксидазой хрена получали периодатным методом.
Иммуноферментный метод выявления антител к вирусу АЧС в формате конкурентного ИФА. Очищенный рекомбинантный белок vp73 сорбировали в лунках микропланшета в 0.1 М карбонатном буфере. рН=9.5 (концентрация 5 мкг/мл) по 100 мкл в лунку в течение ночи при 4°С. После 4-кратной отмывки планшета в лунки вносили по 100 мкл исследуемой сыворотки. Инкубировали планшет 1 час при +37°С. После отмывки планшета в лунки вносили по 100 мкл пероксидазного конъюгата МКА. Инкубировали планшет 1 час при +37°С. После промывания планшета вносили по 0.1 мл субстратного раствора с тетраметилбензидином (МДЛ. Россия). Инкубировали 15 мин при комнатной температуре в темноте и добавляли 0.1 мл 1 М H2S04 для остановки реакции. Оптическую плотность при 450 нм (А450) измеряли на спектрофотометре с вертикальным лучом Multiscan EX (Thermo, США).
Иммуноферментный метод выявления антигена вируса АЧС в формате "сэндвич"-ИФА. Для "сэндвич"-ИФА очищенные МкА сорбировали в лунках микропланшета в 0.1 М карбонатном буфере. рН=9.5 (концентрация 10 мкг/мл) по 100 мкл в лунку в течение ночи при 4°С. После 4-кратной отмывки планшета в лунки вносили по 100 мкл очищенного рекомбинантного vp73 в серийных разведениях (от 5 нг/мл до 320 нг/мл) или подготовленные образцы биоматериала. Инкубировали планшет 1 час при +37°С. После 4-кратной отмывки планшета в лунки вносили по 100 мкл пероксидазного конъюгата детектирующих МкА в рабочих разведениях на ФСБТ. Инкубировали планшет 1 час при +37°С. После промывания планшета вносили по 0.1 мл субстратного раствора с тетраметилбензидином и определяли оптическую плотность как описано выше.
Полимеразная цепная реакция в реальном времени для выявления ДНК вируса АЧС. Выделение ДНК вируса АЧС из биологических образцов проводили с использованием набора для выделения ДНК на колонках ("Ветбиохим". Россия).
ПЦР в реальном времени проводили на приборе ДТ-96 ("ДНК-Технология". Россия) в конечном объеме 25 мкл. Реакционная смесь содержала 5 мкл ДНК. 10 пмоль каждого прайме-ра. 5 пмоль зонда. 0.25 мМ каждого dNTP. 1.25 ед. Taq-полиме-разы, 10 мМ Tris-HCI (рН=9.0). 50 мМ KCI. 0.1% Triton Х-100. 1.5 мМ MgCI2.
Результаты и обсуждение. Рекомбинантный фрагмент конформационного эпитопа белка vp73 вируса АЧС был охарактеризован биохимическими и иммунохимическими методами (электрофорез, иммуноблоттинг. ИФА). Показано, что полученный продукт обладает электрофоретической гомогенностью и детектируется АЧС-специфическими сыворотками. Неспецифические сыворотки не взаимодействуют с полученным продуктом. Рекомбинантный белок был использован в качестве антигена для получения МкА.
После проведения гибридизации было получено 523 гибридных клеточных линий, устойчивых к селективной среде HAT. При первичном тестировании культуральных жидкостей было отобрано 67 клонов реагировавших с рекомбинантным белком vp73.
После повторного клонирования были отобраны 2 клона, обладающих максимальной активностью по отношению к vp73 в непрямом ИФА. Полученные МкА были использованы в дальнейшей работе.
При разработке тест-системы для выявления антител к вирусу АЧС был использован принцип конкурентного ИФА. применяемый в наборе для определения антител к вирусу АЧС INGEZIM РРА СОМРАС (INGENASA. Испания). INGEZIM РРА СОМРАС на основе белка vp73 вируса АЧС обладает 100% чувствительностью и специфичностью и используется в Европе в качестве основного для первичного исследования сывороток при диагностике АЧС. Набор INGEZIM РРА СОМРАС успешно применялся в Испании в рамках национальной программы по искоренению АЧС.
В результате проведенных исследований с использованием полученных рекомбинантного белка vp73 и МкА была разработана тест-система для определения антител к вирусу АЧС "АЧС-CEPOTECT/INGEZIM РРА СОМРАС". Оценка диагностической чувствительности и специфичности тест-системы проводилась в компании INGENASA на широкой панели референтных сывороток крови сывороток крови, полученных от экспериментально зараженных животных и сывороток крови свиней, охарактеризованных референтными методами в соответствии со стандартами OIE (иммуноблоттинг. реакция непрямой иммунофлуорес-ценции. РИФ) [10] .
При исследовании в системе "АЧС-CEPOTECT/INGEZIM РРА СОМРАС" 120 сывороток, показавших негативный результат методами непрямого ИФА и иммуноблоттинга. АЧС-позитивных 21 сывороток не выявлено, т.е. специфичность тест-системы составила 100%.
23 сыворотки, положительные в непрямом ИФА, но отрицательные в иммуноблоттинге были определены как отрицательные. Поскольку иммуноблоттинг является официальным референтным методом по рекомендации OIE. специфичность системы "АЧС-CEPOTECT/INGEZIM РРА СОМРАС" в данном случае также составляет 100%.
30 сильноположительных в непрямом ИФА и иммуноблоттинге сывороток и 5 слабоположительных в непрямом ИФА и сильноположительных в иммуноблоттинге сывороток определены как положительные, т.е. чувствительность системы составила 100%.
Тест-система не выявила перекрестных реакций с антителами к вирусам болезни Ауески. болезни Тешена. КЧС и РРСС.
Диагностическая чувствительность системы была определена при исследовании сывороток свиней, экспериментально зараженных вирулентным штаммом вируса АЧС Ug03H (табл. 1) и слабовирулентными штаммами Е75 и Е70 (табл. 2).
Таблица 1. Результаты анализа сывороток крови свиней после экспериментального заражения штаммом Ug03H в системе "АЧС-CEPOTECT/INGEZIM РРА СОМРАС
Читайте также:
- Можно ли заразиться ветрянкой если уже есть вирус герпесе
- Новый вирус посылки из китая
- Что можно кушать после гепатита а и почему без физических нагрузок
- Вирусный гепатит хронический бронхит
- Здоровье лечение гриппа простуды
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции

