Вируса гриппа in vitro
Аннотация научной статьи по ветеринарным наукам, автор научной работы — Шишкина Л. Н., Небольсин В. Е., Кабанов А. С., Скарнович М. О., Эрдынеева У. Б.
Ингавирин® эффективно ингибирует размножение штаммов вируса гриппа A/California/04/2009 (H1N1)v, A/California/07/2009 (H1N1)v, A/Moscow/225/2009 (H1N1)v, A/Moscow/226/2009 (H1N1)v, а также штаммов A/Chicken/Kurgan/05/2005 (H5N1) и A/Aichi/2/68 (H3N2) в культуре клеток MDCK. При внесении Ингавирина® in vitro снижается гемагглютинирующая и цитопатическая активность этих штаммов вируса гриппа.
Похожие темы научных работ по ветеринарным наукам , автор научной работы — Шишкина Л. Н., Небольсин В. Е., Кабанов А. С., Скарнович М. О., Эрдынеева У. Б.
In vitro Efficacy of Ingavirin® against the Pandemic Influenza Virus A(H1N1/09)v
Ingavirin® was shown to be efficient in inhibition of the influenza virus strains A/California/04/2009 (H1N1)v, A/California/07/2009 (H1N1)v, A/Moscow/225/2009 (H1N1)v and A/Moscow/226/2009 (H1N1)v, as well as the strains A/Chicken/Kurgan/05/2005 (H5N1) and A/Aichi/2/68 (H3N2) in the MDCK cell culture. The hemagglutinin and cytopathic activity of the influenza virus strains decreased at entering Ingavirin® in vitro.
Изучение эффективности Ингавирина® in vitro в отношении штаммов пандемического вируса гриппа A(H1N1/09)v
Л. Н. ШИШКИНА1, В. Е. НЕБОЛЬСИН2, А. С. КАБАНОВ1, М. О. СКАРНОВИЧ1, У. Б. ЭРДЫНЕЕВА1,
Н. А. МАЗУРКОВА1, О. А. СЕРОВА1, Е. А. СТАВСКИЙ1, И. Г. ДРОЗДОВ1
In vitro Efficacy of Ingavirin® against the Pandemic Influenza Virus A(H1N1/09)v
L. N. SHISHKINA, V. E. NEBOLSIN, A. S. KABANOV, M. O. SKARNOVICH, U. B. ERDYNEEVA,
N. A. MAZURKOVA, O. A. SEROVA, E. A. STAVSKY, I. G. DROZDOV
State Research Centre of Virology and Biotechnology VECTOR, Koltsovo, Novosibirsk Region JSC Valenta Pharm, Moscow
Ингавирин® эффективно ингибирует размножение штаммов вируса гриппа A/California/04/2009 (H1N1)v, A/California/07/2009 (H1N1)v, A/Moscow/225/2009 (H1N1)v, A/Moscow/226/2009 (H1N1)v, а также штаммов A/Chicken/Kurgan/05/2005 (H5N1) и A/Aichi/2/68 (H3N2) в культуре клеток MDCK. При внесении Ингавирина® in vitro снижается гемагглютинирующая и цитопатическая активность этих штаммов вируса гриппа.
Ключевые слова: вирус гриппа A(H1N1/09)v, Ингавирин®, противовирусная активность.
Ingavirin® was shown to be efficient in inhibition of the influenza virus strains A/California/04/2009 (H1N1)v, A/California/07/2009 (H1N1)v, A/Moscow/225/2009 (H1N1)v and A/Moscow/226/2009 (H1N1)v, as well as the strains A/Chicken/Kurgan/05/2005 (H5N1) and A/Aichi/2/68 (H3N2) in the MDCK cell culture. The hemagglutinin and cytopathic activity of the influenza virus strains decreased at entering Ingavirin® in vitro.
Key words: influenza virus A(H1N1/09)v, Ingavirin®, antiviral activity.
В лаборатории Центра контроля за инфекционными заболеваниями (СБС, США) 15 апреля 2009 года у 10-летнего ребенка с клиническими признаками респираторного заболевания (лихорадка, кашель, рвота) был выделен новый вариант вируса гриппа А субтипа Н1Ш [1]. Было показано, что новый вариант возник в результате реассортации в геноме штаммов вируса гриппа свиней Евроазиатской линии и штаммов вируса гриппа свиней Североамериканской линии, которая возникла в конце 1990-х после тройной ре-ассортации субтипов Н1Ш, Н3Ш и НШ2 внутри классических свиных штаммов [2].
По данным ВОЗ, к началу ноября 2009 г. было зарегистрировано более 400000 лабораторно подтверждённых случаев заболевания пандемическим гриппом Н1Ш/09, из которых свыше 4740 случаев закончились смертельным исходом [3]. В январе-феврале 2010 г. активность пандемического гриппа НШ1/2009 в странах Европейского региона сохранялась, несмотря на тенденцию к снижению. Наи-
более высокой она оставалась в таких странах, как Грузия, Польша, Сербия и Украина, а также в отдельных регионах РФ. При этом всего с апреля 2009 г. в Европе сообщалось о 4057 случаях смерти, связанных с лабораторно подтверждённым инфицированием вирусом пандемического гриппа А(Н1Ш/09) [4]. Международный опыт в области лечения пандемического гриппа Н1Ш/09 показывает, что плохие клинические результаты связаны с поздним обращением за медицинской помощью и задержкой начала противовирусной терапии [3, 5].
Наряду с пандемией гриппа А(Н1Ш/09) в январе 2010 г. появились сообщения о случаях заболевания, связанных с инфицированием вирусом гриппа птиц в Египте. Они подтверждены Центральными лабораториями общественного здравоохранения Египта, Национальным центром по гриппу в рамках Глобальной сети ВОЗ по эпиднадзору за гриппом (СТ8М) [6]. Из 97 лабораторно подтверждённых случаев заболевания птичьим гриппом А(Н5Ш), зарегистрированных в Египте, 27 закончились смертельным исходом. Во всех случаях имелся контакт с больными и мёртвыми домашними птицами [6].
Существует четыре противовирусных препарата, которые рекомендованы ВОЗ для лечения гриппа: амантадин и римантадин (ингибиторы вирусного белка М2), осельтамивир и занамивир (ингибиторы вирусной нейраминидазы). Недавние исследования показали, что вирус гриппа A(H1N1/09)v, который был выявлен у людей, устойчив к амантадину и римантадину, в то же время этот вирус восприимчив к осельтамивиру и за-намивиру [7].
В связи с ежегодными эпидемиями гриппа, возможностью заражения людей вирусом гриппа животного происхождения и возникновением пандемии гриппа среди людей, остро встаёт вопрос о создании надёжных средств для его профилактики и лечения.
Целью настоящего исследования является изучение эффективности отечественного препарата Ингавирин® in vitro в отношении штаммов пандемического вируса гриппа A(H1N1) 2009 г., а также штаммов вируса гриппа A(H5N1) и A(H3N2).
Материал и методы
Клеточная культура. Для тестирования противовирусной активности препаратов использовали перевиваемую культуру клеток MDCK (клетки почки собаки). По 100 мкл суспензии клеток MDCK с концентрацией 1,0—1,5х105 кл/мл вносили в лунки 96-луночных планшетов. Планшеты с клетками помещали в термостат при температуре 37°C, 5% СО2 и 100% влажности на 1—2 сут до образования сплошного клеточного монослоя.
Инфицирование клеток MDCK вирусом гриппа. Готовили разведения исходных образцов вируса гриппа с 1-го по 7-е с десятикратным шагом с использованием среды MDCK StemAlpha (Франция), содержащей 2 мкг/мл трипсина TPCK (Sigma, СШA). По 50 мкл разведений вируса вносили в лунки с монослоем клеток MDCK (по 6 лунок на каждое разведение).
Адсорбцию вируса проводили в течение 1 ч при комнатной температуре. Затем в каждую лунку с инфицированными клетками MDCK вносили исследуемые препараты в объёме 50 мкл и по 50 мкл питательной среды MDCK StemAlpha с 2 мкг/мл трипсина TPCK.
В контрольные лунки с инфицированными клетками вносили по 100 мкл питательной среды MDCK StemAlpha с 2 мкг/мл трипсина TPCK. Клетки инкубировали 4 сут при температуре 37°C в атмосфере 5% СО2 в термостате ТС-1/80 СПУ (Россия).
Через 4 сут в каждой лунке регистрировали ЦПД в монослое клеток с помощью инвертированного микроскопа и наличие вируса в среде культивирования по реакции гемагглю-тинации (РГА) с 0,5% эритроцитами кур. На основании этого определяли титры вируса в ^ТЦД^/мл в контроле (ИД50 in vitro без препарата) и в опыте (ИД50 in vitro с препаратом) и высчитывали индекс нейтрализации (ИН) вируса под влиянием препарата: ИН = ИД50контроль — ИД50опыт (lg).
Далее определяли, могут ли препараты оказывать влияние на репродукцию и инфекционную активность вируса гриппа. С этой целью собирали культуральную жидкость из одного или двух рядов лунок с клетками, инфицированными одним или двумя наибольшими разведениями вируса, т. е. его наименьшими дозами, при которых вирус был зарегистрирован по РГА в Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Индекс подавления продукции вируса in vitro (в lg)
A/Califomia/04/2009 (H1N1)v 2,0 1:32 4,0±0,6 1:16 1,5±0,0* 2,5
1,0 1:32 4,0±0,6 1:8* 1,5±0,0* 2,5
A/California/07/2009 (H1N1)v 1,7 1:512 7,5±0,0 1:256 6,5±0,8* 1,0
0,7 1:256 6,5±0,0 1:64* 5,3±0,8* 1,2
A/Moscow/225/09 (H1N1)v 1,3 1:32 2,5±0,0 1:32 2,5±0,0 0,0
0,3 1:32 2,5±0,0 1:16 1,5±0,0* 1,0
A/Moscow/226/09 (H1N1)v 2,5 1:16 3,0±0,6 1:16 2,3±0,5* 0,7
1,5 1:16 2,5±0,0 1:4* 1,8±0,5* 0,7
A/Chicken/Kurgan/ 05/2005 (H5N1) 2,0 1:256 6,0±0,6 1:64* 2,8±0,5* 3,2
1,0 1:256 6,0±0,6 1:64* 2,8±0,5* 3,2
A/Aichi/2/68 (H3N2) 2,3 1:256 5,5±0,0 1:32* 2,8±0,5* 2,7
1,3 1:256 5,0±0,6 1:16* 2,8±0,5* 2,2
Примечание. * - отличия от контроля при р=0,05.
Таблица 3. Инфекционность (50% инфицирующая доза — ИД50 в клетках МРСК) штаммов вируса гриппа
A(H1N1)v in vitro в контроле и при инкубировании с Ремантадином® через 4 сут после заражения
Штаммы вируса гриппа ИД50 штамма in vitro ИД50 штамма in vitro Индекс
в контроле при инкубировании с Ремантадином® нейтрализации
(в ^ТЦД50/мл, +I95) (в ^ТЦД;о/мл, ±195) (в lg)
A/Califomia/04/2009 (H1N1)v 4,3±0,4 4,1±0,4 0,2
A/California/07/2009 (H1N1)v 5,0±0,5 5,0±0,5 0,0
A/Moscow/225/09 (H1N1)v 5,6±0,3 5,6±0,3 0,0
A/Moscow/226/09 (H1N1)v 5,8±0,6 5,8±0,5 0,0
A/Chicken/Kurgan/05/2005 (H5N1) 7,3±0,7 5,1±0,4* 2,2*
A/Aichi/2/68 (H3N2) 7,6±0,7 5,6±0,7* 2,0*
Примечание. * - отличия от контроля по ИД50 при р=0,05.
зателям их инфекционности при титровании на клетках MDCK (табл. 2). Как следует из таблицы 2, индексы подавления продукции штаммов вируса гриппа под влиянием Ингавирина® in vitro колебались в диапазоне от 0,7 до 3,2 lg. При этом наиболее высокое значение индекса подавления продукции вируса in vitro наблюдалось при инкубировании Ингавирина® со штаммом вируса гриппа A/Chicken/Kurgan/ 05/2005 (H5N1) (табл. 2).
Показано, что при внесении Ремантадина® в клеточную культуру MDCK, инфицированную штаммами вируса гриппа, достоверно уменьша-
лась инфекционность только двух исследованных штаммов: А/СЫ1скеп/Кш^ап/05/2005 (Н5Ш) и А/А1еЫ/2/68 (Н3Ш) при достижении соответствующих индексов нейтрализации 2,2 и 2,0 (табл. 3). Как следует из таблицы 3, штаммы вируса гриппа А/СаШогта/04/2009 (НШ1)у, А/СаШогта/07/ 2009 (Н1Ш)у, А/Мо8^/225/09 (Н1Ш)у и A/Moscow/226/09 (Н1Ш)у не изменяли своей ин-фекционности в клеточной культуре МБСК при инкубировании с Ремантадином®.
Определение продукции вируса гриппа в лунках с клетками, инфицированными наиболее
Таблица 4. Показатели репродукции (титры) штаммов вируса гриппа A(H1N1)v в клетках MDCK в контроле и при инкубировании с Ремантадином® через 4 сут после заражения
Штаммы вируса гриппа Доза заражения штамма вируса гриппа в ^ТЦД50/ 50 мкл Репродукция штаммов вируса гриппа in vitro в контроле Титры Титры в в РГА ^ТЦД5о/мл, ±І95 Репродукция штаммов вируса гриппа in vitro при инкубировании с Ремантадином® Титры Титры в в РГА ^ТЦД5о/мл, ±І95 Индекс подавления продукции вируса in vitro (в lg)
A/Califomia/04/2009 (H1N1)v 2,0 1:32 4,0±0,6 1:32 4,0±0,6 0,0
1,0 1:32 4,0±0,6 1:32 3,8±0,5 0,2
A/California/07/2009 (H1N1)v 1,7 1:512 7,5±0,0 1:512 7,5±0,0 0,0
0,7 1:256 6,5±0,0 1:256 6,5±0,0 0,0
A/Moscow/225/09 (H1N1)v 1,3 1:32 2,5±0,0 1:32 2,5±0,0 0,0
0,3 1:32 2,0±0,6 1:32 2,0±0,6 0,0
A/Moscow/226/09 (H1N1)v 2,5 1:16 3,0±0,6 1:16 3,0±0,6 0,0
1,5 1:16 2,5±0,0 1:16 2,3±0,5 0,2
A/Chicken/Kurgan/ 05/2005 (H5N1) 3,0 1:256 6,3±0,5 1:64* 4,8±0,5* 1,5
2,0 1:256 6,0±0,6 1:32* 4,3±0,5* 1,7
A/Aichi/2/68 (H3N2) 2,3 1:256 5,5±0,0 1:64* 4,3±0,5* 1,2
1,3 1:256 5,0±0,6 1:32* 4,1±0,4* 0,9
Примечание. * - отличия от Контроля при р=0,05.
низкими дозами штаммов вируса гриппа, при которых наблюдалась РГА в Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
1. Dawood F. S., Jain S., Finelli L. et al. Emergence of a novel swine-ori-gin influenza A (H1N1) virus in humans. Novel Swine-Origin Influenza A (H1N1) Virus Investigation Team. New Engl J Med 2009; 360: 2605—2615.
2. Zimmer S. M, Burke D. S. Historical perspective — emergence of influenza A (H1N1) viruses. N Engl J Med 2009; 361: 279—285.
8. Вирусология. Методы. Пер. с англ. Мейхи Б. М.: 1988; 344.
9. Закс Л. Статистическое оценивание. М.: 1976; 598.
10. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / Под ред. Хабриева Р. У.
13. Семенова Н. П., Прокудина Е. Н., Львов Д. К., Небольсин В. Е. Влияние противовирусного препарата Ингавирин® на внутриклеточные преобразования и импорт в ядро нуклеокапсидного белка (NP) вируса гриппа. Вопр вирусол 2010 (в печати).

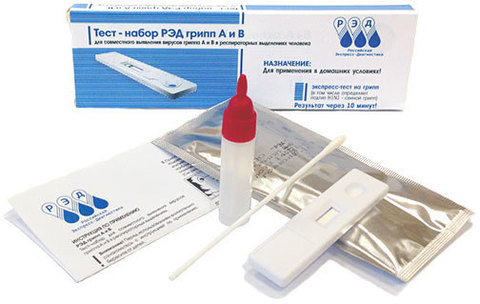
- Форма выпуска: вариант 1: индивидуальная упаковка / 1 исследование; вариант 2: набор / 10 исследований
- Назначение: тест иммунохроматографический для выявления вирусов гриппа А и В в респираторных выделениях
Инструкция по применению
Регистрационное удостоверение: №ФСР 2012/13624 от 29.06.2012
Возбудителем гриппа является вирус, который поражает, главным образом, верхние дыхательные пути – нос, горло, бронхи, реже – лёгкие. Заболевание обычно длится одну-две недели и характеризуется высокой температурой, миалгией, головной болью, недомоганием, сухим кашлем, болью в горле и ринитом.
Для детей, пожилых людей и людей, страдающих заболеваниями лёгких, почек, сердца, диабетом, раком, грипп представляет серьёзную опасность. Эта инфекция может вызвать осложнения основных заболеваний, пневмонию и смерть.
Заболевание человека вызывают, как правило, два типа гриппа – тип А (подтипы H3N2 и H1N1) и тип В. Причиной смертей от гриппа чаще всего является вирус А подтипа H3N2.
Определение основано на принципе иммунохроматографического анализа. Анализируемый образец жидкого биологического материала абсорбируется поглощающим участком тест-полоски. При наличии в образце вируса гриппа А и/или вируса гриппа В они вступают в реакцию с нанесенными на стартовую зону специфическими моноклональными антителами против вируса гриппа А и специфическими моноклональными антителами против вируса гриппа B, меченными окрашенными частицами, и продолжают движение с током жидкости. В соответствующих аналитических зонах тест-полоски происходит взаимодействие со специфическими моноклональными антителами против вируса гриппа А и/или вируса гриппа В, иммобилизованными на поверхности мембраны, с образованием окрашенных иммунных комплексов.
В контрольной зоне тест-полоски специфический окрашенный иммунный комплекс образуется независимо от наличия в тестируемом биологическом материале вируса гриппа А и/или вируса гриппа В.
В том случае, если в анализируемом образце присутствует вирус гриппа А и вирус гриппа В, на тест-полоске образуются три параллельные окрашенные линии (красная и синяя аналитические, обозначенные буквой Т, и зеленая контрольная, обозначенная буквой С), что указывает на положительный результат анализа по вирусам обоих типов. В случае отсутствия в анализируемом образце вируса гриппа А и вируса гриппа В на тест-полоске образуется одна зелёная контрольная линия (С), что указывает на отрицательный результат анализа по вирусам обоих типов.
Кассеты с тест-полосками и одноразовые пластиковые пипетки упакованы в индивидуальные вакуумные упаковки из фольги алюминиевой, содержащие пакетики с силика-гелем.
- одноразовые резиновые или пластиковые перчатки;
- часы или таймер.
Использованные тесты и остатки биологического материала должны быть помещены в специальный контейнер для санитарных отходов.
Свежесобранный биологический материал (респираторные выделения из носовой полости человека), не содержащий консерванты.
Образцы респираторных выделений до определения можно хранить при температуре 2–4°С не более 8 ч.
Перед анализом образцы респираторных выделений должны быть доведены до комнатной температуры.
1. Ввести стерильный ватный тампон на зонде приблизительно на 3 см в одну ноздрю и, вращая его, взять мазок со стенок носового хода (рис. 1-1).
2. Внести в одноразовую пластиковую пробирку из флакона с крышкой-капельницей 15 капель буфера для растворения образца (рис. 1-2).
 |  |  |
| 1. Взять мазок со стенок носового хода | 2. Внести 15 капель раствора для образца | 3. Вращать тампон в пробирке, выжать жидкость |
3. Поместить тампон с образцом в пробирку, смыть образец, вращая тампон по стенкам пробирки минимум 10 раз. Выдавить жидкость из тампона, сдавливая его стенками пробирки (рис. 1-3). Выбросить тампон.
 |  |
| 1 | 2 |
6. Через 10 мин визуально оценить результат реакции.
Выявление в тестовом окошке кассеты одной зеленой контрольной линии (С) свидетельствует об отрицательном результате анализа по обоим типам вируса, т.е. указывает на отсутствие в анализируемом образце респираторных выделений вирусов гриппа А и В (рис. 3-1).


Выявление в тестовом окошке кассеты трёх параллельных окрашенных линий (зеленой, красной и синей) свидетельствует о положительном результате анализа по обоим типам вируса, т.е. указывает на наличие в анализируемом образце респираторных выделений вирусов гриппа А и В (рис. 3-2). Выявление в тестовом окошке кассеты двух параллельных окрашенных линий (зеленой и красной) свидетельствует о положительном результате анализа по вирусу гриппа А, т.е. указывает на наличие в анализируемом образце респираторных выделений вируса гриппа А и отсутствие вируса гриппа В (рис. 3-3). Выявление в тестовом окошке кассеты двух параллельных окрашенных линий (зеленой и синей) свидетельствует о положительном результате анализа по вирусу гриппа В, т.е. указывает на наличие в анализируемом образце респираторных выделений вируса гриппа В и отсутствие вируса гриппа А (рис. 3-4). Интенсивность окраски красной и синей аналитических линии может меняться в зависимости от концентраций, соответственно, вируса гриппа А и вируса гриппа В в образце.

ного выявления вируса гриппа А и/или вируса гриппа В в респираторных выделениях человека.
Возбудителем гриппа является вирус, который поражает, главным образом, верхние
дыхательные пути – нос, горло, бронхи, реже – легкие. Заболевание обычно длится од- ну-две недели и характеризуется высокой температурой, миалгией, головной болью, не- домоганием, сухим кашлем, болью в горле и ринитом.
Для детей, пожилых людей и людей, страдающих заболеваниями легких, почек, серд- ца, диабетом, раком, грипп представляет серьезную опасность. Эта инфекция может вы- звать осложнения основных заболеваний, пневмонию и смерть. Заболевание человека вызывают, как правило, два типа гриппа – тип А (подтипы H3N2 и H1N1) и тип В. Причиной смертей от гриппа чаще всего является вирус А подтипа H3N2.
Определение основано на принципе иммунохроматографического анализа. Анализи-
руемый образец жидкого биологического материала абсорбируется поглощающим участ-
ком тест-полоски. При наличии в образце вируса гриппа А и/или вируса гриппа В они
вступают в реакцию с нанесенными на стартовую зону специфическими моноклональны-
ми антителами против вируса гриппа А и специфическими моноклональными антителами
против вируса гриппа B, меченными окрашенными частицами, и продолжают движение с
током жидкости. В соответствующих аналитических зонах тест-полоски происходит вза-
имодействие со специфическими моноклональными антителами против вируса гриппа А
и/или вируса гриппа В, иммобилизованными на поверхности мембраны, с образованием
окрашенных иммунных комплексов.
В контрольной зоне тест-полоски специфический окрашенный иммунный комплекс
образуется независимо от наличия в тестируемом биологическом материале вируса грип- па А и/или вируса гриппа В.
В том случае, если в анализируемом образце присутствует вирус гриппа А и вирус грип-
па В, на тест-полоске образуются три параллельные окрашенные линии (красная и синяя
аналитические, обозначенные буквой Т, и зеленая контрольная, обозначенная буквой С),
что указывает на положительный результат анализа по вирусам обоих типов. В случае от-
сутствия в анализируемом образце вируса гриппа А и вируса гриппа В на тест-полоске об-
разуется одна зеленая контрольная линия (С), что указывает на отрицательный результат
анализа по вирусам обоих типов.
из пластика белого цвета – 1 шт.;
• флакон с крышкой-капельницей, содержащий буфер для растворения образца –
• одноразовые пластиковые пробирки – 1 шт.,
• стерильные ватные тампоны на зонде – 1 шт.,
• одноразовые пластиковые пипетки – 1 шт.,
• этикетки на клеевой основе для маркировки пробирок пользователем – 1 шт.,
Кассеты с тест-полосками и одноразовые пластиковые пипетки упакованы в индиви-
дуальные вакуумные упаковки из фольги алюминиевой, содержащие пакетики с силика-гелем.
НЕОБХОДИМЫЕ ОБОРУДОВАНИЕ И МАТЕРИАЛЫ,
НЕ ВХОДЯЩИЕ В СОСТАВ НАБОРА
• одноразовые резиновые или пластиковые перчатки;
• часы или таймер.
и 99% по вирусу типа В.
по вирусу типа В.
• Время проведения анализа – 10 мин.
гриппа А и/или вируса гриппа В в респираторных выделениях человека.
При проведении определения следует надевать одноразовые резиновые или пластико-
вые перчатки, т.к. исследуемые образцы биологического материала следует рассматривать
как потенциально инфицированные.
Использованные тесты и остатки биологического материала должны быть помещены
в специальный контейнер для санитарных отходов.
Свежесобранный биологический материал (респираторные выделения из носовой по-
лости человека), не содержащий консерванты.
Образцы респираторных выделений до определения можно хранить при температуре
2–4°С не более 8 ч.
Перед анализом образцы респираторных выделений должны быть доведены
Полный текст:
младший научный сотрудник лаборатории гибридных клеточных культур отдела вирусологии ФГБНУ НИИВС им. И.И. Мечникова РАМН, Москва, Россия;
д.м.н., доцент, зав. лабораторией гибридных клеточных культур отдела вирусологии ФГБНУ НИИВС им. И.И. Мечникова РАМН, Москва, Россия;
к.б.н., ведущий научный сотрудник лаборатории гибридных клеточных культур отдела вирусологии ФГБНУ НИИВС им. И.И. Мечникова РАМН, Москва, Россия;
к.м.н., зав. лабораторией иммунологии ФГБУ НЦЭСМП МЗ РФ, Москва, Россия;
младший научный сотрудник лаборатории гибридных клеточных культур отдела вирусологии ФГБНУ НИИВС им. И.И. Мечникова РАМН, Москва, Россия;
к.м.н., доцент, ведущий научный сотрудник лаборатории гибридных клеточных культур отдела вирусологии ФГБНУ НИИВС им. И.И. Мечникова РАМН, Москва, Россия;
научный сотрудник лаборатории синтеза иммуноглобулинов ФГБНУ НИИВС им. И.И. Мечникова РАМН, Москва, Россия
1. Баркова Е.П., Вдовина Е.Т., Нагиева Ф.Г., Ющук Н.В., Знойко О.О., Никулина В.Г., Воробьев А.С. Функциональная активность интерфероновых рецепторов мононуклеаров периферической крови пациентов с вирусными гепатитами // Биопрепараты. 2001. № 4. С. 18–21. [Barkova E.P., Vdovina E.T., Nagieva F.G., Ushuk N.V., Znoiko O.O., Nikulina V.G., Vorobev A.S. Functional activity (capacity) interferon receptors peripheral blood mononuclear cells of patients with viral hepatitis. Biopreparaty = Biopharmaceuticals, 2001, no. 4, pp. 18–21. (In Russ.)]
2. Баркова Е.П., Нагиева Ф.Г., Кузнецов В.П., Беляев Д.Л., Никулина В.Г., Бабаянц А.А., Крель П.Е., Анджапаридзе О.Г. Экспрессия рецепторов для человеческих интерферонов альфа и гамма на поверхности мононуклеарных клеток периферической крови при некоторых вирусных инфекциях // Вопросы вирусологии. 1998. Т. 43, № 6. С. 16–18. [Barkova E.P., Nagieva F.G., Kuznetsov V.P., Belyaev D.L., Nikulina V.G., Babayans A.A., Krel P.E., Andgaparidze O.G. Expression receptors to human alpha and gamma interferon on surface of peripheral blood mononuclear cells in some virus infections. Voprosy virusologii = Problems of Virology, 1998, vol. 43, no. 6, pp. 16–18. (In Russ.)]
3. Лимфоциты. Методы / Под. ред. Дж. Клаус. М.: Мир, 1990. 395 с. [Limfotsity. Metody. [Lymphocytes. Methods / Ed. Klaus G.]. Moscow: Mir, 1990, 395 p. (In Russ.)]
4. Cоловьев В.Д., Бектемиров Т.А. Интерфероны в теории и практике медицины. М.: Медицина, 1981. 283 с. [Solovev V.D., Bektemirov T.A. Interferony v teorii i praktike meditsiny [Interferons in theory and practice in medicine]. Moscow: Meditsina, 1981. 283 p. (In Russ.)]
5. Mizukoshi E., Kaneko S., Yanagi M., Ohno H., Kaji K., Terasaki S., Shimoda A., Matsushita E., Kobayashi K. Expression of interferon alpha/beta receptor in the liver of chronic hepatitis C patients. J. Med. Virol., 1998, vol. 56, no. 3, pp. 217–223.
6. Reik L.M., Maines S.L., Ryan D.E., Levin W., Bandiera S., Thomas P.E. A simple, non-chromatographic purification procedure for monoclonal antibodies. Isolation of monoclonal antibodies against cytochrome P450 isozymes. J. Immunol. Methods, 1987, vol. 100, no. 1–2, pp. 123–130.
7. Ren J., Liu T., Pang L., Li K., Garofalo R.P., Casola A., Bao X. A novel mechanism for the inhibition of interferon regulatory factor-3-dependent gene expression by human respiratory syncytial virus NS1 protein. J. Gen. Virol., 2011, 92 (Pt. 9), pp. 2153–2159. doi: 10.1099/vir.0.032987-0
8. Skurkovich S.V., Eremkina E.I. The probable role of interferon in allergy. Ann. Allergy, 1975, vol. 35, no. 6, pp. 356–360.
9. Woo H.M., Kim K.S., Lee J.M., Shim H.S., Cho S.J., Lee W.K., Ko H.W., Keum Y.S., Kim S.Y., Pathinayake P., Kim C.J., Jeong Y.J. Single-stranded DNA aptamer that specifically binds to the influenza virus NS1 protein suppresses interferonantagonism. Antiviral Res., 2013, vol. 100, no. 2, pp. 337–345. doi:10.1016/j.antiviral.2013.09.004.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Полный текст:
123098, Россия, Москва, ул. Гамалеи, 18.
123098, Россия, Москва, ул. Гамалеи, 18.
123098, Россия, Москва, ул. Гамалеи, 18.
123098, Россия, Москва, ул. Гамалеи, 18.
123098, Россия, Москва, ул. Гамалеи, 18.
1. Киселев О.И. Геном пандемического вируса гриппа А/H1N1v-2009. СПб. – М.: Димитрейд Гра- фик групп, 2011. [Kiselev O.I. Genome of pandemic influenza A/H1N1v-2009virus]. St. Petersburg – Moscow: Dimitreid Graphic group, 2011.
2. Львов Д.К., Бурцева Е.И., Прилипов А.Г., Базарова М.В., Колобухина Л.В., Меркулова Л.Н., Малы- шев Н.А., Дерябин П.Г., Федякина И.Т., Садыкова Г.К., Усачев Е.В., Щелканов М.Ю., Шевченко Е.С., Тру- шакова С.В, Иванова В.Т., Белякова Н.В., Оскерко Т.А., Алипер Т.И. Изоляция 24.05.09 и депонирование в государственную коллекцию вирусов (ГКВ 2452 от 24.05.09) первого штамма A/IIV-Moscow/01/09 (H1N1) sw1, подобного свиному вирусу А(H1N1) от первого выявленного 24.05.09 больного в Москве // Вопросы вирусологии, 2009. Т. 54, № 5. С.10-14. [Lvov D.K., Burtseva E.I., Prilipov A.G., Bazarova M.V., Kolobukhina L.V., Malyshev N.A. et al. The 24 May, 2009 isolation of the first A/IIV-Moscow/01/2009(H1N1)sw1 strain similar to swine A(H1N1) influenza virus from the first Moscow case detected on May 21, 2009, and its deposit in the State Collection of Viruses (SCV No.2452 dated May 24, 2009. Voprosy virusologii = Problems of Virology, 2009, Vol. 54, no. 5, pp. 10-14. (In Russ.)]
3. Львов Д.К., Бурцева Е.И., Щелканов М.Ю., Прилипов А.Г., Колобухина Л.В., Малышев Н.А. и др. Распространение нового пандемического вируса гриппа А(H1N1)v в России // Вопросы вирусологии, 2010. Т. 55, № 3. С. 4-9. [Lvov D.K., Burtseva E.I., Shchelkanov M.Yu., Prilipov A.G., Kolobukhina L.V., Malyshev N.A. et al. Spread of new pandemic influenza A (H1N1)v virus in Russia. Voprosy virusologii = Problems of Virology, 2010, Vol. 55, no. 3, pp. 4-9. (In Russ.)]
4. Соколова Т.М., Шувалов А.Н., Шаповал И.М., Соколова З.А., Ершов Ф.И. Активация генов сиг- нальных путей иммунитета: различная индивидуальная чувствительность клеток крови человека к пре- паратам интерферонов и индукторов IFN // Медицинская иммунология, 2015. № 1. С. 7-18. [Sokolova T.M., Shuvalov A.N., Shapoval I.M., Sokolova Z.A., Ershov F.I. Activation of genes controlling the immune signaling pathways: differential individual stysitivity of human blood cells for interferon preparations and IFN inducers. Meditsinskaya immynologiya = Medical Immunology (Russia), 2015, no. 1, pp. 7-18. (In Russ.)] doi: 10.15789/1563-0625-2015-1-7-18.
6. Соколова Т.М., Шувалов А.Н., Полосков В.В. Действие рекомбинантного альфа-2 интерферона на ви- рус гриппа H1N1(Москва 2009): активность генов врожденного и адаптивного иммунитета и воспалитель- ных цитокинов // Евразийский Союз Ученых (ЕСУ) 2015. № 17, Ч. 2. С. 49-52. [Sokolova T.M., Shuvalov A.N., Poloskov V.V. Action of recombinant alpha-2 interferon the influenza virus H1N1 (Moscow 2009): activity of genes innate and adaptive immunity and inflammatory cytokines. Evraziyskiy Soyuz Uchenykh (ESU) = Eurasion Union of Scientists (EUS), 2015, no. 17, Pt 2, pp. 49-52. (In Russ.)]
8. Тимофеева Т.А., Игнатьева А.В., Руднева И.А., Мочалова Л.В., Бовин И.В., Каверин Р.В. Влияние мутаций, меняющих антигенную специфичность, на рецептор связывающую активность гемагглютинина вирусов гриппа А подтипов H1 и H5 // Вопросы вирусологии, 2013. T. 58, № 1. C. 24-27. [Timofeeva T.A., Ignatieva A.V., Rudneva I.A., Mochlova L.V., Bovin N.V., Kaverin N.V. Effect of mutations changing the antigenic specificity on the receptor-binding activity of the influenza virus hemagglutinin of H1 and H5. Voprosy virusologii = Problems of Virology, 2013, Vol. 58, no. 1, pp. 24-27. (In Russ.)]
9. Akagawa K.S., Komuro I., Kanazawa H., Yamazaki T., Mochida K., Kishi F. Functional heterogeneity of colony-stimulating factor-induced human monocyte-derived macrophages. Respirology, Vol. 2006, no. 11, S32-S36.
10. Broughton S.E., Dhagat U., Hercus T.R., Nero T.L., Grimbaldeston M.A., Bonder C.S., Lopez A.F., Parker M.W. The GM-CSF/IL-3/IL-5 cytokine receptor family: from ligand recognition to initiation of signaling. Immunological Reviews, 2012, Vol. 250, pp. 277-202.
11. Daigneault M., Preston J.A., Marriott H.M., Whyte M.K.B., Dockrell D.H. The identification of markers of macrophage differentiation in PMA-stimulated THP-1 cells and monocyte-derived macrophages. PLoS ONE, 2010, Vol. 9, no.1, e8668. doi: 10.1371/journal.pone.0008668.
12. Fouchier R.A.M., Bestebroer T.M., Herst S., van der Kemp L., Rimmerlzwaan G.F., Osterhaus A.D.M.E. Detection of influenza A viruses from different species by PCR amplification of conserved sequences in the matrix gene. J. Clinical Microbiology, 2000, Vol. 38, no. 11, pp. 4096-4101.
13. Geiler J., Michaelis M., Sithisarn Р., Cinatl Jr. Comparison of pro-inflammatory cytokine expression and cellular signal transduction in human macrophages infected with different influenza A viruses. Med. Microbiol. Immunol., 2011, Vol. 200, pp. 53-60.
14. Hoeve M.A., Nash A.A., Jackson D., Randall R.E., Dransfield I. Influenza virus A infection of human monocyte and macrophage subpopulations reveals increased susceptibility associated with cell differentiation. PLoS ONE, 2012, Vol. 7, no. 1, e29443. doi: 10.1371/journal.pone.0029443
15. Janguin M., Houlbert N., Fardel O., Lecureur V. Polarization profiles of human M-CSF-generated macrоphages and comparison of M1-markers in classically activated macrophages from GM-CSF and M-CSF origin. Cell Immunol., 2013, Vol. 281, pp. 51-61.
16. Juhas U., Ryba-Stanislawowska M., Szargiej P., Mysliwska J. Different pathways of macrophage activation and polarization. Postery Hig Med Dosw. (online), 2015, Vol. 69, pp. 496-502.
17. Khan K., Arino J., Hu W., Raposo P., Sears J., Calderon F., Heidebrecht C., Macdonald M., Liauw J., Chan A., Gardam M. Spread of a novel influenza A (H1N1) virus via global airline transportation. N. Engl. J. Med., 2009, Vol. 361, no. 2, pp. 212-214.
18. Koyama S., Ishii K.J., Kumar H., Tanimoto T., Coban C., Uematsu S., Kawai T., Akira S. Differential role of TLR- and RLR-signaling in the immune responses to influenza A virus infection and vaccination. J. Immunol., 2007, Vol. 179, no. 7, pp. 4711-4720.
19. Lee N., Wong C.K., Hui D.S., Lee S.K., Wong R.Y., Ngai K.L., Chan M.C., Chu Y.J., Ho A.W., Lui G.C., Wong B.C., Wong S.H., Yip S.P., Chan P.K. Role of human Toll-like receptors in naturally occurring influenza A infections. Influenza and Other Respiratory Viruses, 2013, Vol. 7, no. 5, pp. 666-675.
20. Li J. Нu S., Zhou L., Ye L., Wang X., HoJ., Ho W. Interferon lambda inhibits herpes simplex virus type 1 infection of human astrocytes and neurons. Glia, 2011, Vol. 59, no. 1, pp. 58-67.
21. Liu Y., Chen H., Sun Y., Chen F. Antiviral role of Toll-like receptors and cytokines against the new 2009 H1N1 virus infection. Mol. Biol. Rep., 2012, Vol. 39, no. 2, pp. 1162-1172.
22. Londrigan S.L., Tate M.D., Brooks A.G., Reading P.C. Cell – surface receptors on macrophages and dendritic cells for attachment and entry of influenza virus. J. Leukocyte Biology, 2012, Vol. 92, pp. 97-106.
23. Loregian A., Mercorelli B., Nannetti G., Compagnin G., Palu G. Antiviral strategies against influenza virus: towards new therapeutic approaches. Cell. Mol. Life Sci., 2014, Vol. 71, no. 19, pp. 3659-3683.
24. Osterlund P., Pirhonen J., Ikonen N., Rönkkö E., Strengell M., Mäkelä S.M., Broman M., Hamming O.J., Hartmann R., Ziegler T., Julkunen I. Pandemic H1N1 2009 influenza A virus induces weak cytokine responses in human macrophages and dendritic cells and is highly sensitive to the antiviral actions of interferons. J. Virology, 2010, Vol. 84, no. 3, pp. 1414-1422.
25. Pulendran B., Maddur M.S. Innate Immune Sensing and Response to Influenza. Curr. Top. Microbiol. Immunol., 2015, Vol. 386, pp. 23-71.
26. Sadeghi K., Wisgrill L., Wessely I., Diesner S.C., Schuller S., Durr C., Heinle A., Sachet M., Pollak A., Forster-Waldl E., Spittler A. GM-CSF Down-Regulates TLR Expression via the Transcription Factor PU.1 in Human Monocytes. PLoS ONE, 2016, Vol. 11, no. 10, e0162667. doi: 10.1371/journal.pone.0162667.
27. Sakabe S., Iwatsuki-Horimoto K., Takano R., Nidom C.A., Le M., Nagamura-Inoue T., Horimoto T., Yamashita N., Kawaoka Y. Cytokine production by primary human macrophages infected with highly pathogenic H5N1 or pandemic H1N1 2009 influenza viruses. J. General Virology, 2011, Vol. 92, pp. 1428-1434.
28. Short K.R., Brooks A.G., Reading P.C., Londrigan S.L. The fate of influenza A virus infection of human macrophages and dendritic cells. J. General Virology, 2012, Vol. 93, pp. 2315-2325.
29. Suki M.Y. Lee, Kokc K.-H., Jaumea M., Cheung T.K.W., Yipa T.-F., Laia J.C.C., Guanb Y., Websterd R.G. Toll-like receptor 10 is involved in induction of innate immune responses to influenza virus infection. PNAS, 2014, Vol. 111, no. 10 , pp. 3793-3798.
30. van Riel D., Leijten L.M., van der Eerden M., Hoogsteden H.C., Boven L.A., Lambrecht B.N., Osterhaus A.D., Kuiken T. Highly pathogenic avian influenza virus H5N1 infects alveolar macrophages without virus production or excessive TNF-alpha induction. PLoS Pathog., 2011, Vol. 7, e1002099. doi: 10.1371/journal.ppat.1002099.
31. Viswanathan K., Chandrasekaran A., Srinivasan A., Raman R., Sasisekharan V., Sasisekharan R. Glycans as receptors for influenza pathogenesis. Glycoconj J., 2010, Vol. 27, pp. 561-570.
32. Weber M., Gawanbacht A., Habjan M., Rang A., Borner C., Schmidt A.M., Veitinger S., Jacob R., Devignot S., Kochs G., Garcia-Sastre A., Weber F. Incoming RNA virus nucleocapsids containing a 5-triphosphorylated genome activate RIG-I and antiviral signaling. Cell Host Microbe, 2013, Vol. 13, pp. 336-346.
33. Yang H., We J., Zhang H., Lin L., Zhang W., He S. Upregulation of Toll-like receptor (TLR) expression and release of cytokines from P815 mast cells by GM-CSF. BMC Cell Biology, 2009, Vol. 10, pp. 1-10.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Читайте также:


