Вирус бактериофага кем был открыт
Разделы: Биология
- Познакомить учащихся с неклеточными формами жизни.
- Сформировать у учащихся представление о внутриклеточных паразитах, механизмах проникновения и воздействия вирусов на клетку хозяина
- Профилактика и меры борьбы с вирусами, вызывающими болезни растений, животных, человека.
Правильно ли будет сказать, что все живое имеет клеточное строение? (нет)
Есть живые организмы, которые не имеют клеточного строения- это вирусы. Часто у вирусов годами нельзя обнаружить никаких признаков жизни. Они возникают тогда, когда вирус попадает в достаточно восприимчивую клетку и заражает её. Сегодня мы изучаем тему: (запись темы)
- Выступает ученик 10 А класса Никитенко Кирилл. Он расскажет об истории открытия вирусов.
Выступление 5 минут.
Учитель: Прослушав выступление об истории открытия вируса, ответьте на вопрос: когда и кем был открыт вирус?
Работа в тетради: вирусы открыты в 1892г. Ивановским Д.И., который стал основателем биологической дисциплины- вирусологии.
Вирусы- неклеточные формы жизни. Они являются паразитами, могут функционировать только внутри одно- или многоклеточных организмов. Их невозможно, в отличии от клеток выращивать на искусственных питательных средах, вирусы имеют чрезвычайно малые размеры, проходят через бактериофильтры.
Капсид- белковая оболочка вируса.
Каждый вирус является частичный ДНК или РНК, заключенный в белковую оболочку капсид.
На доске вывешана таблица о вирусах.
- Проникновение вируса в клетку предшествует связывание его с особым белком-рецептором, находящемся на поверхности клетки.
- Собственно размножение вируса выражается в редупликации вирусного генома с помощью соответствующих ферментов, закодированных в геноме вируса.
- Синтез вирусных белков и самосборка капсида.
- Вновь образовавшиеся вирусные частицы покидают клетку, при этом поражают другие клетки.
Демонстрация таблицы: типы вирусной инфекции.
- Выступление учащихся о вирусных заболеваниях. Выступления по 5 минут.
- Корь- выступает 1 ученик.
- Краснуха- выступает 2 ученик.
- Оспа- выступает 3 ученик.
- Бешенство- выступает 4 ученик
- Энцефалит- выступает 5 ученик.
- СПИД- выступает 6 ученик.
Демонстрация таблицы №2.
Для получения информации о вирусных заболеваниях, учащиеся использовали дополнительную литературу (медицинская энциклопедия, справочники врача).
- Итоги урока: выставляются отметки выступающим и художнику.
Тестовые задания собираются для проверки.
- Стихотворение о вирусах и тайнах третьего царства. Читают два ученика.
Стихотворение о вирусах или тайны третьего царства:
Когда-то, миллионы лет назад,
На нашей замечательной планете
Возникла жизнь, и начался парад
Невиданных существ на этом свете.
Бактерии, простейшие, грибы,
Не счесть червей, и так от века к веку
Жизнь становилась гуще и сложней
И, наконец, дошла до человека.
Все хорошо! Но, видимо, Природа
Иль просчиталась где, иль что недоучла,
Но в этой распрекрасной бочке меда
И ложку дегтя нам преподнесла!
Иль существа, а может, вещества
Об этом долгий спор не утихает,
Но вирусы- и все об этом знают
Среди других живут и процветают
Печальная реальность такова!
Грозит нам СПИД- себя как уберечь?!
И птичий грипп откуда-то вдруг взялся!
Как сделать, чтобы затупился меч,
А щит непробиваемым остался!
Оглянемся назад!
Природа словно в прятки
Играет с человеческой судьбой
И любит нам загадывать загадки
Одну сложней загадку за другой!
Как будто бы на прочность испытанье
Проходит у Природы род людской,
И рассыпает щедрою рукой
Она на человечество страданья.
И наблюдает, не спуская глаз,
А выживет ли он на этот раз?!
Но выжил, победил чуму и оспу,
Холеру и дифтерию победил,
И жизни нить достойно утвердил,
Хоть было это и совсем, совсем не просто!
Столетьями, приумножая знанья,
От века к веку становясь мудрей,
Поднялся человек до пониманья,
Предназначенья миссии своей.
Она проста! Мы жить с Природой в мире
Обязаны, ее не покорять,
А лишь познаний горизонты шире
В сотрудничестве с нею раздвигать!
Перед нами нынче XXI век,
Свои проблемы и свои невзгоды.
Пусть будет мудр и славен человек
Разумное творение Природы!
- Задание на дом §20.
Задание: из перечня 1- 17 выберите правильные ответы на вопросы и зашифруйте их:
- Алкоголизм
- Бешенство.
- Малярия.
- Ангина.
- Грипп.
- Туберкулез.
- Скарлатина.
- Наркомания.
- Фагоцитоз.
- СПИД.
- Сифилис.
- Рак печени
- Чума.
- Энцефалит.
- Прививки.
- Образование антител
- Иммунитет.
- Какие болезни заразны и вызываются вирусами ?
- Какие болезни заразны и вызываются бактериями или одноклеточными животными ?
- Какие болезни неизлечимы?
- Вирусы какой болезни передаются через кровь матери?
- Какие инфекционные болезни передаются через половой контакт?
- Какая смертельно опасная болезнь не передается через бытовые приборы и кожу?
- Какие инфекции передаются через животных?
- Какие опасные болезни возникают под влиянием алкоголя и наркотиков?
- Какие болезни опасны не только для самого больного . но и для общества?
- Способ создания искусственного иммунитета?
- Заболевания, приводящие к полному разрушению иммунной системы в организме?
VIII - 1, 8, 10, 11
Таблица №2. СПИД. Его не видно, но он рядом.
| Что такое ВИЧ и СПИД? | ВИЧ- вирус иммунодефицита человека. Он разрушает защитную (иммунную) систему, делает человека неспособным сопротивляться инфекции. |
СПИД (синдром приобретенного иммунодефицита)- вирусное инфекционное заболевание, вызываемое ВИЧ-инфекцией. Заразившийся человек (носитель ВИЧ) не сразу заболевает СПИДом, в течении 10 лет выглядит и чувствует себя здоровым, но неумышленно может распространять инфекцию. СПИД быстрее развивается у тех носителей ВИЧ, чье здоровье ослаблено курением, алкоголем, наркотиками, стрессами и плохим питанием.
Следует иметь в виду, что от момента заражения до реакции организма может пройти несколько месяцев (анализ будет отрицательным, но инфицированный человек уже может передавать ВИЧ другим).
-В специальных кабинетах анонимного обследования, где каждый может пройти тест и получить результат анонимно.
То есть, вирус может передаваться только:
-При любом проникающем сексуальном контакте без презерватива;
-При прямом попадании крови через ранки, язвочки, слизистые оболочки;
-При использовании нестерильных шприцев как в медицинских целях, так и для введения наркотиков;
-От матери к ребенку во время беременности, родов или кормлении грудью.
-Через укусы насекомых и животных;
-При заборе донорской крови, так как при этом используются одноразовые инструменты, шприцы и иглы.
-Подготовьтесь к тому, что некоторые люди, узнав о вашем диагнозе, могут отказаться от общения с вами;
-Примите себя таким, какой вы есть. Помните, что через год ваше здоровье будет таким же, как и сейчас, а что будет через 7-10 лет зависит от вас.
-Узнайте о своих правах и обязанностях.
-Любой человек уязвим для ВИЧ. Отсутствие навыков безопасного полового поведения, а так же использование общих инструментов для введения лекарств, наркотиков, татуирования и пирсинга подвергают вас большому риску инфицирования ВИЧ.
Эра антибиотиков подходит к концу. Колоссальный потенциал их воздействия на микробов обесценен человеческим легкомыслием. Теперь многие ученые возлагают надежды на бактериофаги — природные вирусы — разрушители бактерий. Это лекарство буквально лежит у нас под ногами
Сенсация пришла, откуда не ждали,— с берегов Антарктиды. Пока российские полярники бурили 4-километровый ледяной панцирь над антарктическим озером Восток, стремясь добраться до древних микроорганизмов, шведские исследователи из Университета Упсалы обнаружили бактерии нового типа в морской воде у берегов полярного континента. На первый взгляд это были бактерии самой обычной кишечной палочки, попавшей в океан, судя по всему, вместе с бытовыми отходами соседней чилийской станции Arturo Prat. А необычным в них было то, что эти бактерии способны запросто нейтрализовать активность практически всех известных науке антибиотиков.
Но и это не все. Бактерии оказались из группы носителей гена бета-лактамазы, а он, в свою очередь, входит в состав плазмид — эдаких универсальных деталей, которые, подобно элементам детского конструктора "Лего", могут быть встроены в генную структуру любой другой бактерии. То есть уже завтра эта антарктическая бактерия может передать свою неуязвимость к антибиотикам всем прочим бактериям. И тогда человечество окажется практически безоружным перед угрозой новых глобальных пандемий.
Дешево и эксклюзивно
Специалисты уточняют: угроза далеко не нова. С момента открытия пенициллина все большее число инфекций теряет чувствительность к антибиотикам. Стафилококки, туберкулез, синегнойная палочка, гонорея, множество других приспособившихся к антибиотикам возбудителей болезней втянули человечество в бесконечную "гонку вооружений", в которой науке противостоят примитивные организмы. И медицина, увы, не всегда в ней лидирует: ежегодно в странах ЕС устойчивыми к антибиотикам инфекциями заражается около 400 тысяч человек, а умирает более 25 тысяч. Эта "гонка", подсчитали в Европе, стоит не менее 1,5 млрд евро: в мире ежегодно разрабатывается и тестируется около 2 тысяч новых антибиотиков.
— Однако в последнее время фармацевтические компании сокращают финансирование подобных поисков из-за экономического риска,— говорит "Огоньку" известный эпидемиолог профессор Михаил Фаворов из Международного института вакцин при ООН.— Инфекции слишком быстро приспосабливаются, и колоссальные затраты на разработку новых препаратов не успевают окупаться.
Всемирная организация здравоохранения призывает ввести строгий контроль использования антибиотиков и искать им альтернативу. Один из возможных путей — использование бактериофагов, вирусов, которые по собственному почину уничтожают в природе половину бактерий. Эти нановоители были открыты почти век назад и потрясли научный мир. Первый в США нобелевский лауреат по литературе Синклер Льюис даже написал об этом роман "Эрроусмит".

Фото: Getty Images/Fotobank
Но еще через 10 лет был открыт пенициллин, который оказался эффективнее в борьбе с микробами. Ведь антибиотики способны уничтожать целые группы разных микроорганизмов, а бактериофаг поражает только один. И чтобы лечить бактериофагом, не обойтись без предварительных точных анализов. Фаги не выдержали конкуренции, их исследование было приостановлено почти повсеместно.
Но не в России. Наши ученые не прекращали исследовать бактериофаги и применять это доступное и недорогое средство в хирургии, при лечении острых кишечных инфекций, дисбактериозов и прочих бед. Приверженцы фаговой терапии утверждают: бактериофагами без каких-либо ограничений и осложнений можно лечить почти все болезни, кроме тех, что вызваны вирусами и простейшими.
Сейчас волна интереса к фагам поднимается и на Западе, хотя там их используют не в лечебных целях, а скорее в профилактических. В США Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) признало безопасность и целесообразность фагов в качестве БАДов, предотвращающих размножение нежелательных бактерий на сырах, кисломолочных продуктах и мясных полуфабрикатах,— словом, рекомендовало использовать в качестве консервантов. В июне 2011-го отечественный Роспотребнадзор созвал ученый совет, на котором была подписана резолюция о внедрении бактериофагов как нового класса пищевых добавок.
— У бактериофагов могут быть хорошие перспективы,— говорит биолог Андрей Алешкин из лаборатории биологии бифидобактерий Московского НИИ эпидемиологии и микробиологии (МНИИЭМ) им. Г.Н. Габричевского.— Например, их можно использовать и для борьбы со стойкими внутрибольничными инфекциями. Золотистый стафилококк — это большая проблема, в том числе и родильных домов. Можно обкормить рожениц антибиотиками или бесконечно закрываться на мойку, а можно обработать поверхности и инструментарий аэрозольным фагом, даже не нарушая режима учреждения. Роспотребнадзор делает так называемые контрольные смывы на предприятиях пищевой отрасли, в детских учреждениях, больницах, поэтому спектр бактерий, живущих там, известен. И к нему можно подобрать действенный бактериофаг.
Враг моего врага
Священные воды Ганга еще в 1896 году заинтересовали ученых своим антибактериальным действием. Британский химик Эрнест Ханкин сумел получить из образцов речной воды агент, который вызывал разрушение микробов. В 1917 году французский бактериолог Феликс Д'Эрелль из Института Пастера назвал этих "суперагентов" бактериофагами — пожирателями микробов.
Сейчас уже известно, что бактериофаг — это вирус, состоящий из ДНК и белковой оболочки. Как и все вирусы, он размножается только в живых клетках хозяина. При этом, в отличие от антибиотиков, бактериофаги не нарушают нормальную микрофлору организма. Они способны присоединяться только к единственному типу микробов, а остальным не причиняют вреда. Проникнув внутрь болезнетворной клетки, ДНК фага начинает воспроизводство себе подобных. Размножившись, бактериофаги разрывают оболочку клетки-хозяина и атакуют другие микробы.
Первым делом в 20-х годах прошлого века стафилококковым фагом начали лечить кожные заболевания. А Феликс Д'Эрелль на посту инспектора службы здравоохранения Лиги Наций использовал фаговую терапию в борьбе со вспышками инфекционных заболеваний на Среднем Востоке и в Индии.
В то же время грузинский последователь Д'Эрелля Георгий Элиава при поддержке наркома советской тяжелой промышленности Серго Орджоникидзе основал в Тбилиси Институт исследования бактериофагов. Институт имел большую научную и производственную базу со своими клиниками, он стал всемирным центром фаговой терапии инфекционных заболеваний. В 1937-м по приказу Берии Георгий Элиава был расстрелян как враг народа, но его институт продолжал работать вплоть до распада СССР.
— До 1991 года научными центрами разработки бактериофагов были Тбилиси и Уфа,— напоминает "Огоньку" Андрей Алешкин из МНИИЭМ им. Г.Н. Габричевского.— После распада Союза в России препараты производили независимо в нескольких городах, пока все заводы-производители не были переданы гособъединению ФГУП "НПО "Микроген"", ему теперь принадлежит 13 заводов. И если к 2000-му бактериофагов выпускалось ориентировочно на 10 млн долларов в год, то сейчас производство сократилось. А жаль: рыночный спрос на эти препараты значительно больше предложения.
Изначально бактериофаги выпускали в жидком виде. Затем были разработаны таблетки с кислотоустойчивым покрытием, удобные для употребления и транспортировки, а также концентрат, линимент и гель. При этом сейчас в России используют как препараты с одним действующим вирусом, так и комбинированные (от 2 до 8 видов бактериофагов).
— Чаще всего мы используем бактериофаги при кишечной инфекции,— рассказывает педиатр-инфекционист Татьяна Москалева, которая назначает эти препараты больным детям практически ежедневно.— Они хорошо работают, когда известен возбудитель болезни и проверена его чувствительность к фагам. Тогда лекарство действует направленно, сохраняется нормальная флора, а побочные эффекты практически отсутствуют. Претензии у меня разве что к органолептическим свойствам — уж больно они невкусные. Вот сальмонеллезный бактериофаг в таблетках — приемлемый. А жидкие формы имеют очень неприятный вкус и запах, и это создает сложности при лечении маленьких детей.
Фаговая терапия предусматривает использование вирусов, которые паразитируют на клетках бактерий и убивают их в шесть приемов
Врачи признают, что при вспышках таких инфекций, как пневмония, они скорее будут назначать пациентам интенсивные антибиотики. Но в ряде случаев антибиотики бессильны, а помогают именно фаги. Например, в период подъема заболеваемости дифтерией в 1990-х годах в России многие не болели сами, но являлись носителями инфекции — лежали в больнице месяцами без какого-либо лечебного эффекта. Антибиотики не срабатывали, и на помощь пришли бактериофаги. Та же ситуация сейчас с сальмонеллезом: те люди, которые сами не болеют, но переносят бактерии, чаще излечиваются не антибиотиками, а фагами.
Вместо или вместе
Когда в лаборатории консультативно-диагностического центра при МНИИЭМ им. Г.Н. Габричевского пациенту делают анализ микрофлоры и находят какой-нибудь микроб, то обязательно проводят пробы на чувствительность этого микроба и к спектру антибиотиков, и к спектру бактериофагов. Бактериофагом стоит лечиться только при высокой чувствительности к нему бактерий, но даже в этом случае врачи не могут гарантировать лечебного эффекта.
— В организме не так все просто, как в чашке Петри из лаборатории,— говорит Татьяна Москалева.— Микроб может быть покрыт пленкой, и бактериофаг не сумеет к нему присоединиться. Или может иметь место симбиоз нескольких микробов, тогда реакция тоже будет другой.
За долгую историю фаговой терапии российские исследовательские центры собрали богатую базу (ею сейчас очень интересуются западные микробиологи). Крупнейший музей микроорганизмов, в том числе и фагов, хранится в Научном центре экспертизы средств медицинского применения Минздравсоцразвития России. Здесь поддерживаются в жизнеспособном состоянии тысячи штаммов болезнетворных бактерий, к ним же были выведены вирусы, которые до сих пор используются для производства препаратов бактериофагов.
— В этом может быть проблема,— говорит Андрей Алешкин.— Фаги могут разрушать только тот микроб, против которого они выведены. Фаги, которые производят в России с 1995 года, адресованы тем штаммам бактерий, которые хранятся в музее. А как насчет современных микробов?
Чтобы решить этот вопрос, МНИИЭМ наладил в 1998 году сотрудничество с предприятием "Биофаг" в Уфе. Механизм был такой: НИИ проверял болезнетворные бактерии, входящие в популяцию в текущем сезоне, на чувствительность к препаратам, разработанным на "Биофаге". Но после слияния всех заводов по производству фагов в одно предприятие эта связь была потеряна.
В принципе же селекция бактериофагов значительно проще и дешевле, чем производство новых антибиотиков. Каждый тип бактерий имеет свои фаги, и они могут быть выделены в любом месте существования этих бактерий: из сточных вод, фекалий или почвы.
Есть, впрочем, и доводы против фаговой терапии, один звучит так: фаги, встраиваясь в геном бактериальной клетки, могут переносить генетический материал от одной бактерии к другой, а это ведет к развитию защитного механизма у микробов.
— Лабораторные опыты показывают, что такое возможно, но на практике в нашей стране это не подтверждалось,— объясняет Андрей Алешкин.— Иначе после применения бактериофага появилась бы суперинфекция с нетипичной для данного вида возбудителя симптоматикой. Чтобы исключить это, нужно использовать фаги только после определения их чувствительности к выделенной от пациента микрофлоре. Нужно очищать препараты от умеренных фагов, которые, встроившись в бактерию, не разрушают ее, а какое-то время сосуществуют с ней. Необходимо продолжать исследования и обмениваться данными с производителями.
Ученые ведут работы над генно-инженерными препаратами — планируется использовать только ДНК фага без оболочки, чтобы максимально увеличить эффективность. Создают комбинированные препараты — бактериофаги сочетают с бактериоцинами (ферментами бактерий), с интерфероном. А еще фаги применяют в тандеме с антибиотиками, чтобы многократно увеличить шансы победы над болезнью.
— Ставить крест на антибиотиках все-таки еще рано,— разъясняет профессор Михаил Фаворов.— Они будут становиться все более дорогими и менее доступными, но решающую роль в борьбе с бактериями пока что играть продолжат, возможно, при участии вспомогательных средств, вроде бактериофагов. А для разработки научно обоснованной стратегии использования фагов в медицине было бы важно проведение всеобъемлющего стандартизированного клинического испытания фагосодержащих медицинских препаратов. Пока результаты таких испытаний не опубликованы ни у нас, ни за рубежом.
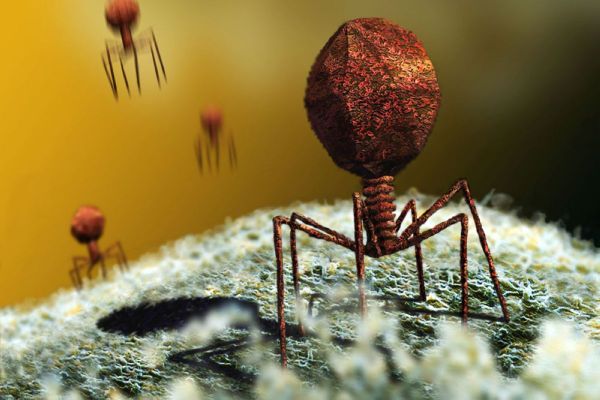
Рис. 1. Нескончаемая гонка вооружений между паразитами-бактериофагами и их жертвами-бактериями лежит в основе быстрой эволюции тех и других. Изображение с сайта discovermagazine.com
Система наследуемого приобретенного иммунитета CRISPR-Cas, широко распространенная у прокариот, надежно защищает своих обладателей от вирусов. Однако вирусы, постоянно мутируя, способны быстро (иногда менее, чем за сутки) преодолевать иммунитет любой отдельно взятой жертвы. Как выяснилось, эффективность системы CRISPR обеспечивается тем, что благодаря ее работе разные бактерии учатся распознавать вирус по разным участкам его генома. В результате способы защиты бактерий от данного вируса становятся настолько разнообразными, что никакие точечные мутации уже не помогают вирусам эффективно приспособиться к коллективной обороне жертв. Это, в свою очередь, способствует эволюции специальных вирусных генов, подавляющих работу системы CRISPR в целом, а бактерии отвечают на это эволюцией новых вариантов системы CRISPR — но такие изменения требуют большего времени.
Генетики и микробиологи из Великобритании, Франции и США предположили, что важный вклад в эффективность CRISPR вносит то обстоятельство, что в ответ на одну и ту же вирусную инфекцию даже генетически идентичные бактериальные клетки вставляют в свой геном разные спейсеры, соответствующие разным участкам генома вируса. В результате популяция жертв быстро приобретает генетическое разнообразие, что сильно усложняет стоящую перед вирусами эволюционную задачу. Приобретя точечную мутацию, защищающую от одного спейсера, вирусы смогут заразить только небольшую часть популяции жертв. К счастью для бактерий, бактериофаг не может определить заранее, какие спейсеры имеются у данной клетки: это станет ясно, только когда он впрыснет в нее свою ДНК, а тогда уже будет поздно передумывать. Поэтому большинство фагов в полиморфной популяции жертв обречено на гибель, даже если у фагов то и дело появляются точечные мутации, защищающие от того или иного спейсера. Чтобы защититься сразу от многих разных спейсеров, фагу нужно одновременно приобрести целый комплекс необходимых точечных мутаций, что крайне маловероятно, ведь мутации случайны.
Авторы подчеркивают, что полное вымирание вирусов в популяциях дикого типа является неожиданным результатом, поскольку известно, что вирусы в принципе умеют обходить CRISPR-иммунитет при помощи точечных мутаций. Может быть, все дело в разнообразии спейсеров, сформировавшихся у бактерий внутри каждой из подопытных популяций? То, что спейсеры действительно получаются разные, было показано в прежних экспериментах. Теперь нужно было доказать, что это разнообразие вносит вклад в эффективность коллективной иммунной защиты. Для этого необходимо сравнить устойчивость к вирусам у популяций с разным уровнем разнообразия спейсеров.
Чтобы получить такие популяции, авторы взяли свои подопытные линии, победившие вирусов при помощи CRISPR, и выделили из них 48 индивидуальных клонов (то есть взяли 48 индивидуальных клеток и получили от каждой многочисленное потомство). Ученые ожидали (и эти ожидания впоследствии подтвердились), что спейсеры у всех или почти всех клонов окажутся разными. Затем из этих клонов были составлены популяции пяти типов, различающиеся по уровню генетического разнообразия: популяции из одного клона (монокультуры) и смешанные популяции, составленные из 6, 12, 24 и 48 клонов.
Эти популяции затем подвергались заражению вирусами. На этот раз ученых интересовала в первую очередь эволюция вирусов, а именно их способность преодолевать иммунную защиту жертв. Поэтому наблюдения продолжались всего 3 дня — время, достаточное для заметных эволюционных изменений у вирусов, но недостаточное, чтобы подопытные популяции бактерий успели, создавая новые спейсеры, выровняться по уровню генетического разнообразия.
Результаты подтвердили ожидания авторов. За трое суток вирусы полностью вымерли во всех популяциях жертв, составленных из 24 и 48 клонов, и во многих популяциях, составленных из 12 клонов. В наименее разнообразных популяциях, составленных из одного или шести клонов, вирусы в большинстве случаев уцелели.
Каждые несколько часов в течение этого трехдневного эксперимента часть вирусов изымалась для детального анализа. Фагов подвергали полногеномному секвенированию, а также внедряли в чистые культуры каждого из 48 клонов бактерий, чтобы посмотреть, в каких случаях вирусы научились преодолевать иммунную защиту жертв.
Оказалось, что у тех вирусов, которые три дня эволюционировали в монокультурах бактерий, в большинстве случаев закрепились мутации, делающие соответствующий спейсер неэффективным. Причем происходило это, как правило, уже в первые сутки. Только с пятью из 48 монокультур вирусам не удалось справиться. Как выяснилось, в трех случаях из этих пяти у бактерий сформировалось не по одному, а по два или более противовирусных спейсеров.
У вирусов, которые эволюционировали в бактериальных популяциях, составленных из 6 и 12 клонов, устойчивость к тем или иным спейсерам сформировалась лишь в немногих случаях. Ну а те бедолаги, которым пришлось эволюционировать в наиболее разнообразных популяциях жертв, составленных из 24 и 48 клонов, не научились преодолевать защиту ни одного из исходных клонов (рис. 2).


Рис. 2. Генетическое разнообразие жертв мешает вирусам преодолевать их иммунную защиту. Рисунок показывает результаты экспериментов по заражению вирусами, коэволюционировавшими с разными популяциями бактерий, каждого из 48 исходных бактериальных клонов. Каждая из пяти колонок соответствует серии экспериментов с одним из пяти уровней разнообразия жертв (слева направо: 1 клон, 6, 12, 24, 48 клонов). В каждом эксперименте вирусов для анализа брали спустя 0, 16, 24, 40, 48, 64 и 72 часа после заражения (6 вертикальных рядов внутри каждой колонки; внизу подписано время в сутках после заражения — d.p.i.). Каждую порцию полученных таким образом вирусов внедряли в чистую культуру каждого из 48 клонов бактерий и смотрели, смогут ли вирусы размножиться (красные квадратики) или вымрут (зеленые квадратики). Толстыми черными горизонтальными линиями разделены повторности, то есть разные подопытные популяции с данным уровнем разнообразия. Рисунок показывает, что в монокультурах бактерий вирусы в большинстве случаев меньше, чем за сутки, научились преодолевать иммунную защиту; в популяциях из 6 и 12 клонов это происходило редко, в популяциях из 24 и 48 клонов — никогда. Рисунок из обсуждаемой статьи в Nature
Эти выводы подтверждаются тем, что число мутаций, обнаруженных в геномах вирусов, эволюционировавших в монокультурах жертв, оказалось существенно выше, чем у вирусов, эволюционировавших в смешанных культурах: в первом случае отбор поддерживал у вирусов полезные мутации, а во втором нет. Кроме того, оказалось, что бактерии из смешанных культур за трое суток не приобрели новых противовирусных спейсеров, тогда как в монокультурах такие спейсеры появились. Это тоже логично: в смешанных культурах опасные для бактерий вирусы так и не появились, а в монокультурах возникли вирусы, пробивающие старую защиту, и система CRISPR создала дополнительные спейсеры.
Таким образом, разнообразие спейсеров, порождаемое системой CRISPR, действительно вносит важный вклад в ее эффективность. Если бы на каждую инфекцию система отвечала созданием одного и того же спейсера у всех бактерий, вирусы легко справились бы с таким иммунитетом. Но поскольку спейсеры каждый раз получаются разные, точечные мутации и отбор становятся для вирусов недостаточно эффективной эволюционной стратегией.
Это объясняет эффективность системы CRISPR и ее широкое распространение у прокариот. Осталось понять, почему бактериофаги до сих пор не вымерли, раз эта система так хороша. Ответ на этот вопрос отчасти уже известен: недавно у фагов были обнаружены особые гены, подавляющие систему CRISPR как таковую (см.: J. Bondy-Denomy et al., 2013. Bacteriophage genes that inactivate the CRISPR/Cas bacterial immune system). В связи с этим возникает следующий вопрос: если существуют вирусные гены, полностью выводящие из строя CRISPR, то почему все вирусы ими не обзавелись? И что бактерии могут этим генам противопоставить? Впрочем, ответ на этот вопрос тоже уже отчасти известен: существует много разных вариантов системы CRISPR, каждый из которых уязвим только для некоторых вариантов генов анти-CRISPR и защищен от других. А содержать в своем геноме кучу дополнительных генов — дорогое удовольствие для вирусов, у которых отбор обычно поддерживает компактизацию генома (это повышает скорость размножения вируса).
Источник: Stineke van Houte, Alice K. E. Ekroth, Jenny M. Broniewski, Hélène Chabas, Ben Ashby, Joseph Bondy-Denomy, Sylvain Gandon, Mike Boots, Steve Paterson, Angus Buckling & Edze R. Westra. The diversity-generating benefits of a prokaryotic adaptive immune system // Nature. 2016. DOI: 10.1038/nature17436.
Читайте также:
- Противовирусные препараты от nsp
- Инфлювак вакцина от гриппа инструкция по применению
- Если повышены лейкоциты это вирусное заболевание
- Можно ли заниматься сексом если девушка болеет гриппом
- Как изменится концентрация мочевины в крови при гепатите
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции

