Трансформация у бактерий и вирусов
ТРАНСФОРМАЦИЯ (от латрансформация transformatio - превращение), в молекулярной генетике, изменение наследственных свойств клеток в результате проникновения в них чужеродной ДНК.
В результате трансформация клетка-реципиент может приобрести и устойчиво передавать своим потомкам признак, ранее у нее отсутствующий, но имеющийся у клетки донора (напр., ген устойчивости к антибиотикам).
трансформация у мн. бактерий (пневмококки, стрептококки, гемофиль-ные бактерии, бациллы)-естественный процесс, происходящий в прир. популяциях. При этом клетки, способные поглощать и включать в свою хромосому чужеродную ДНК, находятся в состоянии трансформация наз. компетентности (готовности), наступающем в определенный период жизненного цикла (конец фазы роста). Развитие компетентности может идти по "каскадному" типу: клетки, ставшие компетентными, выделяют в среду низкомол. белок (трансформация наз. фактор компетентности), который, адсорбируясь на др. клетках, делает их также компетентными.
Механизм трансформация включает необратимую адсорбцию ДНК клетки-донора (напр., выделяемую в среду в результате лизиса клеток) на пов-сти клетки-реципиента. Хорошо адсорбируется лишь ДНК, имеющая мол. массу не менее 300 тыс. У большинства бактерий адсорбироваться может ДНК любого происхождения. У гемофильных бактерий адсорбируются лишь такие фрагменты ДНК, которые несут специфич. последовательности из 11 пар нуклеотидов, характерных лишь для ДНК таких бактерий. Видоспецифич. адсорбция характерна также для гонококков. Адсорбция осуществляется на спец. рецепторах, где ДНК связывается с особыми белками и "втягивается" в клетку. При этом одна из нитей ДНК разрушается благодаря нуклеазной активности связывающих ДНК белков, и в клетку поступает уже однонитевая ДНК. Она тут же обволакивается молекулами белков, которые защищают ДНК от клеточных экзонуклеаз и способствуют ее контакту с хромосомой, а затем рекомбинации с ней. На этом процесс трансформация завершается.
ДНК можно ввести в бактерии также искусственно. Для этого, например, бактерии кишечной группы (для них естественная трансформация не характерна) охлаждают и обрабатывают растворами СаСl 2 или RbCl либо подвергают замораживанию при низких температурах с последующим оттаиванием. Клетки при этом становятся проницаемыми для ДНК, однако механизм трансформация в этом случае совершенно иной, чем описанный выше.
В бактерии посредством трансформация можно ввести также ДНК плазмид. Конечным результатом этого является возникновение клетки, несущей чужеродную плазмиду в автономном состоянии или включенную в состав хромосомы. Механизм проникновения в клетку плазмидной ДНК такой же, как и хромосомной. Однако возникновение однонитевой ДНК и др. процессы, сопутствующие поглощению, настолько "уродуют" плазмиды, что вероятность правильного восстановления кольцевой реплицирующейся формы низка (трансформация клетки мономерными формами плазмид не эффективна). Поэтому употребляют мультимерные (состоящие из неск. плазмид) формы или плазмиды с прямыми повторами нуклеотидов, отчего шансы на "сборку" полноценной плазмиды повышаются.
С помощью плазмид можно также осуществить трансформация протопластов (клетки с удаленной клеточной стенкой), которые затем регенерируют в полноценные клетки. ДНК, проникая в них, почти не повреждается и остается двунитевой. Плаз-мидная трансформация во многом близка к трансформация наз. трансфекции, когда бактерии поглощают ДНК фага (вирус бактерий), предварительно выделенную из фаговых частиц. Эта ДНК в бактерии кодирует образование новых частиц фага, которые разрушают затем бактериальную клетку и выходят наружу.
трансформация у дрожжей м. б. осуществлена только искусственным путем. Для этой цели используют протопласты или обрабатывают клетки солями щелочных металлов. ДНК проникает в дрожжевые протопласты также под действием электрич. разрядов (трансформация наз. электропорация).
трансформация клеток млекопитающих осуществима только искусственно в результате микроинъекций чужеродной ДНК в ядра эмбрионов, соматич. клеток или путем поглощения ДНК клетками в культуре тканей. Чаще всего ДНК добавляют к смеси раствора СаСl 2 и фосфатного буфера; образуется мелкодисперсный осадок, который адсорбируется и поглощается клетками. Возможно также введение ДНК в липосоме или путем использования в качестве переносчика ДНК-содержа-щего умеренного вируса с включением в его геном фрагментов ДНК животных.
Клетки растений не способны поглощать ДНК. При трансформация клеток двудольных растений используют регенерирующие протопласты, поглощающие свободную ДНК и ДНК, заключенную в липосомы. Регенерирующие трансформированные протопласты образуют трансформация наз. каллусную ткань, из которой затем формируется растение. Др. способом введения чужеродной ДНК в геном таких раститрансформация клеток является естественное заражение их бактерией Agrobacterium tume-faciens, несущей Ti- или Ri-плазмиды. Эта бактерия способна проникать в интактные раститрансформация клетки, и освобождающиеся затем плазмиды встраиваются в геном. У однодольных растений эти плазмиды не функционируют в клетке, для их трансформация прибегать к прямому переносу ДНК в протопласты, используя электропорацию. трансформация растений можно осуществлять также путем "выстрела" в клетку ускоренными частицами вольфрама или золота, на которые предварительно нанесена ДНК.
трансформация используют в генетической инженерии для введения в клетку генов, несущих заданную информацию.
трансформация впервые была открыта в 1928 Ф. Гриффитом. В 1944 О. Эвери с сотрудниками показал, что превращение некоторых непатогенных бактерий в патогенные осуществляется в результате переноса в геном первых ДНК, высвобождающейся из клеток вирулентных штаммов.
Литрансформация: Кожина трансформация И., Захаров И. А., "Успехи современной биологии", 1987, трансформация 104, в. 1(4), с. 3-21; Прозоров А. А., Трансформация у бактерий, М., 1988; Sybenga J., "Theor. Appl. Genet.", 1983, v. 66, № 3-4, p. 179-201; Kucherlopati R., Skoultchi A. I., "CRC critical rev. biochem.", 1984, v. 16, № 4, p. 349-79. А. А. Прозоров.
ТРАНСФОРМАЦИЯ (от лат. transformatio - превращение), в молекулярной генетике, изменение наследственных св-в клеток в результате проникновения в них чужеродной ДНК.
В результате трансформации клетка-реципиент может приобрести и устойчиво передавать своим потомкам признак, ранее у нее отсутствующий, но имеющийся у клетки донора (напр., ген устойчивости к антибиотикам).
Т рансформация у мн. бактерий (пневмококки, стрептококки, гемофиль-ные бактерии, бациллы)-естественный процесс, происходящий в прир. популяциях. При этом клетки, способные поглощать и включать в свою хромосому чужеродную ДНК, находятся в состоянии т. наз. компетентности (готовности), наступающем в определенный период жизненного цикла (конец фазы роста). Развитие компетентности может идти по "каскадному" типу: клетки, ставшие компетентными, выделяют в среду низкомол. белок (т. наз. фактор компетентности), к-рый, адсорбируясь на др. клетках, делает их также компетентными.
Механизм трансформации включает необратимую адсорбцию ДНК клетки-донора (напр., выделяемую в среду в результате лизиса клеток) на пов-сти клетки-реципиента. Хорошо адсорбируется лишь ДНК, имеющая мол. массу не менее 300 тыс. У большинства бактерий адсорбироваться может ДНК любого происхождения. У гемофильных бактерий адсорбируются лишь такие фрагменты ДНК, к-рые несут специфич. последовательности из 11 пар нуклеотидов, характерных лишь для ДНК таких бактерий. Видоспецифич. адсорбция характерна также для гонококков. Адсорбция осуществляется на спец. рецепторах, где ДНК связывается с особыми белками и "втягивается" в клетку. При этом одна из нитей ДНК разрушается благодаря нуклеазной активности связывающих ДНК белков, и в клетку поступает уже однонитевая ДНК. Она тут же обволакивается молекулами белков, к-рые защищают ДНК от клеточных экзонуклеаз и способствуют ее контакту с хромосомой, а затем рекомбинации с ней. На этом процесс трансформации завершается.
ДНК можно ввести в бактерии также искусственно. Для этого, напр., бактерии кишечной группы (для них естественная трансформация не характерна) охлаждают и обрабатывают растворами СаСl 2 или RbCl либо подвергают замораживанию при низких т-рах с последующим оттаиванием. Клетки при этом становятся проницаемыми для ДНК, однако механизм трансформации в этом случае совершенно иной, чем описанный выше.
В бактерии посредством трансформации можно ввести также ДНК плазмид. Конечным результатом этого является возникновение клетки, несущей чужеродную плазмиду в автономном состоянии или включенную в состав хромосомы. Механизм проникновения в клетку плазмидной ДНК такой же, как и хромосомной. Однако возникновение однонитевой ДНК и др. процессы, сопутствующие поглощению, настолько "уродуют" плазмиды, что вероятность правильного восстановления кольцевой реплицирующейся формы низка (трансформация клетки мономерными формами плазмид не эффективна). Поэтому употребляют мультимерные (состоящие из неск. плазмид) формы или плазмиды с прямыми повторами нуклеотидов, отчего шансы на "сборку" полноценной плазмиды повышаются.
С помощью плазмид можно также осуществить трансформацию протопластов (клетки с удаленной клеточной стенкой), к-рые затем регенерируют в полноценные клетки. ДНК, проникая в них, почти не повреждается и остается двунитевой. Плазмидная трансформация во многом близка к т. наз. трансфекции, когда бактерии поглощают ДНК фага (вирус бактерий), предварительно выделенную из фаговых частиц. Эта ДНК в бактерии кодирует образование новых частиц фага, к-рые разрушают затем бактериальную клетку и выходят наружу.
Т рансформация у дрожжей м. б. осуществлена только искусственным путем. Для этой цели используют протопласты или обрабатывают клетки солями щелочных металлов. ДНК проникает в дрожжевые протопласты также под действием электрич. разрядов (т. наз. электропорация).
Т рансформация клеток млекопитающих осуществима только искусственно в результате микроинъекций чужеродной ДНК в ядра эмбрионов, соматич. клеток или путем поглощения ДНК клетками в культуре тканей. Чаще всего ДНК добавляют к смеси р-ра СаСl 2 и фосфатного буфера; образуется мелкодисперсный осадок, к-рый адсорбируется и поглощается клетками. Возможно также введение ДНК в липосоме или путем использования в качестве переносчика ДНК-содержа-щего умеренного вируса с включением в его геном фрагментов ДНК животных.
Клетки растений не способны поглощать ДНК. При трансформации клеток двудольных растений используют регенерирующие протопласты, поглощающие свободную ДНК и ДНК, заключенную в липосомы. Регенерирующие трансформированные протопласты образуют т. наз. каллусную ткань, из к-рой затем формируется растение. Др. способом введения чужеродной ДНК в геном таких растит. клеток является естественное заражение их бактерией Agrobacterium tume-faciens, несущей Ti- или Ri-плазмиды. Эта бактерия способна проникать в интактные растит. клетки, и освобождающиеся затем плазмиды встраиваются в геном. У однодольных растений эти плазмиды не функционируют в клетке, для их трансформации прибегать к прямому переносу ДНК в протопласты, используя электропорацию. Трансформацию растений можно осуществлять также путем "выстрела" в клетку ускоренными частицами вольфрама или золота, на к-рые предварительно нанесена ДНК.
Т рансформацию используют в генетической инженерии для введения в клетку генов, несущих заданную информацию.
Т рансформация впервые была открыта в 1928 Ф. Гриффитом. В 1944 О. Эвери с сотрудниками показал, что превращение нек-рых непатогенных бактерий в патогенные осуществляется в результате переноса в геном первых ДНК, высвобождающейся из клеток вирулентных штаммов.
Лит.: Кожина Т. И., Захаров И. А., "Успехи современной биологии", 1987, т. 104, в. 1(4), с. 3-21; Прозоров А. А., Трансформация у бактерий, М., 1988; Sybenga J., "Theor. Appl. Genet.", 1983, v. 66, № 3-4, p. 179-201; Kucherlopati R., Skoultchi A. I., "CRC critical rev. biochem.", 1984, v. 16, № 4, p. 349-79. А. А. Прозоров.
БАКТЕРИИ. Химический состав клеток бактерий в основном такой же, как и у клеток высокоорганизованных организмов. Они окружены оболочкой, внутри которой находится цитоплазма, ядерный аппарат, рибосомы, ферменты и другие включения. В отличие от клеток эукариот в клетках бактерий отсутствуют митохондрии, аппарат Гольджи, эндоплазматическая сеть. Цитоплазма бактерий представляет собой коллоидную часть клетки с гранулярной (зернистой) структурой. Основную массу гранул составляют рибосомы с константой седиментации 70S, участвующие в синтезе белка. В центральной части цитоплазмы бактерий расположен ядерный аппарат - нуклеотид и плазмиды. Ядро прокариот называется нуклеотидом по той причине, что оно в отличии от эукариот не изолировано от цитоплазмы мембраной и представлено одной очень длинной молекулой ДНК (хромосомой). Хромосома бактерии E. coli включает около 5*10 6 пар оснований, имеет имеет молекулярную массу 3*10 9 Д.В хромосоме кишечной палочки ДНК замкнута в кольцо и состоит из дискретно расположенных генов. Длина молекулы ДНК в расправленном состоянии достигает 1 мм, что значительно превышает среднюю длину самой бактерии.
ДНК бактерий не отличается по строению от ДНК высших организмов. Она содержит те же четыре нуклеотида, в состав каждого из которых входят дезоксирибоза, остаток фосфорной кислоты и пуриновое (аденин или гуанин) или пиримидиновое (тимин или цитозин) основание. Соединение мононуклеотидных остатков осуществляется сложноэфирными мостиками.
ВИРУСЫ. Вирусная частица содержит в своём составе одну из нуклеиновых кислот, которая окружена белковой оболочкой (капсидом). Геном вирусов может быть представлен двухцепочной или одноцепочной ДНК, одноцепочной или двухцепочной РНК. Типичная частица состоит из головки и хвостового отростка. В головке плотно упакована ДНК. Головку и хвостовой отросток покрывает белковый чехол. На конце хвостового отростка имеются специальные волоконца, облегчающие прикрепление фага к оболочке бактерий.
7. Внехромосомные факторы наследования.
Наследование признаков через цитоплазму называется внехромосомной. Цитоплазма влияет на активность проявления гена. Некоторые её органоиды, имеющие свою систему белкового синтеза (митохондрии, пластиды), могут влиять на развитие определённых признаков. В процессе развития наблюдается сложное взаимодействие ядра и цитоплазмы. Но определяющую роль всё-таки играет ядро.
8. Роль плазмид в определении у бактерий свойств устойчивости к антибиотическим лекарственным веществам.
У некоторых непатогенных и патогенных видов бактерий обнаружены факторы резистентности к лекарственным веществам – R-факторы. Это довольно крупные плазмиды. Они, присутствуя в цитоплазме бактерий и передаваясь их поколения в поколение, обуславливают устойчивость бактерий к действию одного или нескольких лекарственных веществ.
9. Способы передачи наследственной информации у микроорганизмов: трансформация, трансдукция и конъюгация.
В процессе трансформации принимают участие две бактериальные клетки – донор и реципиент. Трансформирующий агент представляет собой часть молекулы ДНК донора, которая внедряется в геном реципиента, изменяя его фенотип. В процессе трансформации клетки донора и реципиента не соприкасаются друг с другом. Механизм переноса генетического материала заключается в том, что из клеток донора выделяются в окружающую среду молекулы или фрагменты молекул ДНК. Сначала ДНК адсорбируется на оболочке клетки реципиента. Затем через определённые рецепторные участки её стенки при помощи специальных клеточных белков ДНК втягивается внутрь клетки. Проникающая донорская ДНК должна быть двухцепочной. В реципиентной клетке она становиться одноцепочной.
Трансдукция – это перенос генов из одной бактериальной клетки в другую при помощи умеренных фагов. При переносе генетического материала происходит замена участка молекулы ДНК фага. Фаг при это теряет свой собственный фрагмент и становиться дефектным. Различают три вида трансдукции: общую, или неспецифическую, специфическую и абортивную.
Конъюгация – это передача генетического материала от одних бактерий другими при их скрещивании.
Наиболее полно изучена структура бактериального генома, в особенности генома E. coli. Основной объем генетической информации бактериальной клетки заключен в ее единственной хромосоме. Размер генома у разных бактерий колеблется от нескольких сотен тысяч пар нуклеотидов (п.н.) до нескольких миллионов п.н. У E. coli он равен 4,6 млн. п.н., а его кодирующая часть составляет 88,6%.
В состав бактериальных геномов входят независимые гены и опероны. Работа независимых генов не регулируется другими генами, а их экспрессия носит конститутивный (непрерывный) характер. От соседних генов независимые гены отделены некодирующими участками (спейсерами), которые обычно не транскрибируются. В отличие от независимых генов оперон — это группа рядом расположенных структурных генов, имеющих общую систему регуляции. Обычно эти гены участвуют в осуществлении последовательных этапов какого-либо биохимического процесса. Впервые модель оперона была разработана в 1960 г. французскими биохимиками Ф. Жакобом и Ж. Моно на примере процесса сбраживания лактозы. В систему лактозного оперона входят три структурных гена (Z, Y, A), кодирующие три фермента, участвующие в процессе сбраживания молочного сахара (см. схему). Основным ферментом является β-галактозидаза.
К системе регуляции оперона относятся промотор, оператор и ген-регулятор. Промотор расположен перед оператором и является участком, который узнается ферментом РНК-полимеразой, осуществляющим транскрипцию структурных генов. Одна из субъединиц фермента (δ-частица) узнает промотор по специфической последовательности нуклеотидов (блок Прибнова), благодаря чему РНК-полимераза связывается с матрицей.
Схема действия лактозного оперона

Фермент начинает транскрипцию, если расположенный рядом с промотором оператор не связан с белком-репрессором, вырабатываемым под контролем гена-регулятора. Отсутствие этой связи обусловлено наличием в клетке субстрата — лактозы, с которой соединяется репрессор. Как только уровень лактозы в клетке падает, регуляторный белок освобождается и садится на оператор, препятствуя тем самым транскрипции структурных генов. Такой тип регуляции носит название негативной индукции, т.к. отсутствие репрессора запускает работу оперона. У прокариот установлены и другие механизмы оперонной регуляции. Например, при синтезе триптофана она может осуществляться по типу репрессии, при котором сам конечный продукт (триптофан) является корепрессором и в комплексе с белком-регулятором, связываясь с оператором, препятствует транскрипции.
Объем генома прокариот может увеличиваться, с одной стороны, за счет копирования имеющихся генов, а с другой — за счет включения в геном чужеродной генетической информации. Путями переноса информации у прокариот являются процессы трансформации, конъюгации, трансдукции и транспозиции.
Схема процесса трансформации у бактерий

Под трансформацией понимают включение в геном фрагментов чужеродной ДНК, в результате чего клетка приобретает новый признак. Естественную трансформацию наблюдали в смешанных посевах двух штаммов, несущих разные биохимические мутации. О трансформации судили по появлению клеток дикого типа, что возможно только при объединении обеих мутаций в одном геноме и их комплементации. Искусственная трансформация достигается обработкой клеток препаратом ДНК. В обоих случаях клетка, способная воспринимать чужеродную ДНК, находится в особом физиологическом состоянии, которое называется компетенцией. Оно характеризуется увеличением проницаемости клеточной мембраны и активацией ферментативной системы, которая осуществляет перенос фрагмента ДНК через мембрану, разделение его на одиночные цепи и встраивание одиночной цепочки в состав бактериальной хромосомы.
Другим каналом для передачи информации у прокариот является процесс конъюгации. Во время конъюгации между двумя бактериальными клетками возникает контакт с образованием цитоплазматического мостика, по которому из одной клетки в другую поступает ДНК.

Образование конъюгационного мостика
Основная роль в этом процессе принадлежит половому фактору бактерий — F-плазмиде, внехромосомному носителю информации. Клетки, несущие эту плазмиду (F + ), в процессе конъюгации играют роль доноров, а не имеющие ее (F — ) — реципиентов. Переход плазмиды из клетки-донора в клетку-реципиент инициирует процесс обмена между ними генетической информацией, т.к. вслед за F-фактором может переноситься бактериальная хромосома.
Процесс конъюгации у бактерий гомологичен половому процессу у высших организмов, но отличается от него рядом специфических особенностей. Главная из них состоит в неполной передаче наследственного материала (хромосомы) от донора к реципиенту, благодаря чему образуется частичная зигота — мерозигота, по терминологии Ф. Жакоба и Е. Вольмана. Отсюда весь процесс был назван меромиксисом.
В переносе информации от одной бактериальной клетки к другой принимают также участие некоторые бактериальные вирусы — бактериофаги. Это явление получило название трансдукции. Оно было открыто в 1952 г. Дж. Ледербергом и Н. Циндером. Для вирусов, способных переносить информацию, характерен специфический путь развития. Проникнув в клетку, они встраиваются в бактериальную хромосому и могут длительное время находиться в ее составе, уподобляясь ее фрагменту. Это состояние является неактивным, т.к. вирусная ДНК не транскрибируется, и, следовательно, не синтезируются вирусные белки и не образуются новые вирусные частицы.
Схема процесса конъюгации у бактерий

Передача генетического материала в результате конъюгации у E. coli:
а — передача F-фактора от донора к реципиенту в скрещивании F + xF – ; б — образование линии Hfr в результате интеграции F + — фактора и передачи бактериальных генов от донорных к реципиентным клеткам в ходе скрещивания F + x Hfr.
Такой путь развития называется лизогенным, а интегрированный вирус — провирусом. Бактериальная клетка, несмотря на присутствие в ней вируса, не подвергается лизису. Однако через какое-то время вирус может активизироваться и выходить из состава хромосомы, “прихватывая” близлежащий фрагмент ДНК бактерии. Следом начинается процесс репликации вирусной ДНК и вместе с нею фрагмента хромосомы. Затем синтезируются вирусные белки и идет сборка новых вирусных частиц, в геном которых включается фрагмент бактериальной ДНК. При этом аналогичный объем собственной информации вирус утрачивает. Клетка в итоге погибает, а освободившиеся из нее вирусные частицы заражают другие клетки, внося в них фрагмент ДНК первого хозяина.
Схема процесса трансдукции у E. coli

И, наконец, перенос информации в пределах одного генома осуществляется в ходе процесса транспозиции. Транспозиция — это перемещение участка хромосомы из одного места в геноме (локуса) в другой. У бактерий известно два типа транспозирующих элементов: IS-частицы и транспозоны. IS-частицы представляют собой короткие последовательности нуклеотидов, ограниченные концевыми повторами. Они несут информацию о своем перемещении, т.к. в них есть участок, кодирующий структуру фермента транспозазы, осуществляющего вырезание (эксцизию) и встраивание (инсерцию) частицы. Другой информации в IS-частицах нет. В отличие от них транспозоны содержат один или несколько структурных генов, а сложные транспозоны на обоих концах несут еще IS-частицы. Встраивание IS-частиц и транспозонов может вызывать мутации или инактивацию генов, что является одним из возможных путей реорганизации геномов.
Схема строения сложного транспозона

Центральный район, несущий ген или гены сопротивляемости к тетрациклину, фланкирован прямыми или инвертированными IS-элементами. В свою очередь, IS-элементы имеют собственные терминальные инвертированные повторы.
В состав бактериального генома входит также плазмидная ДНК. Плазмида — это экстрахромосомный носитель наследственной информации. Количество плазмид в клетке непостоянно. Плазмиды бывают мелкие и крупные, однокопийные и мультикопийные. Однокопийные плазмиды обычно встраиваются в бактериальную хромосому и реплицируются вместе с ней. Их называют эписомами. Мультикопийные плазмиды существуют автономно и реплицируются независимо от бактериальной хромосомы. Число копий их различно. Некоторые плазмиды (например, F-фактор) могут попеременно находиться либо в интегрированном, либо в автономном состоянии. Плазмидная ДНК определяет такие свойства бактериальной клетки, как устойчивость к антибиотикам (R-плазмиды), синтез колицинов — веществ, подавляющих рост других типов бактерий (Col-плазмиды) и др. Многие плазмиды обладают способностью к трансмиссии, т.е. к переходу из одной клетки в другую. Внутри плазмид могут находиться транспозоны.

Карты F-фактора и плазмиды R
В составе бактериального генома часто обнаруживается вирусная ДНК. Вирусные гены по структуре сходны с бактериальными, но у вирусов есть перекрывающиеся гены. Перекрывание генов происходит в том случае, когда одна и та же последовательность ДНК кодирует структуру двух или трех разных белков за счет изменения рамки считывания.
Перекрывающиеся гены были обнаружены Ф. Сенгером в 1977 г. у фага φХ174. Считается, что такая генетическая система является экономичной. Но одновременно мутация в этом локусе может привести к повреждению сразу нескольких генов.
Читайте также другие статьи темы 7 "Ген и геном":
Перейти к чтению других тем книги "Генетика и селекция. Теория. Задания. Ответы":

Итак, у нас на руках есть плазмидный вектор и есть подходящий для данного вектора штамм бактерии, осталось внести вектор в бактерию.
Для начала рассмотрим вкратце строение оболочки грамположительных и грамотрицательных бактерий.
Оболочка грамотрицательной бактерии состоит из двух липидных бислоёв: внешней мембраны и внутренней мембраны (внутреннюю ещё называют плазматической). Между ними находится периплазматическое пространство, заполненное выполняющими важные функции белками и пептидогликаном.
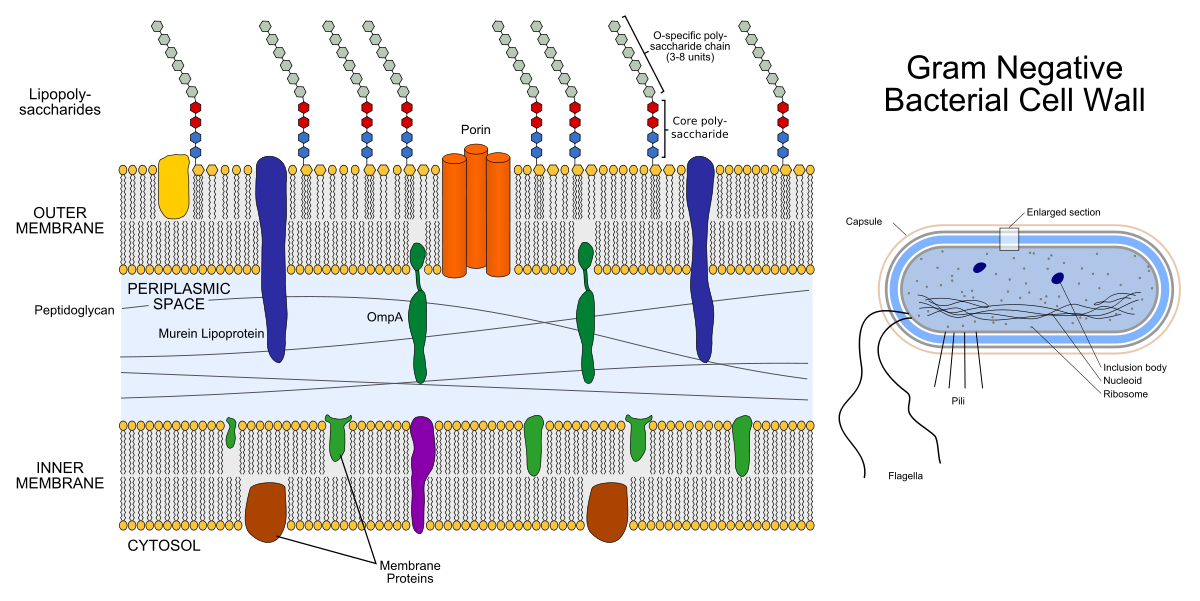
Слева — строение оболочки грамотрицательной бактерии. Цветные штуковины внутри мембран это мембранные белки, а торчащие наружу цепочки — липополисахариды. Справа — строение самой грамотрицательной бактерии.

Оболочка грамположительных бактерий состоит только из внутренней (плазматической) мембраны, очень тонкого периплазматического пространства и внешнего, более толстого, чем у грамотрицательных бактерий слоя пептидогликана.
Шуточная картинка, на которой обыгрывается гидрофобность (водобоязнь) остатков жирных кислот, находящихся внутри двухслойной мембраны.
В свою очередь крупные полярные молекулы (аминокислоты, моносахариды, нуклеотиды), заряженные частицы (ионы) и макромолекулы (ДНК, белки) проникнуть через клеточную оболочку просто так не могут, так как они хорошо растворимы только в полярных растворителях (например, в воде). Тогда как молекулы ДНК попадают внутрь бактериальной клетки?

Скульптура, изображающая трёхмерную структуру комплекса валиномицина и иона калия (ион изображён в виде шара в центре). Установлена перед входом в Институт биоорганической химии РАН имени М. М. Шемякина и Ю. А. Овчинникова (Москва), в котором был установлен механизм антибактериальной активности валиномицина и трёхмерная структура его комплекса с ионом калия.
Схематичное изображение грибкового антибиотика валиномицина, образовавшего комплекс с ионом калия.
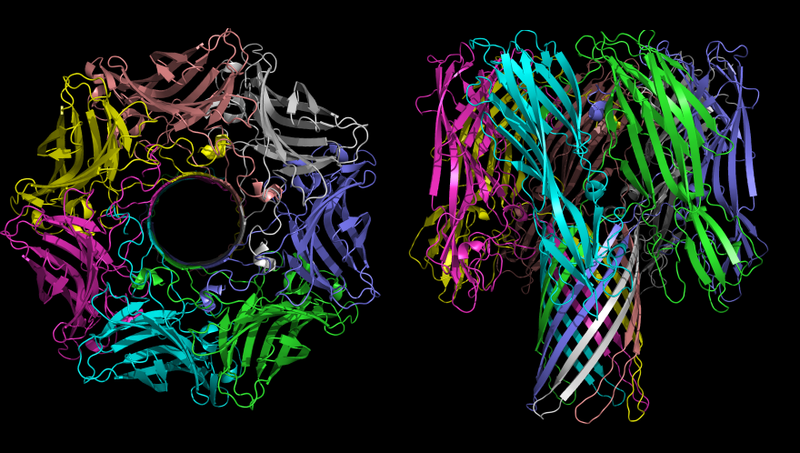
Трёхмерная структура олигомера α-гемолизина — токсина бактерии Staphylococcus aureus. На рисунке слева хорошо видна пора.
Основной функцией α-гемолизина в патогенном процессе является создание некотролируемых каналов в мембране клетки, которые в зависимости от окружающих условий могут пропускать моновалентные ионы, ионы кальция или АТФ. Как было указано выше, ионный дисбаланс крайне токсичен, а транспорт АТФ из клетки является вредным, так как АТФ — это незаменимое звеном почти всех химических процессов любой клетки.
Как видно из приведённых выше примеров, облегчённая диффузия не требует затрат энергии. Напротив, активный транспорт — это поглощение или выделение чего-либо клеткой с затратой энергии на каждый акт переноса. Это может быть транспорт крупных полярных молекул или ионов, причём транспорт ионов может осуществляться как по градиенту концентрации, так и против него. Разумеется, активный транспорт — это контролируемый процесс, в котором участвует целый набор внутриклеточных и трансмембранных белков. Таким образом, сначала клетке нужно затратить ресурсы на то, чтобы синтезировать все эти белки, а затем ещё раз затратить энергию на использование этой транспортной системы.
Примером активного транспорта может служить система энергозависимого транспорта гидрофобных и амфифильных соединений из клетки обратно в окружающую среду (эффлюкс).

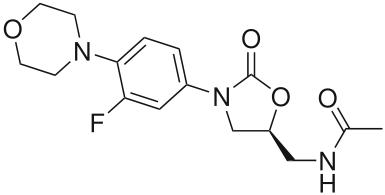
Структура линезолида — антибиотика, применяемого против устойчивых штаммов грамположительных бактерий.
При этом в комфортных условиях в культуре клеток лишь часть из них обладает естественной компетентностью, а доля компетентных клеток от общего их числа является наибольшей тогда, тогда культура находится в определённой фазе роста — log-фазе.

Типичный график зависимости количества бактерий в культуре от времени. Log-фаза — это фаза роста, за которой следует выход на плато и стадия угасания, на которой клеткам уже не хватает питательных веществ и накапливаются токсины.
Конечно, исследователю хотелось бы сделать процесс переноса плазмидного вектора внутрь клетки как можно более эффективным: чем эффективнее процесс трансформации, тем меньше нужно плазмидного вектора для того, чтобы гарантировать хорошие результаты. Поэтому в лабораторных условиях обычно не надеются на саму клетку, а вместо этого создают клетки с искусственной компетентностью.
Существует два основных метода создания искусственной компетентности бактерий: обработка клеточной культуры двухвалентными ионами с последующим кратковременным нагреванием и так называемая электропорация.
Лабораторный холодильник в представлении автора рисунка.
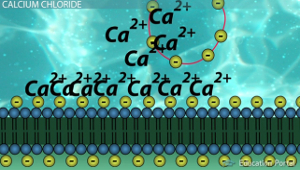
Когда исследователю нужно трансформировать определённый штамм он достаёт клетки из кельвинатора и помещает пробирку в лёд. Затем к находящимся в log-фазе роста клеткам добавляют двухвалентные катионы и нужный нам плазмидный вектор. Пробирка при этом не должна покидать лёд. Типичным донором таких катионов выступает хлорид кальция (CaCl2), в данном случае нашим двухвалентным катионом является Ca2+. Однозначного объяснения того, как Ca2+ помогает ДНК проникать внутрь бактерии нет:
Затем клетки высевают на чашки Петри с селективной средой и на них вырастают колонии.
Основой метода электропорации является тот факт, что электрическое поле может повредить клеточную оболочку. То есть дословно электропорация — это создание пор электрическим полем.
Сначала в специальную пробирку (кювету) помещают бактерии и плазмидный вектор. Затем кювету ставят в специальное устройство, которое на долю секунды создаёт разность потенциалов 0,1-10 кВ, что в свою очередь приводит к обратимому повреждению мембран и векторы могут свободно проникнуть в клетки. Через некоторое время бактериальную культуру высевают на чашки Петри с селективной средой.
Важным требованием к жидкой среде, в которой находятся клетки и вектор в момент электропорации является низкая концентрация ионов: в противном случае возможно короткое замыкание.
Ну что же, подведём промежуточные итоги:
- Мы синтезировали нужный нам ген;
- Вставили его в подходящий плазмидный вектор;
- Выбрали подходящий штамм-продуцент и произвели его трансформацию;
- Получили культуру клонов;
- Наконец, мы перенесли часть этих клонов в большой объём питательной среды с целью получить нужный нам белок в большом объёме.
Следующий шаг: выделить белок из полученной биомассы в настолько чистом виде, насколько это вообще возможно. Но это уже совсем другая история.
Читайте также:


