Роль ингибиторов нейраминидазы в профилактике и лечении гриппа
Прием занамивира ускоряет разрешение симптомов гриппа
Translated, with permission of the ACP—ASIM, from "Zanamivir speeds symptom relief in influenza". ACP J Club 2000;132:92. Abstract of: Monto A.S., Fleming D.M., Henry D., et al., Efficacy and safety of neuraminidase inhibitor zanamivir in the treatment of influenza A and B virus infections. J Infect Dis 1999;180:254—61, and from the accompanying Commentary by K.L. Nichol.
Определить эффективность и безопасность приема занамивира при лечении гриппа.
Рандомизированное (со скрытым отнесением участников к той или иной группе) слепое (для больных и врачей) плацебо-контролируемое испытание с продолжительностью наблюдения 21 день, которое проводилось во время сезонной вспышки гриппа.
Медицинские центры в США и Европе.
1256 больных (средний возраст 35 лет, 66% женщины). Критерии включения: продолжительность заболевания гриппом Ј 48 ч; наличие лихорадки и і 2 из таких симптомов, как боли в мышцах, головная боль, кашель, першение или боль в горле. Критерии исключения: обострение хронического заболевания; прием противовирусных препаратов за і 24 ч. Дополнительные: среднее количество баллов по шкале оценки выраженности симптомов заболевания, наличие нарушений сна, сроки возвращения к повседневной деятельности, частота использования ацетаминофена или декстрометорфана для устранения симптомов гриппа.
Анализ проводили исходя из допущения, что все больные получали предписанное лечение. В обеих группах занамивира симптомы гриппа исчезали быстрее, чем в группе плацебо (6 и 7 сут соотв.; р Ј 0,014). Частота введения препарата не повлияла на клинические исходы (р=0,77). При включении в исследование в течение Ј 30 ч после начала заболевания введение занамивира 2 раза в сутки симптомы разрешались на 1 день(р=0,015), а при введении 4 раза в сутки — на 1,5 дня (р=0,001) скорее. При исходной температуре тела і 37,8°C лихорадка исчезала на 1,5 дня раньше на фоне приема занамивира 2 раза в сутки (р=0,049) и на 2 дня раньше при четырехкратном приеме препарата (р=0,032). При высоком риске развития осложнений (возраст і 65 лет, наличие сердечно-сосудистых, бронхолегочных, эндокринных заболеваний или нарушений обмена веществ) на фоне введения занамивира 4 раза в сутки сроки разрешения симптомов гриппа сокращались на 2,8 дня (р=0,042). Обе схемы лечения занамивиром оказались эффективнее плацебо у больных из группы высокого риска с лабораторными признаками гриппа (р Ј 0,016). Занамивир оказался эффективнее плацебо и при использовании всех дополнительных критериев оценки. Частота развития побочных эффектов во всех группах была одинаковой.
На фоне приема занамивира 2—4 раза в сутки симптомы гриппа исчезают на 1—1,5 дня быстрее. Наибольший эффект лечения отмечался при раннем начале лечения, исходной температуре тела і 37,8°C и высоком риске развития осложнений.
Источник финансирования: Glaxo Wellcome Research and Development.
Адрес для корреспонденции: Dr. A.S. Monto, University of Michigan, School of Public Health, Department of Epidemiology, 109 Observatory Street, Ann Arbor, MI 48109, USA. FAX 734-764-3192.
Смертность и частота развития осложнений при гриппе остаются высокими. Несмотря на то что основным методом профилактики этого заболевания служит вакцинация, противовирусные препараты играют важную дополнительную роль в предотвращении и лечении гриппа.
В 1999 г. применение занамивира и оселтамивира было одобрено для лечения гриппа А и В [1]. До этого времени единственными препаратами, активными в отношении вируса гриппа А, были амантадин и римантадин. Их применение ограничивалось большим числом побочных эффектов (главным образом связанными с поражением центральной нервной системы) и быстрым появлением резистентных штаммов. Прием ингибиторов нейраминидазы обычно хорошо переносится больными (что было продемонстрировано в работах A.S. Monto et al. и F.G. Hayden et al.) и реже приводит к развитию резистентности. В то же время сообщалось о развитии бронхоспазма на фоне приема занамивира и желудочно-кишечных расстройств на фоне приема оселтамивира [1].
Занамивир и оселтамивир эффективны при гриппе А и В у взрослых, если лечение начато не позднее чем через 2 сут после появления симптомов заболевания. A.S. Monto et al. назначали занамивир в виде назального аэрозоля и в более современной форме — в порошке для ингаляций. Продолжительность заболевания в среднем уменьшилась на 1 день, этот показатель был выше у больных с более тяжелым течением заболевания (высокой лихорадкой) и в тех случаях когда лечение было начато в первые 30 ч после появления симптомов. В двух других исследованиях тоже получены сходные результаты: занамивир ускорял излечение на 1—1,5 дня [2, 3]. Прием оселтамивира уменьшает сроки разрешения симптомов гриппа у взрослых без сопутствующих заболеваний приблизительно на 30 ч, если лечение начато в первые 1,5 сут заболевания [4].
В большинстве случаев участники испытаний ингибиторов нейраминидазы были моложе 65 лет и не имели сопутствующих заболеваний. Так, в исследовании A.S. Monto et al. лишь 13% больных не соответствовали этим характеристикам (т.е. относились к группе высокого риска развития осложнений). Несмотря на то что результаты исследования свидетельствуют об эффективности занамивира в данной подгруппе больных, из-за малого размера выборки терапевтический эффект не достиг уровня статистической значимости. Чтобы подтвердить эффективность ингибиторов нейраминидазы у больных с высоким риском развития осложнений гриппа, необходимы дополнительные исследования.
Хотя применение занамивира и оселтамивира для профилактики гриппа не одобрено, клинические испытания свидетельствуют об эффективности указанных препаратов в качестве профилактических средств. F.G. Hayden et al. показали, что прием оселтамивира в течение 6 нед приводит к снижению заболеваемости гриппом на 74%. В другом исследовании 1107 здоровых взрослых принимали препарат на протяжении 4 нед [5]. Вероятность заболевания гриппом снизилась на 67%, а вероятность развития высокой лихорадки — на 84%. По данным F.G. Hayden et al., в течение 2 нед после окончания 6-недельного курса профилактики заболели гриппом 7 участников, 5 из которых входили в группу оселтамивира. Таким образом, ингибиторы нейраминидазы, возможно, эффективны только в период лечения. Необходимы дополнительные исследования, посвященные профилактической ценности препаратов этой группы для пожилых, обитателей домов престарелых и других лиц из групп высокого риска.
Какова роль ингибиторов нейраминидазы в профилактике и лечении гриппа? На первом месте, безусловно, остается вакцинация. Противовирусные препараты, включая ингибиторы нейраминидазы, играют важную дополнительную роль при использовании в период между пандемиями непривитыми лицами, при развитии симптомов гриппа у привитых и при необходимости в период между маем и сентябрем посетить местность, в которой вспышки гриппа регистрируются именно в это время. Выбирая конкретный противовирусный препарат, следует учитывать спектр его действия, побочные эффекты, вероятность развития резистентности у вирусов и стоимость. Учитывая необходимость начинать противовирусную терапию в первые 2 сут после появления симптомов, можно предположить, что широкое использование противовирусных препаратов станет возможным, только если будут разработаны надежные и быстрые методы диагностики гриппа. Не исключено, что противовирусные препараты будут применяться при подготовке к следующей пандемии в случаях, когда возникнут перебои со снабжением вакциной.
Veterans Affairs Medical Center
Minneapolis, Minnesota, USA
1. MMWR Morb Mortal Wkly Rep 1999;48(RR14):1—9.
2. Hayden F.G., Osterhaus A.D., Treanor J.J., et al. N Engl J Med 1997;337:874—80.
3. The MIST (Management of Influenza in the Southern Hemisphere Trialists) Study Group. Lancet 1998;352:1877—81.
Осельтамивир и занамивир были складированы во многих странах для лечения и профилактики сезонного и пандемического гриппа, [чтобы использовать] до того как вакцина против гриппа, соответствующая циркулирующему вирусу, станет доступной. Осельтамивир классифицируется Всемирной организацией здравоохранения как основное (жизненно-важное) лекарственное средство.
Какие подходы к этому обзору использовались
Мы обновили и объединили наши обзоры по противовирусным средствам занамивир и осельтамивир при гриппе у взрослых и детей на основании отчетов производителей в регуляторные органы (отчеты о клинических исследованиях) и комментариев регуляторов. Мы назвали эти комментарии и отчеты "регуляторная информация'. Отчеты о клинических исследованиях не опубликованы, это обширные документы с очень подробными деталями испытаний, которые сформировали базу для маркетингового одобрения. Они включают в себя протоколы, методы и результаты. Отчеты о клинических исследованиях до сих пор были конфиденциальными, их видели только производители и регуляторы.
Почему мы предприняли этот подход
В предыдущих версиях этого обзора мы выявили неразрешенные несоответствия в данных, представленных в опубликованных отчетах по клиническим испытаниям, и существенную предвзятость публикаций (публикационное смещение). Исходя из этого, мы решили не использовать данные из журнальных статей, а включили документы, созданные во время процессов лицензирования (маркетингового одобрения). Мы получили доступ к таким данным из Великобритании, США, Европейского лекарственного агентства (EMA), от японских регуляторов и к отчетам по клиническим исследованиям от производителей (после затяжной кампании в средствах массовой информации). Это позволило нам проверить информацию из рандомизированных плацебо-контролируемых клинических испытаний на взрослых и детях с подтвержденным или предполагаемым контактом с естественно встречающимся гриппом.
Исходя из наших оценок регуляторных документов (более 160 000 страниц), мы пришли к выводу, что были существенные проблемы с дизайном, проведением, отчетностью и доступностью информации во многих из этих клинических испытаний.
Мы использовали в этом обзоре данные из 46 клинических испытаний (20 по осельтамивиру и 26 исследований по занамивиру). Мы определили проблемы в дизайне многих исследований, которые мы включили, и которые отразились на нашей уверенности в их результатах. Мы обнаружили, что оба лекарства сокращали продолжительность симптомов гриппоподобного заболевания (неподтвержденный грипп или "грипп") менее, чем на один день. Осельтамивир, на основании данных от всех людей, включенных в клинические испытания по лечению осельтамивиром, не влиял на число госпитализаций. Клинические испытания по занамивиру этот исход не регистрировали. Сообщения о влиянии на пневмонии и другие осложнения гриппа, такие как бронхит, инфекции среднего уха (средний отит) и синуситы, были не надёжны, как показали истории болезни по документам клинического испытания. Некоторые формы показали ограничения (проблемы) диагностических критериев пневмонии. Регуляторные комментарии отметили проблемы с недостающими дневниками наблюдения у участников. У детей с астмой не было ясного влияния на время до первого облегчения симптомов.
Клинические испытания по профилактике (заболевания) показали, что осельтамивир и занамивир снижали риск симптоматического гриппа у отдельных лиц и в семье. Не было доказательств влияния на бессимптомный грипп или на не грипп, на гриппоподобные заболевания, но проблемы в проведении испытаний препятствуют любому определённому заключению.
Применение осельтамивира было связано с тошнотой, рвотой, головными болями, почечными и психиатрическими событиями; последние три случались, когда его [осельтамивир] применяли для профилактики гриппа. Его [осельтамивира] действие на сердце остается неясным: он может уменьшать симптомы со стороны сердца, но может и вызывать серьезные проблемы сердечного ритма. В клинических испытаниях занамивира у взрослых не было повышенного риска по сообщённым неблагоприятным событиям. Свидетельства возможного вреда, связанного с лечением детей занамивиром, были разрозненные.
Соответствие другим результатам
Отсутствие качественных доказательств, демонстрирующих влияние на осложнения [гриппа], согласуется с осторожными выводами по обоим лекарствам, сделанными Администрацией по контролю за лекарствами и пищевыми продуктами США (FDA). FDA разрешила заявления только по эффективности обоих лекарств в профилактике и лечении симптомов гриппа, но не по другим эффектам (в том числе прерывание распространения вируса от человека к человеку или профилактика пневмонии). FDA описала эффективность обоих препаратов в целом, как "скромную".
Механизм развития благоприятных эффектов
Эти результаты позволяют предположить, что низкий иммунный ответ с низким уровнем прововоспалительных цитокинов, вызванный действием осельтамивира карбоксилата, может уменьшать симптомы гриппа, не связанные с подавлением размножения (репликации) вируса гриппа. Потенциальный гипотермический или жаропонижающий эффект осельтамивира как депрессанта центральной нервной систем, также может вносить вклад в очевидное сокращение симптомов пораженного организма. Заявления о способности осельтамивира прерывать передачу [от человека к человеку] вируса и уменьшать осложнения не поддерживаются никакими данными, к которым мы имели доступ.
Механизм действия, предложенный производителем, (специфичный для вируса гриппа) не соответствует клиническим доказательствам, что позволяет предполагать мультисистемное и центральное действие.
В структуре острых респираторных вирусных инфекций (ОРВИ) грипп занимает ведущее место по показателям тяжелых форм клинического течения, госпитализации, развития осложнений и летальности в период как эпидемий, так и пандемий [1–3].
С появлением и быстрым распространением в 2009 г. нового вируса гриппа A(H1N1)pdm09 изменилась структура циркулирующих штаммов, а также их долевое участие в последующих эпидемических сезонах [4, 5]. В странах Северного полушария в сезонах 2009–2010, 2010–2011, 2012–2013 и 2015–2016 гг. доминировал вирус гриппа A(H1N1)pdm09. Следует отметить, что вирус гриппа A(H1N1)pdm09 низкочувствителен к препаратам адамантанового ряда (римантадину и амантадину). Вирус гриппа A(H3N2) не циркулировал только в сезоне 2009–2010 гг. и проявлял максимальную активность в сезонах 2011–2012 и 2014–2015 гг. Вирус гриппа B наблюдался в период всех семи сезонов и значительную долю в структуре циркулирующих вирусов гриппа занимал в сезонах 2014–2015 и 2015–2016 гг.
Деятельность экспертов Всемирной организации здравоохранения (ВОЗ) предполагает, в частности, мониторинг чувствительности циркулирующих штаммов к применяемым на практике препаратам, оценку их эффективности в лечении и профилактике, а также разработку и внедрение новых форм. Названные направления имеют значение для диверсификации запасов антивирусных препаратов во избежание появления резистентных к ним штаммов и закрепления последних в популяции циркулирующих вирусов гриппа.
В настоящее время ингибиторы нейраминидазы являются референтными и рекомендованы ВОЗ для лечения и профилактики гриппозной инфекции, обусловленной сезонными вирусами гриппа и новым вирусом гриппа с пандемическим потенциалом. Ингибиторы нейраминидазы эффективны также в отношении высокопатогенных вирусов гриппа птиц A(H5N1), A(H7N9) и A(H5N6), случаи инфицирования которыми в последнее время зарегистрированы среди людей [6, 7].
Разработка данной группы препаратов относится к целевым достижениям ученых, которые использовали современные данные о структуре и свойствах одного из поверхностных белков вируса гриппа – нейраминидазы, выполняющей роль и антигена, и фермента [8]. Препараты с антинейраминидазной активностью имитируют структуру натуральных субстратов каталитического сайта нейраминидазы, привлекая вирус к большему взаимодействию. Это не позволяет нейраминидазе действовать в роли фермента для высвобождения из конгломерата на поверхности клетки-хозяина новых поколений вируса, в результате чего предотвращается их распространение на восприимчивые клетки.
Первые официальные сообщения о новых препаратах с антинейраминидазной активностью появились в 1993 г. (занамивир) и 1997 г. (осельтамивир). Практическое применение препаратов началось в 1999 г. При этом осельтамивир быстро завоевал позиции препарата выбора в лечении гриппозной инфекции в период эпидемий и создании резерва на случай пандемии [6]. Причиной тому в определенной степени послужила высокая частота резистентных к римантадину и амантадину штаммов высокопатогенного вируса гриппа птиц A(H5N1), инфицировавших людей в период 2003–2004 гг. С появлением в 2007 г. резистентных к осельтамивиру штаммов вируса гриппа A(H1N1) эксперты ВОЗ изменили рекомендации в отношении подготовки к пандемии, дополнив перечень используемых препаратов занамивиром.
В России с 2001 г. осельтамивир (Тамифлю®) разрешен для лечения детей с одного года, для профилактики гриппа – с 12 лет. В 2005 г. показания к применению были расширены и препарат рекомендовали для лечения и профилактики детей с одного года. В 2007 г. разрешили применение занамивира (Реленза®) у детей с пяти лет и взрослых без ограничения возраста.
К настоящему моменту накоплен огромный практический опыт использования осельтамивира и занамивира в лечении и профилактике гриппозной инфекции как в России, так и за рубежом. Кроме того, в ряде клинических исследований подтверждена высокая эффективность данных препаратов [9, 10]. В частности, C.J. Heneghan и соавт. опубликовали систематический обзор и метаанализ данных об эффективности антинейраминидазных препаратов, в том числе в отношении показателей смертности и риска развития побочных реакций [11].
Показано, что осельтамивир сокращает длительность клинических симптомов у взрослых на 16,8 часа (95%-ный доверительный интервал (ДИ) 8,4–25,1), занамивир – на 14,4 часа (ДИ 9,6–19,2). Оба препарата продемонстрировали эффективность при лечении пневмонии (разность рисков (РР) 1,0%; ДИ 0,2–1,5 и РР 0,3%; ДИ 0,1–0,4 соответственно). Профилактическое применение препаратов повышало риск возникновения тошноты у 3,7% взрослых, рвоты – у 4,6% взрослых и 5,3% детей. Профилактика осельтамивиром и занамивиром снижала риск развития клинических симптомов гриппозной инфекции у отдельных лиц (РР 3,1%; ДИ 1,8–3,9 и РР 1,98%; ДИ 1,0–2,5 соответственно) и в семьях (РР 13,6%; ДИ 9,5–15,5 и РР 14,8%; ДИ 12,2–16,6 соответственно). Во время и после лечения осельтамивиром имели место психические расстройства (РР 1,06%; ДИ 0,07–2,8) и во время лечения головные боли (РР 3,2%; ДИ 0,9–5,8). Результаты 30 исследований показали зависимость частоты летальных исходов от времени начала приема препарата и снижение риска летальных исходов у пациентов, инфицированных пандемическим вирусом гриппа A(H1N1)pdm09. Авторы также указали, что, решая вопрос об использовании осельтамивира и занамивира, следует обосновывать необходимость их назначения и учитывать потенциальный риск развития побочных эффектов.
S.G. Muthuri и соавт. провели метаанализ исследований эффективности ингибиторов нейраминидазы у пациентов с пневмониями, этиологически связанными с вирусом гриппа A(H1N1)pdm09 [12]. Авторы проанализировали индивидуальные данные 20 634 пациентов, у которых был диагностирован грипп, вызванный вирусом A(H1N1)pdm09 (лабораторно подтвержден у 20 021 пациента, клинически – у 613). Рентгенологическое подтверждение пневмонии было также обязательным критерием включения пациентов в анализ. Исследователи установили, что раннее назначение антинейраминидазных препаратов не снижало риск развития вирусной пневмонии, но достоверно сокращало частоту случаев подключения больных к искусственной вентиляции легких и летальных исходов.
Препараты с антинейраминидазной активностью являются препаратами выбора при лечении гриппозной инфекции у беременных. A.B. Beau и соавт. оценивали безопасность осельтамивира у 337 беременных и 674 небеременных женщин с гриппозной инфекцией. Достоверных различий по таким показателям, как самопроизвольный аборт (относительный риск (ОР) 1,52; 95% ДИ 0,80–2,91), преждевременные роды (ОР 0,64; 95% ДИ 0,31–1,27) и патология плода (ОР 0,62; 95% ДИ 0,23–1,54), не выявлено [17].
Одним из направлений в разработке новых противогриппозных препаратов является изучение эффективности инъекционных форм, в частности занамивира и перамивира. Такие формы имеют особое значение для пациентов, испытывающих затруднения (желудочный стаз, мальабсорбция, наличие рвоты, бронхоспазм) при использовании пероральных или ингаляционных форм.
Перамивир – противогриппозный препарат, избирательно ингибирующий нейраминидазу вирусов гриппа человека, а также потенциально активный в отношении нейраминидазы высокопатогенного вируса гриппа птиц A(H5N1). Химическая структура перамивира позволяет взаимодействовать с нейраминидазой вируса гриппа с большим сродством, чем осельтамивир. В лабораторных исследованиях у перамивира регистрировались меньшие значения ингибирующих концентраций по сравнению с другими ингибиторами нейраминидазы [18–20].
Результаты изучения эффективности перамивира в плацебоконтролируемых исследованиях у взрослых, как входящих, так и не входящих в группы риска, продемонстрировали, что введение препарата в дозах 300/600 мг/сут в течение одного – пяти дней значительно сокращает длительность клинических симптомов по сравнению с группой контроля. Средняя продолжительность клинических симптомов составила 68,6 часа (90% ДИ 30,0–82,7), у принимавших 300 мг/сут – 114,4 часа (90% ДИ 40,2–253,3), у получавших 600 мг/сут – 42,3 часа (90% ДИ 30,0–82,7). Побочные реакции зарегистрированы у 33,3% пациентов. Какие-либо серьезные клинические симптомы отсутствовали. При измерении концентрации препарата в крови не выявлено признаков его накопления и задержки выведения.
T. Hikita и соавт. изучали эффективность перамивира у 223 детей в возрасте до 18 лет. Средняя продолжительность лихорадки составила один день. Этот показатель существенно отличался от аналогичного показателя в группе сравнения – два дня на фоне применения занамивира (p = 0,02420). Побочных реакций не зарегистрировано, что позволило рекомендовать перамивир для использования в педиатрической практике [21]. Убедительные данные о безопасности препарата, в том числе у беременных и госпитализированных пациентов с тяжелыми формами гриппа, получавших постоянную заместительную почечную терапию и экстракорпоральную мембранную оксигенацию, позволили начать его практическое применение в Японии в 2010 г. (Rapicta), а затем в США и Южной Корее [22].
Ланинамивир (R-125489, или CS-8958) – одна из последних удачных разработок японских ученых, занимающихся поиском новых препаратов с антинейраминидазной активностью. Ланинамивир в отличие от представленных в настоящем обзоре препаратов обладает продолжительным действием: его однократное интраназальное введение на курс лечения подтверждено результатами клинических исследований в 2008–2009 гг. [23–25]. Эффективность ланинамивира сравнима с таковой других препаратов с антинейраминидазной активностью. Однако одним из его преимуществ является снижение риска инфицирования контактирующих лиц при прерывании или недостаточности курса других препаратов на фоне длительно протекающей инфекции, особенно вызванной вирусом гриппа A(H1N1)pdm09. Ланинамивир (инавир), в настоящее время производимый компанией Daiichi Sankyo Co., Ltd (Tokyo), в Японии разрешен для лечения с 2010 г., для профилактики – с 2012 г.
В 2014–2015 гг. частота штаммов вирусов гриппа с пониженной чувствительностью к препаратам с антинейраминидазной активностью была низкой – 1,9%, в 2015–2016 гг. – около 1,0%. Большинство штаммов были выделены у больных, получавших курс лечения осельтамивиром, или пациентов с иммунодепрессивными состояниями [28, 29].
Таким образом, учитывая низкую частоту штаммов с пониженной чувствительностью к препаратам с антинейраминидазной активностью, можно утверждать, что они остаются препаратами выбора в лечении и профилактике гриппозной инфекции. К практическому применению рекомендованы новые препараты, а также их формы. В 2016 г. в России зарегистрирован отечественный препарат с антинейраминидазной активностью – Номидес, активным веществом которого является осельтамивир.
19 декабря 2017
- 1617
- 1,2
- 0
- 1
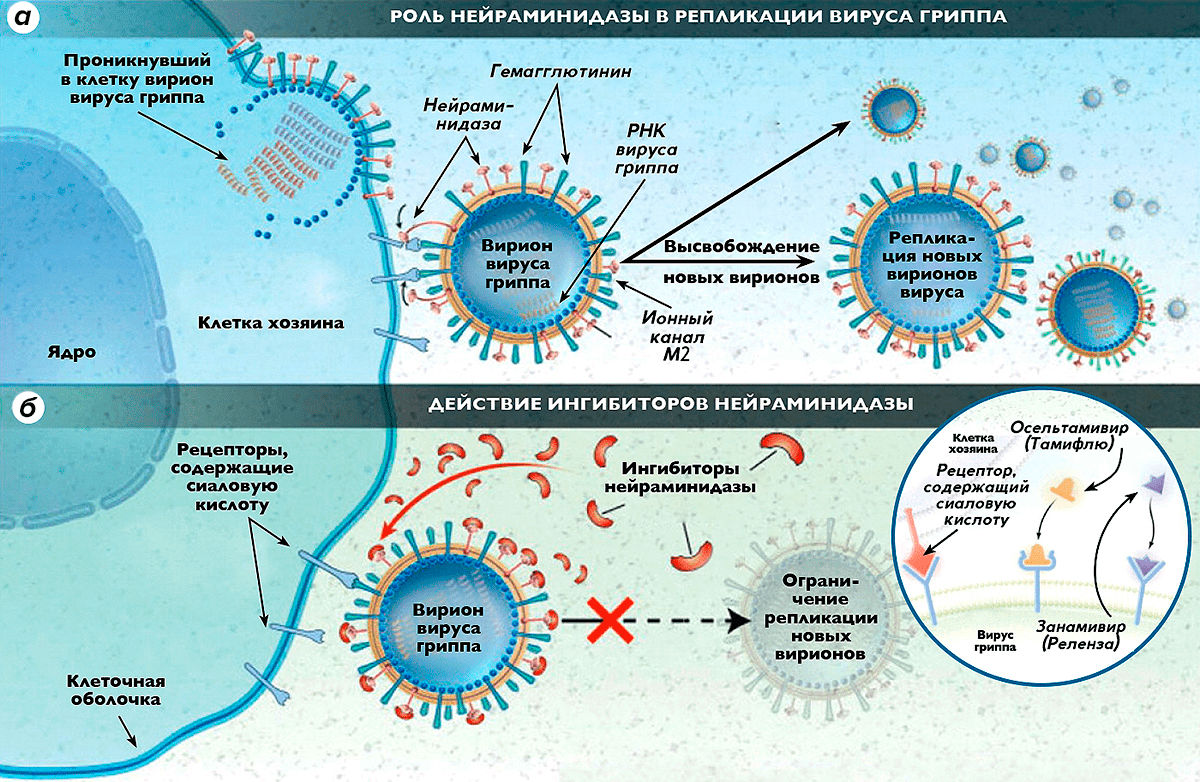
Рисунок 1. Роль нейраминидазы в репликации вируса гриппа и действие ингибиторов нейраминидазы. а — В наружной липидной оболочке вириона вируса гриппа типа А имеются 3 основных белка (гемагглютинин, нейраминидаза и ионный канал М2), играющих основную роль в инфекционном процессе. Шипчики гемагглютинина объединяются с рецепторами восприимчивой клетки хозяина, связываясь с сиаловой кислотой, входящей в состав этих рецепторов. Нейраминидаза отщепляет концевые группы клеточных рецепторов, содержащих сиаловую кислоту, в результате чего клетка теряет способность распознавать антиген, и вирус проникает внутрь нее. Далее в клетке хозяина происходит сборка новых вирионов вируса, которые при помощи нейраминидазы выходят из поврежденной клетки, разносясь с кровотоком и заражая новые клетки. б — Ингибиторы нейраминидазы нарушают способность вирусов гриппа проникать в здоровые клетки, блокируют действие нейраминидазы внутри клетки хозяина, делая невозможным высвобождение из нее новых поколений вирионов вируса гриппа и, соответственно, препятствуя заражению новых клеток.
Каковы альтернативы?
Эффективно? Нет?
До сих пор ингибиторы нейраминидазы принято считать препаратами с недоказанной эффективностью, обладающими к тому же выраженными побочными эффектами, и многие адепты доказательной медицины уверены в их полной бесполезности. Доказательством этой точки зрения обычно служат выводы метаанализа независимой исследовательской организации Cochrane (бывшая The Cochrane Collaboration). Однако — и это самое странное — именно они окончательно запутывают дело.
Эксперты из Cochrane анализировали ингибиторы нейраминидазы несколько раз (рис. 2), и до 2009 года их отчеты практически ничем не отличались от официальных выводов и информации Roche. Однако в 2009 году грянул гром: японский педиатр Кейдзи Хаяси усомнился в качестве их данных и провел собственное расследование.
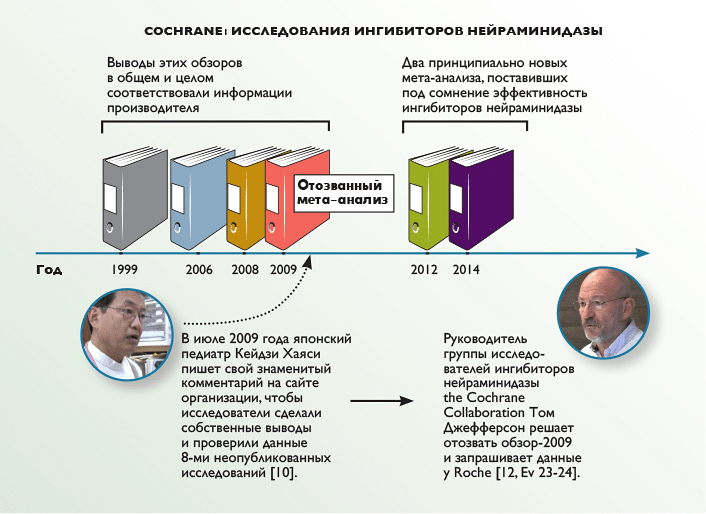
Рисунок 2. Cochrane: исследования ингибиторов нейраминидазы.
Тогда, в 2009 году, пообещав детально разобраться в ситуации, руководитель исследовательской группы ингибиторов нейраминидазы Cochrane — эпидемиолог Том Джефферсон поднял опубликованные материалы и с удивлением обнаружил, что оригиналы данных придется искать в архивах производителя. Тогда он обратился к Roche с просьбой предоставить необходимые материалы. Концерн долго артачился и даже предлагал Джефферсону подписать соглашение о неразглашении (тот, естественно, отказался), но в конце концов уступил и выслал семь небольших документов.
Таких как IL-6, IL-10, IFN-γ, TNF-α, MIP-1α и −1β, MCP-1.
И еще кое-что про пониженные титры антител. Не удивительно, что в конечном итоге этот феномен сказывается на риске дальнейшего повторного заражения: Том Джефферсон и его коллеги отмечают, что снижение титров защитных антител у пациентов из групп лечения согласуется с данными испытаний на животных, показавших, что по сравнению с группой контроля, применение препарата у подопытных мышей привело к выделению недостаточного уровня секреторного иммуноглобулина IgA (а также подавлению индукции IgA-образующих клеток) на слизистой носа, но при этом не оказало значительного влияния на системный IgG-ответ [22]. А это может означать, что существует риск повторного заражения пациента, у которого вследствие терапии осельтамивиром выработался недостаточный иммунный ответ слизистой оболочки (IgA) [22]. Однако эти данные не указывают на отсутствие лечебного эффекта. Что же касается риска повторного заражения, то он может быть естественным процессом вследствие низкого уровня выработанных защитных антител.
В общем, чтобы подтвердить негативное действие ингибиторов нейраминидазы на иммунный ответ, необходимо хотя бы изучить различие количества антител при разной концентрации вируса, а также понять, спустя какое время после момента заражения регистрировалось это различие, и как параллельно снижалась вирусная нагрузка (рис. 3 и 4). В целом, снижение указанных параметров по сравнению с группой контроля может быть как следствием иммуносупрессивного действия препаратов, так и результатом быстрого подавления репликации вируса, не позволяющего развиться полноценному иммунному ответу.
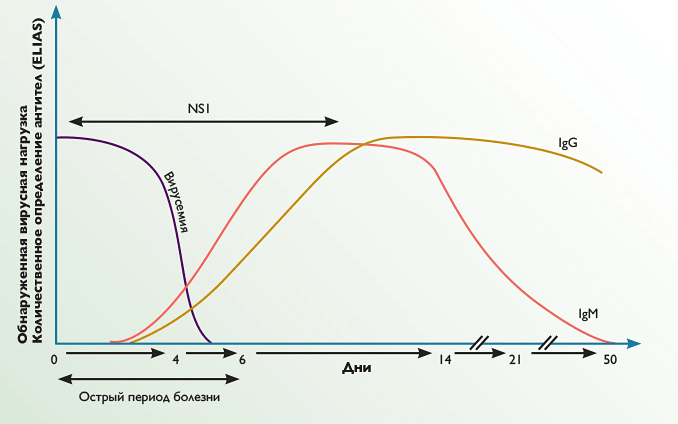
Рисунок 3. Временнáя кривая накопления антител.
ГРИПП - это распространенное заболевание, возбудителями которого являются вирусы семейства Orthomyxoviridae. Вирусы гриппа А и В вызывают эпидемии заболевания, в то время как вирус гриппа С считают причиной развития легких респираторных инфекций. Хотя грипп в большинстве случаев характеризуется относительно благоприятным течением и заканчивается выздоровлением, серьезность этого заболевания не следует недооценивать. Во-первых, у части больных развиваются осложнения, среди которых наиболее серьезными являются пневмония и обострения хронических заболеваний дыхательной и сердечно-сосудистой систем. Частота осложнений в целом не велика, однако абсолютное число таких больных может быть значительным за счет высокой распространенности гриппа в период эпидемий. Кроме того, риск осложнений повышен у детей, пожилых людей, больных, страдающих серьезными сопутствующими заболеваниями. В США от гриппа ежегодно умирают 10000-40000 человек. Примерно 20% из них ранее не страдали какими-либо болезнями [1]. Во-вторых, ежегодные эпидемии гриппа оборачиваются огромными экономическими потерями, которые на 90% связаны с временной нетрудоспособностью и снижением производительности труда. В-третьих, по мнению экспертов ВОЗ, мир в настоящее время стоит на пороге пандемии гриппа, которая может унести миллионы жизней. В связи с этим необходимо иметь четкие представления о современных подходах к профилактике и лечению этого заболевания, которые помимо общих мер включают в себя вакцинацию и применение противовирусных препаратов - ингибиторов М2-каналов и нейраминидазы. В России с целью профилактики гриппа используют также дипиридамол, индукторы интерферона, различные гомеопатические средства, эффективность которых в контролируемых клинических исследованиях не доказана.
Строение и репликация вирусов гриппа
Вирусы гриппа представляют собой шаровидные РНК-вирусы диаметром 80-120 нм, на поверхности которых находятся гемагглютинин и нейраминидаза. В оболочке вирусов гриппа А и В имеются М2- и NB-каналы соответственно. После попадания вируса в организм человека гемагглютинин связывается с сиаловой кислотой на эпителиальных клетках, выстилающих дыхательные пути. Вирус проникает в эпителиальную клетку путем эндоцитоза и начинает размножаться. Образующиеся вирионы транспортируются на поверхность клетки и остаются связанными с ней мостиком между гемагглютинином и сиаловой кислотой. Нейраминидиза разрушает этот мостик и обеспечивает высвобождение новых вирусов, которые инфицируют другие клетки [2].
Вирусы гриппа А и В находятся в состоянии генетического дрейфа, сопровождающегося накоплением мутаций, которые приводят к изменению структуры гемагглютинина и/или нейраминидазы. Эти мутации, возникающие спонтанно или под действием противовирусных антител, вызывают появление новых штаммов вируса, которые быстро распространяются среди людей, обладающих частичным иммунитетом, и вызывают ежегодные эпидемии гриппа. Реже происходят более выраженные изменения генетической структуры вирусов гриппа ("антигенный шифт"), вероятной причиной которых считают гибридизацию генов вирусов гриппа А человека и животных. Крупным резервуаром вирусов гриппа являются водяные птицы. Антигенный шифт может привести к пандемии гриппа, которая характеризуется высокой заболеваемостью и смертностью, так как большинство людей обладают слабым иммунитетом или не обладают иммунитетом к новому штамму вируса. Учитывая постоянные изменения вируса, формирование стойкого иммунитета к гриппу невозможно.
Эффективным методом профилактики гриппа является вакцинация. С этой целью обычно используют расщепленные инактивированные вакцины для внутримышечного применения, содержащие очищенные вирусы гриппа трех штаммов, состав которых ежегодно изменяется с учетом эпидемиологической обстановки. Кроме того, существуют субъединичные вакцины, содержащие только поверхностные белки вируса гриппа и обладающие пониженной реактогенностью. Разрабатываются также живые ослабленные вакцины против гриппа для интраназального или перорального применени. Вакцинацию обычно проводят в период с октября до конца ноября. Антитела у взрослых образуются в течение 2 недель и сохраняются в течение года. Если имеется соответствие между вирусами, включенными в вакцину, и циркулирующими вирусами, то вакцинация обеспечивает снижение частоты лабораторно подтвержденной инфекции у здоровых взрослых людей на 70-90%, а также уменьшает число визитов к врачу, длительность болезни и потребление антибиотиков на 34-44, 32-45 и 25% соответственно [3].
Вакцинация против гриппа в первую очередь показана пациентам группы риска, у которых наиболее высока вероятность развития осложнений в случае инфекции [4]:
- пожилые люди в возрасте 65 лет и старше;
- взрослые и дети, страдающие хроническими заболеваниями легких, в том числе астмой, и сердечно-сосудистой системы;
- взрослые и дети, страдающие хроническими метаболическими заболеваниями (в том числе сахарным диабетом), нарушением функции почек, гемоглобинопатиями или иммуносупрессией;
- беременные женщины (если второй-третий триместры беременности приходятся на период возможной вспышки заболеванием ости гриппом).
По данным мета-анализа исследований, в которых изучалась эффективность инактивированной вакцины против гриппа у пациентов в возрасте 65 лет и старше [4], вакцинация привела к снижению заболеваемости гриппом на 35%, а также частоты госпитализаций по поводу пневмонии и гриппа на 33%, госпитальной смертности от этих заболеваний на 47% и общей смертности на 50%. Многие эксперты рекомендуют проводить вакцинацию у людей в возрасте от 50 до 64 лет, так как среди них высока доля пациентов группы риска [5], а также у медицинских работников и членов семей (включая детей) людей, у которых высок риск развития осложнений гриппа.
Целесообразность вакцинации молодых взрослых людей более спорная, учитывая низкий риск неблагоприятных исходов в случае развития заболевания. В этом случае следует учитывать не только медицинские, но и экономические аспекты вакцинации, т.е. соотношение между ее стоимостью (затраты на саму вакцину и ее введение, лечение возможных нежелательных эффектов и т.п.) и экономией затрат, связанных с гриппом. С.Bridges и соавт. [6] в двойном слепом, плацебоконтролируемом исследовании проанализировали эффективность вакцинации против гриппа более чем у 1000 здоровых взрослых людей в возрасте от 18 до 64 лет. При наличии соответствия между вирусами, включенными в состав вакцины, и циркулирующими вирусами эффективность вакцинации составила 86% (р=0,001). У пациентов основной группы было отмечено снижение частоты гриппоподобных заболеваний, числа визитов к врачу и временной нетрудоспособности на 34, 42 и 32% соответственно.
Основным нежелательным эффектом парентерального введения вакцины являются местные реакции, которые обычно легко выражены и быстро проходят. Например, в рандомизированном, плацебоконтролируемом исследовании у 729 пожилых людей частота реакций в месте введения вакцины составила 11,3% в основной группе и 5,1% в группе плацебо, однако частота системных побочных эффектов не отличалась [7]. Эффективность вакцины не снижается при повторном применении [8].
Таким образом, вакцинация является эффективным методом профилактики гриппа. Ее проведение наиболее обосновано у пожилых людей и других пациентов, у которых высок риск развития осложнений в случае развития инфекции. Следует учитывать, что вакцинация проводится далеко не всем людям, которым она показана. Эффективность ее снижается при несовпадении вакцинных и циркулирующих штаммов. В случае пандемии гриппа потребуются месяцы, что создать вакцину и произвести ее в достаточном количестве. В связи с этим важное значение имеет разработка эффективных методов лечения гриппа.
Амантадин и ремантадин были открыты в 60-х годах и используются с начала 80-х гг. Оба препарата оказывают действие на М2-каналы вируса гриппа А и, соответственно, не эффективны в отношении вируса гриппа В. Через М2-каналы в вирусные частицы проникают ионы водорода, которые вызывают диссоциацию комплекса М1-белка и рибонуклеопротеида и обеспечивают поступление последнего в ядро клетки и начало репликации [9]. Профилактическое применение амантадина и римантадина в сезон гриппа снижает его частоту на 61% и 72% соответственно [10]. При лечении гриппа оба препарата уменьшали длительность болезни примерно на 1 день. Однако они вызывали выраженные желудочно-кишечные нарушения (тошноту, рвоту, диспепсию), а у больных, получавших амантадин, частота нежелательных реакций со стороны центральной нервной системы (ЦНС) была в два раза выше, чем в группе плацебо. Неврологические расстройства включают в себя тревогу, депрессию, бессонницу, частота которых у здоровых людей достигает 10%. При более высоких концентрациях амантадина могут развиться галлюцинации и судороги. В плацебоконтролируемом исследовании у студентов профилактическое применение ремантадина и амантадина сопровождалось развитием неврологических расстройств в 6 и 13% случаев соответственно, а плацебо - в 4% [11].

Рис. 1. Механизм действия ингибиторов нейраминидазы [2]
Недостатком ингибиторов М2-каналов является также быстрое появление устойчивых штаммов вируса гриппа. При анализе более 60000 штаммов H3N2 вируса гриппа А, выделенных в различных странах мира, выявлено увеличение устойчивости к ингибиторам М2-каналов с 0,4% в 1995 году до 12,3% в 2004 году [12]. Частота устойчивости оказалась самой высокой в Азии: в Гонг Конге и Китае в 2004 году резистентными были соответственно 69,6% и 73,8% выделенных штаммов. В США были изучены штаммы вируса гриппа А, выделенные в сезон гриппа 2005-2006 гг. 92,3% (193/209) штаммов H3N2 и 25% (2/8) штаммов H1N1 содержали замену аминокислоты в положении 31 гена М2-канала; подобные изменения коррелируют с устойчивостью к ингибиторам М2-каналов [13]. Между амантадином и ремантадином существует перекрестная резистентность, т.е. формирование устойчивости к одному препарату означает наличие резистентности и к другому.
На основании результатов вирусологических исследований Центры по контролю по заболеваний в США не рекомендовали применение амантадина или ремантадина для лечения или профилактики гриппа А в 2005-2006 гг. [14]. Сходное решение приняло Канадское агентство по охране здоровья [15].
Нейраминидаза находится на поверхности вирусов гепатита А и В и играет важную роль в репликации вируса. Хотя генетическая структура вирусов гриппа и нейраминидаза постоянно меняются, аминокислотная последовательность активного участка фермента остается постоянной, что делает ее идеальной мишенью для противовирусной терапии. Изучение трехмерной структуры нейраминидазы послужило основой для разработки ингибиторов этого фермента (рис. 1) [2]. В настоящее время существуют два препарата этой группы - осельтамивир и занамивир. Первый предназначен для приема внутрь, в то время как второй может использоваться только ингаляционным путем. В России занамивир не зарегистрирован, в то время как осельтамивир (Тамифлю) разрешен к применению. Осельтамивир карбоксилат плохо всасывается при приеме внутрь, поэтому была разработана пролекарственная форма препарата (этиловый эфир осельтамивира фосфата), которую можно принимать перорально. Пролекарство быстро превращается в активную форму (осельтамивира карбоксилат) под действием печеночных эстераз.
Осельтамивир выпускается в капсулах по 75 мг или в виде порошка для приготовления пероральной суспензии. Осельтамивир применяют для лечения гриппа А или В у детей (в возрасте >1 года), подростков и взрослых. Лечение осельтамивиром следует начинать как можно раньше в течение первых 48 ч после появления симптомов и продолжать в течение 5 дней. Осельтамивир используют также для профилактики гриппа людей, которые имели контакт с больными, и сезонной профилактики. Профилактику следует начинать в течение 2 дней после контакта и продолжать в течение 10 дней. В Европе осельтамивир разрешен к применению для сезонной профилактики у взрослых и детей старше 1 года. Длительность сезонной профилактики осельтамивиром может достигать 6 недель [16]. Рекомендуемые дозировки в различных группах больных приведены в табл. 1.
Таблица 1. Рекомендуемые лечебные и профилактические дозы осельтамивира в различных возрастных группах
| Больные | Лечение (5 дней) | Профилактика после контакта (10 дней) | Сезонная профилактика (до 6 нед) |
|---|---|---|---|
| Взрослые, подростки (≥13 лет) и дети с массой тела более 40 кг | 75 мг два раза в день | 75 мг один раз в день | 75 мг один раз в день |
| Дети Масса тела, кг ≤15 > 15-23 23-40 30 мг два раза в день 30 мг один раз в день 30 мг один раз в день | |||
| Почечная недостаточность у взрослых Клиренс креатинина, мл/мн >30 >10-30 Обычная доза Обычная доза Не рекомендуется |
Осельтамивир карбоксилат - это активный метаболит осельтамивира, являющийся селективным ингибитором нейраминидазы вирусов гриппа. Подавляя активность этого фермента, он предупреждает высвобождение образующихся вирусов из клетки хозяина и, таким образом, ограничивает распространение инфекции. В опытах in vitro осельтамивир карбоксилат проявлял активность в отношении всех известных штаммов вирусов гриппа А и В. Доза, необходимая для ингибирования активности нейраминидазы на 50%, составляет менее 5 нМ. После приема внутрь осельтамивир хорошо всасывается на всем протяжении желудочно-кишечного тракта [17] и быстро превращается в активный метаболит осельтамивира карбоксилат. Препарат обладает высокой биодоступностью. Примерно 80% принятой внутрь дозы осельтамивира поступает в системный кровоток в виде активного метаболита [18]. Пища не влияет на биодоступность осельтамивира карбоксилата.
Почечный клиренс осельтамивира карбоксилата снижается параллельно с ухудшением функции почек [18]. У больных легкой и умеренной почечной недостаточностью нет необходимости изменять дозу осельтамивира. У больных тяжелой почечной недостаточностью (клиренс креатинина
Читайте также:


