Поверхностные белки вируса гриппа
Вирусы гриппа А и В являются важными возбудителями респираторных заболеваний человека. ВГ представляют род Orthomyxovirus в составе семейства Orthomyxo-viridae. По различию специфических антигенов нуклеопротеина (НП) и матриксного белка они делятся на 3 типа: А (1933), В (1940) и С (1949). Оба типа вирусов (и А, и В) вызывают сезонные эпидемии гриппа, а с межсезонья - спорадические случаи и вспышки. В умеренном климате сезонные эпидемии обычно наблюдаются зимой, в то время как в тропических регионах грипп может наблюдаться в течение всего года. ВГ типа А описаны по номенклатуре, включающей биологического хозяина, географическое происхождение, номер штамма и год его выделения. Вирусы гриппа А делятся на подтипы по разным белкам на их поверхности: гемагглютинин (Н) и нейраминидаза Антигенная классификация по поверхностным белкам Н и N дана в скобках, например А/Гонконг/1/68(H3N2). Вместе с тем H5N1-вирус имеет Н5- и N1-белок, а H7N9 - Н7- и N9-белок. Возможно много комбинаций Н- и белков. Всего насчитывается 17 антигенных подтипов гемагглютинина (Н1-Н17) и 10 подтипов нейраминидазы (N1^10). Тип А: наиболее опасный тип вируса, который дает вспышки каждые 2-3 года, способен к мутации с образованием нового штамма, тяжелые симптомы болезни с высокой лихорадкой, может быть причиной смерти и, кроме человека, может поражать некоторых животных, птиц, свиней, лошадей. Среди штаммов вируса гриппа В и С подтипы не выделяются, т. к. вариантов антигенов Н и N у них значительно меньше. Все подтипы вируса гриппа обнаруживают только у водоплавающих птиц.
Пандемический вирус гриппа 2009 г. А(Н1) имел характеристики, которые ранее не встречались, был чрезвычайно заразен и вызвал пандемию гриппа. Этот вирус очень опасен, т. к. дает значительное число осложнений гриппа. Пандемический вирус А(Н109 с 2009 г. в настоящее время свободно циркулирует среди людей как сезонный вирус гриппа.
Вирус гриппа А уникально приспособлен к размножению в клетках человека, животных и птиц благодаря своей структуре: 1) односетевая сегментированная РНК, каждый сегмент которой имеет самостоятельную транскрипцию РНК вируса гриппа, что способствует реассортации РНК частиц разных вирусов; 2) мембрана вируса из 2 липидных слоев, которая формируется за счет клетки хозяина и состоит из матричного белка мембраны - М1 и трансмембранного белка (только в типе А - М2); 3) типоспецифический антиген НП, по которому разделяют вирусы гриппа на типы А, В и С; 4) матричные полипептиды Р, ассоциированные с НП, осуществляют РНК-транскрипцию вириона (полимераза РА, РВ1, РВ2); 5) большой гликопротеид гемагглютинин (Н), который осуществляет адсорбцию вирионов на клеточных рецепторах мембраны клетки и синтезируется как отдельный первичный продукт одного гена. У человека, свиней и лошадей наибольшее значение имеют три подтипа Н: Н1, Н2 и Н3; 6) полипептид нейраминидазы (является гликопротеидом с субъединицами, он обладает способностью нарушать поверхностные гликопротеиды клеток. У человека, свиней и лошадей наибольшее значение имеют два подтипа N N1 и N2, 7) неструктурные белки и NS2) направлены на локальное подавление системы интерферона и создание местной иммуносупрессии.
Вирусы гриппа обладают способностью к изменчивости поверхностных гликопротеидов (Н и N и относительно низкой иммуногенностью. Частичная антигенная изменчивость поверхностных гликопротеидов (например, обусловленная точечными мутационными процессами), называемая антигенным дрейфом, является причиной развития эпидемии каждые 2-3 года. Крупная или полная замена одного подтипа Н (реже N на другой, называемая шифтом, приводит к развитию пандемии гриппа. Ядерная фаза репликации вирусов гриппа зависит от ДНК клетки хозяина, фрагментарность их генома обусловливает аномальную склонность к рекомбинации и генетическим пересортировкам. Генетическая рекомбинация между вирусом гриппа А человека и животных или птиц прослеживается каждые 10 лет. Вирус гриппа типа В не демонстрирует антигенные шифты из-за отсутствия резервуара гриппа среди животных и не подразделяется на подтипы. Однако одновременная циркуляция 2 различных антигенных линий гриппа В (Виктория и Йамагата) была зафиксирована во многих территориях мира .
Грипп - воздушно-капельная инфекция. Пути заражения: воздушно-капельный, контактный, контактно-бытовой. Входные ворота - эпителий респираторного тракта. Схема развития инфекции следующая: после проникновения вируса гриппа в дыхательные пути гемагглютинин (НА) вируса активируется протеазами хозяина и связывается с сиаловой кислотой эпителиальной клетки, методом эндоцитоза проникает внутрь клетки, где происходит размножение и сборка вирионов за счет структур клетки хозяина, транспортировка вирионов на поверхность клетки, в оболочке которой находятся Н-, N- и М2-каналы. После сборки вирионов нейраминидаза (NA) разрушает мостик с поверхностью клетки и сиаловой кислотой и высвобождает новые вирусы.
Инкубационный период при гриппе колеблется от 1-го до 4 дней, в среднем составляя 2 дня. У младенцев и детей раннего возраста передача выделяемых вирусов может начаться перед самым началом появления симптомов и продолжаться в течение 2 нед. после начала заболевания, тогда как у взрослых выделение вируса обычно непродолжительное. Дети, посещающие дошкольные учреждения и школы, являются важным источником распространения гриппа среди населения.
Клинические синдромы у больного гриппом связаны с поражением эпителия респираторного тракта, подавлением функции макрофагов и Т-лимфоцитов, развитием вторичной бактериальной инфекции, виремии, токсикоза с поражением капилляров, нейротоксическим синдромом. По данным 2009 г., среднетяжелое и тяжелое течение гриппа среди пациентов, обратившихся за медицинской помощью, встречалось в 76% случаев.
Среди людей широко распространены подтипы гриппа А, которые в настоящее время циркулируют: H1N1-, H1N2- и Н3N2-вирусы. Тип В менее тяжелый, чем тип А, поражает ранее не болевших детей, дает небольшие вспышки, формирует иммунитет, мутации редкие
Ранняя диагностика гриппа имеет большое значение для правильного лечения и своевременной оценки эпидемиологической ситуации. Специфическая диагностика гриппа основана на выделении вируса гриппа из культуры клеток (оптимально в течение 3 дней от начала болезни), индикации и детекции вирусной нуклеиновой кислоты из мазков с помощью полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) в режиме реального времени (оптимально в течение 7 дней от начала болезни), быстром диагностическом тесте на наличие антигена вируса гриппа отпечатков и смывов со слизистой зева, носоглотки и мокроты с помощью иммунофлюоресцентного или иммуноферментного методов. Специфичность этих тестов составляет приблизительно 90-95%, а их чувствительность - приблизительно 50-70% в сравнении с культуральным методом или ОТ-ПЦР. Однако чувствительность варьирует, и в целом она выше у детей, чем у взрослых, и выше при гриппе А, чем при гриппе В.
Если у пациента тяжелое течение гриппа, то для исследования может быть взят аспират из нижних отделов дыхательных путей, который следует хранить в холодильной камере и исследовать в течение 48-72 ч, а при невозможности исследования заморозить и хранить при температуре -70 °С. Серологические исследования показывают увеличение титра IgG-антиН и комплементсвязывающих антител в 4 и более раза в течение 10-14 дней и свидетельствуют о перенесенном гриппе. Если генетические маркеры значимого вируса не могут полностью объяснить тяжесть клинических проявлений гриппа, то необходимо проводить вирусологическое исследование как можно раньше, чтобы выявить новый штамм вируса для создания вакцины, его тестирование по стандартному репрезентативному набору антител, а также определить генетические маркеры резистентности вируса к противовирусным препаратам.
Грипп дает ряд осложнений со стороны респираторной системы: пневмония первичная и вторичная бактериальная, обычно вызываемая Streptococcus pneumoniae, Haemophilus influenzae или Staphylococcus aureus, является частым осложнением гриппа, особенно у лиц преклонного возраста и лиц с определенными хроническими заболеваниями, эмпиема плевры, абсцесс легких, круп, брон-хиолит, обострение хронических болезней легких, острый респираторный дистресс-синдром, молниеносная форма гриппа с летальным исходом. Вакцинация против Pneumococcus пациентов с повышенным риском заболевания и лечение тяжелого заболевания противовирусными и антимикробными препаратами могут снизить смертность от ассоциированных с гриппом респираторных инфекций. Кроме того, при гриппе имеют место и нереспираторные осложнения: фебрильные судороги, синдром токсического шока с энцефалопатией и дистрофией печени (синдром Рейе), сепсис, миозит и миоглоби-нурия, миокардит, острый средний отит, менингит и другие неврологические осложнения, включая синдром Гийена - Барре, поперечный миелит и энцефалит, риск развития умственной недостаточности при воздействии вируса на плод во II триместре беременности. Частота осложнений у заболевших гриппом достигает 30%.
Для профилактики распространения гриппа большое значение имеют общие санитарно-гигиенические мероприятия, направленные на снижение распространения гриппа (отделение больного от здоровых, ношение маски, мытье рук, влажная уборка помещений, где находится больной гриппом) и своевременное лечение с применением противовирусных лекарственных средств. Имеется 2 классических антивирусных препарата для применения при гриппе: (i) ингибиторы трансмембранных ионных каналов (протеин М2) (амантадин, римантадин) и (ii) ингибиторы нейраминидазы (осельтамивир и занамивир и недавно появившиеся - перамивир и ланинамивир). ВОЗ рекомендует ингибиторы нейраминидазы как препараты первого ряда для лечения, требующего антивирусной терапии, т. к. циркулирующие в настоящее время вирусы резистентны к М2-ингибиторам. Устойчивость пандемического ВГ A(H1N1)2009 к адамантану в 2009-2010 гг. достигала 73%, но ВГ сезонный сохранял чувствительность.
Эпидемический подъем заболеваемости гриппом и ОРВИ в целом в России зарегистрирован на 2-й календарной неделе 2016 г. (11-17.01.2016) в 13 субъектах Российской Федерации (РФ) [2]. Пик эпидемии пришелся на 4-5-ю нед. (25-31.01.2016 и 01.02-07.02.2016), когда превышение эпидемических порогов было отмечено в 74 и 68 субъектах соответственно всех федеральных округов РФ с вовлечением в эпидемический процесс всех возрастных групп населения. В структуре циркулирующих вирусов преобладали вирусы гриппа А(Нт)2009 (82,0-85,0%). Снижение активности эпидемического процесса отмечалось к 8-й нед. и 16-й нед. не превышало пороговый уровень. В структуре респираторных вирусов превалировали вирусы негриппозной этиологии (65%), а среди вирусов гриппа доминировал вирус гриппа В.
На пике заболеваемости гриппом и ОРВИ зарегистрировано максимальное количество случаев внебольничной пневмонии (ВП) - 23-26 случаев в неделю, что превысило уровень 2015 г. в 1,9-2,3 раза и выше среднего многолетнего уровня (за 4 года) на 45-56%. При этом около 1% заболеваний закончились летальным исходом, что превысило средние многолетние уровни на 11-36%.
Тяжелые формы заболевания у вакцинированных против гриппа отсутствовали, что подтверждает эффективность иммунизации. Летальность была обусловлена сопутствующими заболеваниями и поздним обращением за медицинской помощью. В ходе подготовки к эпидемическому сезону 2015-2016 гг. было привито 44,9 млн человек, что составляет 31,3% общей численности населения страны.
Для того чтобы добиться оптимальной эффективности вакцины против вирусов, превалирующих как в Северном, так и Южном полушарии, антигенная структура вакцин пересматривается дважды в год и конкретизируется в соответствии с антигенной характеристикой циркулирующих вирусов гриппа, определенных ВОЗ в рамках глобальной системы эпиднадзора за гриппом (GISRS).
Вакцинация против гриппа - надежный способ защиты против опасной вирусной инфекции, а вакцинация против пневмококка - снижает риск заболевания пневмококковой пневмонией и другими пневмококковыми инфекциями (отит, заболевания нижних дыхательных путей, менингит и др С целью профилактики гриппа на территориях Российской Федерации регулярно проводится вакцинопрофилактика среди населения групп повышенного риска заболевания и тяжелого течения гриппа, которые представлены в национальном календаре прививок: дети с 6 месяцев, учащиеся 1-11 классов; студенты высших профессиональных и средних профессиональных учебных заведений; взрослые, работающие по отдельным профессиям и должностям (работники медицинских и образовательных учреждений, транспорта, коммунальной сферы); взрослые старше 60 лет; беременные; лица, подлежащие призыву на военную службу; лица с хроническими заболеваниями, в т. ч. с заболеваниями легких, метаболическими нарушениями и ожирением, больные сердечно-сосудистыми заболеваниями.
Недавно проведенный систематический анализ позволил рассчитать общую заболеваемость при гриппе среди не привитых медработников, которая составила 18,7% (95% ДИ 16-22%) за сезон, 7,5% из которых сопровождалось проявлением симптомов. Кроме того, медработники могут играть ключевую роль в распространении нозокомиальной инфекции гриппа среди пациентов высокого риска, находящихся на лечении.
Для вакцинопрофилактики в России имеются трехвалентные инактивированные вакцины (ТИВ) против гриппа, которые содержат части убитого вируса трех штаммов (два А и один В): цельновирионные, субъединичные, расщепленные. Цельновирионные вакцины представлены Грипповаком. Цельноклеточные и живые вакцины обладают хорошей способностью формировать иммунитет против гриппа, наиболее реактогенны, особенно у маленьких детей, поэтому применяются только у ограниченных групп взрослого населения. Субъединичные вакцины содержат поверхностные белки гемагглютинин и нейраминидазу: Гриппол, Гриппол Плюс, Совигрипп (с 18 лет), Инфлювак, Агриппал, Инфлексал В. Расщепленные вакцины содержат внутренние белки (типоспецифические антигены) и поверхностные белки гемагглютинин и нейраминидазу - Ваксигрип, Бегривак, Флюарикс, Флюваксин, Ультрикс, Грифор. По иммуногенности и реактогенности вакцины сопоставимы между собой. Сплитвакцину получают путем расщепления вируса. В результате высвобождаются структурные белки вирусного матрикса и нуклеокапсида. Такие вакцины содержат все внутренние и поверхностные антигены, необходимые для адекватной индукции иммунитета, при этом в них нет реактогенных липидов. Сплитвакцины менее реактогенны, чем цельновирионные, и в связи с этим разрешены к применению у детей начиная с 6-месячного возраста.
Внутренние антигены вируса гриппа - иммунодоминантные фрагменты М (матриксного) и N (нуклеокапсидного) белков вириона содержат т. н. консервативные антигенные детерминанты, являющиеся общими для штаммов, принадлежащих к одному типу. В этой связи биологическая значимость присутствия консервативных внутренних антигенов в вакцине очень велика, поскольку именно они индуцируют (хотя и со слабой степенью иммуногенности) образование антител, способных к перекрестной нейтрализации неблизкородственных штаммов диких вирусов. Это обстоятельство в какой-то мере объясняет более высокую профилактическую эффективность сплит-вакцин у детей (которые иммунны против ограниченного числа штаммов) по сравнению с субъединичными вакцинами, в составе которых внутренние антигены полностью отсутствуют. Субъединичные вакцины содержат только гемагглютинин и нейраминидазу (иногда в сниженных дозировках). По сравнению со сплитвакцинами системные и местные реакции выражены в равной степени (поскольку, как и сплитвакцины, субъединичные вакцины не содержат реактогенных липидов), однако при этом субъединичные вакцины менее иммуногенны (из-за отсутствия внутренних белков вириона) и их эффективность оценивается на 10-15% ниже, чем у сплитвакцин, для всех групп населения.
В целом вакцины ТИВ считаются безопасными, хотя временные местные реакции в месте введения препарата встречаются часто (>1/100), а повышение температуры, миалгия, общее недомогание и другие системные побочные проявления могут наблюдаться у лиц, ранее не подвергавшихся воздействию вакцинных антигенов гриппа, таких как дети раннего возраста [4]. При исследовании, включавшем 791 здорового ребенка в возрасте от 1 года до 15 лет, поствакцинальное повышение температуры наблюдалось у 12% детей в возрасте 1-5 лет, у 5% - в возрасте 6-10 лет и у 5% - в возрасте 11-15 лет. В целом такие побочные проявления встречаются реже у взрослых.
Беременные женщины должны быть вакцинированы ТИВ на любой стадии беременности. Эта рекомендация основана на данных о наличии значительного риска развития тяжелого заболевания у лиц этой группы и данных о том, что вакцина против сезонного гриппа безопасна для вакцинации на протяжении беременности и эффективна для предотвращения гриппа у женщин, а также их младенцев, среди которых бремя болезни также высокое. Когда вакцинные штаммы строго соответствуют циркулирующим вирусам гриппа, степень эффективности среди лиц моложе 65 лет обычно колеблется от 70 до 90%, тогда как эффективность ТИВ по защите от гриппа среди лиц в возрасте 65 лет и старше выше среднего, независимо от места, населения и структуры исследования.
Вирусы гриппа передаются воздушно-капельным путём и могут сохранять жизнеспособность в течение 2-8 часов на одежде и бумаге, а на металлических поверхностях — даже до суток (8 и 9). Инфекция легче распространяется зимой, и некоторые исследователи связывают это с тем, что в условиях холодного и сухого воздуха вирус дольше сохраняет вирулентность. Дополнительный фактор — то, что температура в верхних дыхательных путях человека в этот период больше подходит для размножения вируса (10).
Чаще всего от осложнений, вызываемых гриппом, погибают пожилые люди старше 65 лет, дети до двух лет, а также люди с хроническими заболеваниями. Однако следует отметить, что от пандемии свиного гриппа 2009 года погибло аномально большое число молодых людей. Этот факт объясняют тем, что у пожилых людей мог сохраниться иммунитет к схожим штаммам гриппа, которые циркулировали в популяции значительно раньше (11 и 12).
При переходе от одного штамма к другому вирулентность и уровень смертности от гриппа сильно варьируются. Так, птичий грипп H5N1, вызвавший региональную эпидемию в Восточной Азии в 1997 году, отличался крайне высоким уровнем смертности среди заболевших (до 50%), однако передавался он весьма неэффективно, и количество заражённых не превысило нескольких сотен человек (18).
Морфология и структурные белки
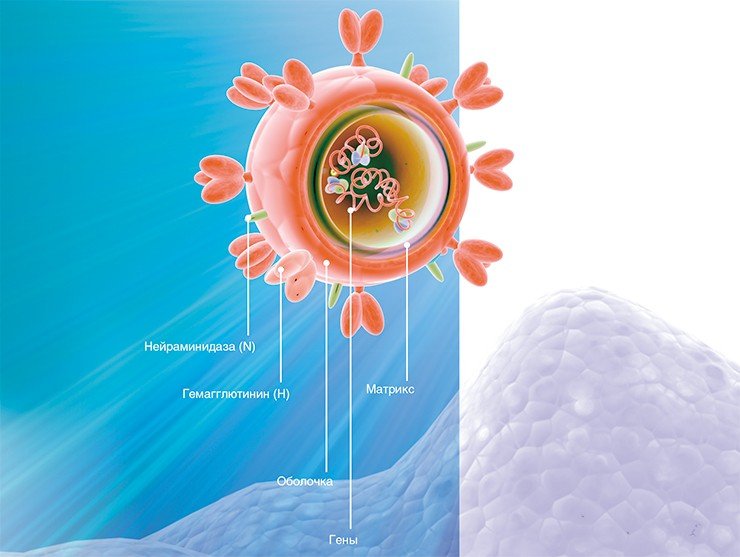
Вирусы семейства Orthomyxoviridae имеют липидную оболочку, образованную частью мембраны хозяйской клетки (19 и 20). В мембрану включены поверхностные белки. У вирусов гриппа их два — гемагглютинин (H), необходимый для того, чтобы связываться с клеточными рецепторами и проникать внутрь клетки хозяина, и нейраминидаза (N), которая отрезает новообразованную частицу вируса от клеточных рецепторов и дает ей возможность переместиться к новой клетке. Также мембрана вируса содержит образованные белком М2 каналы — они служат для распаковки частицы в цитоплазме. Под мембраной вируса находится слой матрикса, сформированный структурным белком М1. В центре частицы располагается генетический материал, представленный восемью молекулами РНК, каждая из которых соединена со структурными белками NP (nucleoprotein) и полимеразным комплексом, ответственным за их копирование (5, 21, 22).
Вирусы гриппа могут иметь как сферическую, так и филаментную форму (23). Диаметр сферических частиц сопоставим с диаметром ВИЧ — 80-120 нм. Вариации в форме разных типов и штаммов обусловлены различиями в строении белков матрикса, который располагается непосредственно под мембраной (24 и 25). Отдельные белки вируса гриппа являются объектом исследования как вероятные мишени для противовирусных препаратов. Так, большое внимание уделяется разработке ингибиторов нейраминидазы, блокирующих работу этого фермента, что не дает новому вирусу покинуть клетку (26). По этому принципу, в частности, работают лекарства Тамифлю и Реленца (27). Разработаны также препараты, мешающие частице распаковываться в цитоплазме зараженной клетки или содержащие антитела к различным типам гемагглютинина (28).
Ключевые белковые молекулы, обеспечивающие жизнедеятельность и воспроизводство вируса гриппа — поверхностный белок гемагглютинин, энзим нейраминидаза и белки матрикса M1. По принципу строения гемагглютинин напоминает поверхностный белок вирусаЭбола (29 и 30). Этот белок является гомотримером, имеющим трансмембранную и поверхностную части, которые связаны между собой дисульфидными связями. Попадание вируса в клетку происходит после того, как гемагглютинин связывается с клеточными рецепторами, несущими сиаловую кислоту (31). Вирус попадает в цитоплазму в составе везикулы. Когда среда внутри везикулы становится более кислой, гемагглютинины меняют свою конформацию и вызывают слияние вирусной мембраны и мембраны везикулы (32). Белки М2 формируют каналы, через которые ионы водорода попадают внутрь вирусной частицы, нарушая взаимодействие между матриксом и генетическим материалом вируса и обеспечивая тем самым возможность последнему попасть в цитоплазму (33). Препараты Ремантадин иАмантадин (а также их аналоги) нацелены на ингибирование белка М2 и предотвращение распаковки вируса — однако, они менее эффективны, чем ингибиторы нейраминидазы, и сейчас их уже редко рекомендуют для лечения гриппа (27).
Работа нейраминидазы важна на завершающих стадиях жизненного цикла вируса. Этот белок состоит из четырех одинаковых субъединиц (34), а его функция заключается в отщеплении терминальных остатков сиаловой (нейраминовой) кислоты от гликозилированных рецепторов, с которыми связывается гемагглютинин. Без этого вновь образованные вирусные частицы не смогут отсоединиться от поверхности хозяйской клетки (35). Отщепление сиаловой кислоты также препятствует повторному заражению клетки другими вирусными частицами. Ингибиторы нейраминидазы, замедляющие распространение вируса в организме, являются действующим компонентом противогриппозных препаратов Занамивира и Озельтамивира (36). Впрочем, озельтамивир (действующее вещество препарата Тамифлю) перестаёт действовать, если в нейраминидазе вируса 274-я аминокислота гистидин меняется на тирозин. Занамивир (действующее вещество препарата Реленца) в этом случае не теряет активности, однако он провоцирует побочные эффекты, поэтому его рекомендуют применять только в тех случаях, когда Тамифлю не действует (27 и 37).
Белки матрикса М1 играют ключевую роль в сборке новых вирусных частиц (38 и 39). Перед формированием новых вирионов они скапливаются с внутренней стороны клеточной мембраны, взаимодействуя при этом как с поверхностными белками, так и с находящимися в цитоплазме комплексами вирусного генома, благодаря чему все компоненты будущего вируса собираются воедино. Наличие матрикса характерно для вирусов с липидной мембраной — таких, например, как ВИЧ или вирус Эбола (40 и 41). Кроме того, этим вирусам присуще почкование из специфических областей клеточной мембраны — липидных рафтов, молекулярный состав которых делает их несколько менее лабильными в сравнении с другими участками мембраны (42).
Внутри вируса: как упакован генетический материал
Основная цель любого вируса — это воспроизводство собственного генома путём создания копий. Информация обо всех структурных и функциональных компонентах вируса находится в РНК. Каждая вирусная частица содержит одну копию генома, компактно уложенную в виде восьми отдельных спиральных структур. Совокупная длина этих молекул рибонуклеиновой кислоты превышает диаметр вируса в N раз. В переносе и хранении генетической информации важную роль играет то, что РНК содержится в вирусе в составе рибонуклеиновых комплексов.
Генетический материал гриппа разделён на части, каждая из которых отвечает за синтез отдельных вирусных белков. Поэтому в случае попадания в одну клетку разных штаммов при сборке новых частиц могут образовываться гибридные штаммы, что ускоряет эволюцию вирусов и осложняет борьбу с ними (43). Сегменты РНК гриппа не равнозначны, и в частицу должен попасть фиксированный набор из восьми разных РНК, каждая из которых выполняет свою функцию. Как это достигается в природе, понятно не до конца. Видимо, между вирусными рибонуклеопротеиновыми комплексами (РНП) существует специфическое взаимодействие, обеспечивающее сборку разных частей генома в нужном составе (44).
Публикации результатов исследований, описывающих структуру вирусных РНП, стали появляться сравнительно недавно. Одну из последних и наиболее детальных работ на эту тему подготовили и опубликовали в журнале Science (45) коллективы лабораторий Хайме Мартина-Бенито и Хуана Ортина. Доктор Мартин-Бенито комментирует специфику их исследований:
Когда мы приступили к изучению структуры полного РНП нативных вирусов гриппа в Национальном центре биотехнологии в Мадриде, вся доступная информация на эту тему была ограничена данными рентгеноструктурного анализа нуклеопротеина без РНК (46 и 47) и фрагментов полимеразы (48 и 49). РНП представляют собой разные по размеру, гибкие и суперскрученные структуры (50), что очень затрудняет исследования. В этой ситуации криоэлектронная микроскопия оказывается уникальным методом, способным выдать приемлемый результат. Основные проблемы были обусловлены различием длины отдельных РНП, а также их подвижностью. Чтобы это преодолеть, мы отдельно анализировали центральные и конечные части РНП, изолированных из выделенных вирионов, после чего проводили их 3D-реконструкцию (45). Здесь наиболее трудным этапом стала классификация полученных изображений. Необходимо было получить гомогенные группы, что позволило бы сделать финальную реконструкцию. Для того чтобы сгенерировать финальную структуру, было использовано более 90 тысяч изображений. Мы потратили на это миллионы часов компьютерного времени«.
Хайме Мартин-Бенито (Испанский национальный центр биотехнологий, Мадрид, Испания)
Строение и конформации РНП, а также их взаимодействие с другими белками вируса обеспечивают им специфические свойства и функции. Геном гриппа представлен восемью молекулами РНК негативной полярности и разной длины. Такое число сегментов генома характерно для всех ортомиксовирусов (кроме тоготовирусов, содержащих по шесть молекул РНК). РНК связывается с полимеразными комплексами (48) и белком NP (51), формируя РНП (44). РНП организованы в двойные спирали из двух цепей РНК, ассоциированных с белками НП и расположенных друг против друга (45).
Различие длины разных РНП гриппа обусловлено различиями длин сегментов их РНК. Три наиболее протяженных сегмента имеют длину порядка 2500 нуклеотидов, тогда как длина самого короткого сегмента лишь немногим превышает 800 нуклеотидов. РНП обычно группируются в частице вокруг одного из наиболее длинных РНП таким образом, чтобы полимеразные концы всех РНП оказывались собранными вместе, взаимодействуя при этом с белками матрикса на одном из полюсов вириона. В эту же область попадают и белки NEP, чья функция — экспорт новосинтезированных РНП из ядра клетки к месту сборки вируса.
Одной из проблем, вызывающих сейчас активный интерес сообщества структурных вирусологов, является изучение причин специфической упаковки необходимого набора разных РНП в каждую новую частицу. Считается, что молекулы РНК в составе каждого РНП способны специфически взаимодействовать с РНК соседних сегментов. Мы отразили этот момент в нашей модели, однако конкретные механизмы такого взаимодействия — объект дальнейших исследований (44, 45, 52).
Для многих мембранных вирусов характерно присутствие в вирионах белков, захваченных из клетки хозяина. Так, внутри ВИЧ обнаруживают актин и циклофилин, а в мембране этого вируса присутствуют белки, относящиеся к главному комплексу гистосовместимости, что делает вирус менее уязвимым для иммунной системы (53, 54, 55). Наличие человеческих белков в вирусной частице гриппа на данный момент не продемонстрировано с должной достоверностью, хотя некоторые данные по этому вопросу опубликованы (56).
Высокая изменчивость и непредсказуемость вируса гриппа рано или поздно может привести к новой пандемии. Во избежание этого предпринимаются разные меры — как на глобальном, так и на локальном уровне. Всемирная организация здравоохранения (ВОЗ) и региональные организации в разных странах ведут постоянный мониторинг циркулирующих штаммов гриппа, поскольку год за годом состав сезонных штаммов меняется, пополняясь новыми потенциально опасными вариантами. Изменчивость вирусов гриппа — большая проблема для фармацевтических компаний, разрабатывающих противовирусные препараты (27 и 57). Так, в настоящее время растет процент штаммов гриппа, устойчивых к озельтамивиру.
Профилактические вакцины от гриппа совершенствуются каждый год в зависимости от преобладающих штаммов. Их разрабатывают как с использованием целых инактивированных вирионов, так и на основе фрагментированных вирусных частиц или даже отдельных поверхностных белков. Обычно вакцины направлены на профилактику заражения как штаммами типа А, так и вирусами типа В (58).
Часто присущие гриппу симптомы (повышенная температура, боль в горле и мышцах, головная боль) бывают вызваны и другими вирусами. Среди возбудителей простудных заболеваний есть коронавирусы, риновирусы и аденовирусы (59). Выявление конкретного возбудителя в таких случаях не всегда целесообразно, поэтому подобные заболевания часто относят к группе острых респираторных вирусных инфекций (ОРВИ).
Именно эта особенность вируса лежит в основе эффективного механизма, защищающего его от иммунной системы человека, поскольку приводит к появлению таких штаммов, с которыми не могут связываться антитела, ранее наработанные в организме в ответ на инфекцию или вакцинацию. Мутантный штамм поэтому активно размножается до тех пор, пока в организме не будут выработаны новые специфичные антитела.
Молекулярные механизмы, обеспечивающие проникновение вируса внутрь клетки-мишени, до сих пор остаются предметом многих научных исследований. Главная цель последних – помочь в разработке лекарственных препаратов, способных предотвратить инфицирование клетки вирусом. Остановить болезнь на начальной стадии крайне важно – это означает не дать вирусной частице создать армию своих клонов, готовых к заражению других здоровых клеток.
В настоящее время в связи с возможностью новой пандемии гриппа, причиной которой может стать мутированный штамм так называемого птичьего гриппа, исследования вируса гриппа типа А (к нему относится большинство штаммов гриппа млекопитающих и птиц) приобрели еще большую актуальность. Создание новых эффективных средств профилактики и лечения этого заболевания требует глубокого понимания сложных механизмов межмолекулярных взаимодействий, процессов регуляции работы генов как вируса, так и организма хозяина.
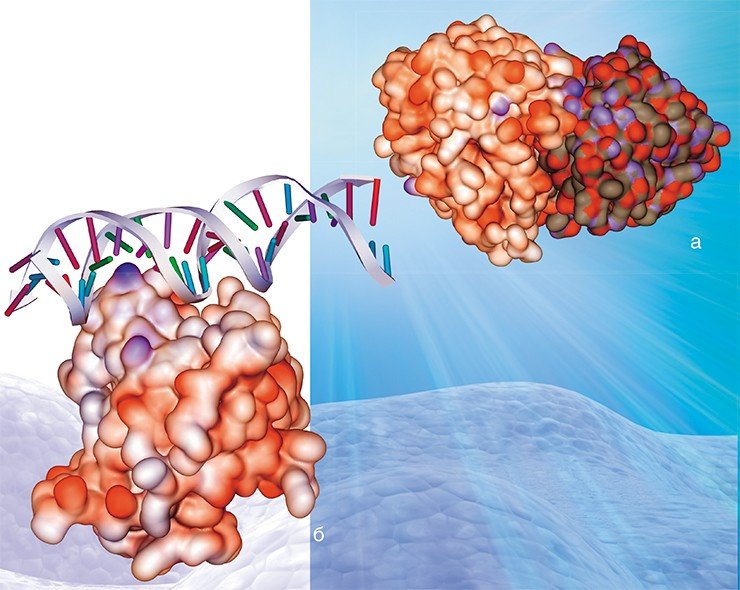
В лаборатории теоретической генетики ИЦиГ СО РАН компьютерные методы и подходы в эволюционной биологии и протеомики (науки о белках) активно развиваются в течение последних 15 лет. Одним из важнейших объектов исследований в настоящее время стал вирус гриппа А, точнее – гемагглютинин, один из его поверхностных белков.
Генетический материал вируса защищен оболочкой из особого белка, вокруг которой располагается мембрана из липидов (жироподобных веществ). В ней удерживаются молекулы трех белков: гемагглютинина, нейраминидазы и белка М 2, формирующего особые ионные каналы. При помощи гемагглютинина вирус прикрепляется к клеточной мембране, а нейраминидаза ее разрушает, открывая вирусу путь внутрь клетки. Затем внутри вириона-захватчика благодаря ионным каналам изменяется кислотность среды (pH), чем создаются условия для освобождения генетического материала из вирусной капсулы.
Что увидел компьютер
В принципе белковые молекулы могут взаимодействовать с другими молекулами самой разной природы: с макромолекулами, в числе которых могут быть белки или нуклеиновые кислоты, носители генетической информации; с низкомолекулярными соединениями; а также с различными ионами. И в этом смысле белки вирусов ничем не отличаются от белков других живых организмов, в том числе человека.

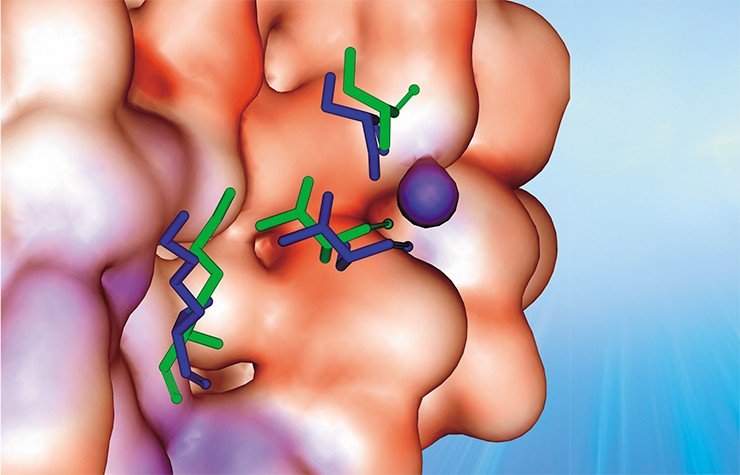
Возможно, именно эти свойства гемагглютинина позволяют вирусу гриппа с легкостью ускользать от нашей иммунной системы, обеспечивая его высокую эпидемичность. Аргументом в пользу этого соображения является тот факт, что выявленные участки связывания ионов практически перекрываются с участками расположения антигенных детерминант.
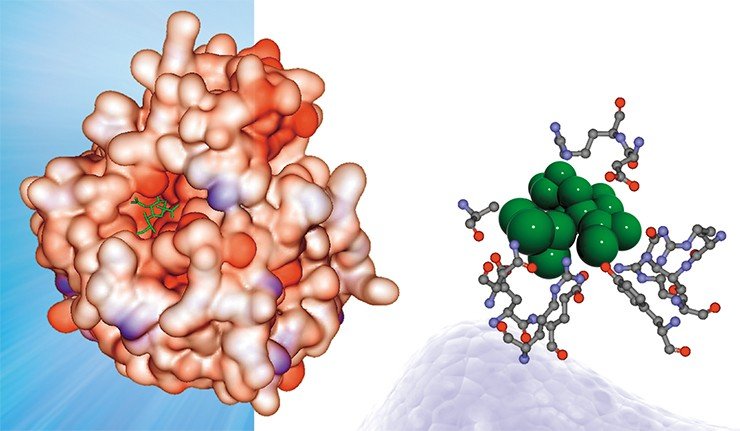
В лаборатории теоретической генетики ИЦиГ СО РАН создана база данных (PDBSite), содержащая информацию о пространственных структурах более чем 30 тыс. различных функциональных участков (сайтов) белков, включая каталитические центры ферментов, сайты взаимодействий белок–белок, белок–ДНК/РНК, белок–лекарственные препараты и т. д. В базе в удобном для поиска и использования виде хранятся данные о физико-химических, структурных и эволюционных характеристиках этих сайтов, полученные с помощью компьютерного анализа экспериментально расшифрованных комплексов. Эти сведения успешно используются для распознавания функциональных сайтов в пространственных структурах малоизученных белков путем определения их структурного сходства с известными. Например, в результате анализа структуры гемагглютинина – поверхностного белка вируса гриппа – выяснилось, что один из его участков схож с сайтом связывания сульфат-иона (SO4), что свидетельствует о потенциальной способности этого белка связываться в этом участке с сульфат-ионом
В пространственной структуре поверхностного белка вируса гриппа обнаружено множество сайтов связывания различных ионов (а также потенциальных мест такой посадки), благодаря чему вокруг вируса может формироваться своеобразный ионный щит, защищающий его от атак иммунной системы
Высказанные нами предположения, позволившие сформировать новый взгляд на проблему механизмов защиты вирусов от атаки иммунной системы организма-хозяина, а также обнаружить новых молекулярных участников, задействованных в процессе проникновения вируса внутрь клетки, безусловно, требуют дальнейшего анализа и экспериментальной проверки.
Однако то, что ионы могут быть важными факторами, регулирующими жизненный цикл вируса гриппа, уже не вызывает сомнения. Как и то, что исследования подобных молекулярных механизмов будут содействовать открытию новых фармакологических мишеней и созданию эффективных вакцин и лекарственных препаратов.
Читайте также:


