Метаболический синдром и гепатит с
Метаболический синдром развивается у 40 % людей в основном пенсионного возраста и у всех, кто ведет малоподвижный образ жизни и неправильно питается. Распространенность метаболического синдрома продолжает расти.
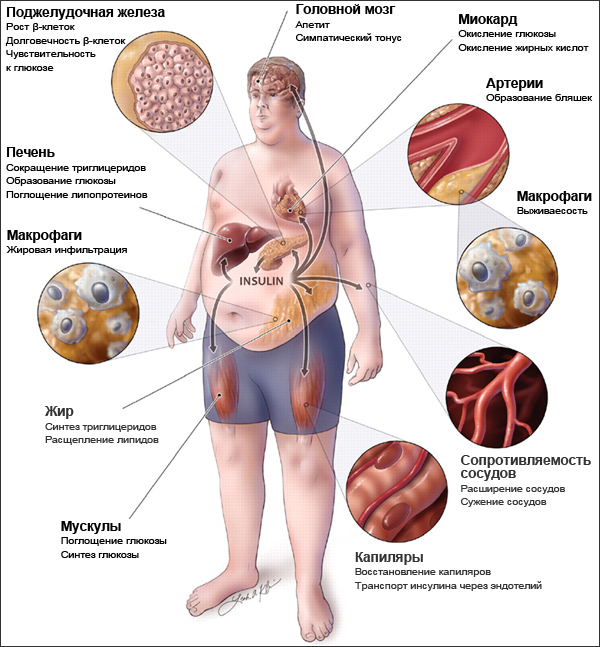
В основе метаболического синдрома и его проявлений лежит инсулинрезистентность. Резистентность (устойчивость) к инсулину заключается в том, что для поддержания нормального метаболизма требуется большее количество инсулина.
Отмечено, что инсулинрезистентность часто встречается у больных с хроническим вирусным гепатитом С (ХГС), что свидетельствует о тесной связи этих двух состояний. Поскольку ХГС больны более 170 млн. человек, сочетание инфекции с инсулинрезистентностью представляет серьезную проблему мирового здравоохранения.
С резистентностью к инсулину связано также развитие у больных ХГС стеатоза – жирового перерождения печени, которое почти в 2 раза чаще, чем в среднем у населения. Стеатоз связан также с повышением индекса массы тела (ИМТ), сахарным диабетом 2 типа, возрастом старше 40 лет, гепатитом С, вызванным вирусом С генотипа 3 и фиброзом.
Генотип вируса 3 оказывает прямое стеатогенное действие, у пациентов с другими генотипами вируса основную роль в формировании стеатоза играет инсулинрезистентность.
Независимо от того, что развивается первым, резистентность к инсулину является основным фактором риска тяжелого фиброза печени и рассматривается как важный прогностический фактор формирования цирроза печени.
Резистентность к инсулину играет основную роль в формировании сахарного диабета 2 типа, поэтому не удивительно, что среди больных гепатитом С он встречается в 2 раза чаще.
Резистентность к инсулину ухудшает результаты лечения ХГС. Для оценки инсулинрезистентности используют индекс HOMA-IR. При значении этого индекса больше 4 эффективность лечения (частота устойчивого вирусологического ответа – УВО) снижалась на 40 %. У пациентов с индексом HOMA-IR меньше 2 ранний вирусологический ответ определялся у всех пациентов.
Жировой гепатоз также значительно ухудшает прогнозы на выздоровление.
Поскольку на успех противовирусной терапии значительно влияют степень ожирения, резистентность к инсулину и стеатоз печени, следует оценивать эти факторы при назначении терапии. Если они присутствуют, то для достижения наилучшего терапевтического эффекта требуется коррекция резистентности к инсулину и лечение стеатоза.
Симптомы метаболического синдрома
Нарушения, объединенные рамками метаболического синдрома, длительное время протекают бессимптомно. Наиболее ранними проявлениями метаболического синдрома являются дислипидемия и повышение артериального давления. Часто не все компоненты метаболического синдрома встречаются одновременно:
- абдоминально-висцеральное ожирение (окружность талии более 102 см у мужчин и более 88 см у женщин);
- инсулинорезистентность при высоком уровне инсулина;
- дислипидемия (сочетание гипертриглицеридемии — больше 1,7, низкого уровня ХЛ ЛВП и повышения фракции мелких ХЛ ЛНП;
- артериальная гипертензия (артериальное давление выше 130/85 мм рт. ст.);
- ранний атеросклероз и ишемическая болезнь сердца.
Возможные жалобы на повышенную утомляемость, апатию, одышку, повышенный аппетит, жажду, учащенное мочеиспускание, головную боль, сухость кожи, потливость.
Лечение метаболического синдрома
Лечение назначают в зависимости от степени обменных нарушений и тех заболеваний, которые выявлены у пациента. Лечение направлено на коррекцию углеводного обмена, снижение массы тела, купирование артериальной гипертонии и симптомов сахарного диабета.
Немедикаментозное лечение метаболического синдрома
Первым этапом лечения метаболического синдрома является изменения стиля жизни, в первую очередь правильное питание и повышение физической нагрузки. Первым шагом и его обязательным звеном должно быть снижение таким образом массы абдоминально-висцерального жира, который играет ключевую роль в развитии и прогрессировании метаболического синдрома.
Снижение общей массы тела на 10-15% от исходной сопровождается уменьшением висцеральной жировой ткани, т. е. жира, расположенного не в подкожном слое, а вокруг внутренних органов. Это, как правило, ведет к повышению чувствительности тканей к инсулину, улучшению показателей липидного и углеводного обмена, нормализации повышенного артериального давления.
Снижение массы тела должно быть постепенным. Быстрый и резкий сброс массы тела на 10-20 кг приводит к снижению гормона лептина и к возникновению труднопреодолимого чувства голода, и в результате к возврату лишних килограммов, иногда даже в большем количестве, чем до терапии.
Потеря массы тела снижает содержание свободных жирных кислот в печени, что приводит к снижению инсулинрезистентности, повышает внепеченочную чувствительность к инсулину, уменьшает воспаление в жировой ткани.
Медикаментозное лечение метаболического синдрома
Дополнительным лечением метаболического синдрома является назначение урсодезоксихолевой кислоты и витамина Е, которые оказывают антиоксидантное действие и улучшают результаты лечения ХГС.
Препараты, повышающие чувствительность к инсулину (тиазолидиндиолы и метформин) снижают резистентность к инсулину и уменьшают выраженность фиброза и степени жирового гепатоза у больных гепатитом С.
Все это улучшает результаты терапии противовирусными препаратами.
Поэтому обследование пациентов, готовящихся к противовирусной терапии, в особенности с генотипом 3, обязательно должно включать анализ на инсулинрезистенстность (индекс HOMA-IR), оценку степени метаболического синдрома и всех его компонентов с обязательной последующей коррекцией желательно до начала терапии.
Тактика лечения пациентов с ожирением и метаболическим синдромом при гепатите С
При выявлении у пациентов с HCV сопутствующего поражения печени в результате метаболического синдрома (неалкогольная жировая болезнь печени - стеатоз) необходимо провести дополнительное обследование на показатели обменных и гормональных нарушений, характерных для этого заболевания.
Рекомендуется для оценки степени поражения печени использовать исследование крови – Фибромакс, которое дает возможность оценить отдельно степень поражения печени вирусом и отдельно метаболическим синдромом.
Тактика лечения зависит от степени поражения печени в целом, и отдельно каждым повреждающим фактором. Лечение противовирусными препаратами может быть назначено сразу, а дальнейшее лечение метаболического синдрома после получения УВО.
Если степень поражения печени вирусом значительно меньше, чем метаболическим синдромом, возможно начинать противовирусную терапию после лечения метаболического синдрома.
В случаях наличия сопутствующих заболеваний печени необходимо ставить целью лечения не только получение УВО, но и сохранение и восстановление печени, пострадавшей от других патологических факторов.
Вирусный гепатит С продолжает оставаться одной из глобальных проблем современного здравоохранения. По расчетным данным, в мире число инфицированных достигает 500 млн человек. К клиническим особенностям гепатита С в первую очередь следует отнести высокую частоту хронизации (85%), что обеспечивает неуклонное увеличение числа больных хронической инфекцией. Другой особенностью заболевания является длительное субклиническое или малосимптомное его течение при одновременном прогрессировании патоморфологических изменений в ткани печени с исходом в цирроз печени. Вследствие этого нередко гепатит С впервые диагностируется на далеко зашедших стадиях, иногда в дебюте декомпенсации на цирротической стадии заболевания.
Вирусный гепатит С продолжает оставаться одной из глобальных проблем современного здравоохранения. По расчетным данным, в мире число инфицированных достигает 500 млн человек. К клиническим особенностям гепатита С в первую очередь следует отнести высокую частоту хронизации (85%), что обеспечивает неуклонное увеличение числа больных хронической инфекцией. Другой особенностью заболевания является длительное субклиническое или малосимптомное его течение при одновременном прогрессировании патоморфологических изменений в ткани печени с исходом в цирроз печени. Вследствие этого нередко гепатит С впервые диагностируется на далеко зашедших стадиях, иногда в дебюте декомпенсации на цирротической стадии заболевания.
Эти обстоятельства объясняют пристальное внимание исследователей к механизмам развития инфекционного процесса и, в частности, инициации и прогрессирования фиброза печени при хроническом гепатите С (ХГС), что имеет большое значение для клинической практики. В настоящее время уже установлен ряд факторов, влияющих на прогрессирование заболевания, среди которых выделяют возраст больных (старше 40 лет), длительность инфекции, мужской пол, генотип вируса (генотип 1) и употребление алкоголя [1]. Повышенный интерес представляют характеристики макроорганизма, которые могут оказывать влияние на темпы развития инфекционного процесса, имеют патогенетическое значение в формировании и прогрессии фиброза печени.
В этой связи в последнее время широко обсуждается наличие инсулинорезистентности при хронической HCV-инфекции, которая представляет собой метаболическое нарушение, характеризующееся снижением реакции инсулинчувствительных тканей на инсулин при его достаточной концентрации, приводящее к хронической компенсаторной гиперинсулинемии. Инсулинорезистентность определяют также как состояние, характеризующееся потребностью в более высокой концентрации инсулина, чем в норме, для реализации его биологических эффектов, или как состояние, при котором нормальное содержание инсулина не обеспечивает его метаболические функции (снижается чувствительность тканей к инсулину). Инсулинорезистентность рассматривается как основа такого широко распространенного в популяции патологического состояния, как метаболический синдром, который характеризуется сочетанием ожирения, пограничной гипергликемии натощак, артериальной гипертензии и дислипопротеидемии. Показано, что именно инсулинорезистентность при метаболическом синдроме имеет существенно более тесную связь с риском развития сердечно-сосудистых заболеваний, чем другие отдельные его компоненты (ожирение, сахарный диабет, артериальная гипертензия, дислипопротеидемия) [2]. При этом данные о встречаемости метаболического синдрома у пациентов с хронической HCV-инфекцией неоднозначны. Имеются сведения о более частом, примерно в 25% случаев, обнаружении метаболического синдрома при ХГС в сравнении с 22% случаев в популяционных исследованиях, проведенных на Среднем Западе США [3].
Не меньший интерес представляет другой, специфический для гепатита С механизм развития резистентности к инсулину. Убедительно доказана ее непосредственная связь с инфицированием вирусом гепатита С и развитием гепатита – это так называемая вирусная инсулинорезистентность [8, 9, 10, 11, 12].
Инсулинорезистентность (как вирусиндуцированная, так и метаболическая) приводит к развитию гиперинсулинемии, которая является важным аспектом формирования фиброза печени. Гиперинсулинемия стимулирует синтез внеклеточного матрикса звездчатыми клетками, что приводит к прогрессированию процессов фиброгенеза [16]. Эти данные свидетельствуют о важной роли инсулинорезистентности при ХГС как фактора, влияющего на течение патологического процесса.
Кроме того, гиперинсулинемия как следствие инсулинорезистентности нарушает метаболизм липидов в гепатоците и, следовательно, способствует формированию стеатоза и стеатогепатита, с повышением рисков развития сахарного диабета.
Стеатоз печени в последние годы стали рассматривать как фактор прогрессирования ХГС. Важно понимать, что при стеатозе печени включаются механизмы формирования фиброза, в развитии которого ключевая роль отводится окислительному стрессу, что привлекает к себе внимание как точка приложения средств фармакокоррекции. Известна высокая частота обнаружения стеатоза печени при ХГС (от 30 до 80%), особенно при инфицировании генотипом 3 вируса [21, 22, 23].
Таким образом, определение роли различных характеристик макроорганизма в формировании патологического процесса прогрессирования инфекции и его исходов является условием разработки перспективных способов фармакологической коррекции. Это может быть существенным дополнением современных схем противовирусной терапии в плане повышения ее эффективности.
Цель исследования: оценить частоту инсулинорезистентности по индексу HOMA-IR у больных ХГС и ее связь с нарушением жирового обмена.
Материалы и методы
В исследование были включены 75 больных ХГС (35 мужчин и 40 женщин) в возрасте от 20 до 55 лет. Средний возраст обследованных составил 36,1 ± 9,2 лет.
Диагноз ХГС устанавливался на основании обнаружения в крови маркеров вируса: суммарных антител (HCV-Ab), РНК-HCV, а также по совокупности клинико-анамнестических, эпидемиологических, биохимических, инструментальных данных согласно классификации хронических гепатитов (Лос-Анджелес, 1994).
У 76% больных гепатит С был впервые выявлен при скрининговом обследовании на маркеры вирусов гепатитов, и 24% пациентов были обследованы целенаправленно в связи с наличием каких-либо клинико-лабораторных отклонений (умеренное повышение активности аланинаминотрансферазы (АлАТ), обнаружение гепатомегалии по данным УЗИ, реже – ухудшение самочувствия в виде астеновегетативного и диспепсического синдромов).
Критериями исключения при подборе пациентов для проведения исследования были признаки субкомпенсированного и декомпенсированного цирроза печени (по Сhild-Pugh, 1973), хронические заболевания печени другой этиологии (в том числе вирусный гепатит В), хронический алкоголизм, сахарный диабет, симптоматическая артериальная гипертензия, тяжелая сопутствующая соматическая патология, а также потребление наркотических средств и ВИЧ-инфекция.
Практически у половины пациентов (44,6%) давность гепатита составила более 8 лет, у 27% – от 3 до 8 лет, у 18,9% – до 3 лет, у 9,5% продолжительность заболевания установить не удалось.
ХГС у 52,4% пациентов был обусловлен 1b генотипом ВГС, у 46% – 3а генотипом. Об активности гепатита судили по биохимическим показателям – активности АлАТ (МЕ/л) и уровню тимоловой пробы (ЕД), отражающим выраженность цитолитического и мезенхимально-воспалительного синдромов. У 20 пациентов была оценена степень фиброза печени по шкале METAWIR по результатам биопсии печени, эластографии печени и Фибромакс-теста.
У всех больных рассчитывали индекс массы тела (ИМТ) методом Кетле (кг/м²). Согласно критериям ожирения ВОЗ (1997), распределение пациентов по ИМТ оказалось следующим: у 36 больных ХГС (48%) масса тела была нормальной, у 31 (41,3%) обнаружена избыточная масса тела; у 6 пациентов (8,0%) диагностировано ожирение 1-й степени, у 2 (2,6%) – ожирение 2-й степени.
Наличие абдоминального ожирения устанавливали путем измерения обхвата талии в соответствии с IDF-критерием 2005 года (у мужчин > 94 см, у женщин > 80 см). На этом основании у 33 больных ХГС (44%) диагностировано абдоминальное ожирение. Уровень глюкозы в венозной крови определяли натощак ферментативным колориметрическим методом. Содержание иммунореактивного инсулина в плазме крови определяли натощак методом ИФА с использованием тест-системы DRG Insulin ELISA (США). Для оценки инсулинорезистентности использовали индекс HOMA-IR (D. Matthews, 1985). Показатели HOMA-IR ≥ 2,27 свидетельствовал о наличии инсулинорезистентности.
Результаты исследования и обсуждение
Инсулинорезистентность (HOMA-IR ≥ 2,27) диагностирована у 27 (36,0%) больных ХГС. Результаты анализа значений HOMA-IR и частоты выявления инсулинорезистентности в зависимости от возраста пациентов, наличия признаков нарушения жирового обмена представлены в таблице 1.
Следует отметить, что у 52% обследованных пациентов было повышение ИМТ разной степени выраженности. Как видно из данных таблицы 1, средние значения HOMA-IR были достоверно выше у больных ХГС старшей возрастной группы (старше 40 лет). Существенное повышение средних значений HOMA-IR выявлялось у пациентов с повышенным ИМТ (≥ 25 кг/м²) и наличием абдоминального ожирения. У этих пациентов частота выявления инсулинорезистентности была достоверно выше (51,5–56,4%), чем у больных без аналогичных признаков (соответственно 23,4–13,9%). Результаты корреляционного анализа подтвердили тесную связь инсулинорезистентности у больных ХГС с признаками нарушения жирового обмена. Также была получена положительная корреляция между значениями HOMA-IR и ИМТ (p


Целью обзора явилось изучение литературных источников о наличии, методах оценки инсулинорезистентности и её влиянии на течение и лечение хронического гепатита С. Данные литературы свидетельствуют о том, что гепатит С на фоне сахарного диабета способен отягощать течение и влиять на эффективность сахароснижающей терапии, а инсулинорезистентность и сахарный диабет 2 типа могут оказывать негативное действие на противовирусную терапию гепатита С.

Аметов, А.С. Инсулиносекреция и инсулинорезистентность: две стороны одной медали / А.С. Аметов // Проблемы эндокринологии.- 2002.- Т.48, №3.- С.31-36.
Байжанова, Ж.Ж. Метаболический синдром у пациентов с хроническим гепатитом С / Ж.Ж.Байжанова, Т.М.Игнатова, Т.П.Некрасова // Клин. гепатология.- 2010. - №1.- С.17-23.
Богомолов, П.О. Неалкогольная жировая болезнь печени: стеатоз и неалкогольный стеатогепатит / П.О.Богомолов, О.Ю.Шульпекова // Клин. перспективы гастроэнтерологии, гепатологии. - 2004.- №3. - С.20-27.
Влияние Метформина на формирование устойчивого вирусологического ответа / О.О. Хафисова [и др.] // Вестник РУДН. - 2011.- №2.- С.48-57
Гулинская, О.В. Инсулинорезистентность у пациентов с хроническим гепатитом С / О.В. Гулинская, В.М. Цыркунов // Современные проблемы инфекционной патологии человека.- Минск.- 2012.- С.175-178.
Гулинская, О.В. Инфицированность и роль НСV у пациентов с сахарным диабетом / О.В. Гулинская // Тезисы докладов конференции студентов и молодых ученых, посвященной памяти профессора И.П. Протасевича. - Гродно.- 2010. - С.127-128.
Гулинская, О.В. Роль вируса С (НСV) в развитии нарушения углеводного обмена / О.В. Гулинская // Актуальные вопросы медицины (материалы, посвященные 50-летию УО "ГрГМУ").- Гродно.-2008.- С. 90-91.
Игнатова, Т. М. Внепеченочные проявления хронической HCV-инфекции / Т.М. Игнатова, З.Г. Апросина, В.В. Серов // Рос. мед. журнал.- 2001.- №2.- С.13-18.
Онищенко, Г.Г. Актуальные вопросы эпидемиологии и профилактики вирусных гепатитов В и С в Российской Федерации. / Г.Г.Онищенко, И.В. Шахгильдян // Журн. микробиол.- 2000.- №1.- С.50-54.
Стельмах, В. В. Рациональная терапия хронического гепатита C. / В.В. Стельмах, В.Г. Радченко, В.К. Козлов // Врач. - 2006. - №2.- С.57-62.
Цыркунов, В.М. НCV-инфекция: монография / В.М. Цыркунов, Н.В. Матиевская, С.П. Лукашик; под ред. В.М. Цыркунова.- Минск: Асар, 2012.- 480с.
Bortoletto, G. Insulin resistance (IR) defined by the homeostasis model of assessment insulin resistance (HOMA-IR) index has a direct effect on early viral kinetics during pegylated-interferon therapy for chronic hepatitis C / G. Bortoletto, S. Realdon, F. Dal Pero // Hepatology.- 2007.- Vol.46.- Р.361.
Community-based study of hepatitis C virus infection and type 2 diabetes: an association affected by age and hepatitis severity status / C.S. Wang [et al.] // Am. J. Epidemiol.- 2003.- Vol.158. - Р.1154-1160.
D'Souza, R. Insulin resistance plays a significant role in liver fibrosis in chronic hepatitis C and in the response to antiviral therapy / R. D'Souza, C.A. Sabin, G.R. Foster // Am. J. Gastroenterol.- 2005. - Vol.100. - Р.1509-1515.
Effect of significant histologic steatosis or steatohepatitis on response to antiviral therapy in patients with chronic hepatitis C /S.A. Harrison [et al.]// Clin. Gastroenterol. Hepatol. - 2005. - Vol.3. - Р.604-609.
Epidemiological factors affecting the severity of hepatitis C virus-related liver disease /F.Roudot-Thoraval [et al.] // Hepatology. -1997. - Vol.26, №2. - P.485-490.
Fried, M. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection / М. Fried, М. Shiftman // New Engl. J. - Med. - 2002. - Vol.347. - P.975-982.
Gulinskaya, O.V. А revalence of chronic virus hepatitis C in patients with diabetes / O.V. Gulinskaya // International Congress of Young Medical Scientists. - May 11-12th 2012, Poznan, Poland. - 2012.- Р.54
Harrison, S.A. Correlation between insulin resistance and hepatitis C viral load / S.A. Harrison // Hepatology. - 2006. - Vol.43. - Р.1168.
Hepatitis C viremia increases the association with type 2 diabetes mellitus in a hepatitis B and C endemic area: an epidemiological link with virological implication / J.F. Huang [et al.] // Am. J. Gastroenterol. - 2007. - Vol.102. - Р.1237-1243.
Hui, J.M. Insulin resistance is associated with chronic hepatitis C and virus infection fibrosis progression / J.M. Hui, А.Sud, G.C. Farrell // Gastroenterology. - 2003. - Vol.125. - Р.1695-1704.
Increased risk of type 2 diabetes in noncirrhotic patients with chronic hepatitis C virus infection / Н. Knobler [et al.] // Mayo. Clin. Proc. - 2000. - Vol.75. - Р.355-359.
Insulin resistance impairs sustained response rate to peginterferon plus ribavirin in chronic hepatitis C patients / Romero-Gomez M. [et al.] // Gastroenterology. - 2006. - Vol.128. - №3. - Р.636-641.
Insulin resistance and insulin secretion in chronic hepatitis C virus infection / R.Narita [et al.] // J. Hepatol. - 2004. - Vol.41. - Р.132-138.
Insulin resistance is associated with steatosis in non-diabetic patients with genotype 1 chronic hepatitis C / С. Саmma [et al.] // Hepatology. - 2006. - Vol.43. - Р.64-71.
Kawaguchi, T. Causal relationship between hepatitis C virus core and the development of type 2 diabetes mellitus in a hepatitis C virus hyperendemic area: a pilot study / Т.Kawaguchi, Y.Nagao, К.Tanaka // Int. J. Mol. Med. - 2005. - Vol.16. - Р.109-114.
Khalili M., Lim J.W., Bass N. et al. New onset diabetes mellitus after liver transplantation: the critical role of hepatitis C infection // Liver Transplant. - 2004. - №10. - Р.349-355.
Mehta, S.H. Hepatitis C virus infection and incident type 2 diabetes / S.H. Mehta, F.L. Brancati, S.A. Strathdee // Hepatology. - 2003. - Vol.38. - Р.50-56.
Peginterferon alfa-2a and ribavirin combination therapy in chronic hepatitis C. A randomized study of treatment duration and ribavirin dose / S. Hadziyannis [et al.] // Ann. Intern. Med. - 2004. - Vol.140. - P.346 -355.
Petit, J-M. Risk factors for diabetes mellitus and early insulin resistance in chronic hepatitis C / J-M. Petit, J-B. Bour, С. Galland-Jos // J. Hepatol. - 2001. - Vol.35. - Р.279-283.
Prevalence of type 2 diabetes mellitus among persons with hepatitis C virus infection in the United States / S.H. Mehta [et al.] // Ann. Intern. Med. - 2000. - Vol. 133. -Р.592-599.
Reaven, G. Role of insulin resistance in human disease / G.Reaven // Diabetes. - 1988. -Vol.37, №12. - P. 1595-1607.
Sanyal, A.J. Role of insulin resistance and hepatic steatosis in the progression of fibrosis and response to treatment in hepatitis C / A.J. Sanyal // Journal Article Liver Int. - 2009. - Jan. - Р.23-28.
Sanyal, A.J. Hyperinsulinemia blocks the inhibition of hepatitis C virus (HCV) replication by interferon: a potential mechanisms for failure of interferon therapy in subjects with HCV and nonalcoholic fatty liver disease / A.J Sanyal, N.Chand, К Comar // Hepatology.- 2004.- Vol.40.- Р.179-186.
Shintani, Y. Hepatitis C virus infection and diabetes: direct involvement of the virus in the development of insulin resistance /Y.Shintani, Н.Fujie, Н.Miyoshi // Gastroenterology - 2004. - Vol.126. - Р.840-848.
Steatosis and steatohepatitis in patients with chronic hepatitis C / D.Kleiner [et al.] // Hepatology. - 2002. - Vol.36, № 4. - P.411.
World Health Organization: Report of a WHO Consultation: Definition, Diagnosis and Classification of Diabetes Mellitus and ins Complications. Geneva, World Health Organization, 1999.
Yazicioglu, G. Insulin resistance in chronic hepatitis C / G. Yazicioglu, F.Isitan, Н.Altunbas // Int. J. Clin. Pract. - 2004. - Vol.58. - Р.1020-1022.
- На текущий момент ссылки отсутствуют.

Пациент Н…, 47 лет, обратился в клинику с жалобами на колебания АД, чаще повышенное, головные боли, шум в ушах на фоне повышения АД (max до 200/100 мм. рт. ст.), иногда одышку при нагрузке, дискомфорт в области сердца, сухость во рту, жажду, частое мочеиспускание, боли в нижних конечностях, прибавку веса за последние 2 года на 15 кг, ноющие боли и тяжесть в правом подреберье после приема жирной и жареной пищи.
Из анамнеза заболевания известно, что подъемы АД впервые стали беспокоить несколько лет назад. Постоянной антигипертензивной терапии не получал, лишь эпизодически самостоятельно использовал нолипрел или энап. Следует отметить, что пациент всегда был повышенного питания мужчиной. Данная тенденция была связана с образом жизни и гастрономическими пристрастиями пациента: в чрезмерном количестве употребляя жирную пищу, не может жить без мучного и сладкого, что в большей степени связано с пищевыми привычками, заложенными в его семье с детства (у бабушки, мамы и сестер был сахарный диабет). Напомним, что семья играет особую роль в развитии привычек здорового питания и физической активности. Развитие ожирения у детей связано с образом жизни всех членов семьи в целом, их пищевого поведения.
При объективном осмотре состояние относительно удовлетворительное. Кожные покровы бледно-розовые, расчесы и шелушение на коже голеней. Периферических отеков нет. Рост 175 см., вес 130 кг, ИМТ=43кг/м2. Антропометрические маркеры абдоминального типа ожирения – окружность талии 120 см. В легких дыхание везикулярное, хрипы не выслушиваются. Смещение перкуторных границ сердца влево, что у пациентов с высокой степенью АГ свидетельствует в пользу гипертрофии миокарда левого желудочка. Тоны сердца ритмичные, акцент 2-го тона на аорте. АД=210/110 мм.рт.ст. Живот увеличен в объеме за счет подкожно-жирового слоя, безболезненный при пальпации, печень на 1.5 см от края реберной дуги по правой срединно-ключичной линии, край закруглен, поверхность гладкая.
По данным лабораторного обследования выявлены другие признаки метаболического синдрома: атерогенная дислипидемия с повышением уровня общего холестерина до 7,63 мгмоль/л, повышение уровня ЛПНП до 4,59. Определялась гипергликемия натощак 19,46 ммоль/л. Кроме того сывороточные трансаминазы были повышены: АлАТ 145,9 и АсАТ 96 ед/л. Маркеры гепатитов В и С не онаружены. С высокой степнью вероятности, повышение АлАТ и АсАТ у тучных людей указывает на неалкогольный стеатогепатит.
На ЭКГ: ритм синусовый, регулярный, ЧСС – 75 в минуту, положение ЭОС горизонтальное. Косвенные признаки гипертрофии левого желудочка.
ЭхоКГ: гипертрофия миокарда симметричная. Дилатации полостей нет, сохраненная фракция выброса (66,7%).
По данным УЗИ ОБП: признаки гепатомегалии, диффузные изменения в печени по типу жирового гепатоза, деформации желчного пузыря с наличием полипов и застоем густой желчи в его полости, реномегалии с обеих сторон.
Одновременное наличие у разбираемого пациента неалкогольной жировой болезни печени (НАЖБП) и сердечно-сосудистых заболеваний заставляет задуматься о потенциальном влиянии НАЖБП на сердечно-сосудистый риск. Согласно последним научным исследованиям НАЖБП позиционируется как новый фактор риска сердечно-сосудистых заболеваний.
При выборе тактики лечения пациента Н…, 47 лет, необходимо было учитывать некоторые особенности его истории болезни. Пациенту, молодому мужчине, требовалось сохранить высокую социальную активность, обязательным условием терапии являлось снижение массы тела. Следовало обязательно достигнуть адекватного контроля АД и липидного профиля для профилактики сердечно-сосудистых катастроф, провести корреляцию гликемии.
Больному была назначена
гипохолестериновая, гипокаллорийная диета, увеличена физическая активность, а также медикаментозная коррекция с использованием сахароснижающих препаратов , гипотензивных препаратов – тут предпочтение было отдано препарату с удобным приемом, 1 раз в день, из группы сартана (БРА). Клинические исследования доказали не только антигипертензивную эффективность БРА (блокаторов рецепторов к ангиотензину), положительное влияние на диастолическую функцию миокарда, улучшение инсулиночувствительности, но и возможность уменьшать фиброз печени, воспаление, стеатоз, снижать активность трансаминаз. Гиполипидемическая терапия осуществлялась статином. Терапия неалкогольного стеатогепатоза проводилась препаратом содержащим эссенциальные фосфолипиды, т.к. препараты данной группы обладают дополнительными « полезными «эффектами для терапии НАЖБП с сопутствующей дислипидемией и метаболическим синдромом.
На фоне проводимой терапии через 10 дней отмечалось клиническое улучшение: головные боли не беспокоят, АД= 125/80 мм.рт.ст., гликемия натощак 7,2 ммоль/л. Пациент продолжает курс лечения. Таким образом, представленный клинический случай демонстрирует пример успешного лечения комплексного больного. Еще раз хочется подчеркнуть, что у больных с ожирением наблюдается множественная сочетанная патология. С учетом выше указанного, лечение таких пациентов целесообразно проводить комплексно с задействованием кардиолога, эндокринолога, диетолога, гастроэнтеролога. Всех этих специалистов можно посетить в клинике АЦМД- Медокс и успех лечения Вам гарантирован.
Несмотря на различную этиологию, хронические гепатиты характеризуются схожими морфологическими изменениями в виде диффузного воспалительно-дистрофического поражения печени с гистиолимфоплазматической инфильтрацией портальных полей, гиперплазией купферовских клеток, умеренным фиброзом в сочетании с дистрофией печеночных клеток при сохранении дольковой структуры. Гистологические изменения, как правило, зависят от тяжести поражения печени. Они также неспецифичны для различных этиологических факторов (алкогольного, вирусного, токсического и др.). Прогрессирование хронического гепатита ведет к усилению фиброза и перестройке архитектоники печени с развитием узлов. Это формирует цирроз печени с портальной гипертензией, нарастающей печеночной недостаточностью и другими нарушениями [3]. Одними из универсальных механизмов клеточного повреждения являются свободнорадикальные процессы. Под влиянием различных этиологических факторов, вызывающих хроническую патологию печени, происходит усиление процессов перекисного окисления липидов.
На практике, как показывают исследования, у молодых мужчин клинические симптомы хронических заболеваний печени в большинстве случаев немногочисленны, а у половины пациентов — отсутствуют. На наличие патологии печени часто указывают лишь повышенные показатели аланинаминотрансферазы, но и нормальные показатели ее еще не гарантируют отсутствия изменений в печени.
Среди многочисленных причин и механизмов, ведущих к повреждению и заболеваниям печени, ожирение, сахарный диабет 2-го типа и гиперлипидемия признаются наиболее частыми причинами развития, в частности, стеатоза и стеатогепатита и являются прогностическими факторами более выраженного гистологического поражения печени [4]. Но в то же время сопутствующие заболевания печени у таких пациентов имеют потенциально серьезное влияние на терапию ожирения, гипергликемии, гиперхолестеринемии и артериальной гипертензии. Наиболее частые причины неалкогольной жировой болезни печени и неалкогольного стеатогепатита могут быть представлены в двух группах.
1. Метаболические факторы:
- ожирение (особенно висцерального типа);
- сахарный диабет 2-го типа;
- гиперлипидемия (особенно гипертриглицеридемия);
- метаболический синдром.
2. Лекарственные препараты:
- метотрексат;
- амиодарон;
- тамоксифен;
- аналоги нуклеотидов;
- другие.
Таким образом, печень при метаболическом синдроме выступает в роли органа-мишени с развитием неалкогольной жировой болезни печени и сама обуславливает высокий атерогенный потенциал метаболического синдрома, активно участвуя в патогенезе атерогенной дислипидемии. Тесная связь между гиперлипидемией и жировой инфильтрацией печени определяет возрастающее значение медикаментозного лечения дислипидемий у пациентов с неалкогольной жировой болезнью печени.
По мнению ряда исследователей (Wenk и соавт., 2011) при псориазе имеется весьма высокий риск развития патологии печени. Известно, что у больных псориазом закономерно наблюдается высокий уровень ИЛ-1, что приводит к развитию инсулинорезистентности, которая, в свою очередь, лежит в основе системного воспаления с активацией провоспалительных адипокинов и развитием признаков метаболического синдрома, компонентом которого становится неалкогольный жировой гепатоз.
Надо сказать, сегодня существуют убедительные доказательства того, что среди многочисленных коморбидностей псориаза метаболический синдром является ведущим как по частоте, так и по риску развития кардиоваскулярных последствий, вплоть до инфаркта миокарда [8]. В силу этого обстоятельства обследование больного псориазом, направленное на выявление метаболического синдрома, сегодня представляется задачей именно дерматолога как ведущего специалиста любого псориатического больного [9].
Помимо значимого риска развития повреждений и заболеваний печени по причине метаболического синдрома и других коморбидных состояний при псориазе, существует опасность гепатотоксичных воздействий в результате применения специфических дерматологических химиопрепаратов для лечения псориатического больного по показаниям и в соответствии с существующими официальными рекомендациями и стандартами [10].
Давно известный факт, что опасность развития медикаментозного повреждения печени представляют фотосенсибилизаторы, применяющиеся при ПУВА-терапии у больных псориазом, которая, кстати, считается одним из самых эффективных терапевтических мероприятий при тяжелых распространенных формах псориаза. В связи с этим риском сопутствующие острые и хронические заболевания печени у больных псориазом являются противопоказанием для проведения ПУВА-терапии. Как следствие, перед началом такого лечения необходимо, как минимум, провести биохимическое исследование крови (трансаминазы, щелочная фосфатаза, триглицериды, холестерин) и при незначительных отклонениях в этих показателях фотохимиотерапию проводить можно, но с одновременным назначением максимально эффективного гепатопротектора.
Согласно отечественным и международным клиническим рекомендациям первой линией системной терапии тяжелых форм псориаза, особенно в сочетании с псориатическим артритом, является метотрексат, обладающий, как известно, прогнозируемой гепатотоксичностью. Повреждающее действие метотрексата на ткань печени давно доказано, в том числе с помощью описанных гистологических изменений при его применении [11]. Эти морфологические изменения включают сужение просвета печеночных протоков, уменьшение количества и разрушение микровилл, разрушение билиарных эпителиальных митохондрий, наличие фокусов внутриклеточного отека, изменения аппарата Гольджи с клеточной атрофией, расслоение базальной мембраны и др. Весь этот набор патоморфологических изменений неминуемо сказывается на функциональном состоянии печени, что естественно требует назначения гепатопротекторов при проведении терапии метотрексатом у больных псориазом.
Вообще гепатотоксическим действием среди наиболее часто применяемых системных дерматологических препаратов при других дерматозах, кроме метотрексата и фотосенсибилизаторов, обладают азатиоприн, часто применяемый при пузырчатке и лимфомах; синтетические ретиноиды, назначаемые при тяжелых угрях, дискератозах, псориазе; гризеофульвин, по-прежнему незаменимый при трихомикозах; циклоспорин А, показанный при упорных формах псориаза и атопического дерматита. И этим списком не ограничивается круг системных дерматологических химиопрепаратов с гепатотоксичческим эффектом, в том числе и при их комбинированном применении по механизму лекарственного взаимодействия, далеко не всегда достаточно хорошо известного.
Таким образом, как оказывается, едва ли не в большей части случаев назначения высокоэффективных на уровне доказательных исследований химиотерапевтических системных средств при тяжелых хронических, иногда жизнеугрожающих дерматозах, существует риск развития гепатотоксичности и повреждений печени, что является веским основанием для настоятельных рекомендаций одновременного применения препаратов с гепатопротективным эффектом. Гепатопротекторы — это фармакологическая группа разнородных лекарственных средств, которые препятствуют разрушению клеточных мембран и стимулируют регенерацию гепатоцитов [12].
К гепатопротекторным препаратам относят группу лекарственных средств с различными механизмами действия, направленными на нормализацию функциональной активности печени, потенцирование репаративно-регенеративных процессов, восстановление гомеостаза и повышение устойчивости органа к действию патогенных факторов [13]. К таким лекарственным средствам относятся биофлавоноидные препараты природного происхождения. Более 200 лет с этой целью применяют различные препараты, изготовленные из расторопши пятнистой (Silybum marianum). В последние годы из нее выделено много компонентов, обладающих гепатопротекторными свойствами. Силимарин — общее название химически связанных изомеров флавонолигнана из плодов расторопши. Основными биофлавоноидами в силимарине являются: силибинин, силидианин, силикристин, изосилибинин, среди которых силибинин обладает наибольшей биологической активностью.
Особое внимание стоит обратить на оригинальный гепатопротектор Легалон®. Он содержит в своем составе наибольшее количество силибинина (77%), поэтому считается наиболее эффективным гепатопротектором, имеющим широкий спектр воздействия на большую часть патогенетических механизмов хронических заболеваний печени. Многочисленные исследования доказали, что силибинин, содержащийся в препарате Легалон®, способствует значительному повышению содержания восстановленного глутатиона в печени, тем самым повышая защиту органа от окислительного стресса, поддерживая ее нормальную дезинтоксикационную функцию.
Противовоспалительный и иммунорегулирующий эффекты обуславливают антифиброзное действие силибинина. Легалон®, предотвращая действие фактора некроза опухолей (ФНО-α) на клетки Купфера, замедляет активацию звездчатых клеток, снижает коллагенообразование. Имеются данные о замедлении темпов прогрессирования фиброза печени на фоне длительного приема силибинина.
Легалон® целесообразно применять у больных с лекарственно-индуцированными заболеваниями печени с клиническими и биохимическими признаками активности, профилактическими курсами при необходимости длительного приема гепатотоксичных препаратов (например метотрексата, цитостатиков, нестероидных противовоспалительных средств, антиаритмических средств, антидепрессантов, контрацептивов и т. д.), при вынужденной полипрагмазии (особая группа риска — женщины после 40 лет). Лекарственную терапию пациентам, с указанием в анамнезе на диффузные заболевания печени любой этиологии или страдающим алкогольной и никотиновой зависимостью, следует также проводить под прикрытием препарата Легалон®.
Доказательство антифибротического эффекта силимарина было получено в результате специально проведенного клинического исследования, в которое было вовлечено 998 больных с хроническими заболеваниями печени (стеатоз печени, стеатогепатит и цирроз печени различной этиологии) [14]. На протяжении 12 недель больные получали силимарин по 140 мг 3 раза в день. В результате терапии у 96% больных были достигнуты клиническое улучшение или ремиссия заболевания, при этом нормализация показателей индикатора фиброза произошла у 47% больных стеатозом, у 41% — стеатогепатитом и у 26% — циррозом печени. У значительной части больных после терапии наблюдалась нормализация количества проколлагена как маркера фиброза.
Известно, что глутатион способствует выведению токсинов печени, является мощным естественным антиоксидантом и стимулирует обмен веществ. Как показано в исследованиях [15], силимарин связывает свободные радикалы, тормозит перекисное окисление липидов и стимулирует синтез глутатиона, что в целом лежит в основе антиоксидантного эффекта препарата Легалон®.
Кроме того, противовоспалительное действие силимарина продемонстрировано в работах [16], показывающих блокирующее влияние препарата на ферменты, продуцирующие медиаторы воспаления (лейкотриен В4 и простагландин Е2), а также путем взаимодействия с клетками Купфера, приводящего к подавлению воспалительного процесса.
Путем стимулирования синтеза рибосомальных РНК и синтеза белка силимарин приводит к восстановлению структурных единиц гепатоцитов, что составляет регенеративный эффект препарата, так необходимый при повреждениях печени различной природы [17].
Наконец, мембраностабилизирующий эффект силимарина осуществляется путем встраивания его в мембрану гепатоцита с последующим восстанавливающим биохимическим воздействием. Это находит подтверждение в клинических наблюдениях, демонстрирующих нормализацию уровней билирубина у 82% больных и АСТ у 60% после терапии силимарином [18].
Таким образом, возвращаясь к тяжелым хроническим дерматозам, необходимо помнить, что при подозрении или доказанном повреждении печени медикаментозного происхождения и жировом гепатозе метаболического характера во время проведения системной терапии больного рекомендуется сопровождать основное лечение назначением препарата Легалон® в дозе 140 мг трижды в сутки в качестве лечебного воздействия с переходом на поддерживающую дозу в 70 мг трижды в сутки как профилактическую терапию на протяжении последующих 3–4 мес.
В качестве заключения приводим табл. 2 и 3 с целью демонстрации достоинств и преимуществ оригинального препарата Легалон® перед другими гепатопротекторами.
Литература
- Степанов Ю. М., Залевский В. И. // Сучасна гастроентерологія, 2007, 6 (38), 14–21.
- Adams L. A., Lymp J. F., Sauver J. et al. The natural histori of non_alcogolic fatty liver discase: A population-based cohort study // Gastroenterology. 2005. № 129. Р. 113–121.
- Andersen T., Gluud C. Liver morphology in morbit obesity; a literature study // Int. J. Obes. 1984. Vol. 8. P. 107–115.
- Braillion A., Capron J. P., Herve M. A. et аl. Liver in obesity // Gut. 1985. Vol. 26. P. 133–139.
- Кочергин Н. Г., Смирнова Л. М., Потекаев Н. Н., Билалова У. В. Псориаз: коморбидности и комедикации // Врач. 2009, № 5, с. 15–20.
- Christophers E. Comorbidities in psoriasis // Clin. Dermatol. 2007; 25: 529–534.
- Abuabara K. et al. // BJD, 2010, v. 163, p. 585–592.
- Gisondi P., Tessari G., Conti A. et al. Prevalence of metabolic syndrome in patients with psoriasis // Br. J. Dermatol, 2007, v. 157, p. 68–73.
- Boehnke W. H. EADV Congress, 2014, D2 T11. 1 C.
- Farrell G. C. Liver disease caused by drags, anesthetics, and toxins / Feldman M., Scharschmidt B. E., Sleisenger M. H. (eds). Gastrointestinal disease. Philadelphia, PA$ WB Saunders, 2002. P. 1403–1447.
- Farreli G. C. Drag-induced liver disease. Edinburgh: Churchill Livingstone. 1994.
- Рук-во для практикующих врачей / Под общ. ред. В. Т. Ивашкина, А. О. Буеверова. М., 2009. 296 с.
- Журавлева Л. В., Кривоносова Е. М. // Сучасна гастроентерологія, 2013, 4 (72), 93–101.
- Schuppan. Z. // Allg. Med. 1998. 74, 577–584.
- Campos et al. // Planta Med. 1989. 55, 417–419.
- Dehmlow et al. // Life Sci. 1996. 58, 749–754.
- Sonnenbichler and Zeti in: Plant flavonoids in biology and medicine. 1986, 319–331.
- Kiesewetter E. et al. // Leber Magen Darm. 1977. V. 7, p. 318–323.
Н. Г. Кочергин, доктор медицинских наук, профессор
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
Читайте также:


