Клетки которые убивают опухолевые и зараженные вирусом клетки
Медицинский информационный портал SIBMEDA 1 октября 2018 г.
Новосибирские учёные рассказали о перспективах и проблемах, связанных с клеточной терапией онкологических заболеваний
Новосибирские учёные включились в проведение исследований терапии рака генно-модифицированными клетками пациента. Результаты зарубежных коллег обнадёживают: от 50 до 90 процентов больных некоторыми видами рака в терминальной стадии переходят в стойкую ремиссию.

кбн АА Горчаков, кбн СВ Кулемзин
О ситуации с клеточной терапией онкологических заболеваний в России рассказывают старшие научные сотрудники Института молекулярной и клеточной биологии СО РАН, к.б.н. Андрей Горчаков и к.б.н. Сергей Кулемзин:
– Известно, что у нас в организме время от времени появляются раковые клетки. Однако собственная иммунная система обладает способностью такие клетки распознавать и уничтожать. Человек живет и не подозревает о том, от чего защитила его иммунная система.
Но иногда раковые клетки мутируют и “притворяются” здоровыми, тогда иммунная система их не распознаёт. То же может случиться при ослабленном иммунитете. Речь не об ослабленном иммунитете в обиходном понимании, когда мы говорим, что легко подхватываем вирусы или простужаемся, а о том, что отдельные звенья иммунной системы по разным причинам работают неактивно. И тогда раковые клетки начинают бесконтрольно размножаться.
Если мы научимся манипулировать иммунной системой, чтобы она всегда могла опознать раковую клетку, то мощности собственной иммунной системы будет достаточно для излечения от раковых опухолей.
Один из обнадеживающих способов использовать возможности организма в борьбе против онкологических заболеваний, терапия так называемыми Т-лимфоцитами с химерными антигенными (антигены – чуждые для организма вещества, вызывающие его иммунный ответ – ред.) рецепторами, сокращенно CAR-Т, (от англ. сhimeric antigen receptor T-cell) появился сравнительно недавно, в конце ХХ века.
– И его в многочисленных публикациях называют “прорывом в лечении онкологии”, “новой эрой в медицине”. Почему?
– В чем идея такой молекулы? Одна из её частей распознает маркеры на поверхности опухолевой клетки, а другие части передают в клетку иммунной системы активирующий сигнал на уничтожение клетки опухоли. Производятся CAR-Т клетки следующим образом: из крови пациента извлекаются Т-лимфоциты, то есть клетки, которые в норме должны защищать нас от раковых и заражённых вирусами клеток. Затем в хромосомы Т-лимфоцитов встраивают ДНК, кодирующую CAR, и клетка начинает продуцировать на своей поверхности те самые химерные, то есть, искусственно созданные, не существующие в природе рецепторы. Они сконструированы так, чтобы Т-лимфоциты обнаруживали маркеры на поверхности раковых клеток и получали сигнал атаковать их. Полученные таким образом CAR T-клетки размножают и вводят обратно в кровь пациента.
– Что происходит дальше?
– Если CAR–T в организме пациента сталкиваются с нормальной клеткой, то они просто проплывают мимо друг друга, если обнаруживают раковую клетку, то химерный антигенный рецептор опознаёт на ней специфический маркер, на который он был настроен при создании. Т-лимфоцит убивает раковую клетку и начинает очень активное деление. Из одной клетки, оснащённой CAR–T рецептором, получаются сотни и даже тысячи. Такое саморазмножающееся лекарство.
И пока в каких-то уголках организма будут находиться раковые клетки, CAR–T лимфоциты будут их уничтожать. Когда все раковые клетки будут уничтожены, CAR–T лимфоциты по большей части погибнут, некоторые останутся в костном мозге, чтобы в случае повторных рецидивов снова появиться, размножиться и уничтожить рак.
– Звучит убедительно. Почему же тогда даже в лучшем случае эффективность лечения 50-90 процентов. А не 100?
– Далеко не всегда опухоль гомогенна по составу. Например, 90 процентов клеток могут нести мишень, на которую нацелены CAR–T лимфоциты, а 10 процентов – нет. И эти 10 процентов остаются в организме нетронутыми и размножаются. Кроме того, даже изначально гомогенная по составу опухоль может “ускользнуть” от CAR–T лимфоцитов, если “уберёт” или модифицирует мишени на поверхности своих клеток. Есть и другие проблемы, осложняющие лечение химерными антигенными рецепторами. Например, несмотря на то, что CAR–T клетки сами по себе могут жить долго, в истощённом множественной химиотерапией организме они будут достаточно вяло размножаться и неэффективно бороться с раковыми клетками. Отчасти поэтому такой подход работает не во всех случаях.
– Известно, какие побочные эффекты возможны при лечении CAR–T клетками?
– В мире уже проведены клинические испытания на нескольких тысячах пациентов с онкогематологическими заболеваниями, такими как острый лимфобластный лейкоз и некоторые варианты лейкемии. Побочные эффекты связаны с тем, что CAR–T клетки оказываются слишком мощными. Атакуя опухолевые клетки, они воздействуют и на другие клетки иммунной системы, заставляя их массово выделять биологически активные вещества, цитокины, и возникает состояние, названное “цитокиновым штормом”. Поднимается температура, падает до критических значений давление, возможны галлюцинации, могут отказать почки. Это состояние требует реанимационных мероприятий. Отрадно, что врачи уже научились предсказывать и контролировать развитие цитокинового шторма у большинства пациентов. Кроме того, не будем забывать, что риски, связанные с CAR-T терапией, в общем-то ниже, чем при применяемой у больных лейкозом в качестве последней линии терапии трансплантации костного мозга.
– Для каких видов онкологии CAR–T терапия эффективна уже сегодня?
– Изначально терапию применяли для острого лимфобластного лейкоза, того вида рака, которым чаще всего болеют дети. Возможно, поэтому встречается информация о наибольшей эффективности CAR–T терапии для лечения детей. Но и у взрослых с этим заболеванием результат оказался ничуть не хуже.
Сейчас эта терапия показывает эффективность 50–90 процентов при лечении пациентов даже с терминальной стадией лимфобластного лейкоза, лимфомы и миеломы.
Есть попытки лечить CAR–T клетками так называемые солидные опухоли (солидные опухоли – собирательное обозначение опухолей, которые имеют определённую локализацию – место расположения, и этим отличаются от другой группы – опухолевых заболеваний кроветворной и лимфоидной ткани – лейкозов – ред.), но тут пока не удаётся добиться удовлетворительного результата.
– Почему?
– Дело в том, что CAR–T клетке достаточно тяжело проникать в такую опухоль, надо продвигаться против градиента давления, в солидной опухоли CAR-T клеткам буквально нечем дышать. А раковые клетки к тому же активно защищаются и выделяют вещества, способные убить или “усыпить” CAR–T клетку. Получается, что CAR–T клетки, даже добравшиеся до опухоли, не способны выполнять свои функции. Солидные виды рака встречаются очень часто.
И сейчас сотни компаний по всему миру проводят собственные клинические испытания, чтобы приспособить эту технологию для лечения солидных видов рака. Создаются технологические решения с целью заставить клетку направленно мигрировать в опухоль, выживать в агрессивной среде, привлекать себе в помощь дополнительные клетки иммунной системы. Доклинические исследования на мышах показывают убедительные результаты. Клинические (на пациентах) пока скромные. Но учитывая, что этим сейчас занимается весь мир, очень серьёзные клиники, фармкомпании и университеты, мы уверены в том, что в ближайшее время разные типы онкозаболеваний станут более восприимчивы к CAR–T терапии.
– За счёт чего?
– Можно выбрать другие клетки-носители, – и в этих разработках участвует и наша лаборатория. Или модифицировать саму клетку-носитель, изменить ее геном, чтобы затем изменились ее свойства. Мы подумываем и это делать. Пока мы модифицируем CAR, чтобы они стимулировали лимфоциты не слишком сильно, но и не слишком слабо. Чтобы не стимулировали лимфоцит в отсутствие раковой клетки, чтобы лучше находили редкие маркеры на поверхности раковых клеток. Мы занимаемся созданием и модификацией CAR для маркеров острого лимфобластного лейкоза и рака простаты. В последнем случае мы не можем пока говорить о клиническом результате, работа ведётся на мышах.
– Каковы перспективы применения химерных антигенных рецепторов для лечения онкологических заболеваний в нашей стране?
– Обратите внимание на график распределения клинических испытаний по странам мира (график 1). По общему числу проводимых клинических испытаний Китай находится на 3 месте. По CAR–T терапии – на первом! (график 2) И это притом, что фундаментальные научные работы в CAR–T области, в основном, ведутся в США. С чем это связано? За счёт того, что в Китае законодательная политика в отношении проведения клинических испытаний наиболее лояльна, они практически превратили клинические испытания в лечебный процесс. Китайские учёные используют CAR–T, разработанные в лабораториях мира, анализируют чужой опыт, проводят клинические испытания, и одновременно разрабатывают собственные CAR–T продукты. И поток онкологических пациентов из разных стран, в том числе, из России, стремящихся получить CART-клеточную терапию в Китае, становится все больше.
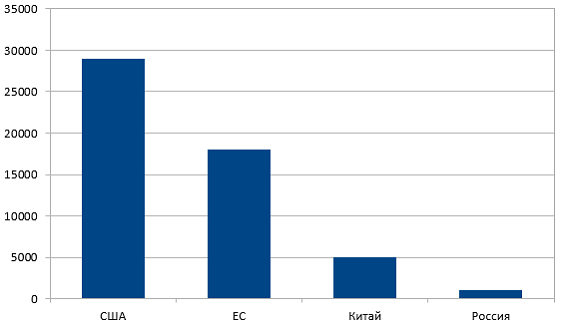
График 1
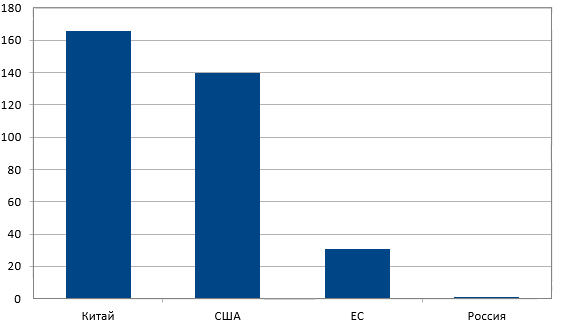
График 2
– А что сейчас происходит в этой сфере в России?
– В России, благодаря энергии и энтузиазму врачей, проходит одно клиническое испытание CAR-T клеток в Центре детской онкогематологии им. Димы Рогачёва.
– Против 160 в Китае? Что мешает повторить их опыт?
– Да, китайский путь развития CAR–T терапии выглядит наиболее приемлемым для России. Если же идти по пути создания собственных CAR–T рецепторов с нуля, то нас ждут интересные, но очень долгие исследования, а пациентам можно помочь уже сейчас.
Сложность в том, что существующий Федеральный закон “О биомедицинских клеточных продуктах” от 23.06.2016 N 180-ФЗ (ред. от 03.08.2018) не доработан окончательно. В том варианте, в котором он существует сейчас, внедрение в практику CAR T-клеточных продуктов требует процедур, схожих с внедрением химических препаратов. Даже для доклинических испытаний CAR T-клетки должны быть произведены в формате GMP (надлежащая производственная практика), сами испытания должны быть проведены GLP (надлежащая лабораторная практика) – cертифицированными лабораториями. Это фактически отрезает академическую науку от разработки CAR T-клеточной терапии. Сейчас учёные надеются на подзаконные акты, которые смягчат существующие требования.
Клеточная терапия – новый инструмент медицины, и к нему должен быть разработан новый, сбалансированный нормативно-правовой подход. А пока к нам приходят письма с вопросами, где и как можно пройти CAR–T терапию. И мы отвечаем: “В Китае”.
Как вирусы провоцируют раковые опухоли
Среди направлений, которые современная медицина разрабатывает в поиске средств для борьбы с раком, важное место принадлежит вирусологии. С начала XX века известно, что онкозаболевания и инфицирование вирусами могут быть связаны друг с другом, но лишь теперь становится ясно, как именно и в каких случаях проникновение вируса в тело человека приводит к появлению злокачественной опухоли. Редакция N + 1 приготовила для своих читателей рассказ о том, что на сегодняшний день известно об этой теме.
О причинах возникновения опухолей ходили догадки начиная с античных времен, и некоторые из них оказались удивительно проницательными для своего времени. Так еще в 1775 году английский врач Персифаль Пот обнаружил, что у трубочистов подозрительно часто встречается рак мошонки и связал это с канцерогенными свойствами сажи. Позже появились и другие подтверждения того, что некоторые вещества — позже их назовут канцерогенами — способны провоцировать образование опухолей.
Примерно в то же время российский ветеринар Мстислав Новинский продемонстрировал передачу болезни при переносе раковых клеток от больной собаки здоровой, показав тем самым, что рак может возникать и от контакта с живыми клетками. Тем не менее, эти два способа не объясняли всех случаев, и врачи продолжали искать возможные причины. Поэтому неудивительно, что после того, как в начале XX века были открыты вирусы, их тоже кинулись проверять на причастность к этой болезни.
Впервые доказательство их вины удалось получить Фрэнсису Пейтону Роусу (Francis Peyton Rous) и его датским коллегам Вильгельму Эллерману (Vilhelm Ellermann) и Олафу Бангу (Olaf Bang). Они продемонстрировали, что кур можно заразить раком при помощи бесклеточных фильтратов из опухолей больных птиц, но сделали это на разных примерах. Роус обнаружил вирусную природу птичьей саркомы, а датчане открыли вирус лейкоза птиц. Открытие оказалось настолько важным, что спустя полвека Роусу вручили за него Нобелевскую премию по медицине.
Обидно, но его датские коллеги, хоть и выступили со своим открытием на два года раньше, остались без премии, а их статья долгое время оставалась незамеченной. Возможно, причина этого заключалась в том, что раковая природа лейкемии долго оставалась неизвестной. Аналогичным образом остались без внимания работы итальянца Джузеппе Чуффо (Giuseppe Ciuffo), который в 1907 году продемонстрировал вирусную природу бородавок — связь папилломы и рака обнаружили гораздо позже.

Та самая курица с саркомой, с которой начались исследования Роуса
P. Rous / J. Exp. Med., 1911
Идея вирусного происхождения рака оказалась слишком новой для того времени, и должна было пройти еще пара десятков лет, прежде чем у нее появились новые поклонники. В тридцатых годах в аналогичных экспериментах на кроликах и мышах была подтверждена онкогенность других вирусов. На Западе наибольшую известность приобрели эксперименты Джона Биттнера (John Bittner), а в Советском Союзе его идеи были проверены Львом Зильбером — ученым с очень непростой судьбой.
Жизнь кидала Зильбера от Парижа до Печоры, а основные постулаты своей вирусной теории канцерогенеза он сформулировал в тюрьме. Работая в шарашке (НИИ тюремного типа при НКВД), ученый много экспериментировал с вирусом папилломы у кроликов — после заражения и дополнительной стимуляции канцерогенами у животных развивались опухоли.
Зильбер заметил, что к моменту появления внешних признаков опухоли вирус в тканях уже не обнаруживается. Это позволило предположить, что вирус папилломы только провоцирует клетку к злокачественной трансформации, а потом может элиминироваться из-за неспособности жить в условиях опухоли. Догадка насчет папилломы оказалась отчасти верна и получила мощное развитие уже в XXI веке, но попытка Зильбера в целом представить вирусы чуть ли не основными и единственными двигателями канцерогенеза не подтвердилась.
Со временем накопилось немало свидетельств того, что разные вирусы могут провоцировать развитие рака у животных, и начиная с шестидесятых годов аналогичные случаи начали массово описывать у людей.
Ниже представлены основные онкогенные вирусы и соответствующие им опухоли (источник).

Вирус папилломы, или HPV, — самый известный и хорошо изученный пример онкогенного вируса, провоцирующего у людей рак шейки матки и опухоли головы и шеи. Рак шейки матки — это четвертое по распространенности и смертности онкозаболевание среди женщин. Хуже всего с ним в Африке, но и в России его частота выше, чем во многих других странах, — 17 заболевших на 100 тысяч женщин. Фотография из работы первооткрывателя этой связи Гаральда цур Хаузена (Harald zur Hausen), получившего за свои работы Нобелевскую премию.
H. zur Hausen, Current Topics in Microbiology and Immunology 1977

Клетки с необычной цветочной формой ядра — характерный признак лейкемии, вызванной HTLV-1, Т-лимфотропным вирусом. Этот вирус довольно распространен в тропических странах и Японии. Обычно он ведет себя тихо, но в 5-10 процентах случаев может провоцировать опухолеобразование. У HTLV-1 есть много способов это сделать: как и другие ретровирусы, он умеет встраивать (и встаивает) свою ДНК в геном хозяина, а его белки могут взаимодействовать с CTCF — важным клеточным регулятором активности генов и организации хроматина.
American Society of Hematology, Blood Journal 2010

Гепатоцеллюлярная карцинома, по-простому рак печени, в 75 процентах случаев развивается на фоне хронического поражения вирусами гепатита B и С. Несмотря на сходный результат своей деятельности, эти вирусы вообще не родственны друг другу и ведут себя по-разному. HBV сделан на основе ДНК, может встраиваться в человеческий геном и дестабилизировать его. У HCV вместо ДНК РНК, он живет в цитоплазме и провоцирует рак за счет того, что мешает клетке чинить свою ДНК и тем самым увеличивает количество мутаций.
Delaney, Antiviral Research 2013

Среди других онковирусов — относительно редкий вирус герпеса 8 типа (KSHV), провоцирующий саркому Капоши и обычный обитатель нашей кожи вирус клеток Меркеля (MCV). Несмотря на широкое распространение, его открыли лишь в 2008 году благодаря метагеномному анализу кожи пациентов с карциномой клеток Меркеля.
После того как ученые наткнулись в образцах на последовательность ДНК неизвестного им раньше вируса, им удалось найти его самого, а заодно разработать аккуратный метод детекции. К их удивлению, этот вирус обнаружился практически у всех больных.
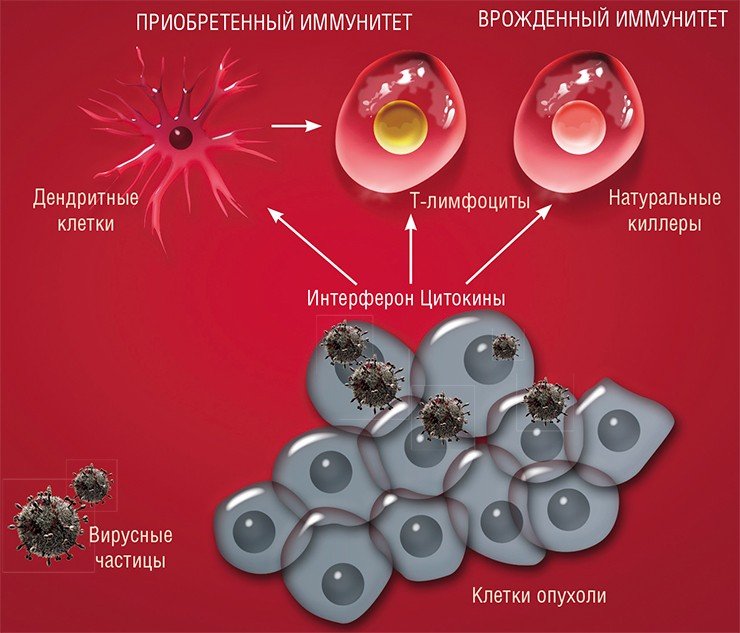
Действие онколитических вирусов основано на том, что они заражают преимущественно раковые клетки. В этом случае они ведут себя довольно агрессивно и убивают зараженную клетку, кроме того, их присутствие привлекает внимание иммунной системы.
Такими свойствами в отношении разных типов опухолей обладают парвовирусы, вирус везикулярного стоматита и другие, например созданный в лаборатории онколитический вирус герпеса. Последний получается путем удаления у обычного вируса герпеса первого типа гена ICP-34.5. Из-за этой манипуляции тот теряет способность размножаться в нервной ткани и ополчается на клетки опухоли.
Сейчас сразу несколько препаратов, основанных на этом принципе, находятся на разных стадиях клинических испытаний.
Сразу стоит отметить, что связь между заражением вирусом и канцерогенезом не столь однозначна, как можно представить. Сам по себе рак не заразен — известно всего несколько исключений из этого правила, вроде лицевой опухоли у тасманийского дьявола, но все они обнаружены не у людей, а у других животных и не связаны с вирусами. Тем не менее, можно легко заразиться вирусом, деятельность которого в дальнейшем может привести к раку.
Есть несколько типов опухолей, напрямую связанных с вирусами. Так, саркому Капоши находят только у KSHV+ людей, а такие распространенные опухоли, как рак шейки матки или рак печени, в 70-90 процентах случаев спровоцированы соответствующими вирусами.
Аналогичным образом, MCV провоцирует образование опухолей далеко не во всех случаях и становится агрессивным только после приобретения ряда мутаций — и то не у любых людей.
Для некоторых вирусов их онкогенный статус находится под вопросом — бывает, что их обнаруживают в пациентах с определенными видами раков, но такие совпадения находятся недостаточно часто, чтобы однозначно клеймить вирус. Например, вирус SV40 долгое время находился под подозрением, поскольку он вызывает рак у других видов животных. После многочисленных проверок ученые пришли к выводу, что для людей такой ассоциации не существует, и сейчас он полностью оправдан.
Шансы, что малозаметная вирусная инфекция приведет к онкогенезу, зависят от разных факторов. Во-первых, очень большую роль играет штамм вируса. Так, среди множества папиллом есть вирусы высокого и низкого риска, а около 70 процентов случаев опухолей — дело рук всего двух штаммов HPV16 и HPV18.

На текущий момент известно больше сотни штаммов вируса папилломы, освоивших самые разные ткани. На филогенетическом дереве хорошо видно, что онкогенность — как и специализация к отдельным тканям — возникала несколько раз независимо и свойственна лишь отдельным штаммам.
Ma et al., Journal of Virology 2014
Заякоривание вируса в организме может иметь свои причины — ослабленный иммунитет больного или усугубляющее действие канцерогенов вроде курения и других вирусов. Так, коинфекция вирусами гепатита B, C и ВИЧ в любых комбинациях повышает риск развития хронического гепатита и смертность от рака печени.
На молекулярном уровне переход инфекции в хроническую стадию часто сопровождается интеграцией ДНК вируса в человеческий геном. При этом сам вирус может давно покинуть хозяина, но застрявшие в геноме сломанные реплики будут продолжать мешать клетке нормально функционировать. По-видимому, именно это и наблюдал Лев Зильбер, когда видел, что у излечившихся от папилломы животных всё равно возникали опухоли.
Альтернативный путь — научиться манипулировать клеточным жизненным циклом, подталкивая ее к делению и синтезу ДНК. В большинстве случаев вирусы достигают этого, мешая работать белку Rb, который как раз ограничивает переход клетки к делению.
Кроме того, вирусам выгодно увеличивать продолжительность жизни клетки и не допускать ее апоптоза — самоубийства зараженных или просто больных клеток во имя здоровья всего организма. Для этого они давят работу классического онкосупрессора p53. Это регулятор клеточного цикла, который может запретить клетке переходить к делению при обнаружении каких-то патологий.
Та же интеграция вируса это тупиковый варинт развития событий. Из-за появления ошибок в ДНК при вставке вирус теряет способность к размножению и оказывается навсегда похоронен в человеческом геноме. Регуляция генов в них нарушена, и обычно малоактивные вирусные онкогены — например E6 у папилломы — включаются на полную мощность. В итоге плохо становится всем — и вирусу, и клетке.

Несмотря на то, что MVC открыли недавно, довольно быстро в общих чертах стало ясно, как и почему он провоцирует онкогенез. При сравнении MCV+ и MCV- раковых больных со здоровыми носителями MCV выяснилось: в опухоли вирус обычно интегрирован в человеческий геном так, что теряет способность к нормальному размножению (справа). Это приводит к тому, что самого вируса нет, но его белки по-прежнему синтезируются и вмешиваются в клеточные процессы. Второе обязательное изменение, которое должно произойти, это поломка гена LT. Из-за нее синтезируется укороченная версия этого белка, которая умеет влиять на экспрессию других генов и стабилизирует другие онкопротеины. В отсутствие вируса злокачественная трансформация клеток Меркеля достигается за счет множества мутаций из-за воздействия ультрафиолета (слева).
Harms et al., Nature Reviews Clinical Oncology 2018
По-видимому, есть вирусы, которые паразитируют на человеке, размножаясь ограниченно в группах клеток и не причиняя видимого вреда своему хозяину. Однако при определенных условиях они могут мутировать с образованием более патогенных вариантов. В этом случае возникает острая вирусная инфекция, которая заканчивается, когда в организме сформируется специфический иммунитет к патогену.
Но несмотря на относительно слабую изученность вирусного сообщества человека, практически сразу после открытия вирусов был обнаружен удивительный факт: у онкобольных вирусная инфекция может повлиять на протекание злокачественного процесса. Были зафиксированы случаи улучшения состояния таких пациентов и даже наступление длительной ремиссии после перенесенного вирусного заболевания либо вакцинации.
На основе этой информации еще в начале XX в. родилась идея использовать вирусы в борьбе с раковыми заболеваниями человека.
Взлеты и падения
Возможность создания принципиально новой формы терапии онкологических заболеваний, основанной на присущей вирусам способности убивать клетки, в которых он размножается, была впервые показана в середине прошлого века на примере рака шейки матки (Newman, 1954).
В результате удалось выделить и типировать ряд непатогенных для людей энтеровирусов, на основе которых были созданы живые энтеровирусные вакцины для профилактики сезонных вирусных заболеваний. При этом в ряде случаев удалось наблюдать положительный клинический эффект и в отношении злокачественных заболеваний, вплоть до полного исчезновения первичной опухоли и метастазов.

В ходе дальнейших исследований вакцинотерапию получили более полутора тысяч больных на поздних стадиях опухолевого процесса, и у части из них было отмечено улучшение состояния (Ворошилова, Ваганова, 1969; Ворошилова и др., 1977; Ворошилова, 1988).
Но уже в начале 1990-х гг. онколитические вирусы вновь стали объектом пристального внимания исследователей после публикации работы, посвященной лечению глиобластомы модифицированным вирусом простого герпеса (Martuza, 1991).
За последующие десятилетия благодаря выдающимся достижениям в молекулярной биологии и генетике и стремительному развитию биотехнологических методов исследования удалось проделать огромную экспериментальную работу по описанию специфических взаимодействий онколитических вирусов с раковымм клетками и выявить перспективные для терапии вирусные штаммы и типы опухолей, которые они могут поражать.
Почему же вирусы – и не какая-нибудь специфическая группа, а все в целом – поражают в первую очередь именно опухолевую ткань? Причин этому несколько.
Таким образом, первая причина высокой чувствительности раковых клеток к вирусам – их физическая доступность.
Вторая причина связана со способами размножения самих инфекционных агентов. Дело в том, что вирусы в этом смысле не самодостаточны и используют для размножения ресурсы зараженной клетки. Обычно это происходит тогда, когда клетка сама находится в процессе деления и в ней присутствуют все ферменты, необходимые для репликации генетического материала и синтеза белков.
Некоторые вирусы имеют специальные механизмы, которые позволяют перевести клетку из покоящегося состояния в делящееся (к ним относятся и так называемые онкогенные вирусы, например, вирус папилломы, который вызывает рак шейки матки именно за счет стимуляции клеточного деления). Однако очень многие вирусы могут размножаться только в уже активно делящихся клетках, например, клетках слизистой (которая, как известно, в первую очередь поражается при сезонных вирусных инфекциях). И в этом смысле раковые клетки, главное занятие которых – деление, особенно беззащитны перед вирусной интервенцией.
Здоровые – в безопасности
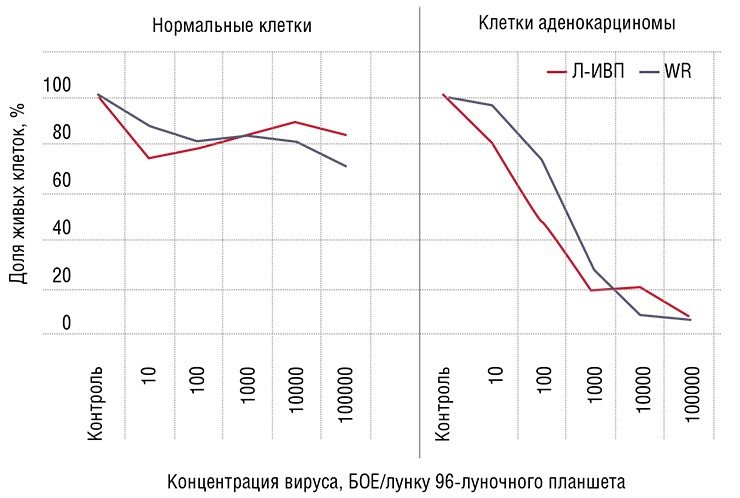
Таким образом, раковые клетки по милости самой природы служат готовой мишенью для вирусов. С использованием современных биотехнологий сегодня можно создавать вирусные препараты, которые будут специфически поражать и уничтожать только раковые клетки, не затрагивая здоровые.
Поэтому мишенью вируса должны стать хаотичные скопища активно делящихся клеток. При этом в первую очередь будут поражаться наименее дифференцированные, наиболее злокачественные клетки. Здоровые же дифференцированные клетки будут защищены от проникновения такого дефектного вируса механизмами противовирусной защиты.
Персональный подход
Для решения этой задачи, в частности, проводится селекция вирусов на их способность размножаться в различных культурах раковых клеток. На основе анализа генетической структуры таких вирусов можно определить, какие из приобретенных вирусом мутаций делают его наиболее действенным в отношении определенного типа опухолевых клеток.
Имея панель таких онколитических вирусов, можно будет, взяв биопсию опухоли от конкретного пациента, подобрать для него наиболее эффективный набор вирусных штаммов. Причем эту процедуру можно повторять по мере лечения, поскольку сама опухоль может меняться, ускользая от действия онковируса. В таком случае сможет помочь уже другой вариант вируса, а так как он будет отличаться по антигенной структуре от предыдущего, то не уничтожится под действием механизмов противовирусного иммунитета, сформировавшегося в ходе предыдущего лечения.
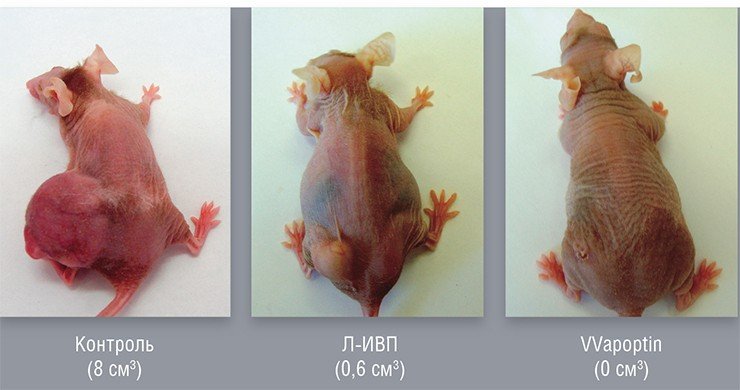
Онколитические вирусы можно дополнительно вооружить и генами, продуцирующими в раковой клетке белки, опасные лишь для этих клеток. Например, белок апоптин, выделенный из вируса птичьей анемии, по еще не совсем понятному механизму вызывает самоубийство исключительно только раковых клеток. На основе вируса осповакцины генно-инженерным способом уже создан такой штамм, способный эффективно уничтожать клетки опухоли человека, подсаженные лабораторным мышам.
Еще одна проблема терапии с помощью онколитических вирусов связана с разработкой наиболее эффективных способов их введения в организм. Ведь на пути вируса в организме встает много барьеров. К примеру, та же печень, являющаяся своего рода мощнейшим антивирусным фильтром.
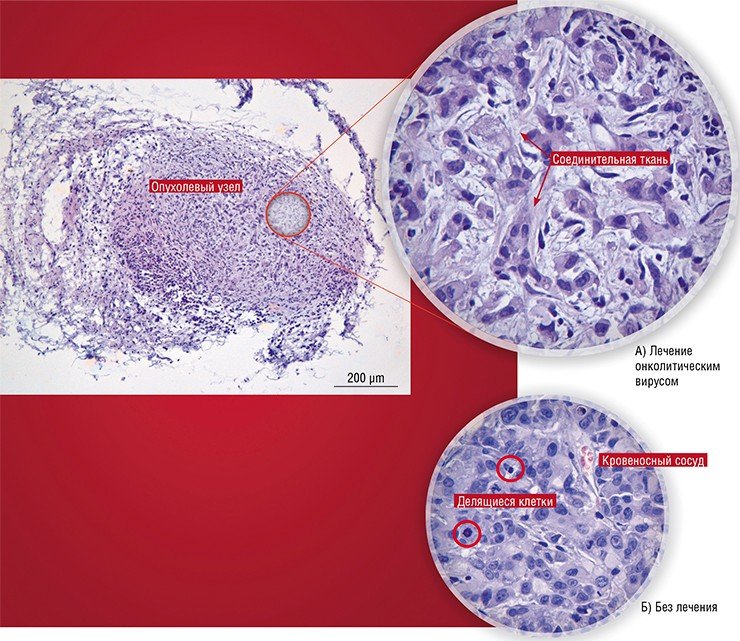
За и против
В настоящее время, несмотря на все успехи в изучении онколитических свойств вирусов, их применение в онкотерапии является, скорее, исключением, чем правилом.
Так, разработанный в США препарат сегодня применяется с согласия пациента при лечении глиобластомы в качестве дополнительной терапии. В Китае лицензирован и успешно применяется для терапии карцином один из штаммов аденовируса, несущий две генетические делеции (Yu, 2007).
В Латвии после распада СССР были продолжены работы по изучению онколитических вирусов, начатые в рамках противополиомиелитных исследований. В результате на основе одного из энтеровирусов был создан и сегодня используется на практике препарат Ригвир, направленный против меланом, который можно вводить непосредственно в кровяное русло.
Всего же сегодня в мире проходят клинические испытания свыше тридцати разнообразных онколитических вирусных препаратов. И основная проблема здесь не столько научная, сколько экономическая. Дело в том, что терапия рака (в первую очередь химиотерапия) – это большие деньги. В условиях сложившегося и процветающего рынка химиотерапевтических препаратов применение новых, пусть даже и более безопасных биотерапевтических средств потребует весьма дорогостоящей перестройки всей системы лечения. А это не может не затронуть интересы крупных фармацевтических компаний.
Стратегия таких компаний в отношении нарождающихся разработок в области онколитических вирусов неоднозначна. Так, права на один из первых онколитических препаратов ONYX-015 вместе с самой компанией-разработчиком были приобретены одной известной фармацевтической фирмой, после чего исследования по этой теме были закрыты. С другой стороны, по¬скольку полностью остановить прогресс в этой области невозможно, уже сегодня во многих фармацевтических компаниях создаются подразделения, занимающиеся изучением вирусных онколитиков. Оптимизма добавляет и тот факт, что за последние пятнадцать лет число работ по этой тематике растет как снежный ком.
Одновременно с прогрессом в создании вирусных противораковых средств в обществе, как и в случае пресловутых генетически модифицированных организмов (ГМО), возникают разнообразные фобии и слухи. Они во многом базируются на недостаточной осведомленности широкой общественности в сути дела и раздуваются благодаря действиям некоторых заинтересованных компаний.
Действительно, вопрос о безвредности тех или иных вирусов пока изучен не до конца. Поэтому приходится мириться с тем, что на пути к широкому внедрению этих очень перспективных методов лечения рака будут вставать многие преграды. В любом случае, исследователи должны действовать очень обдуманно, осторожно взвешивая все возможные последствия.
Но, как учит история науки, подобные проблемы всегда вставали на пути любого нового перспективного метода лечения и, как правило, успешно преодолевались.
Сейчас крепнет уверенность, что знания, накапливающиеся в области вирусологии, иммунологии, биологии клетки и других смежных дисциплин, позволят (и уже позволяют!) создавать такие варианты вирусов, которые будут не только эффективно и избирательно уничтожать раковые клетки, не затрагивая нормальные, но еще и стимулировать в организме естественные механизмы противоопухолевой защиты.
В будущем основой для терапии рака могут стать искусственные вирусы. Уже сейчас дальней целью разработок московских и новосибирских специалистов является создание модульной вирусной системы (в будущем – полностью синтетической) – своего рода молекулярного конструктора, из которого исследователь по желанию сможет собрать из отдельных генетических компонентов нужный вариант онколитического вируса.
Такие синтетические вирусы не должны структурно напоминать природные. Это важно потому, что схожие вирусы способны рекомбинировать друг с другом, обмениваясь участками своего генома, благодаря чему терапевтический вирус может приобрести неполезные гены и, соответственно, нежелательные, опасные свойства. Можно разработать такой синтетический вирус, который по функциям и общему плану строения будет похож на природный, но по нуклеотидной последовательности будет настолько от него отличаться, что утратит способность к рекомбинации со своими природными собратьями.
Ворошилова М. К. Полезные для организма непатогенные штаммы энтеровирусов: профилактическое и лечебное их применение. М.,1988. С. 24–29.
Качко А. В. и др. Рекомбинантная плазмидная ДНК pAd5 f, несущая фрагмент генома аденовируса 5 типа с делецией в гене Е 1 В 55 К, и штамм мутантного аденовируса Adel2, обладающий селективной противоопухолевой активностью. Патент РФ № 2194755 (467) 05.03.01.
Качко А. В. и др. Варианты аденовируса типа 5 с делениями в ранних генах: способность к селективной репликации в р53 дефектных опухолевых клетках человека // Молекулярная биология. 2003. № 37 (5). С. 868–875.
Martuza R. L.et al. Experimental therapy of human glioma by means of a genetically engineered virus mutant//Science. 1991. V. 252. P. 854–856.
Первый за Уралом
Победители первого конкурса научных мегагрантов Правительства РФ, направленных на поддержку исследований под руководством ведущих ученых в российских вузах, были названы в октябре 2010 г. Всего на конкурс подавалось 507 заявок, которые были рассмотрены международными экспертами и утверждены Советом по грантам. Победители, среди которых оказался и Новосибирский национальный исследовательский государственный университет, получили финансирование в размере 150 млн рублей
Новосибирский национальный исследовательский государственный университет (НГУ) получил в 2010 г. три мегагранта правительства РФ, один из которых под руководством д.б.н., профессора П. М. Чумакова, предназначался для создания университетской лаборатории по исследованию онколитических вирусов.

В 2010—2012 гг. за счет средств мегагранта и софинансирования в НГУ реконструированы помещения для проведения практических занятий по микробиологии и частично – по аналитической химии. На этой базе был создан исследовательский комплекс из лаборатории микробиологии и вирусологии (руководитель П. М. Чумаков) и лаборатории бионанотехнологий (руководитель – проректор по научной работе НГУ, д.б.н., профессор С. В. Нетесов).
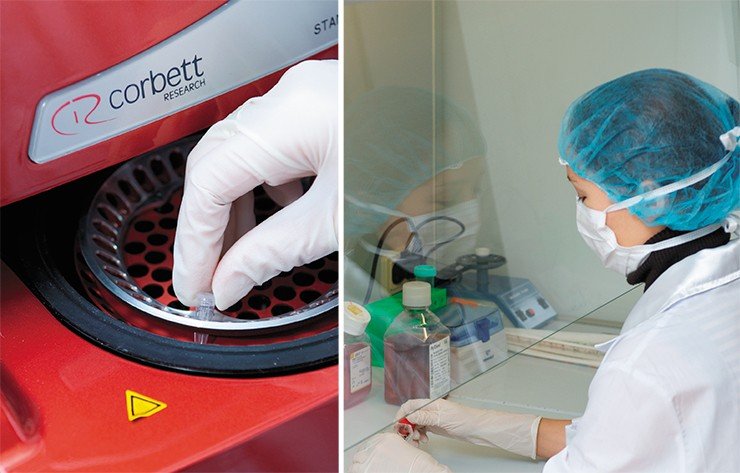
В вирусологическом боксе, оснащенном всем необходимым современным оборудованием для высокопроизводительной работы с непатогенными вирусами и их геномами, могут одновременно проводить исследования три сотрудника. Весной 2013 г. заканчивается реконструкция помещений для генно-инженерных работ, секвенирования геномов, а также биоинформационных и биотехнологических исследований.

В штат лабораторий вошли на долговременной основе несколько специалистов – докторов и кандидатов наук, а также аспиранты и студенты, ориентированные на научные исследования и разработки в самых современных областях микробиологии и молекулярной биологии. Во-первых, это изучение молекулярного разнообразия геномов вирусных возбудителей желудочно-кишечных и респираторных заболеваний человека и животных на территории азиатской части России. Во-вторых – создание онколитических рекомбинантных вирусов, а также бактерий, производящих рекомбинантные биологически активные белки человека, которые на сегодня признаются одними из самых перспективных противораковых препаратов.
Таким образом, принимая во внимание наличие в Научно-образовательном комплексе по наноматериалам и наносистемам НГУ нескольких суперсовременных электронных микроскопов, можно с утверждать, что в университете вступил в строй первый за Уралом современный лабораторный мини-комплекс по изучению микроорганизмов и разработке на их основе новых биомедицинских приложений.
Работы по этой тематике планируется проводить в сотрудничестве с передовыми биотехнологическими компаниями Новосибирской области и всего Сибирского федерального округа, а также, в случае взаимной заинтересованности, и с ведущими зарубежными предприятиями аналогичного профиля.
* Этот уровень биологической безопасности, по зарубежной классификации, используется для работы с возбудителями заболеваний человека, представляющими умеренную опасность для персонала и окружающей среды
Читайте также:


