Гроприносин для детей вирусной инфекции
Действующее вещество:
Содержание
Фармакологические группы
Нозологическая классификация (МКБ-10)
Состав
| Таблетки | 1 табл. |
| активное вещество: | |
| инозин пранобекс | 500 мг |
| вспомогательные вещества: крахмал картофельный — 85 мг; повидон К25 — 45 мг; магния стеарат — 10 мг |
Описание лекарственной формы
Таблетки: белые или почти белые продолговатые, двояковыпуклые, с риской на одной стороне.
Фармакологическое действие
Фармакодинамика
Иммуностимулирующее средство, обладающее противовирусным действием. Представляет собой комплекс, содержащий инозин и соль пара-ацетамидобензойной кислоты с N,N-диметиламино-2-пропанолом в молярном соотношении 1:3.
Эффективность комплекса определяется присутствием инозина, второй компонент повышает его доступность для лимфоцитов. Гроприносин ® блокирует размножение вирусных частиц путем повреждения генетического аппарата, стимулирует активность макрофагов, пролиферацию лимфоцитов и образование цитокинов. Второй компонент повышает доступность препарата Гроприносин ® для лимфоцитов. Уменьшает клинические проявления вирусных заболеваний, ускоряет реконвалесценцию, повышает резистентность организма.
При назначении препарата Гроприносин ® в качестве вспомогательного ЛС при инфекционном поражении слизистых оболочек и кожи, вызванных вирусом Herpes simplex, происходит более быстрое заживление пораженной поверхности, чем при лечении традиционным способом. Реже возникают новые пузырьки, отеки, эрозии и рецидивы болезни. При своевременном применении препарата сокращается частота возникновения вирусных инфекций, снижается длительность и тяжесть заболевания.
Фармакокинетика
После приема внутрь препарат быстро и практически полностью (>90%) всасывается и обладает хорошей биодоступностью. При приеме внутрь в дозе 1500 мг Cmax инозина пранобекса достигается через 1 ч и составляет 600 мкг/мл. Не определяется в крови спустя 2 ч после приема. Инозин пранобекс состоит из инозина и соли пара-ацетамидобензойной кислоты с N,N-диметиламино-2-пропанолом. Каждый из компонентов инозина пранобекса быстро подвергается метаболизму. Практически 100% метаболитов обнаруживаются в моче в интервале от 8 до 24 ч с момента приема. Инозин подвергается метаболизму по циклу, типичному для пуриновых нуклеотидов, с образованием мочевой кислоты, концентрация которой в сыворотке крови может повышаться. В результате возможно образование кристаллов мочевой кислоты в мочевых путях. Повышение концентрации мочевой кислоты носит нелинейный характер и может изменяться на ±10% в течение 1–3 ч после приема препарата внутрь. В результате метаболизма пара-ацетамидобензойной кислоты образуется орто-ацилглюкуронид; N,N-диметиламино-2-пропанол метаболизируется до N-оксида. AUC пара-ацетамидобензойной кислоты ≥88%, AUC N,N-диметиламино-2-пропанола — ≥77%. Кумуляция препарата в организме не обнаружена. Инозин и его метаболиты экскретируются с мочой. При достижении Css при приеме ежедневной дозы 4 г суточная экскреция с мочой пара-ацетамидобензойной кислоты и ее метаболита составляет примерно 85% принятой дозы; T1/2 — 50 мин, T1/2 N,N-диметиламино-2-пропанола — 3–5 ч. Полная элиминация инозин пранобекса и его метаболитов из организма наступает в течение 48 ч.
Показания препарата Гроприносин ®
иммунодефицитные состояния, вызванные вирусными инфекциями у пациентов с нормальной и ослабленной иммунной системой, в т.ч. заболевания, вызванные вирусом Herpes simplex (тип I и тип II, генитальный герпес и герпес прочей локализации);
подострый склерозирующий панэнцефалит.
Противопоказания
повышенная чувствительность к инозину пранобексу и другим компонентам препарата;
хроническая почечная недостаточность;
период кормления грудью;
детский возраст до 3 лет (масса тела до 15–20 кг).
С осторожностью: при одновременном назначении с ингибиторами ксантиноксидазы, диуретиками, зидовудином; при острой печеночной недостаточности.
Применение при беременности и кормлении грудью
Противопоказан беременным и женщинам, кормящим грудью, т.к. безопасность препарата не исследовалась.
Побочные действия
Побочные действия определяются следующим образом: часто — >1/100 и 1/1000 и ЖКТ : часто — снижение аппетита, тошнота, рвота, боль в эпигастрии; нечасто — диарея, запор.
Со стороны гепатобилиарной системы: часто — повышение активности печеночных ферментов, ЩФ .
Со стороны кожи и подкожно-жировой клетчатки: часто — зуд, сыпь.
Со стороны почек и мочевыводящих путей: нечасто — полиурия.
Аллергические реакции: нечасто — пятнисто-папулезная сыпь, крапивница, ангионевротический отек.
Общие расстройства: часто — боль в суставах, обострение подагры.
Лабораторные и инструментальные данные: часто — повышение концентрации азота мочевины крови.
Взаимодействие
Иммунодепрессанты ослабляют иммуностимулирующий эффект препарата Гроприносин ® .
Гроприносин ® следует применять с осторожностью пациентам, принимающим одновременно ингибиторы ксантиноксидазы (аллопуринол) или петлевые диуретики (фуросемид, торасемид, этакриновая кислота), т.к. это может приводить к повышению концентрации мочевой кислоты в сыворотке крови.
Совместное применение препарата Гроприносин ® с зидовудином приводит к увеличению концентрации зидовудина в плазме крови и удлиняет его T1/2 . Таким образом, при совместном применении препарата Гроприносин ® с зидовудином может потребоваться коррекция дозы зидовудина.
Способ применения и дозы
Внутрь, после еды, запивая небольшим количеством воды, через равные промежутки времени (8 или 6 ч) 3–4 раза в сутки.
Взрослые: от 6 до 8 табл. в сутки, в 3–4 приема.
Дети от 3 до 12 лет: 50 мг/кг/сут, в 3–4 приема.
Взрослые и дети при тяжелых инфекционных заболеваниях: дозу можно увеличить до 100 мг/кг/сут, в 4–6 приемов. Максимальная суточная доза у взрослых составляет 3–4 г в сутки, у детей — 50 мг/кг/сут.
При острых заболеваниях: лечение обычно продолжается от 5 до 14 дней. После исчезновения симптомов лечение следует продолжить в течение 1–2 дней или более, в зависимости от показаний.
При хронических рецидивирующих заболеваниях: лечение у взрослых и детей проводится курсами продолжительностью 5–10 дней с интервалами 8 дней. Длительность поддерживающего лечения может составлять до 30 дней, при этом доза может быть снижена до 500–1000 мг/сут.
Лечение инфекций, вызванных вирусом герпеса, у взрослых и детей: следует провести несколько курсов продолжительностью 5–10 дней до исчезновения симптомов. Для сокращения количества рецидивов рекомендуется проводить поддерживающее лечение по 1 табл. 2 раза в день в течение 30 дней.
Особые группы пациентов
Пожилые. Необходимости в коррекции дозы нет, препарат применяется так же, как у пациентов среднего возраста. У пожилых пациентов чаще происходит повышение концентрации мочевой кислоты в сыворотке крови и в моче, чем у пациентов среднего возраста.
Дети. Применяется у детей старше 3 лет.
Почечная и печеночная недостаточность. На фоне лечения препаратом Гроприносин ® следует каждые 2 нед проводить контроль содержания мочевой кислоты в сыворотке крови и моче. Контроль активности печеночных ферментов рекомендуется проводить каждые 4 нед при длительных курсах лечения препаратом.
Передозировка
Лечение: промывание желудка и симптоматическая терапия.
Особые указания
Перед началом лечения следует проконсультироваться с врачом.
Гроприносин ® , как и другие противовирусные средства, наиболее эффективен при острых вирусных инфекциях, если лечение начато на ранней стадии болезни (лучше с первых суток).
Поскольку инозин выводится из организма в форме мочевой кислоты, при длительном применении рекомендуется периодически контролировать концентрацию мочевой кислоты в сыворотке крови и моче. Пациенты со значительно повышенной концентрацией мочевой кислоты в организме могут одновременно принимать препараты, понижающие ее концентрацию.
Необходимо контролировать концентрацию мочевой кислоты в сыворотке крови при назначении препарата одновременно с препаратами, увеличивающими концентрацию мочевой кислоты или препаратами нарушающими функцию почек.
Гроприносин ® следует с осторожностью применять у пациентов с острой печеночной недостаточностью, поскольку препарат подвергается метаболизму в печени.
Влияние препарата на способность управлять автотранспортом и на работу с механизмами. Влияние препарата Гроприносин ® на психомоторные функции организма и способность управлять транспортными средствами и движущимися механизмами не исследовалось. При применении препарата следует учитывать возможность возникновения головокружения и сонливости.
Форма выпуска
Таблетки, 500 мг. В блистере из ПВХ/ПВДХ/ПЭ-алюминиевой фольги по 10 шт. 2, 3 или 5 блистеров в картонной пачке.
Производитель
Тел.: (495) 363-39-50; факс: (495) 363-39-49.
- КЛЮЧЕВЫЕ СЛОВА: инфекции, антибиотики, Гроприносин
Следствием бесконтрольного и необоснованного применения этиотропных химиотерапевтических методов в борьбе с бактериальными инфекциями стало появление микробов с множественной лекарственной устойчивостью. Высокая изменчивость вирусов, быстрая селекция и экспансия штаммов, резистентных к противовирусным средствам, значительно ускорили поиск иных направлений терапии/профилактики инфекционных болезней, в частности основанных на модуляции иммунитета. Направленная иммуномодуляция базируется на данных о механизмах и клинической эффективности иммуномодуляторов различной природы [1–3].
Механизмы, обеспечивающие формирование длительно действующего адаптивного иммунитета после перенесенного инфекционного заболевания или вакцинации, в целом понятны и не вызывают сомнений. Напротив, информация о том, что курсовое применение неспецифических иммунокорректоров способно индуцировать стойкое состояние повышенной сопротивляемости вторжению патогенов, не находила объяснения в рамках общепринятых представлений об иммунной памяти и функциях врожденного иммунитета. Такую информацию следует рассматривать в свете модернизации ключевых иммунологических парадигм, затрагивающих специфичность/неспецифичность, а также особенности/сходство/взаимосвязь адаптивных и врожденных иммунных реакций.
Неспособность формировать память традиционно считалась главным отличием врожденного и адаптивного иммунитета. Однако результаты ряда исследований, проведенных на растениях, беспозвоночных и млекопитающих, убедительно доказали существование иммунной памяти в рамках врожденного противоинфекционного ответа, механизмы которой принципиально отличаются от таковых адаптивного иммунитета [4–6]. В связи с этим предпринимается попытка распространить новые представления о механизмах иммунной памяти, обусловливающих более эффективный и быстрый ответ на повторную встречу с патогеном, на данные клинических исследований, полученных при использовании иммуномодуляторов у детей [7].
Представления о неспецифичности врожденного иммунитета развиваются. Описаны различные классы паттернраспознающих рецепторов (PRR) – Toll-подобных рецепторов (TLR), лектиновых рецепторов С-типа (CLR), NOD-подобных рецепторов (NLR) и RIG-I-хеликаз, присутствующих на поверхности, в эндосомах и цитоплазме лейкоцитов и других клеток. Эти рецепторы специфически распознают патоген-ассоциированные молекулярные паттерны (PAMP) – высококонсервативные молекулы, общие для большого числа возбудителей инфекций, принадлежащих к разным таксономическим группам, и тем самым запускают активацию клеток врожденной иммунной системы.
Таким образом, в основе широкого спектра противоинфекционного действия врожденного иммунитета лежит специфическое лиганд-рецепторное взаимодействие. Кроме того, помимо ключевой роли в ранней защите от инфекций врожденный иммунный ответ играет существенную роль в инициации и регуляции приобретенных иммунных реакций.
Пересматриваются и представления о том, что врожденный иммунный ответ не способствует приобретению памяти, помогающей организму более действенно противостоять болезнетворным микробам впоследствии. Это основано на данных о повышении эффективности иммунного ответа после повторного заражения беспозвоночных, например тараканов, жуков и креветок, у которых адаптивный иммунитет в классическом представлении вообще отсутствует. Беспозвоночные обладают способностью не только интенсивнее отвечать на вторичные инфекционные вызовы, но и передавать повышенную сопротивляемость потомству. Установлено, что механизмы формирования врожденной иммунной памяти могут быть использованы для вакцинации беспозвоночных [2, 3, 8].
Молекулярный механизм формирования тренированного иммунитета опосредован активацией бета-глюканами, входящими в состав клеточной стенки Candida albicans, дектин-1/Raf-1-зависимого биологического каскада, приводящего к активации триметилирования H3K4 и эпигенетическому перепрограммированию моноцитов/макрофагов [8]. Благодаря возможности альтернативного сплайсинга генов рецепторов врожденного иммунитета, формированию пула NK-клеток памяти и перепрограммированию моноцитов/макрофагов возможно эффективное применение иммуномодуляторов при рецидивирующих вирусных инфекциях.
Именно у детей с рецидивирующими вирусными респираторными инфекциями, или у часто болеющих детей (ЧБД), как принято их называть в нашей стране, широко применяются иммуномодуляторы. Оценка подобной терапии может проводиться как с позиций доказательной медицины, так и с позиций возможной коррекции выявляемых нарушений мукозального иммунитета, в ряде случаев приводящих к развитию осложнений (синуситов, отитов, бронхитов) [9, 10].
Кроме того, иммуномодуляция позволяет значительно расширить подходы к лечению пациентов с недостаточностью противоинфекционной защиты, у которых антимикробные препараты часто оказываются недостаточно эффективными. Наконец, иммунотропные средства, обладая потенциально широким спектром активности в отношении вирусов, бактерий, грибов и простейших, могут использоваться в качестве неспецифической экстренной терапии при появлении нового возбудителя или биологической атаке [11, 12].
Значительные фенотипические и генетические индивидуальные особенности восприимчивости к патогенам, динамичность иммунного ответа в процессе взаимодействия хозяина и возбудителя затрудняют разработку адекватных методов иммунотерапии. Реагируя на инвазию патогена, иммунная система постоянно претерпевает тонкие перестройки. Поэтому введение одного и того же иммуномодулятора в различные периоды может по-разному влиять на противоинфекционный ответ. Применительно к ЧБД назначение иммунотропных препаратов ограничивается недостаточной доказательной базой эффективности большинства иммуномодуляторов и отсутствием надежных лабораторных критериев для их назначения. Тем не менее дефекты в системе мукозального иммунитета, отмеченные у длительно и часто болеющих детей, могут служить стартовым механизмом формирования хронической воспалительной патологии, в том числе бронхиальной астмы. Именно поэтому профилактические мероприятия, направленные на усиление защитных свойств слизистых оболочек верхних дыхательных путей, должны решаться с помощью иммуномодуляторов с комплексными механизмами действия, реально препятствующих проникновению патогенных микроорганизмов в организм человека. Применение иммуномодуляторов позволяет снижать частоту и тяжесть респираторных заболеваний, предотвращать развитие возможных осложнений [9, 11].
Клинический опыт подтверждает, что при наличии аллергических заболеваний у ЧБД можно применять иммуномодуляторы. Так, до 80% обострений бронхиальной астмы связаны с риновирусной инфекцией. Поэтому важны препараты, обладающие одновременно иммуномодулирующими и противовирусными свойствами [13]. Эффективная терапия способствует восстановлению иммунитета. Но на фоне применения иммунотропных препаратов тот же результат гарантирован в более короткие сроки. Элиминации возбудителя удается достичь за счет меньшего объема химиопрепаратов. В перспективе создание идеальных иммуномодуляторов приведет к минимизации этиотропного лечения, что важно не только исходя из экономических соображений. Хорошо известны факты (последние годы накапливаются сведения ввиду постоянной тенденции к повышению доз и расширению возрастных рамок применяемых препаратов) ингибирующего действия антибиотиков на эффекторы иммунитета и стимулирующего влияния на продукцию провоспалительных цитокинов. Следует также отметить, что, пожалуй, нет ни одной группы антибиотиков, которая хотя бы потенциально не обладала способностью оказывать нефротоксическое или иное тяжелое побочное действие.
Другая сфера применения иммуномодуляции основана на новом понимании адекватного или неадекватного иммунного ответа. Так, адекватный ответ на вирусную инфекцию достигается при использовании препаратов, одновременно обладающих противовирусным и иммуномодулирующим действием. Это ограничивает избыточную активацию Т-клеток и/или способствует переходу на новый цитокиновый профиль, например с Th2 на Th1 у детей и лиц с аллергическими заболеваниями, что оптимально для осуществления противовирусного действия [14, 15].
К дополнительным требованиям при применении таких иммуномодуляторов относятся клинически доказанная высокая противовирусная эффективность, безопасность, отсутствие побочных и канцерогенных эффектов, а также изученные схемы метаболизма и путей выведения из организма, возможность сочетания с другими лекарственными средствами, применяемыми при респираторных инфекциях.
Инозин – природное пуриновое соединение. Инозин содержится в пище и входит в состав некоторых важных веществ: пуриновых коэнзимов, высокоэнергетических фосфатных соединений (аденозин-трифосфат, гуанозинтрифосфат) и циклических пуриновых нуклеотидов. Обладая противовоспалительным, анаболическим, метаболическим, антигипоксическим и антиаритмическим свойствами, инозин принимает участие в регуляции многих физиологических процессов в организме. Как показали результаты клинических исследований, он хорошо переносится (практически неиммуногенный), что скорее всего обусловлено близостью (родственностью) компонентов препарата, обнаруженных в организме [17]. Инозин ингибирует продукцию радикалов супероксида стимулированными нейтрофилами. Инозин пранобекс – синтетический аналог инозина, полученный путем соединения инозина с вспомогательной молекулой, которая, как уже отмечалось, повышает доступность инозина для лимфоцитов и усиливает его иммуностимулирующие свойства. Инозин пранобекс, стимулируя дифференцировку Т-лимфоцитов в цитотоксические Т-клетки и Т-хелперы, повышает продукцию интерлейкинов 1 и 2, интерферона гамма и функциональную активность клеток-киллеров. Инозин пранобекс также модулирует функцию нейтрофилов и моноцитов, усиливая хемотаксис макрофагов и фагоцитоз, нормализуя ключевые параметры врожденного иммунитета. В то же время, стимулируя дифференцировку B-лимфоцитов в плазматические клетки и повышая продукцию антител, препарат повышает концентрации иммуноглобулинов G, A и M, а также поверхностных маркеров комплемента и вируснейтрализующих антител [18].
В международной анатомо-терапевтическо-химической классификации лекарственных средств Всемирной организации здравоохранения инозин пранобекс зарегистрирован в группе иммуномодуляторов (L) и противомикробных антивирусных препаратов (J) для системного использования.
Комплексное действие инозина пранобекса объясняет его успешное применение при вирусных респираторных заболеваниях. Показано, что препарат характеризуется противовирусным действием в отношении вирусов гриппа A и В. Ингибирующее влияние на репродукцию вирусов гриппа выявлено как при предварительной обработке культуры клеток (профилактический режим), так и при внесении препарата непосредственно после инфицирования клеток (терапевтический режим). Экспериментально доказаны высокая эффективность Гроприносина в отношении вирусов гриппа типа A, в том числе пандемического А (H1N1) (снижал репродукцию вирусов на 3–4 lg ТЦПД (титр вируса, выраженный в тканевых цитопатических дозах) 50/0,2 при обработке монослоя инфицированных клеток по профилактической схеме), и умеренная активность в отношении вирусов гриппа типа В [19].
Доказана высокая безопасность Гроприносина. Он не обладает антигенностью, не вызывает передозировку и гиперстимуляцию иммунитета (обеспечивает физиологичный иммунный ответ). Препарат не токсичен, хорошо переносится даже при длительных курсах терапии, совместим с антибиотиками, интерферонами, противовирусными средствами. Гроприносин можно назначать без специальных иммунологических исследований, основываясь на клинической симптоматике, и применять у пациентов всех возрастных групп (у детей с трех лет).
Эффективность инозина пранобекса в лечении и профилактике острых респираторных вирусных инфекций (ОРВИ) у детей изучали в течение многих лет [20].
На фоне применения Гроприносина у детей, включая лиц с неблагополучным преморбидным фоном, сокращалась продолжительность практически всех симптомов заболевания, в том числе температурной реакции, интоксикации и катаральных явлений в носоглотке. Причем продолжительность эпизодов ОРВИ не превышала шести – восьми дней у 64–70% детей, принимавших препарат, что существенно превосходило аналогичный показатель у детей контрольной группы (4–25%) [19].
Препарат выпускается в таблетках по 500 мг. Его назначают перорально после еды через равные промежутки времени (шесть или восемь часов) три-четыре раза в сутки. При гриппе и других ОРВИ взрослым назначают в сутки по 50 мг/кг массы тела (обычно по две таблетки три раза в день) в течение пяти – семи дней. У детей от трех до 12 лет лечебная суточная доза составляет 50 мг/кг массы тела, в среднем одна таблетка на 10 кг массы тела три раза в день в течение пяти – семи дней.
Возможны другие схемы использования Гроприносина. При острой герпетической инфекции препарат назначают в суточной дозе 3 г по две таблетки три раза в день в течение пяти – десяти дней до исчезновения симптомов, в целях профилактики – в суточной дозе 1 г по одной таблетке два раза в день в течение 30 дней с последующим восьмидневным перерывом. Повторные курсы можно проводить до полугода.
В 2010 г. был представлен систематический обзор и метаанализ оценки клинической и иммунологической эффективности инозина пранобекса при респираторных инфекциях у иммунокомпрометированных пациентов. Проанализированы результаты десяти опубликованных исследований, в которых у 2500 участников (детей и взрослых) инозин пранобекс использовали с лечебно-профилактической целью. 275 больных применяли традиционные методы лечения ОРВИ. 74 пациента составили группу плацебо, а десять здоровых детей – группу контроля. Кроме того, 67 здоровых добровольцев были инфицированы вирусом гриппа/риновирусом на фоне применения инозина пранобекса (n = 34) или плацебо (n = 33). Снижение частоты новых эпизодов респираторных инфекций при профилактическом режиме приема, уменьшение тяжести и длительности проявлений респираторных инфекций при использовании препарата в лечебном режиме на фоне восстановления нарушенных ключевых параметров врожденного и адаптивного иммунитета свидетельствовали об эффективности инозина пранобекса. Более того, в три-четыре раза снизилась частота осложнений респираторных инфекций – острого бронхита, пневмонии и отита. В результате применения инозина пранобекса (Гроприносина) удалось сократить частоту использования антибиотиков у детей на 93,5%, других неантибактериальных препаратов – на 78,3% [20, 21].
Клинический, иммуномодулирующий и противовирусный эффекты инозина пранобекса наблюдали у 60 детей в возрасте от пяти до 14 лет с персистирующей атопической бронхиальной астмой. 30 больных при ОРВИ получали инозин пранобекс по 50 мг/кг массы тела на три или четыре приема в течение пяти – семи дней, 30 больных – только симптоматическую терапию [21]. Показано, что на фоне приема Гроприносина уменьшаются клинические проявления респираторной инфекции и предупреждается развитие вызываемых ими обострений бронхиальной астмы. Установлена активация Th1-зависимого иммунного ответа с повышением продукции интерферона гамма и интерлейкина 12 с последующей активацией эффекторных звеньев врожденного иммунитета. Частота выявления смешанных респираторных инфекций также снижается с 46,7 до 26,7%.
Клинический опыт и данные этих исследований подтверждают, что, чем раньше начато лечение, тем выше его эффективность. При гриппе, других вирусных инфекциях, остром или обострении хронического бронхита прием Гроприносина начинают при появлении первых признаков заболевания (недомогание, кашель, насморк). Раннее начало лечения гарантирует сокращение сроков и более легкое течение болезни. Даже при начале лечения на второй-третий день заболевания снижается вероятность развития осложнений.
При изучении иммунного статуса авторы отметили повышение числа Т-лимфоцитов (CD3+-, CD4+- и CD8+-клеток) в периферической крови на фоне применения препарата [22]. Аналогичные данные по динамике параметров клеточного иммунитета представили M. Golebiowska-Wawrzyniak и соавт. по результатам обследования детей с неблагоприятным преморбидным фоном и рецидивирующими респираторными инфекциями [16].
Клинические наблюдения указывают на целесообразность более раннего применения иммуномодуляторов одновременно с этиотропной химиотерапией. При этом зачастую результаты более углубленных иммунологических исследований подтверждают корригирующую роль комплексной терапии, что невозможно определить в условиях обычного иммунологического мониторинга. Иммуномодуляторы могут использоваться и в целях иммунопрофилактики и иммунореабилитации. На этих этапах их часто назначают в виде монотерапии. Причем данные иммунного статуса не должны быть единственным критерием для их применения. Так, у практически здоровых лиц могут выявляться различные изменения при иммунодиагностическом обследовании, что не должно рассматриваться как основание для применения иммуномодуляторов. Напротив, после перенесенной тяжелой респираторной инфекции, сопряженной с различными стрессовыми воздействиями, каждый человек нуждается в иммунореабилитации независимо от результатов иммунологического обследования, как правило проводимого в ограниченном объеме [23, 24].
Представленные исследования свидетельствуют о возможном применении препарата у ЧБД с отягощенным преморбидным фоном. Прослеживаются тенденции к сокращению длительности и облегчению тяжести ОРВИ на фоне применения Гроприносина, что является важнейшим подтверждением его эффективности. Помимо клинической эффективности в большом числе работ продемонстрирован хороший профиль безопасности препарата – очень низкий уровень побочных действий и отсутствие мутагенности.
Таким образом, инозин прабонекс – эффективный иммуномодулятор, применение которого оправдано даже при аллергических заболеваниях, когда целью иммунотерапии является не только ликвидация инфекционного очага, но и снижение выраженности воспалительной реакции и улучшение клинической картины основного заболевания. Включение Гроприносина в комплексную терапию респираторных инфекций позволяет обеспечить локализацию очагов инфекции, снизить риск развития осложнений, а также уменьшить потребность в антибактериальных и противовоспалительных препаратах.
Проблемы острых респираторных вирусных заболеваний в педиатрии
Острые респираторные вирусные инфекции (ОРВИ) — особая группа заболеваний, которая по удельному весу в структуре инфекционной патологии как детей, так и взрослых прочно занимает одно из ведущих мест. Значимость проблемы обусловлена также высоким риском развития серьезных осложнений. ОРВИ приводят к структурным изменениям слизистой оболочки дыхательных путей, срыву адаптационных механизмов защиты и формированию хронической патологии ЛОР-органов, бронхолегочной системы, а также к другим соматическим заболеваниям (кардит, гломерулонефрит и т.д.) [1].
Гроприносин модулирует клеточный иммунный ответ и усиливает гуморальный. По механизму действия на клеточное звено иммунитета Гроприносин сравнивают с препаратами вилочковой железы, что особенно отчетливо проявляется в условиях вторичного клеточного иммунодефицита. Препарат предотвращает поствирусное ослабление синтеза РНК и белка в клетках, подвергшихся инфицированию, что особо значимо для клеток иммунной системы (такое действие Гроприносина не распространяется на вирусную РНК, синтез которой одновременно замедляется). В результате деятельность иммунной системы нормализуется и активизируется, что способствует повышению устойчивости организма к инфекционным болезням и быстрой локализации очага в случае повторного инфицирования.
В связи с вышеизложенным целью настоящего исследования было определение не только клинической, но и профилактической эффективности Гроприносина в период подъема заболеваемости ОРВИ у детей.
В исследование были включены 66 детей в возрасте 4–10 лет. Основную группу составили 32 ребенка, которым помимо обычных санитарно-гигиенических мероприятий, направленных на предотвращение контакта с источником инфекции, назначали Гроприносин. 34 ребенка из группы сравнения профилактического лечения не получали (табл. 1).
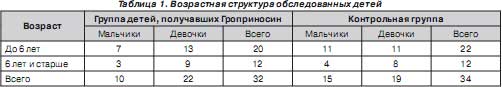
В целях профилактики препарат применяли у детей в дозе 50 мг/кг массы тела в сутки, за 3 приема, 3 раза в неделю в течение 4 недель. При контакте с больными гриппом и другими ОРВИ препарат назначали по 100 мг/кг ежедневно в течение 5 дней.
Для оценки профилактической эффективности Гроприносина в течение 3 месяцев после отмены препарата наблюдали за каждым ребенком, участвующим в исследовании, учитывая частоту эпизодов заболевания ОРВИ, включая повторные случаи, их тяжесть, наличие осложнений. Клиническую эффективность терапии препаратом оценивали по его влиянию на тяжесть течения и продолжительность заболевания. Больным проводили стандартное симптоматическое лечение. Заболеваемость у наблюдаемых групп детей оценивали весной 2005 года и в аналогичный период 2006 года.
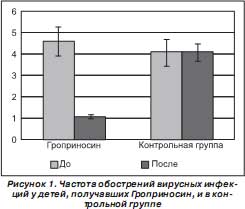
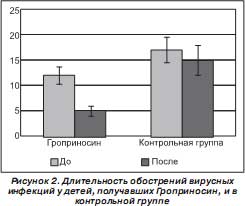
Установлено, что при проведении полного профилактического курса с применением Гроприносина количество детей, заболевших ОРВИ, оказалось в 2,3 раза, а общее число первичных и повторных эпизодов инфекции — в 3,5 раза меньше по сравнению с таковыми в контрольной группе. Число обострений на одного человека на фоне приема Гроприносина снизилось с 4,6 ± 0,3 до 1,0 ± 0,1 (р = 0,002), в контрольной группе количество обострений на одного человека не изменилось и составило 4,1 ± 0,2. Средняя продолжительность одного обострения в группе детей, получавших Гроприносин, за три месяца 2006 года составляла 5,0 ± 1,1 дня, а за аналогичный календарный период 2005 г . — 12,0 ± 2,1 (р = 0,01). В контрольной группе, не получавшей Гроприносин, средняя продолжительность одного обострения в 2006 и 2005 гг. составляла 15,0 ± 2,2 и 17,0 ± 2,7 дня.
Подтверждением лечебно-профилактической эффективности Гроприносина было сравнительно легкое течение заболевания и снижение риска развития осложнений. У пациентов основной группы количество случаев острого бронхита, пневмонии, отита оказалось в 4 раза, других осложнений — в 3,3 раза меньше, чем в контрольной группе (табл. 2).
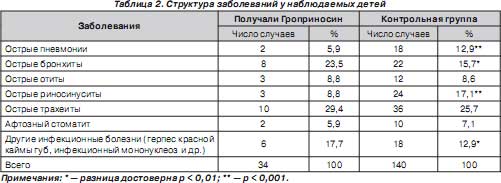
Препарат хорошо переносился всеми детьми, аллергических реакций не отмечалось.
Полученные результаты позволили сделать следующие выводы:
1. Гроприносин можно с успехом использовать для профилактики ОРВИ в период подъема заболеваемости, так как его применение достоверно снижает частоту заболеваний.
2. При использовании препарата Гроприносин в 2,4 раза сокращается продолжительность респираторных заболеваний, в 4,1 раза — частота осложненных форм, что свидетельствует о высокой терапевтической эффективности препарата.
Читайте также:


