Гамма герпетический вирус что это такое

Герпесвирусные инфекции широко распространены среди детей и взрослых. По данным ВОЗ до 90 % взрослого и детского населения планеты инфицировано герпесвирусами, причем у 50 % из них отмечают манифестное, рецидивирующее течение вызываемых ими заболеваний. Инфекционный мононуклеоз является наиболее характерным типичным клиническим проявлением герпесвирусных инфекций. В мире инфекционным мононуклеозом ежегодно заболевают от 16 до 800 лиц на 100 тыс. населения. В России ежегодно регистрируют 40–80 случаев инфекционного мононуклеоза на 100 тыс. населения [1, 2, 3, 5]. Большинство клиницистов связывают инфекционный мононуклеоз с вирусом Эпштейна – Барр, хотя в настоящее время доказана роль цитомегаловируса (5-й тип) и вируса герпеса человека 6-го типа, а также вирусов простого герпеса 1-го, 2-го типов в этиологии заболевания [5]. Установлена роль вируса Эпштейна – Барр в развитии злокачественных новообразований, аутоиммунных, неврологических заболеваний и синдрома хронической усталости [3, 8, 9, 10]. Показано, что после перенесённой инфекции новое поколение В-клеток содержит несколько генокопий вируса Эпштейна – Барр в латентной форме, в результате чего вирус может длительно персистировать в организме, вызывая иммунодефицитное состояние и повышая риск развития онкогематологических заболеваний [8, 9]. В крови у часто болеющих детей выявлена определённая концентрация цитомегаловируса и вируса Эпштейна – Барр. Вероятно, персистенция инфекции приводит к возникновению иммунной недостаточности, на фоне которой формируется частая заболеваемость [1, 4]. В последние годы доказана гепатотропность герпетических вирусов, которые могут вызывать различные поражения печени – от бессимптомного гепатита до гепатоцеллюлярной карциномы [2].
Инфекционным мононуклеозом преимущественно болеют дети: их доля в суммарной заболеваемости достигает 65–80 %. Исключение составляют дети первых 6–7 месяцев жизни, защищенные материнскими антителами [6].
Целью исследования является анализ особенностей клинического течения инфекционного мононуклеоза у детей в современных условиях.
Материал и методы исследования
Для проведения исследования была проведена экспертная оценка 32 историй болезни больных с инфекционным мононуклеозом. Под наблюдением находились дети, госпитализированные в инфекционный стационар г. Чебоксары. Лабораторная диагностика проводилась методом качественного иммунохроматографического экспресс-теста для определения специфических IgМ-антител к вирусному капсидному антигену (VCA) вируса Эпштейна–Барр в сыворотке крови, методом иммуноферментного анализа с определением в крови маркеров Эпштейн–Барр вирусной инфекции (IgM VCA), определялась ДНК-EBV методом полимеразной цепной реакции.
Для статистической обработки данных исследования использован параметрический метод с определением доверительных границ средних величин и относительных показателей генеральной совокупности. Заданная степень вероятности безошибочного прогноза Р=95 %, при этом t=2. Проводился корреляционный анализ с определением коэффициента корреляции Пирсона.
Из 32 наблюдаемых пациентов мальчики составляли 69 %, девочки – 31 % (22 и 10 детей соответственно).
Максимальная заболеваемость инфекционного мононуклеоза приходится на 4–8-летний возраст, дети первого года жизни болеют редко. В нашем исследовании большинство заболевших (44 %) составили дети дошкольного возраста, самой малочисленной группой (3 %) оказались дети грудного возраста, детей от 1 до 3 лет было 22 %, 7–12 лет – 22 %, старше 12 лет – 9 %.
Согласно данным некоторых исследований, этиология инфекционного мононуклеоза зависит от возраста [2]. Так, у детей первых 4 лет жизни чаще (37,2 %) определяется цитомегаловирусная этиология; у детей в возрасте от 4 до 7 лет чаще наблюдается Эпштейн – Барр вирусная инфекция (76,2 %) с манифестными формами заболевания с характерными клиническими симптомами и гематологическими изменениями (атипичные мононуклеары выявлены у 94,6 % пациентов); в старших возрастных группах достоверно чаще развивается микст-инфекция, тяжелая степень болезни, чаще встречается поражение печени. Риск хронизации инфекции возникает с 4-летнего возраста и более характерен для подростков и взрослых [2].
Наблюдаемые нами пациенты с инфекционным мононуклеозом были обследованы с целью выяснения этиологии заболевания. У всех больных подтверждена причастность к заболеванию вируса Эпштейна – Барр: у 19 % детей методом полимеразной цепной реакции в пробе крови, у 31 % – методом иммуноферментного анализа, у 50 % – с помощью экспресс-теста для определения специфических IgМ VCA.
У 56 % детей диагностировано заболевание средней степени тяжести, у 44 % – тяжёлой.
По данным литературы наиболее часто больными предъявляются жалобы на затруднение носового дыхания (52,3 %), боль в горле (68,5 %), недомогание (59 %), головную боль (44,5 %), боль в животе, тошноту, рвоту (15 %), озноб (10 %) [2].
У большинства обследуемых детей (47 %) наблюдались жалобы на заложенность носа, на боль в горле жаловались 19 %, недомогание – 35 %, головную боль – 10 %, боль в животе, рвоту – 7 %, кашель – 13 % детей.
Температура у больных мононуклеозом в течение первых 2–5 дней чаще бывает субфебрильной, а в период разгара поднимается выше 38 ºС в 83 % случаев и держится на протяжении первых двух недель болезни, иногда – месяц. Увеличение лимфоузлов и ангина наиболее выражены в первые две недели, наблюдаются в 98–99,3 % и 80,7–96 % соответственно, гепатоспленомегалия – на второй-третьей неделе (41–100 %) [2, 3, 5, 6]. Лимфоузлы увеличиваются симметрично, они болезненны, но подвижны, размеры их варьируются от мелкой горошины до грецкого ореха или куриного яйца. Чаще всего страдают заднешейные и затылочные лимфоузлы, но встречается и генерализованное увеличение. В клинической картине часто лидирует ангина, при этом в 85 % случаев на миндалинах появляются различные наложения. Небные миндалины отечны, налеты могут быть беловато-желтоватого или грязно-серого цвета, легко снимаются, ткань миндалины после снятия налёта обычно не кровоточит. Гиперемия ротоглотки обычно умеренно выражена, боль в горле незначительная. У 5 % больных появляется пятнисто-папулезная или папулезная сыпь, обычно на туловище и руках. Инфекционный мононуклеоз в большинстве случаев длится 2–4 нед. [3, 6, 7].
В нашем исследовании у всех детей наблюдалось повышение температуры, причём у большинства (75 %) её значение превышало 38 ºС. Увеличение лимфоузлов обнаруживалось у всех пациентов, преимущественно шейных групп. Изменения в ротоглотке характеризовались лёгкой гиперемией в 50 %, умеренной – в 22 %, яркой – в 28 % случаев. Увеличение миндалин зарегистрировано у 72 % детей, в 6 % случаев – III степени, при этом у 6 % больных наблюдался отёк нёбных дужек и миндалин. Наложения на миндалинах обнаружены у 81 % пациентов, по форме они были сплошными у 22 %, островчатыми – у 37 %, точечными – у 22 % детей, цвет их был в 19 % случаев жёлтым, в 66 % – белым. Гепатоспленомегалия выражена во всех возрастных группах, за исключением детей старшего школьного возраста, что подтверждено данными ультразвукового исследования. При проведении корреляционного анализа гепатоспленомегалии выявлена прямая высокая положительная корреляционная связь – коэффициент корреляции Пирсона 0,87 (рисунок). У 6 % детей наблюдалась экзантема. При проведении лабораторного исследования периферической крови выявлены атипичные мононуклеары у всех пациентов (таблица).
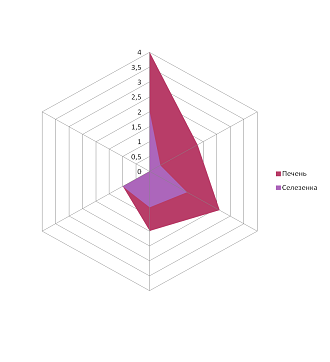
Гепатоспленомегалия при инфекционном мононуклеозе, прямая корреляционная связь
Клинические признаки и лабораторные показатели инфекционного мононуклеоза
16-23 ноября 2017 года проводилась Международная неделя герпеса.
Это мероприятие призвано привлечь внимание общественности к герпетической инфекции и расширить осведомленность населения о вирусе герпеса.
Тип герпесвируса
Основные ассоциированные заболевания
Вирус простого герпеса 1 типа, ВПГ-1 Herpes simplex type 1
Везикулезные или пустулезные высыпания на коже и слизистых (орофарингеальный лабиальный, генитальный герпес, герпес кожи), офтальмогерпес, энцефалит.
Вирус простого герпеса 2 типа, ВПГ-2 Herpes simplex type 2
Везикулезные или пустулезные высыпания на коже и слизистых (неонатальный, генитальный, диссеминированный герпес), менингит.
Вирус Варицелла-Зостер, ВЗВ Varicella zoster virus, Human herpes virus type 3
Ветряная оспа, опоясывающий герпес.
Вирус Эпштейна–Барр, ВЭБ Epstein–Barr virus, Human herpes virus type 4
Инфекционный мононуклеоз, назофарингеальная карцинома, лимфома Беркитта, В-клеточная лимфома.
Цитомегаловирус, ЦМВ Cytomegalovirus, Human herpes virus type 5
Пре- и перинатальная инфекция; поражения различных органов и систем (легкие, слюнные железы, центральная и периферическая нервная система, глаза, печень, сердце, урогенитальный тракт); генерализованные формы.
Вирус герпеса человека 6 типа, ВГЧ-6 Human herpes virus type 6
Внезапная экзантема (эритема новорожденных), лихорадка новорожденных с судорожным синдромом, мононуклеозоподобный синдром; у иммунокомпрометированных лиц – лихорадка, пневмония, гепатит, поражение ЦНС.
Вирус герпеса человека 7 типа, ВГЧ-7 Human herpes virus type 7
Внезапная экзантема (эритема новорожденных), синдром хронической усталости.
Вирус герпеса человека 8 типа, ВГЧ-8 Human herpes virus type 8
В большинстве случаев герпетические инфекции протекают асимптомно, а клинически выраженное заболевание носит доброкачественный характер.
В то же время, герпесвирусы могут быть причиной тяжелой клинической патологии, в ряде случаев приводящей к летальному исходу, особенно у лиц с выраженными нарушениями иммунитета.
Наибольшую угрозу для здоровья представляют герпетические нейроинфекции (летальность достигает 20%, частота инвалидизации — 50%), офтальмогерпес (развитие катаракты или глаукомы почти в 50% случаев); генитальный герпес (существенное нарушение качества жизни). Доказана роль ряда герпес-вирусов (ВЭБ, ВГЧ-8) в развитии злокачественных новообразований (лимфома Беркитта, В-клеточная лимфома, саркома Капоши и др.) или предполагается в развитии аденокарциномы кишечника, простаты и др. (ВПГ-2, ЦМВ).
Всем герпетическим инфекциям свойственно рецидивирующее течение. Частота рецидивов связана со снижением иммунных сил организма, что зависит от многих провоцирующих факторов (стресс, эндокринные нарушения, беременность, изменение географической зоны проживания, гиперинсоляция, употребление алкоголя, снижение иммунитета на фоне ВИЧ-инфекции, приема иммунодепрессантов и пр.).
Для диагностики герпесвирусной инфекции может быть использован весь арсенал методов лабораторной диагностики: визуальное выявление при использовании световой микроскопии, выделение вируса на чувствительных клеточных культурах, определение антигенов с использованием различных методов иммунохимии, выявление ДНК вирусов молекулярно-биологическими методами (ПЦР), определение специфических антител. Многие исследователи подчеркивают важную роль одновременного использования нескольких методов диагностики.
При интерпретации результатов следует учитывать, что факт инфицированности герпесвирусами не свидетельствует об активности инфекционного процесса, поскольку для данной группы характерно существование в латентной форме. Необходимо помнить, что антитела к большинству герпесвирусов выявляются более чем у 90% людей старше 25 лет, не имевших на момент обследования клиники каких-либо герпетических заболеваний, а обнаружение в крови ДНК герпес-вируса не всегда означает дальнейшее развитие клинически манифестной инфекции или является причиной имеющейся патологии.
Герпес-вирусные инфекции — группа широко распространенных антропонозных инфекционных болезней, вызываемых вирусами семейства Herpesviridae. Герпес-вирусы — семейство крупных ДНК-вирусов — подразделяют на три подсемейства в зависимости от типа клеток, в которых протекает инфекционный процесс, характера репродукции вируса, структуры генома, молекулярно-биологических и иммунологических особенностей: альфа (ВПГ-1, ВПГ-2, ВЗВ), бета (ЦМВ, ВГЧ-6, ВГЧ-7), гамма (ВЭБ, ВГЧ-8). В настоящее время известно 8 патогенных для человека герпес- вирусов (Табл.).
Герпес-вирусы и ассоциированные заболевания
| Тип герпес-вируса | Основные ассоциированные заболевания |
|---|---|
| Вирус простого герпеса 1 типа, ВПГ-1 Herpes simplex type 1 | Везикулезные или пустулезные высыпания на коже и слизистых (орофарингеальный лабиальный, генитальный герпес, герпес кожи), офтальмогерпес, энцефалит |
| Вирус простого герпеса 2 типа, ВПГ-2 Herpes simplex type 2 | Везикулезные или пустулезные высыпания на коже и слизистых (неонатальный, генитальный, диссеминированный герпес), менингит |
| Вирус Варицелла-Зостер, ВЗВ Varicella zoster virus, Human herpes virus type 3 | Ветряная оспа, опоясывающий герпес |
| Вирус Эпштейна–Барр, ВЭБ Epstein–Barr virus, Human herpes virus type 4 | Инфекционный мононуклеоз, назофарингеальная карцинома, лимфома Беркитта, В-клеточная лимфома |
| Цитомегаловирус, ЦМВ Cytomegalovirus, Human herpes virus type 5 | Пре- и перинатальная инфекция; поражения различных органов и систем (легкие, слюнные железы, центральная и периферическая нервная система, глаза, печень, сердце, урогенитальный тракт); генерализованные формы |
| Вирус герпеса человека 6 типа, ВГЧ-6 Human herpes virus type 6 | Внезапная экзантема (эритема новорожденных), лихорадка новорожденных с судорожным синдромом, мононуклеозоподобный синдром; у иммунокомпрометированных лиц – лихорадка, пневмония, гепатит, поражение ЦНС |
| Вирус герпеса человека 7 типа, ВГЧ-7 Human herpes virus type 7 | Внезапная экзантема (эритема новорожденных), синдром хронической усталости |
| Вирус герпеса человека 8 типа, ВГЧ-8 Human herpes virus type 8 | Саркома Капоши |
Герпес-вирусная инфекция характеризуются хроническим рецидивирующим течением и пожизненным персистированием возбудителя в организме, широким распространением среди населения. Инфицированность ВПГ-1 достигает в европейских странах 50–80%, ВПГ-2 — 10–25%. Вирусом Эпштейна–Барр инфицировано до 50% молодых людей (до 18 лет) в развитых странах. В США антитела к ВЭБ в крови обнаруживают у 95% лиц, достигших 35-летнего возраста. Частота выделения ВГЧ-7 у детей в возрасте старше 36 мес — 100%.
Источник герпес-вирусов — больные острыми формами болезней (стоматит, генитальный герпес, ветряная оспа) и здоровые инфицированные лица, которые периодически выделяют возбудитель в окружающую среду со слюной, назофарингеальным секретом, секретом слизистых оболочек половых органов. В большинстве случаев первичное или повторное заражение происходит контактно-бытовым или половым путями, возможны вертикальный, парентеральный пути передачи.
В большинстве случаев герпетические инфекции протекают асимптомно, а клинически выраженное заболевание носит доброкачественный характер. В то же время, герпесвирусы могут быть причиной тяжелой клинической патологии, в ряде случаев приводящей к летальному исходу, особенно у лиц с выраженными нарушениями иммунитета. Наибольшую угрозу для здоровья представляют герпетические нейроинфекции (летальность достигает 20%, частота инвалидизации — 50%), офтальмогерпес (развитие катаракты или глаукомы почти в 50% случаев); генитальный герпес (существенное нарушение качества жизни). Доказана роль ряда герпес-вирусов (ВЭБ, ВГЧ-8) в развитии злокачественных новообразований (лимфома Беркитта, В-клеточная лимфома, саркома Капоши и др.) или предполагается в развитии аденокарциномы кишечника, простаты и др. (ВПГ-2, ЦМВ).
Герпес-вирусы занимают важное место в группе возбудителей TоRCH-инфекций. К наиболее значимым герпес-вирусным инфекциям, представляющим серьезную угрозу для репродуктивного здоровья населения, относят герпетическую инфекцию (возбудитель ВПГ-1 и ВПГ-2) и цитомегаловирусную инфекцию (возбудитель ЦМВ), сведения о влиянии ВЭБ и ВЗВ на течение беременности или развитие внутриутробной патологии противоречивы.
Всем герпетическим инфекциям свойственно рецидивирующее течение. Частота рецидивов связана со снижением иммунных сил организма, что зависит от многих провоцирующих факторов (стресс, эндокринные нарушения, беременность, изменение географической зоны проживания, гиперинсоляция, употребление алкоголя, снижение иммунитета на фоне ВИЧ-инфекции, приема иммунодепрессантов и пр.).
Значительна зараженность герпес-вирусами больных ВИЧ-инфекцией. В США АТ к ВПГ-2 обнаруживают у 70% ВИЧ-инфицированных; АТ либо к ВПГ-1, либо к ВПГ-2 — у 95% больных. Герпетические поражения половых органов, в том числе бессимптомные, повышают риск передачи и заражения ВИЧ на 50%, согласно другим исследованиям – почти в 6 раз. Рецидив или реактивация ВПГ-2 может стимулировать репликацию ВИЧ, повышая количество ВИЧ в крови в 3–4 раза. ВИЧ-инфекция также оказывает неблагоприятное действие на течение герпетических заболеваний. Выделение ВПГ-2 у зараженных ВИЧ лиц по сравнению с неинфицированными в 4 раза выше и значительно возрастает по мере углубления иммуносупрессии. Опоясывающий герпес, особенно при рецидивирующем характере течения, выступает сигналом иммунологического неблагополучия. У ВИЧинфицированных лиц отмечено более частое выделение ВЭБ, возбудитель может присутствовать в орофарингиальных смывах у всех больных на стадии СПИДа. Вирус герпеса человека 8 типа ассоциирован с саркомой Капоши, которая является одним из оппортунистических заболеваний и чаще регистрируется у больных СПИДом.
Для диагностики герпес-вирусной инфекции может быть использован весь арсенал методов лабораторной диагностики: визуальное выявление при использовании световой микроскопии, выделение вируса на чувствительных клеточных культурах, определение АГ с использованием различных методов иммунохимии, выявление ДНК вирусов молекулярно-биологическими методами (преимущественно ПЦР), определение специфических АТ. Многие исследователи подчеркивают важную роль одновременного использования нескольких методов диагностики.
При интерпретации результатов следует учитывать, что факт инфицированности герпес-вирусами не свидетельствует об активности инфекционного процесса, поскольку для данной группы характерно существование в латентной форме. Необходимо помнить, что АТ к большинству герпес-вирусов выявляются более чем у 90% людей старше 25 лет, не имевших на момент обследования клиники каких-либо герпетических заболеваний, а обнаружение в крови ДНК герпес-вируса не всегда означает дальнейшее развитие клинически манифестной инфекции или является причиной имеющейся патологии.
Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
Copyright ФБУН Центральный НИИ Эпидемиологии Роспотребнадзора, 1998 - 2020

! Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
ИНТЕРФЕРОН-ГАММА В ЛЕЧЕНИИ ГЕНИТАЛЬНОГО ГЕРПЕСА
М.В. Мезенцева, М.Р. Рахматулина, А.А. Гиндис, Н.В. Кашина,
ГУ НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи РАМН, Москва
ФГУ ЦНИКВИ Росмедтехнологий, Москва
Рассматривается проблема лечения больных генитальным герпесом (ГГ), связанная с рецидивирующим характером течения данного заболевания. Приводятся современные представления о клиническом течении ГГ и иммунологической реактивности организма при данном заболевании. Описаны результаты собственных исследований применения интерферона-γ на примере отечественного препа¬рата Ингарон в терапии ГГ.
Введение
Под генитальным герпесом (ГГ) понимают хроническое рецидивирующее вирусное заболевание, передающееся преимущественно половым путем, которое вызывается вирусом простого герпеса (ВПГ) 2 и/или 1 типа. В большинстве наблюдений инфекционным агентом при ГГ является ВПГ-2, однако, как показывает мировая практика, до 30 % случаев ГГ вызывает ВПГ-1, что объясняется бытовым и орально-генитальным путями заражения. Входными воротами для ГГ служат кожные покровы, слизистые оболочки наружных гениталий и влагалища.
Эпидемиология
ГГ является наиболее распространенным язвенным заболеванием половых органов. Сероэпидемиологи-ческие исследования, проведенные в США, указывают на повсеместное распространение генитальной герпетической инфекции. Ежегодно ГГ заболевают 500 тыс. человек. У большинства из них инфекция остается нераспознанной вследствие отсутствия клинических проявлений (3). Частота инфицирования вновь приобретенным ВПГ-2 составляет 5,1 на 100 человек в год. В избранных группах частота герпетической инфекции выше. Так, антитела к ВПГ-2 обнаружены у 23 % пациентов венерологических клиник Лондона, в то время как у доноров крови этот показатель составлял 8 %. В тех же группах частота инфицирования ВПГ-1 достигала 60 и 45 % соответственно (4, 5).
Заболевание передается преимущественно при сексуальных контактах от больного ГГ или носителя ВПГ. Контакт может быть генитальным, орально-генитальным или орально-анальным. Инфицирование может происходить как при наличии клинической симптоматики герпетической инфекции у партнера - источника заболевания, так и в ее отсутствие, но в период выделения вируса, что имеет важное эпидемиологическое значение. Будучи однажды инфицированным, человек пожизненно сосуществует с ВПГ.
Характеристика герпесвирусов
Описано более 100 представителей семейства герпесвирусов. Герпесви-русы человека распространены повсеместно - это убиквитарная инфекция. Отличительным свойством представителей этого семейства является способность вызывать хроническую латентную инфекцию, т. е. способность к длительному (пожизненному) персистированию с последующей периодической реактивацией.
Размер вириона составляет 120-150 нм. Геном ВПГ представлен двуспиралъной линейной ДНК (де-зоксирибонуклеиновой кислотой). Структура генома герпесвирусов отличается от таковой других ДНК-содержащих вирусов: 2 нуклеотида, расположенные в специфической последовательности, с обеих сторон окружены теми же нуклеотидами, но расположенными в инвертированной последовательности. Эти 2 компонента могут меняться местами по отношению друг к другу, так что ДНК, изолированная из вируса, состоит из 4 изомеров, различающихся ориентацией 2 компонентов. Геномы ВПГ-1 и -2 гомологичны примерно на 50 %. Вирусный геном упакован в капсид правильной иксаэдральной формы, состоящий из 162 капсомеров. Снаружи вирус покрыт липид-содержащей оболочкой, представляющей собой участок модифицированной клеточной мембраны. На своей оболочке ВПГ имеет антирецепторы, благодаря чему он может присоединяться к клеткам экто- и эндодермального происхождения. Между капсидом и липидной оболочкой находится еще одна оболочка, состоящая из ряда вирусных белков (1, 2).
ВПГ имеет 11 поверхностных гликопротеидов, которые обозначают заглавными латинскими буквами (gB, gD и т. д.). Различия между ВПГ-1 и -2 обусловлены типоспецифическими различиями в гликопротеиде G. Этот феномен используется при проведении серологической лабораторной диагностики для дифференциации ВПГ-1 и -2.
Герпесвирусы могут существовать в двух формах; активной (реплицирующейся или размножающейся) и в форме латентно-ассоциированных транскриптов. Пребывая в латентном состоянии, возбудитель не образует полноценных вирионов. Размножение ВПГ в эпителиоцитах слизистой оболочки ротовой полости, генитального тракта или коже приводит к распространению вируса к чувствительным нервным окончаниям. Далее периневрально ВПГ проникает в нейроны чувствительных ганглиев. При этом гематогенный и лимфогенный пути распространения носят подчиненный характер. После непродолжительного периода репликации в нейронах под влиянием клеточных реакций иммунитета, обусловленных элементами астроглии, устанавливается латентная инфекция. Некоторые авторы считают, что герпесвирусы обладают некоторым базалъным уровнем репликации даже в латентном состоянии: по мнению других авторов, вирусы полностью неактивны.
Современные представления о клиническом течении генитального герпеса
Согласно существующей международной классификации, различают первичный и рецидивирующий ГГ. Рецидивирующий ГГ в свою очередь подразделяют на типичную и атипичную клинические формы и бессимптомное выделение вируса.
Рецидивирующая инфекция, как правило, диагностируется у пациентов, имеющих одновременно симптомы ГГ и антитела к реактивированному типу вируса. У половины из них рецидив ГГ возникает в первые шесть месяцев от перенесенного первичного эпизода. Тяжесть и продолжительность клинических проявлений при рецидивах менее выражены, чем при первичной форме ГГ. Обычно длительность рецидива составляет 7—10 дней. Рецидивы при инфицировании ВПГ-2 возникают раньше и чаще, чем при ВПГ-1.
Факторами, способствующими рецидивированию ГГ, являются снижение иммунологической реактивности, переохлаждение организма, тяжелые интеркуррентные заболевания, резкая перемена климата, медицинские манипуляции (аборты и введение внутриматочных контрацептивов, гистероскопия) и др.
У большинства больных рецидив ГГ возникает после характерного продромального периода длительностью 12—36 часов, при котором больные отмечают зуд, жжение или боль в месте, где в дальнейшем появятся герпетические пузырьки. Иногда могут возникать невралгические боли с иррадиацией в поясничную область и нижние конечности. В последующем появляются высыпания в виде отдельных или сгруппированных вези-кулезных элементов размером 2—3 мм на эритематозном фоне, имеющих тенденцию к возвратным проявлениям на том же месте. В дальнейшем везикулы вскрываются с образованием эрозий с полициклическими очертаниями.
Наиболее характерное проявление рецидивирующего ГГ у мужчин — рецидивирующий баланопостит, диагностируемый примерно у половины больных. У женщин наиболее часто встречаются герпетический вульво-вагинит и цервицит, особенностью течения которых является нередкое присоединение отека пораженной области. Иногда клинические проявления отечности половых губ превалируют над появившимися эрозивными высыпаниями. Общие симптомы при рецидиве ГГ встречаются редко и ограничиваются невыраженной головной болью и слабостью. Паховые лимфаденопатии наблюдаются только при обширных герпетических высыпаниях.
Многообразие клинических проявлений простого герпеса, повсеместное распространение вируса, пожизненная персистенция ВПГ в организме инфицированных больных нередко затрудняют диагностику и лечение этого заболевания. В связи с этим ГГ относится к числу тех заболеваний, при которых полного излечения достичь невозможно.
Принципы противовирусного лечения
Основные задачи лечения ГГ:
- уменьшение тяжести и продолжительности клинических проявлений инфекции;
- предупреждение развития осложнений и максимально возможное удлинение периода ремиссии.
Главным направлением в лечении ГГ является применение высокоспецифичных противовирусных средств -ациклических нукдеозидов, блокирующих репликацию ВПГ. Рандомизированные контролируемые исследования показали, что ацикловир, валаци-кловир и фармцикловир оказывают достоверное супрессивное воздействие на ВПГ (6-8).
Согласно принятой в мире практике, если число рецидивов за год не превышает шести, проводят эпизодическую терапию в момент конкретного обострения аналогами ну-клеозидов; если число рецидивов превышает шесть за год, супрессивная терапия продолжается не менее полугода.
Нарушения иммунологической реактивности при генитальном герпесе
Поскольку любое обострение ГГ связано с неблагоприятными изменениями иммунного статуса, при лечении герпетической инфекции показано использование иммунотерапии, включающей интерфероны (ИФН) или стимуляторы их эндогенного образования.
Так, в исследовании Feduchi и со-авт. (1989) показано, что ИФН-α не ингибировал репликацию ВПГ-1 ни в HeLa, ни в НЕр-2 клетках. Однако ИФН-γ ингибировал трансляцию ВПГ-1 в НЕр-2 клетках, инфицированных с низкой множественностью. При этих условиях транскрипция вирусных генов альфа-22, тимидинки-назы и гамма-0 была значительно уменьшена. Добавление человеческих ИФН-γ и фактора некроза опухоли α (ФНО-α) к НЕр-2 клеткам проявляет синергичное ингибирование трансляции генов ВПГ-1. Исследования ВПГ-1 генной транскрипции показали, что действия и ФНО и ИФН-γ блокировали шаг до ранней генной экспрессии. Этот ранний шаг в репликации, замедляемой ФНО и ИФН-γ, отмечался после прикрепления и проникновения вируса в клетки, т. к. интернализация радиоактивных ВПГ-1 частиц вириона не была блокирована наличием этих двух цитокинов.
В дальнейшем анализ эффектов ИФН-γ на ранних этапах репликации ВПГ-1 в первичных культурах селезеночных макрофагов в сравнении с ИФН-α/β показал, что обработка макрофагов рекомбинантным ИФН-γ вела к дозозависимому сокрашению выработки вирусного потомства. Ингибирование белкового синтеза соблюдено для α-, β- и γ-белков ВПГ-1.
Экспрессия раннего гена IE3 (ICP-4) различалась в ИФН-γ или ИФН-γ обработанных клетках. По данным Klotzbucher и соавт. (1990), ИФН-γ и ИФН-α/β ингиби-руют ВПГ-1 репликацию с помощью различных механизмов, которые могут вести к синергичному повышению ингибирования при комбинированном лечении.
Исследуя роль ИФН-γ при влагалищной инфекции ВПГ-2, Parr и Parr (1999) продемонстрировали, что через 8 часов после внутри влагалищного инфицирования мышей концентрации ИФН-γ во влагалищных секретах достигли уровней, которые могли быть противовирусными in vitro. Этот быстрый синтез ИФН-γ произошел в иммунокомпетентных мышах, но отсутствовал в неиммунокомпе-тентных, что указывает на необходимость присутствия Т-лимфоцитов памяти. Наличие ИФН-γ во влагалищных секретах коррелировало со сверхрегуляцией антигенов II класса главного комплекса гистосовмести¬мости (ГКГС) в эпителии и с энергичным (30-кратным) привлечением Т- и В-лимфоцитов во влагалище. Введение анти-ИФН-γ антител in vivo иммунокомпетентным мышам за 17 часов до вирусного инфицирования блокировало все последующие проявления ИФН-γ (сверхрегуляцию антигенов 11 класса ГКГС, прилипание Т-лимфоцитов к эндотелию, их привлечение во влагалище) и заметно уменьшило иммунитет против повторной инфекции влагалищного эпителия.
Во многих исследованиях показано, что ИФН-γ способен вызвать значительную продукцию окиси азота в макрофагах, что играет ключевую роль в антивирусной иммунологической защите. При этом ВПГ проявляет синергичный эффект с ИФН-γ в индукции синтеза NO. Кроме того. большинство типов вирусоинфицированных клеток умеет синтезировать ИФН-α/β в процессе вирусной инфекции. Однако синтез ИФН-γ индуцируется митогенными или антигенными стимулами и только в некоторых клетках иммунной системы.
То есть в ВПГ-инфицированном организме уже есть некоторый уровень ИФН-α/β и для достижения выраженного синсргичного противовирусного ответа необходимо добавить ИФН-γ.
Материал и методы
С целью изучения эффективности и безопасности применения нового отечественного ИФН-γ (человеческого рекомбинантного сухого, Ин-гарон, ООО НПП "Фармаклон") в терапии ГГ в ФГУ ЦНИКВИ было проведено исследование. Препарат, полученный путем микробиологического синтеза в рекомбинантном штамме Е. coli и очищенный путем колоночной хроматографии, представляет собой белок, состоящий из 144 аминокислотных остатков, с молекулярной массой 16,9 кДа. Сравнение эффективности и безопасности применения полученного препарата при его подкожном введении проводилось с препаратом ацикловир при его приеме внутрь пациентами с ГГ.
В исследование были включены 15 пациентов обоего пола в возрасте от 20 до 48 лет с диагнозом "гениталъная герпетическая инфекция", условно разделенных на две группы. Группа А была представлена 7 паци¬ентами, которым проводилась терапия ИФН-γ (подкожно по 500 тыс. ME 1 раз в сутки через день). Курс лечения состоял из пяти инъекций. В группу В вошли 8 пациентов, которым проводилась терапия препаратом ацикловир (по 200 мг 5 раз в сутки, перорально в течение 10 дней).
Критерии включения в исследование:
- возраст от 18 до 50 лет;
- впервые диагностированный ГГ, не менее чем за год до включения в ис следование;
- не менее 4 рецидивов ГГ в течение последнего года;
- наличие текущего обострения ГГ;
- подтверждение диагноза ГГ с помощью методов полимеразной цепной реакции (ПЦР) и/или прямой иммунофлуоресценции (ПИФ).
Из исследования были исключены пациенты с положительными результатами обследования на наличие инфекций, передающихся половым путем, гепатитов В и С, ВИЧ-инфекции, пациенты с выраженной патологией со стороны сердечно-сосудистой системы, желудочно-кишечного и респираторного трактов, а также больные, получавшие любую иммунотропную терапию в течение последних шести недель до включения в исследование.
Мероприятия, проведенные перед включением пациентов в исследование:
- изучение анамнеза (демографические данные, сведения о сопутствующих заболеваниях и о сопутствующей терапии);
- оценка обших показателей (частоты сердечных сокращений, артериального давления, пульса, температуры тела);
- физикальное обследование (наружный осмотр аногенитальной области, обследование с помощью гинекологического зеркала Куско);
- тест на беременность;
- получение клинического материала из уретры, боковых сводов влагалища, цервикального канала и прямой кишки для лабораторного исследования.
Лабораторное исследование включало: микроскопическое исследование полученного материала. ПЦР-исследование на ВПГ, серологическое исследование на сифилис и ВИЧ-инфекцию гепатиты (HbsAg, anti-HCV); клинический анализ крови и мочи.
На момент обращения за медицинской помощью длительность заболевания у пациентов составляла не менее года. В течение последнего года у всех пациентов было не менее четырех рецидивов ГГ. В момент включения пациентов в исследование все они имели герпетические высыпания, большинство пациентов предъявляли жалобы на зуд, жжение и болезненность в области высыпаний (табл. 1). Диагноз ГГ подтвержден физикально и лабораторно (ПЦР, ПИФ).
При оценке эффективности лечения зарегистрированы: длительность ремиссии после активной терапии, рецидивы ГГ за шесть месяцев, время исчезновения клинических проявлений герпеса (высыпаний) и субъективных ощущений (боль, жжение, зуд).
Оценивая безопасность, выявили побочные эффекты, связанные с исследуемым препаратом и способом его введения; осуществили контроль динамики результатов гематологического и биохимического исследований крови, данных физикалъного исследования и определения показателей жизненных функций.
К одиннадцатому дню лечения в группе А субъективные проявления заболевания в виде болезненности и зуда в области высыпаний сохранены у 1 (14,3 %> пациента. В группе В в 3 (37,5 %> наблюдениях отмечены герпетические высыпания, сопровождавшиеся зудом и болезненностью в области поражения. Через три дня после выполнения последней инъекции ИФН-γ в группе А и через день после завершения курсового приема ацикловира в группе В проведена оценка клинических проявлений заболевания и параметров безопасности ИФН-γ. Дополнительно оценка эффективности и безопасности проведенной терапии осуществлена через 40 и 105 дней после завершения активной терапии.
Через 40 дней после окончания терапии клинические проявления ГГ зарегистрированы только у 1 (14,3 %) пациента в группе А, в группе В субъективные и объективные признаки герпесвирусной инфекции были выявлены в 2 (25,0 %) наблюдениях. На заключительном визите через 105 дней после окончания терапии ни у одного из пациентов, получавших терапию ИФН-γ, не зарегистрировано клинических проявлений герпетической инфекции, в группе В, получавшей терапию препаратом ацикловир, клинические симптомы заболевания наблюдались у 1 (12,5%) пациента (табл. 2).
На основании полученных лабораторных данных изменений показателей во время и после окончания лечения не наблюдалось. Все пациенты отметили хорошую переносимость ИФН-γ.
Результаты биохимического и клинического исследований крови значимых изменений лабораторных показателей не выявили. У 1 (14,3 %) пациента из группы А отмечено незначительное повышение температуры тела до 37,1 °С. Клинически значимых изменений при физикальном обследовании выявлено не было.
Выводы
Таким образом, после терапии ИФН-γ отмечено отсутствие субъективных жалоб и объективных клинических проявлений у 100 % пациентов. Согласно проведенным исследованиям и полученным данным, ИФН-γ обладает высоким клиническим эффектом и может быть использован при лечении ГГ.
ЛИТЕРАТУРА
- Guthrie R. American Herpes Foundation Monitor 1999; 1:1
- Patrick D. Managing genital herpes: a primary care toolkit. PAREXEL MMS Europe Ltd, 2004.
- Division of STD Prevention CFDCAP. Sexually transmitted disease surveillance, 1996. Atlanta: CDC 1997.
- Cowan FM, Johnson AM, Ashley R, et al. Relationship between antibodies to herpes simplex virus (HSV) and symptoms of HSV infection. J In¬fect Dis 1996;174:470.
- Nahmias Al, Lee FK, Bechman-Nahmias S.. Seroepidemiological and sociological patterns of herpes simplex virus infection in the world. Scand J Infect Dis 1990;69:19.
- Wald A, Benedetti J, Davis G, et al A randomized, double-blind, comparative trial comparing high-and standard-dose oral acyclovir for first-episode genital herpes infections. Antimicrob Agems Chemother 1994;38:174.
- Perry CM, Wagstaff AJ. Famciclovir. A review of its pharmacological properties and therapeutic effi¬cacy in herpesvirus infections. Drugs 1995;50:396.
- Perry CM, Faulds D. Valacidovir. A review of its antiviral activity, pharmacokinetic properties, and therapeutic efficacy in herpesvirus infec¬tions. Drugs 1995:52:754
Читайте также:


