Активация фурина при вирусной инфекции
У РНК-содержащих ретровирусов сначала происходит обратная транскрипция генома в ДНК, затем ее интеграция в клеточные хромосомы и лишь после этого транскрипция генов.
Цитопатические эффекты при вирусных инфекциях разнообразны, они определяются как вирусом, так и клеткой и сводятся к разрушению клетки (цитолитический эффект), сосуществованию вируса и клетки без гибели последней (латентная и персистирующая инфекция) и трансформации клетки.
Вовлеченность организма в инфекционный процесс зависит от ряда обстоятельств - количества погибших клеток, токсичности вирусов и продуктов распада клеток, от реакций организма, начиная от рефлекторных и заканчивая иммунными. Количество погибших клеток влияет на тяжесть инфекционного процесса. Например, будут ли поражены при гриппе только клетки носа и трахеи или вирус поразит клетки эпителия альвеол, зависит тяжесть и исход болезни.
Хотя вирусы и не образуют типичных токсинов, однако и вирионы, и вирусные компоненты, накапливающиеся в пораженных тканях, выходя в кровоток, оказывают токсическое действие. Неменьшее токсическое действие оказывают и продукты распада клеток. В этом случае действие вирусной инфекции столь же неспецифично, как и действие патогенных организмов, убивающих клетки и вызывающих их аутолиз. Поступление токсинов в кровь вызывает ответную реакцию - лихорадку, воспаление, иммунный ответ. Лихорадка является преимущественно рефлекторным ответом на поступление в кровь и воздействие на ЦНС токсичных веществ.
Если лихорадка - общий ответ организма на вирусную инфекцию, то воспаление - это местная многокомпонентная реакция. При воспалении происходят инфильтрация пораженных тканей макрофагами, утилизация продуктов распада, репарация и регенерация. Одновременно развиваются реакции клеточного и гуморального иммунитета. На ранних стадиях инфекции действуют неспецифические киллеры и антитела класса IgM. Затем вступают в действие основные факторы гуморального и клеточного иммунитета. Однако гораздо раньше, уже в первые часы после заражения, начинает действовать система интерферона, представляющая семейство секреторных белков, вырабатываемых клетками организма в ответ на вирусы и другие стимулы. Описанные явления относятся к так называемой острой репродуктивной вирусной инфекции. Взаимодействие вируса и клеток может происходить, как отмечалось выше, без гибели последних. В этом случае говорят о латентной, т.е. бессимптомной или персистирующей хронической вирусной инфекции. Дальнейшая экспрессия вируса, образование вирусспецифических белков и вирионов вызывает синтез антител, на этой стадии латентная инфекция переходит в персистирующую и появляются первые признаки болезни.
Репродукция вируса в клетках сопровождается развитием цитопатических процессов, специфичных для разных вирусов и для разных типов инфекционных процессов. Цитопатические процессы при вирусных инфекциях разнообразны, они определяются как вирусом, так и клетками, причем специфика их больше "задается" клеткой, нежели вирусом, и сводится в основном к разрушению клеток, сосуществованию вируса и клеток без гибели последних и трансформация клеток. Несмотря на значительные различия цитоцидного действия разных вирусов, в общем, они сходны. Подавление синтеза клеточных макромолекул - нуклеиновых кислот и белков, а также истощение энергетических ресурсов клетки ведут к необратимым процессам, заканчивающимся гибелью пораженной клетки. Повреждение клеток вирусами, их отмирание и распад переносят вирусную инфекцию с клеточного уровня на уровень организма в целом.
При встрече организма с вирусной инфекцией продукция интерферона (растворимого фактора, вырабатываемого вирус-инфицированными клетками, способного индуцировать антивирусный статус в неинфицированных клетках) становится наиболее быстрой реакцией на заражение, формируя защитный барьер на пути вирусов намного раньше специфических защитных реакций иммунитета, стимулируя клеточную резистентность, - делая клетки непригодными для размножения вирусов.
Продукция и секреция цитокинов относятся к самым ранним событиям, сопутствующим взаимодействию микроорганизмов с макрофагами. Этот ранний неспецифический ответ на инфекцию важен по нескольким причинам: он развивается очень быстро, поскольку не связан с необходимостью накопления клона клеток, отвечающих на конкретный антиген; ранний цитокиновый ответ влияет на последующий специфический иммунный ответ.
Интерферон активирует макрофаги, которые затем синтезируют интерферон-гамма, ИЛ-1, 2, 4, 6, ФНО, в результате макрофаги приобретают способность лизировать вирус-инфицированные клетки.
Интерферон-гамма является специализированным индуктором активации макрофагов, который способен индуцировать экспрессию более 100 разных генов в геноме макрофага.
Продуцентами этой молекулы являются активированные Т-лимфоциты (Тh1-тип) и естественные киллеры (NK-клетки). Интерферон-гамма индуцирует и стимулирует продукцию провоспалительных цитокинов (ФНО, ИЛ-1, 6), экспрессию на мембранах макрофагов, антигенов МНС II; гамма-интерферон резко усиливает антимикробную и противовоспалительную активность путем повышения продукции клетками супероксидных радикалов, а усиление иммунного фагоцитоза и антителоопосредованной цитотоксичности макрофагов под влиянием гамма-интерферона связано с усилением экспрессии Fc-рецепторов для JgG. Активирующее действие интерферона-гамма на макрофаги опосредовано индукцией секреции этими клетками ФНО -альфа. Этот пик наблюдается совместно с ФНО-альфа. Максимум продукции ИЛ-4 наступает через 24-48 ч с момента активации клеток. При этом ИЛ-4 рассматривается как цитокин, ограничивающий иммуновоспалительные реакции и снижающий ответ организма на инфекцию, угнетая при этом экспрессию гамма-интерферона. Интерферон-гамма ин витро усиливает фагоцитарную активность нейтрофилов, что обусловлено усилением экспрессии Fc-рецепторов и поверхностных белков семейства интегринов на нейтрофилы. Это позволяет нейтрофилам осуществлять цитотоксические функции и фагоцитоз. В качестве основных эффекторных клеток воспалительного процесса, они обеспечивают элиминацию инфекта из организма.
Взаимодействие цитокина с клеткой определяется универсальной биологической системой, специфическим механизмом которой является рецепторный аппарат, связанный с восприятием метаболического кода. Для проявления биологической активности цитокина необходимо присутствие на поверхности чувствительных клеток специфических рецепторов, которые могут экспрессироваться параллельно с синтезом цитокина. Рецепторы цитокинов представляют собой комплексы, состоящие из двух и более рецепторных молекул, которые объединяются на мембране клетки-мишени и образуют высокоаффинный рецепторный комплекс. Большинство рецепторов состоит из отдельных молекул, связывающих цитокины, которые ассоциируются после связывания лиганда с сигналпередающим рецепторным компонентом; часть рецепторов существует как растворимые изоформы, способные связывать и растворять цитокины, а часть функционирует как многокомпонентные блоки; механизм комплексирования субъединиц рецепторов объясняет плейотропные и дублирующие эффекты цитокинов, имеющих большое структурное сходство. Рецепторы ИЛ-10 имеют гомологию рецепторов интерферона, и подобно ИЛ-10 индуцирует экспрессию в моноцитах гена Fc- рецептора. Для полного функционирования цитокиновой системы необходимы повышение уровня цитокина в ответ на инфект и экспрессия нормального количества рецепторов к ним на клетках. Изменение рецепторов после их связывания с цитокином заключается в интернализации комплексов цитокин - рецептор внутрь клетки. На поверхности клеток рецептор появляется заново, постепенно синтезируясь в течение 24-36 ч (время появления рецепторов интерферон-альфа). В этот период клетки остаются чувствительными к последующим дозам цитокина, чем объясняется эффективность введения препаратов интерферона и их индукторов три раза в неделю.
Пик продукции цитокинов после стимуляции макрофагов наблюдается через 1-2,6,18-48 ч, а пик продукции интерферон-гамма наступает через 20 ч после первого выхода цитокина из клетки. Поскольку интерферон-гамма ингибирует миелопоэз, то нормализация числа нейтрофилов после элиминации инфекта связана с системой регуляции нейтропоэза. Через 6 ч после стимуляции интерферон-альфа для выполнения своих функций NK-rклетки (активность которых регулируется ИЛ-1, 4, 2) продуцируют гамма-интерферон, в результате чего происходит лизис инфицированных клеток.
При антигенной стимуляции клеток трансдукция сигнала с активированного рецептора на генетический аппарат осуществляется с помощью внутриклеточных регуляторных систем, компоненты которых (белки мембран, ферментов, хроматина) связываются с чувствительными к ним последовательностями ДНК. После связывания цитокина (интерферон) с поверхностными клеточными мембранными рецепторами происходит активация ферментов протеинкиназы-С (ПКС), тирозинкиназы, ц-АМФзависимой протеинкиназы, серин-треонинкиназы. Интерферон-альфа активирует tyk 2 и jak 1-киназы, а интерферон-гамма активирует jak 1 и 2-киназы. Далее факторы транскрипции перемещаются в ядро клетки и связывают гены раннего ответа.
Первый ответ клеток на цитокин - это быстрая индукция генов раннего ответа ("immediate early" генов), в число которых и входит ген интерферон-гамма. Стимуляция экспрессии этих генов важна для выхода клеток из Go-стадии и перехода в Gi-стадию и дальнейшей прогрессии клеточного цикла. Их индукция происходит после активации рецепторов роста на клеточной мембране и активации протеин-киназной системы. Гены раннего ответа являются ключевыми регуляторами клеточной пролиферации и дифференцировки, кодируют белки, регулирующие репликацию ДНК.
Таким образом, при активации клеток происходит стимуляция генов раннего ответа, что ассоциируется с изменением фаз клеточного цикла. Основная протективная роль в иммунном ответе, направленном против внутриклеточных паразитов (грибы, простейшие, вирусы, микобактерии туберкулеза), принадлежит клеточным механизмам. Способность перечисленных возбудителей переживать и размножаться внутри клеток делает их защищенными от действия антител и системы комплемента. Резистентность к антимикробным факторам макрофагов позволяет им длительно переживать внутри этих клеток. Для элиминации возбудителя необходим специфический клеточно-опосредованный ответ. Его специфичность определяется антигенраспознающими СД8+-Т-лимфоцитами, которые пролиферируют, активируются и формируют клон эффекторных цитотоксических лимфоцитов. Решающий момент специфического иммунного ответа - это ответ СД4+Т-лимфоцитов с хелперной направленностью на распознавание антигена. На этом этапе определяется форма иммунного ответа: либо с преобладанием гуморального иммунитета, либо с преобладанием клеточных реакций (ГЗТ). Направление дифференцировки СД4 + -лимфоцитов, от которого зависит форма специфического иммунного ответа, контролируется цитокинами, образующимися в ходе воспалительной реакции. Так, в присутствии ИЛ-12 и интерферон-гамма СД4 + -лимфоциты дифференцируются в воспалительные Тh1-клетки, начинают продуцировать и секретировать интерлейкин-2, интерферон-гамма, ФНО и определяют клеточный характер специфического иммунного ответа. Присутствие ИЛ-12 обеспечивается его продукцией макрофагами, а интерферон-гамма - естественными киллерами, активированными в раннюю фазу ответа на внутриклеточно паразитирующие бактерии и вирусы. В отличие от этого, в присутствии ИЛ-4 СД4 + -лимфоциты дифференцируются в хелперы Тh 2, которые начинают продуцировать и секретировать ИЛ-4, ИЛ-5, ИЛ-6 и запускают гуморальный иммунный ответ, т.е. синтез специфических антител - иммуноглобулинов. Воспалительные Тh 1-лимфоциты нужны для борьбы с внутриклеточными паразитами, а Тh 2 хелперы нужны для элективной защиты от внеклеточных паразитов.
Вирусная инфекция может вызывать быстрое подавление экспрессии ряда клеточных генов (из которых наиболее изучены интерфероновые гены и гены, кодирующие дс-РНК-зависимые ферменты -2,5-ОАС и ПК-дс), принимающих участие в антивирусном действии. Специальные исследования механизма антивирусного действия интерферонов и дс-РНК в клеточных и бесклеточных системах показали ключевую роль в этом процессе вышеуказанных ферментов. ПК-дс, взаимодействуя с дс-РНК, фосфорилируется и в активной форме фосфорилирует регуляторные факторы транскрипции и трансляции, из которых наиболее изучен инициирующий фактор трансляции (eIF2).
ПК-дс выполняет регуляторную роль в системе клеточной пролиферации на уровне факторов трансляции и активации ряда генов цитокинов. Вероятно, существует связь между подавлением транскрипции мРНК и ПК-дс, угнетением общего синтеза клеточного белка при вирусных инфекциях и накоплением в ядрах клеток белка нуклеокапсида и белка NSP2. Фрагментация клеточных хромосом, наблюдающаяся на ранних сроках вирусной инфекции, может быть одной из причин подавления экспрессии генов, участвующих в противовирусном ответе.
Есть основания предполагать участие белков NSP2 в регуляции активности генов цитокинов - низкомолекулярных белковых регуляторных веществ, продуцируемых клетками и способных модулировать их функциональную активность. Нарушения в системе цитокинов приводят к нарушению кооперативных взаимодействий иммунокомпетентных клеток и нарушению иммунного гомеостаза.
В последние годы показано, что ИЛ- 12, относящийся к провоспалительным цитокинам, является ключевым для усиления клеточно-опосредованного иммунного ответа и инициации эффективной защиты против вирусов.
Средства терапии гриппа и ОРЗ можно разделить на этиотропные, иммунокорригирующие, патогенетические и симптоматические. Приоритет принадлежит этиотропным препаратам, действие которых направлено непосредственно на возбудитель инфекции. Все препараты этиотропного действия целесообразно рассматривать с учетом их точек приложения в цикле репродукции вирусов гриппа и других ОРЗ.
Применение химиопрепаратов для профилактики и лечения гриппа и ОРЗ относится к базовой терапии и является общепризнанным мировым стандартом. Многолетние клинические исследования достоверно выявили их высокую лечебно-профилактическую значимость. Химиотерапевтические средства представлены тремя основными группами: это блокаторы М2-каналов (амантадин, ремантадин); ингибиторы нейраминидазы (занамивир, озельтамивир) и ингибиторы протеаз (амбен, аминокапроновая кислота, трасилол). Препараты оказывают прямое антивирусное действие, нарушая различные фазы репликативного цикла вирусов. Несколько особняком стоит группа вирулицидных препаратов, применяемых местно для предотвращения адсорбции и проникновения вирионов в клетки.
- Грипп и другие респираторные вирусные инфекции / под ред. О.И. Киселева, И.Г. Мариничева, А.А. Сомининой. - СПб, 2003.
- Дриневский В.П., Осидак Л.В., Цыбалова Л.М. Острые респираторные инфекции у детей и подростков // Практическое руководство под редакцией О.И. Киселева. - СПб, 2003.
- Железникова Г.Ф., Иванова В.В., Монахова Н.Е. Варианты иммунопатогенеза острых инфекций у детей. СПб, 2007. - 254 с.
- Ершов Ф.И. Грипп и другие ОРВИ // Антивирусные препараты. Справочник. - М., 2006. - С.226-247.
- Ершов Ф.И., Романцов М.Г. Антивирусные средства в педиатрии. - М., 2005. - С.159-175.
- Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы (от молекул до лекарств). М., 2005. - С.287-292.
- Иванова В.В. Острые респираторно-вирусные заболевания // Инфекционные болезни у детей. - М., 2002.
- Онищенко Г.Г., Киселев О.И., Соминина А.А. Усиление надзора и контроля за гриппом как важнейший элемент подготовки к сезонным эпидемиям и очередной пандемии. - М., 2004. - С.5-9.
- Об утверждении стандарта медицинской помощи больным гриппом, вызванным идентифицированным вирусом гриппа (грипп птиц) // Приказ Минздравсоцразвития №460 от 07.06.2006 г.
- Романцов М.Г., Ершов Ф.И.Часто болеющие дети: Современная фармакотерапия. - М., 2006. - 192 с.
- Стандартизированные принципы диагностики, лечения и экстренной профилактики гриппа и других острых респираторных инфекций у детей / под ред. О.И. Киселева. - Санкт-Петербург. - 2004. - С.82-95.
- Лекарственные средства в фармакотерапии патологии клетки / под ред. Т.Г.Кожока. - М., 2007.
Сейчас известно 39 видов коронавирусов, в каждый вид могут входить десятки и сотни штаммов. Кроме того, есть еще 10 видов — кандидатов в коронавирусы. Специалисты пока только проверяют, можно ли их считать настоящими коронавирусами. У них широкий спектр хозяев среди птиц и зверей, у которых они вызывают заболевания дыхательной системы и желудочно-кишечного тракта. К людям коронавирусы приходят от животных: вирус атипичной пневмонии 2002—2003 годов SARS-CoV пришел от подковоносых летучих мышей, от которых он перескочил в мусанга, или малайскую пальмовую куницу, а из мусанга — уже в человека. (Любителям кофе малайская пальмовая куница должна быть знакома — это тот самый зверек, без которого не было бы кофе копи-лювак: мусангам скармливают кофейные зерна, которые определенным образом ферментируются в кишечнике, изменяя вкусовые свойства; кофе из зерен, которые прогнали через мусангов, считается особо изысканным и стоит весьма немалых денег.)
Еще один человеческий коронавирус известен по вспышке ближневосточного респираторного синдрома, первые случаи которого были зарегистрированы в 2012 году в Саудовской Аравии, — он получил название MERS-CoV. Этот вирус также пришел к людям от летучих мышей с промежуточной остановкой в одногорбых верблюдах (оттого его еще называют верблюжьим гриппом, что неправильно, — коронавирусы от вирусов гриппа отличаются). Умирают от него более трети заразившихся, однако заразиться им сложно: с момента появления вируса и до начала этого года в мире зарегистрировано лишь около двух с половиной тысяч случаев.
Подозревают, что и новый вирус SARS-CoV-2 тоже пришел к нам от летучих мышей.
Наконец, есть еще четыре человеческих коронавируса, два из которых, HCoV-229E и HCoV-OC43, были известны еще до атипичной пневмонии от SARS-CoV, а два других, HCoV-NL63 и HCoV-HKU1, открыли в 2004 и 2005 годах. Все четыре не вызывают ничего серьезнее мягкой простуды; хотя коронавирусная простуда встречается довольно часто — на ее счет относят 15—30% всей простуды в мире.
Но об эпидемиологии коронавирусов мы рассказывать не будем, а вместо этого поговорим о том, как они устроены и как на них реагируют наши клетки.
Обладатели белковой короны
И белок S, и белок HE сидят в мембранной липидной оболочке. Откуда она берется? Как мы помним, наши клетки окружены мембраной и внутри них существует много мембранных органелл — клеточных органов, выполняющих разные функции и ради правильной работы отделенных от остальной клетки двуслойной липидной мембраной. Ее-то вирус и заимствует, выходя из клетки, а как именно, скажем чуть ниже. Кроме S и HE в ней сидит очень много белка М, который поддерживает и структурирует мембрану, и еще немного белка E. Под липидной оболочкой с белками мы найдем геном вируса — нить молекулы РНК, которая усажена белком N: он упаковывает вирусную РНК в компактную свернутую спираль. (Белковая оболочка вирусов, непосредственно взаимодействующая с нуклеиновой кислотой, называется капсидом.) Когда РНК попадает в клетку, то на ней сразу можно синтезировать белки, и такую РНК у вирусов обозначают плюсом.
По этим признакам коронавирусы относят к РНК-содержащим вирусам, чей геном представляет собой одну-единственную плюс-цепь РНК. Так же выглядит геном у множества других вирусов, среди которых есть риновирусы (одна из самых частых причин простуды) и вирус гепатита С. В то же время коронавирусы относят к оболочечным вирусам, у которых кроме нуклеиновой кислоты и связанного с ней структурно-защитного белка (у коронавирусов это белок N) есть еще мембранная оболочка. К оболочечным вирусам еще относятся, например, вирусы герпеса, у которых наследственная информация хранится в ДНК, и ВИЧ. Как видим, по отдельности разные молекулярные черты можно найти у множества вирусов и лишь по их сочетанию отделить одну группу вирусов от другой.
Кстати, геном в виде РНК — это, можно сказать, слабость коронавирусов. В нуклеиновых кислотах время от времени появляются мутации либо из-за внешних факторов, вроде фоновой радиации, либо из-за стандартных ошибок белков, которые эти нуклеиновые кислоты копируют. Но в клеточной ДНК мутации могут быть исправлены специальными ремонтными белками. Этим же ремонтом способны воспользоваться вирусы с геномом в виде ДНК или же те, которые геномную РНК на время копируют в ДНК (такие вирусы называются ретровирусами). А в коронавирусной РНК ошибки никак не исправляются. Мутации помогают вирусам сменить хозяина, но среди мутаций есть очень много вредных, и если вирус не может никак корректировать дефекты в ДНК, они в какой-то момент могут сделать его просто нежизнеспособным.
Любые вирусы — это, грубо говоря, лишь комок молекул, пусть и сложно устроенный. Собственного обмена веществ у вирусов нет, и размножаться за пределами клетки они не могут. Вирусам с мембранной оболочкой проникнуть в клетку проще как из-за самой мембраны, так и благодаря сидящим на ней белкам: они хорошо подходят к клеточным рецепторам. Кроме того, белки мембранной оболочки, как собственно вирусные, так и те, которые вирус прихватил у клетки вместе с куском мембраны, помогают вирусу уходить от иммунной атаки. Но из-за мембраны такие вирусы более чувствительны к разным неблагоприятным факторам, вроде обезвоживания или моющих детергентов, мембрану разрушающих. Поэтому вирусы с мембранной оболочкой лучше всего передаются от хозяина к хозяину, а сидеть на какой-то поверхности и ждать, когда их оттуда снимет потенциальный хозяин, они долго не могут. Этим они отличаются от вирусов без мембраны, которые представляют собой нуклеиновую кислоту, заключенную в белковый капсид, — они более устойчивы в окружающей среде, но проникнуть в клетку для них зачастую сложнее.
Внедрение в клетку
Разные вирусы пользуются разными клеточными белками для входа. Так, вирус атипичной пневмонии SARS-CoV и относительно безобидный HCoV-NL63 связываются с ангиотензинпревращающим ферментом 2, который помогает регулировать кровяное давление, участвует в управлении иммунитетом и играет роль еще в целом ряде процессов. Но белка одного вида для входа бывает недостаточно, поэтому, например, SARS-CoV нужен еще белок TMPRSS2 — одна из сериновых протеаз, участвующая в разных биохимических реакциях. Вирус сначала связывается с одним белком на поверхности клетки, а потом второй белок на поверхности клетки режет вирусный белок S, после чего мембраны вируса и клетки соединяются.
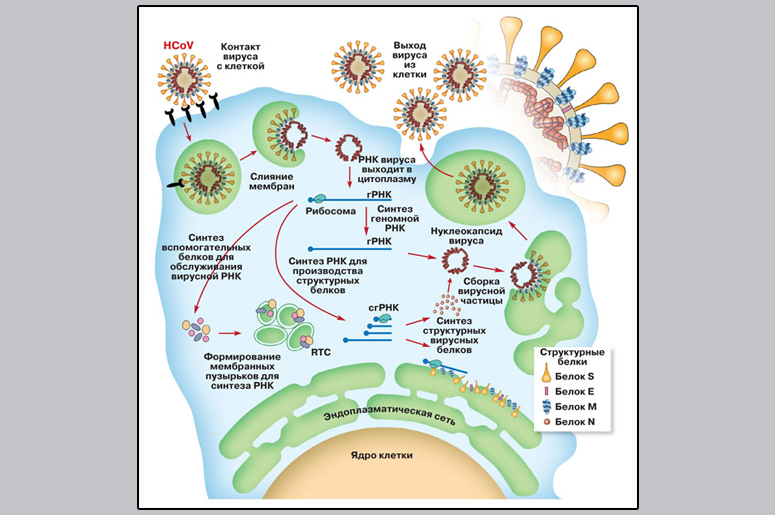
Схема жизненного цикла коронавируса. Проникнув в клетку, вирус высвобождает свою РНК, на которой рибосомы — клеточные машины для белкового синтеза — собирают вирусные белки, необходимые для формирования мембранных пузырьков и для синтеза плюс-цепи геномной РНК — гРНК. На вспомогательных мембранных пузырьках появляются вирусные белки, образующие RTC — replication transcription complex, этот комплекс выполняет репликацию (удвоение генома вируса) и транскрипцию — синтез коротких субгеномных РНК (сгРНК), предназначенных для сборки структурных вирусных белков. Структурный белок N соединяется с геномной РНК и образует нуклеокапсид вируса (геном плюс капсидный белок). На эндоплазматической сети синтезируются другие структурные белки, которые организуют вирусу липидную мембрану.
Вирус проник в клетку, и теперь он начинает копировать свой геном, то есть молекулу РНК, и синтезировать белки, нужные для копирования РНК и для формирования вирусных частиц. Кроме полных геномных РНК коронавирусы создают еще набор более коротких РНК — они синтезируются на больших геномных РНК и нужны только для синтеза белков; в вирусные частицы эти короткие РНК не попадают (точно так же ведут себя некоторые другие вирусы, которые вместе с коронавирусами объединяют в группу Nidovirales). Все вирусные РНК синтезируются в особых белковых комплексах, которые, в свою очередь, закреплены в небольших мембранных пузырьках. Эти пузырьки создает сам вирус: его белки вторгаются во внутриклеточные мембраны и фрагментируют их, создавая пузырьки-везикулы, чтобы РНК-синтезирующим комплексам было к чему пришвартоваться.
Часть насинтезированной РНК остается плавать в цитоплазме клетки — на ней синтезируется белок N, который будет упаковывать геномную вирусную РНК в спираль. Другие структурные белки, те, что потом окажутся в мембранной оболочке вируса (S, M и пр.), синтезируются на РНК, осевшей на особой внутриклеточной структуре — эндоплазматической сети, или эндоплазматическом ретикулуме (ЭР). Эндоплазматическая сеть — это огромная система мембранных канальцев, цистерн и пузырьков, на которых сидят белоксинтезирующие молекулярные машины рибосомы и собирают белки в соответствии с информацией в РНК. Готовые белки погружаются внутрь полостей ЭР, где приобретают правильную пространственную форму и потом либо переходят в клеточную цитоплазму, либо отправляются на экспорт, наружу из клетки, будучи заключены в транспортный мембранный пузырек.
Особенности внутриклеточной борьбы
О том, что у нее внутри орудует вирус, клетка может догадаться по неполадкам с внутренними мембранами — мы помним, что коронавирусы фрагментируют мембраны, чтобы дать опору своим белкам, синтезирующим РНК, и сами вирусные частицы прихватывают себе куски мембран. Кроме того, вирусные белки накапливаются в эндоплазматической сети и вызывают так называемый ЭР-стресс, то есть стресс эндоплазматического ретикулума. ЭР-стресс заставляет клетку остановить синтез белков (что, несомненно, бьет по вирусу — ведь он зависит от клеточной белоксинтезирующей машины) и активирует сигнальные молекулярные пути, которые включают программы клеточного суицида. Наконец, клетка может понять по вирусной РНК, что внутри у нее поселилась инфекция, и в ответ начать синтез интерферона первого типа. Это сигнальный белок, который выходит из клетки и оповещает всех об инфекции, в результате здоровые клетки готовятся защищаться от своей соседки, а иммунные клетки стремятся уничтожить зараженную клетку.
Как и ОРВИ, и грипп, новый коронавирус SARSCOV-2 (заболевание, к которому он приводит, принято теперь называть COVID-19) легко распространяется через капли, выделяющиеся при кашле или чихании инфицированных людей. Таким образом, соблюдение санитарно-гигиенических правил имеет решающее значение для профилактики этой инфекции.
Какой инкубационный период у вируса?
Ученые проанализировали данные о всех случаях заболевания новым коронавирусом (само семейство коронавирусов известно давно, к нему относят до 40 видов вирусов, которые поражали человека и животных, но смертельными их не считали). Вывод гласит: в среднем инкубационный период COVID-19 составляет пять дней, а первые симптомы могут проявиться в течение 11 дней. Таким образом, 14-дневный карантин, который ввели во многих странах, представляется вполне разумным.
Стоит отметить при этом, что ученые из Института психиатрии, психологии и нейробиологии Великобритании подчеркивают, что длительный карантин — непростое испытание для психики. Они проанализировали исследования в десяти странах, где люди перенесли в карантине тяжелый острый респираторный синдром (SARS), лихорадку Эбола, грипп H1N1, ближневосточный респираторный синдром (MERS), и отмечают: люди на карантине испытывают высокий уровень страха перед заражением и возможностью заражения других. Они часто склонны к катастрофическим интерпретациям событий, а отсутствие четкой информации может усугубить это. Рекомендация следующая: период карантина должен быть как можно короче (в разумных пределах, конечно), а негативные психологические последствия смягчает сознательная (добровольная) самоизоляция.
Есть ли лечение от COVID-19?
На данный момент специального лечения для этой инфекции нет. Заболевшим назначают поддерживающие меры, которые снимают симптомы. Поскольку это вирусная инфекция, антибиотики в данном случае бесполезны.
Почему вирус так легко заражает людей?

Можно ли было предотвратить появление новой инфекции?
Новые инфекционные заболевания появляются регулярно, за последние десятилетия мир узнал вирусы Зика и Эбола, ВИЧ, новые типы гриппа и вот теперь SARSCOV-2. Такие заболевания обычно возникают, когда животному вирусу удается проникнуть в организм человека из-за тесного контакта между людьми и животными. Вероятность предотвратить это в любой точке мира равна нулю. Что мы можем сделать, так это быть готовыми реагировать как можно быстрее, когда это произойдет.
Насколько эффективны санитарно-гигиенические меры?
При исследовании больничных палат, где лежали пациенты с COVID-19, вирус был обнаружен на множестве поверхностей, в том числе на перилах кроватей, дверных ручках, стульях, выключателях освещения, окнах, раковинах, стетоскопах, воздушных вентиляторах и туалетах. Но достаточно протереть поверхности обычным хлорсодержащим средством, чтобы ликвидировать вирус. То есть он не более живучий, чем грипп или норовирус (его еще называют кишечный грипп).
А вот смыв воды в туалете и воздушные сушилки для рук — самый эффективный способ распространения разных вирусов, в том числе и коронавируса.
Несколько случаев заболевания произошло в одной семье в результате совместного обеда, когда все ели из одной посуды.
Может ли этот вирус исчезнуть?
Единственный способ полностью уничтожить вирус — это разработать вакцину, как в случае с оспой. Во всех остальных случаях вирус так и будет циркулировать.
Когда закончится эпидемия?
По осторожным прогнозам, к лету все должно закончиться. Во-первых, большинство респираторных вирусов циркулируют именно в зимнее, холодное, время года. Во-вторых, в странах Южного полушария, где сейчас лето, случаи заболевания единичны. Еще один аргумент в подтверждение — SARS, близкий родственник нынешней SARSCOV-2, исчез как раз к июлю.
Можно ли заболеть дважды?
По идее после первой встречи с инфекцией организм вырабатывает иммунитет. Он может быть нестойким, как, например, после заболевания гриппом. Но вряд ли человек переболеет гриппом дважды за один сезон. Тем не менее в Китае и Японии зафиксировано несколько случаев повторного заражения коронавирусом. Пока ученые полагают, что эта информация нуждается в перепроверке. Впрочем, окончательную ясность о продолжительности иммунной защиты можно будет получить лишь после проведения серологического исследования (анализ антител) населения.
Кто уязвим больше всего?
Опаснее ли коронавирус, чем грипп?
Пока преждевременно оценивать его опасность или безопасность. Смертность от сезонного гриппа составляет 0,1 процента. От коронавируса — на данный момент в пределах 2–3 процентов. Но окончательные цифры можно будет понять лишь по окончании эпидемии. Коронавирус кажется более заразным, чем грипп. Но в большей степени это связано с более пристальным вниманием к этой инфекции.
Стал ли он опаснее после мутации?
SARSCOV-2 действительно в процессе эпидемии приобрела генетические мутации, разделившие ее на два штамма. Китайские исследователи утверждают, что наиболее вирулентный является и самым распространенным. Но их исследование было основано на анализе лишь сотни генетических последовательностей вируса. Чтобы делать выводы, этого слишком мало. В Институте Пастера считают, что мутации, которые совершенно ожидаемы для этого типа вируса, привели лишь к его незначительным модификациям, не сделав его особо опасным.

Но даже если вирус продолжит мутировать, эти мутации не сделают его смертельным для человека. Почему? Вирус, убивающий всех инфицированных, сам неминуемо погибнет. Так что убийство не в его интересах. Эволюция отбирает не самые смертоносные вирусы, а те, которые лучше распространяются. Пример — вирус чикунгунья, который переносят комары: в начале 2000-х из-за потепления он из тропиков распространился на гигантские территории, вплоть до юга России. Инфекция не стала более опасной, но легче передавалась.
Появится ли вакцина?
Работы ведутся разными институтами в разных направлениях. Одни добиваются иммунного ответа, используя фрагменты генетического кода коронавируса, которые помещают в безвредные вирусы. Другие используют ДНК либо РНК вируса напрямую: после инъекции они начинают производить кусочки вирусных белков.
Но и эти, более быстрые способы создания вакцины могут оказаться недостаточно эффективными. Дело в том, что SARSCOV-2 может мутировать еще быстрее. Поэтому наиболее перспективным считается использование методов синтетической биологии. Исследователи предполагают создать наночастицы из белков и прикрепить к ним вирусные молекулы в повторяющемся ряду с расчетом на то, что наша иммунная система воспримет такое повторяющееся расположение как опасность, с которой надо бороться (дело в том, что такое строение имеют клеточные стенки бактерий). Если это удастся, то такие наночастицы можно будет использовать для борьбы и с другими коронавирусами — SARS, MERS, что даст шанс защититься от всех разом. К тому же такой подход позволяет быстро создать миллионы и даже миллиарды доз вакцин.
Нужно ли отказаться от поездок в другие страны?
Анализ запретов на поездки внутри Китая и за его пределами и математический расчет показали: запреты задержали развитие эпидемии всего на три-пять дней в материковом Китае и на две-три недели в других странах. Объяснение простое — до 60 процентов случаев коронавирусной инфекции оставались незамеченными и продолжали невидимо распространяться по миру. И как только эти случаи попадают в новую страну, начинаются локальные вспышки, уже не связанные с Китаем. И хотя запреты на поездки сыграли некоторую положительную роль, наиболее эффективными мерами предотвращения распространения вируса ученые считают быструю идентификацию инфицированных, изоляцию их и отслеживание контактов.
Источники:Институт Пастера (Франция), Клиника Майо (США), Университет Торонто (Канада), Университет Джонса Хопкинса (США), Университет науки и техники Хуачжун в городе Ухане
Читайте также:


