Устойчивость к рифампицину при туберкулезе чем заменить
Лекарственно устойчивые штаммы туберкулёза возникают естественным путём в ходе спонтанного мутагенеза как ответная реакция на введение антибиотиков. Они, как правило, обладают слабым фитнесом, т.е. они медленнее растут, слабее размножаются, у них нет других преимуществ, за исключением устойчивости к антибиотикам. И, соответственно, первоначальная стратегия при столкновении с лекарственно устойчивыми штаммами заключалась в том, чтобы, во-первых, антибиотики, направленные на лечение туберкулёза, были изъяты из широкой сети обращения и использовались только в специализированных учреждениях и, во-вторых, курс лечения проводился особым образом: сначала больного лечили антибиотиками, потом делали перерыв, за это время оставшиеся лекарственно чувствительные штаммы начинали доминировать, соответственно вытесняя лекарственно устойчивые варианты, затем опять проводили химиотерапию, достигали хороших результатов, что снова приводило к появлению лекарственно устойчивых штаммов, снова делали перерыв и так до полного излечения. Но потом оказалось, и обнаружили это, прежде всего в Африке, что такие проблемы как СПИД, который поражает иммунную систему, приводят к значительному росту числа лекарственно устойчивых штаммов. Причём если раньше эти штаммы были в основном в лечебных учреждениях, то теперь они стали обнаруживаться во всей популяции. И наиболее распространённая на сегодняшний день теория, для которой находится всё больше и больше подтверждений, заключается в том, что для того, чтобы лекарственно устойчивые штаммы вырвались в популяцию, они должны пройти несколько циклов размножения в организме со слабой иммунной системой, а именно такими объектами являются, прежде всего, больные СПИДом. Далее обнаружилось, что в странах, где происходят колоссальные социальные пертурбации, где всё рушится, возникает большая прослойка бедных, социально дезориентированных людей, у которых доходы ниже прожиточного реального минимума и иммунная система ослаблена, и такие люди тоже становятся тем резервуаром, в котором лекарственно устойчивые штаммы могут адаптироваться и приобрести такие преимущества, которые позволяют им конкурировать с лекарственно чувствительными штаммами. Таким образом с появлением и распространением СПИДа в мире, а также с началом таких крупных социальных потрясений, как в бывших странах СНГ, появились две большие зоны, включающие Африку, Азию, страны СНГ, где лекарственно устойчивые штаммы стали стремительно распространяться.
И тогда первыми забеспокоились международные организации, потому что эпидемия любого заболевания, в том числе и туберкулёза, в одной стране, является проблемой многих. В данном случае это было связано и усугублялось миграцией, поскольку открылись все ворота, люди стали эмигрировать из бывшего Советского Союза, и в Западной Европе вдруг стали обнаруживать те генотипы туберкулёза, которые раньше там не регистрировались.
Несмотря на то, что со дня открытия туберкулёза прошло уже больше ста лет, микобактерия хорошо изучена, известен и расшифрован её геном, но, тем не менее, мы пока не имеем надёжных средств вакцинации от туберкулёза. Спектр имеющихся лекарственных препаратов из-за проблемы лекарственной устойчивости приходится постоянно расширять и модифицировать, и ещё одна большая проблема – это проблема ранней диагностики туберкулёза.
Кох, открыватель туберкулёза, получивший за это Нобелевскую премию, был уверен, что можно быстро справиться с этой инфекцией. Но оказалось, что вакцина Коха защиты не даёт. Тогда появилась другая вакцина, БЦЖ, но она защищает только детей, а после 14 лет – что её вводи, что ни вводи – защиты нет. Кроме того, эффективность использования этой вакцины значительно меняется в зависимости от географического региона. В некоторых странах она обеспечивает высокую защиту детей – до 80%, а в других – 0%. К этому могли привести очень многие факторы. БЦЖ отличается от диких штаммов туберкулёза, у неё отсутствует фрагмент генома, и соответственно, несколько десятков генов у БЦЖ нет. В каждой стране штаммы для производства вакцины свои, единого мирового стандарта нет. По утверждениям специалистов-фтизиатров, наблюдается неуклонный рост осложнений при вакцинации БЦЖ. В чём причины? Они могут быть разнообразными. Может быть, сам ребёнок и его состояние, потому что в последнее время возросло число патологий среди новорождённых. Может быть, вакцинный штамм. Вакцинные штаммы строго контролируют по всем стандартным микробиологическим параметрам, но эти параметры не позволяют учитывать генотипические варианты. Так, во Франции на сегодняшний день идентифицировано не менее четырех штаммов БЦЖ, которые используют для вакцинации, в России – около двадцати. Поскольку при производстве штамм контролируется не на генетическом уровне, то не исключено, что на генетическом уровне могут происходить изменения и некоторые из них могут привести к не очень хорошим свойствам, которые, в свою очередь, и приводят к осложнениям. Возможно. Этого никто не проверял. Мы готовы принять участие в таких исследованиях, и мы могли бы найти те нуклеотидные замены, которые не должны присутствовать в исходном штамме, и создать устройство, с помощью которого можно было бы контролировать штаммы в ходе производства. Это позволяло бы проводить более глубокий независимый внутренний производственный контроль. Это в любом случае необходимо делать и, безусловно, это будет сделано, потому что любые живые вакцины требуют такого контроля. Всё в этом мире меняется, хотим мы или нет, это естественный, неизбежный процесс, возникают мутации, приобретаются какие-то селективные преимущества, иногда эти селективные преимущества срабатывают в организме, и это может привести к осложнениям. Такие работы – составление генетических портретов вакцинных штаммов - необходимы для практического здравоохранения и весьма интересны с научной точки зрения.
Следующая проблема – диагностика. Для детей это – реакция Манту, для взрослых – флюорография или томография. В ходе наших исследований и в ходе общения с коллегами, мы поняли, что реакция Манту имеет весьма условное диагностическое значение. Во-первых, реакция Манту не однозначна и существенно зависит от иммунного статуса человека. Во-вторых, она не всегда обладает высокой специфичностью и чувствительностью и не может отличить иммунитет, полученный при вакцинации БЦЖ, от дикой бактерии. Ведь реакция Манту – это суммарные белки от БЦЖ, и если вы вакцинированы БЦЖ, то они пересекаются с белками, полученными при прививке, появляется папула, на основании чего возникает подозрение, и надо проводить исследования дальше, тщательно проверять, что же происходит в организме. Чувствительность реакции Манту очень высока, а специфичность очень низкая, по оценкам некоторых специалистов она составляет всего 8-20%. Если же ещё накладывается коассоциированная инфекция – ВИЧ, или гепатит, или респираторные заболевания, то это вносит ещё большую путаницу. Поэтому в случае положительной реакции Манту необходимо провести подтверждающие диагностические анализы с помощью более совершенных методов. Если же говорить о флюорографии или результатах томографических исследований, то они выдают уже патологию. Т.е. это, безусловно, очень нужная, но уже не ранняя диагностика.
В России Т-клеточные технологии пока не внедрены. А в мире эти технологии уже внедрены в Германии и США, в специализированных крупных центрах, что надо делать и нам. Там не только есть центры, но действует система иммунологического мониторинга и система мониторинга генотипов микобактерии туберкулёза. Это позволяет реально оценивать эффективность всех противотуберкулёзных мероприятий, позволяет изучать процессы, которые реально происходят с микобактерией туберкулёза, вовремя выявлять эпидемические очаги, а не работать, как это делали раньше, по территориям в целом.

Дата публикации: 23.11.2019 2019-11-23
Статья просмотрена: 87 раз
Туберкулез по-прежнему остается одной из глобальных проблем здравоохранения, несмотря на то, что он является излечимым заболеванием. В 2015 г. было зарегистрировано 10,4 млн. новых случаев туберкулеза и 1,4 млн. смертей от этого заболевания. В 2015 г. коэффициент летальности от туберкулеза варьировал в широких пределах — от менее 5 % в некоторых странах до более 20 % в большинстве стран Африканского региона ВОЗ. Эти данные подчеркивают сохранение большого неравенства в доступе к высококачественным услугам диагностики и лечения туберкулеза. Европейский регион ВОЗ имеет самый высокий коэффициент заболеваемости туберкулезом с множественной лекарственной устойчивостью к рифампицину (МЛУ/РР-ТБ) на уровне 14 случаев на 100 000 населения. [1]
Множественная лекарственная устойчивость (МЛУ) микобактерий туберкулеза (МБТ) — это устойчивость возбудителя к сочетанию изониазида и рифампицина независимо от наличия устойчивости к другим противотуберкулезным препаратам (ПТП). Пред-широкая лекарственная устойчивость микобактерий туберкулеза (пред-ШЛУ МБТ) — это вид устойчивости, при которой определяется устойчивость микобактерий туберкулеза к изониазиду и рифампицину в сочетании с устойчивостью к фторхинолону или аминогликозиду/полипептиду (канамицин и/или амикацин и/или капреомицин) независимо от наличия устойчивости к другим противотуберкулезным препаратам. Широкая лекарственная устойчивость микобактерий туберкулеза (ШЛУ МБТ) — это вид устойчивости, при которой определяется устойчивость микобактерий туберкулеза к изониазиду, рифампицину, фторхинолону и аминогликозиду/полипептиду (канамицину и/или амикацину и/или капреомицину) одновременно, независимо от наличия устойчивости к другим противотуберкулезным препаратам. [5]
По классификации А. Г. Хоменко (1980) различают два вида устойчивости МБТ:
– монорезистентность — устойчивость к одному противотуберкулезному препарату;
– полирезистентность — устойчивость к двум и более противотуберкулезным препаратам.
В свою очередь существует истинная полирезистентность, при которой бактериальная клетка одновременно устойчива ко многим противотуберкулезным препаратам, и ложная (или множественная) резистентность, при которой отдельные особи популяции устойчивы к одному, а другие — к другому препарату. [4]
По своей природе лекарственная резистентность МБТ обусловлена одной или нескольких хромосомных мутаций в независимых генах МБТ. В клинической практике причинами возникновения МЛУ-ТБ являются: поздняя диагностика первичной лекарственной устойчивости (ЛУ) возбудителя, неадекватное или незавершенное предыдущее лечение, а также использование некачественных ПТП. Неадекватный или ошибочно выбранный режим химиотерапии приводит к тому, что лекарственно-устойчивый мутант, встречающийся в микобактериальной популяции, становится доминирующим у пациента, болеющего туберкулезом. Но даже при правильно назначенной противотуберкулезной терапии перерывы в лечении, временные отмены того или иного препарата, несоблюдение сроков химиотерапии способствуют формированию приобретенной устойчивости возбудителя. [5] Перед началом лечения больному назначается двукратное микробиологическое исследование используют световую и люминесцентную микроскопию мокроты. Бактериологический (культуральный) метод выявления МБТ состоит в посеве мокроты и другого патологического материала на твердые и жидкие питательные среды. Для выделения культуры МБТ достаточно 20–100 микробных тел в 1 мл мокроты. Рост культуры происходит за 21–90 сут. ПЦР для выявления ДНК возбудителя. Используют систему BACTEC (Приказ МЗ РФ № 19 от 21 марта 2003 г). [5, 4]
Для пациентов с подтвержденным рифампицин-чувствительным и изониазид-устойчивым туберкулезом рекомендуется лечение рифампицином, этамбутолом, пиразинамидом и левофлоксацином в течение 6 месяцев. Не рекомендуется добавлять в режим лечения пациентов с подтвержденным рифампицинчувствительным и изониазид-устойчивым туберкулезом стрептомицин или другие инъекционные препараты. МЛУ/РУ-ТБ, находящихся на длительном режиме лечения, необходимо включить три препарата группы А (левофлоксацин/моксифлоксацин, бедаквилин, линезолид) и один препарат группы В (клофазимин, циклосерин/теризидон), чтобы лечение начиналось как минимум с четырех противотуберкулезных препаратов. При лечении двумя препаратами группы A, то в режим необходимо включить оба препарата группы B. Если режим не может быть составлен только из препаратов групп A и B, их необходимо дополнить препаратами группы C (этамбутол, деламанид, пиразинамид, имипенем-циластатин, меропенем, амикацин (стрептомицин), этионамид/ протионамид, парааминосалициловая кислота). Канамицин и капреомицин, клавулановую кислоту не следует включать в длительные режимы лечения МЛУ/РУ-ТБ. Левофлоксацин или моксифлоксацин, линезолид необходимо включать в длительные режимы лечения МЛУ/РУ-ТБ. Бедаквилин необходимо включать в длительные режимы лечения МЛУ/РУ-ТБ у пациентов в возрасте от 18 лет и 6–17 лет. Клофазимин и циклосерин или теризидон, этамбутол, пиразинамид, имипенем-циластатин или меропенем можно включать в длительные режимы лечения МЛУ/РУ-ТБ. Деламанид можно включать в длительные режимы лечения МЛУ/РУ-ТБ у пациентов в возрасте от 3 лет. Амикацин можно включать в длительные режимы лечения МЛУ/РУ-ТБ у пациентов в возрасте от 18 лет при условии подтверждения чувствительности к нему и принятия достаточных мер для контроля нежелательных реакций. В случае недоступности амикацина его можно заменить стрептомицином при соблюдении тех же условий.
– Этионамид или протионамид можно включать в длительные режимы лечения МЛУ/РУ-ТБ только в том случае, если в них не входят бедаквилин, линезолид, клофазимин или деламанид или если невозможно составить режим из более предпочтительных препаратов.
– Парааминосалициловую кислоту можно включать в длительные режимы лечения МЛУ/РУ-ТБ только в том случае, если в них не входят бедаквилин, линезолид, клофазимин или деламанид или если невозможно составить режим из более предпочтительных препаратов. [6]
Общая продолжительность лечения МЛУ/РУ-ТБ составляет 18–20 месяцев; она может быть изменена в зависимости от ответа пациента на терапию. Предполагаемая продолжительность лечения после достижения конверсии культуры составляет 15–17 месяцев. С использованием амикацина или стрептомицина, предполагается интенсивная фаза продолжительностью 6–7 месяцев. У пациентов с МЛУ/РУ-ТБ, которые ранее на протяжении более 1 месяца не принимали препараты второго ряда, используемые в коротком режиме лечения МЛУ-ТБ, или у которых была исключена устойчивость к фторхинолонам и инъекционным препаратам второго ряда, вместо длительных режимов может использоваться короткий режим лечения МЛУ-ТБ продолжительностью 9–12 месяцев. [6, 5] Для мониторинга ответа на лечение рекомендуется посев мокроты в дополнение к микроскопии мазка мокроты ежемесячно. У пациентов с РУ-ТБ или МЛУ-ТБ одновременно с рекомендуемым режимом лечения МЛУ-ТБ может применяться выборочная частичная резекция легких (лобэктомия или клиновидная резекция). [6, 5]
Пациентам, проходящим лечение от ТБ, может быть предложена помощь в виде отслеживание хода лечения и/или цифровой мониторинг приема препаратов, материальная поддержка, психологическая поддержка. Обучение персонала. Пациенты могут лечиться под непосредственным наблюдением (ЛНН) на дому или с привлечением обученных медицинских работников. Лечение под видеонаблюдением (ЛВН) может заменить. Для пациентов, проходящих лечение от МЛУ-ТБ, более предпочтительной является децентрализованная, а не централизованная модель лечения. [6, 4]
Рост лекарственной устойчивости МБТ у больных туберкулезом легких и отсутствие новых противотуберкулезных препаратов ставит фтизиатрическую службу в трудные условия, что заставляет фтизиатров обратиться к богатому опыту борьбы с туберкулезом в доантибактериальный период, а именно в 20–50-е гг. прошлого столетия. Именно в доантибактериальный период были сформированы основные принципы массовой флюорографии, когда более 50 % всех больных деструктивным туберкулезом легких с бактериовыделением умирали в течение 5–6 лет после установления диагноза. В это время рентгенологический метод стал основным способом выявления начальных форм туберкулеза легких. Еще в 30-х гг. XX в. Бройнинг в Германии, Мальмрос и Хедвалл в Швеции и Г. Р. Рубинштейн и И. Е. Кочнова в СССР показали, что преобладающая форма туберкулеза, наиболее рано возникающая у клинически здоровых взрослых людей, является очаговый туберкулез легких, как правило, выявляют через 6–12 месяцев после получения нормальной рентгенограммы. [4]

В 2004 году по инициативе д.м.н., профессора Михаила Александровича Владимирского, заведующего сектором молекулярной диагностики туберкулёза НИИ Фтизиопульмонологии Первого МГМУ им. И.М.Сеченова, мы начали разработки в области ПЦР-диагностики туберкулёза.
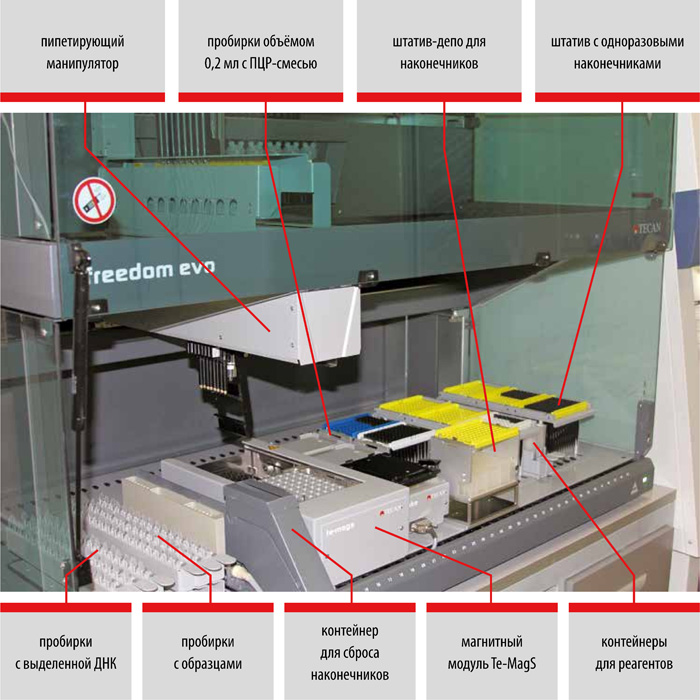
Выделение ДНК: использование оригинальных реагентов и магнитных частиц обеспечивает получение максимального количества чистой ДНК и позволяет автоматизировать процесс выделения ДНК.
ПЦР в реальном времени: одновременная детекция нескольких различных участков генома комплекса микобактерий туберкулёза (МБТ) увеличивает информативность и достоверность анализа.
I этап – Пробоподготовка, инактивация
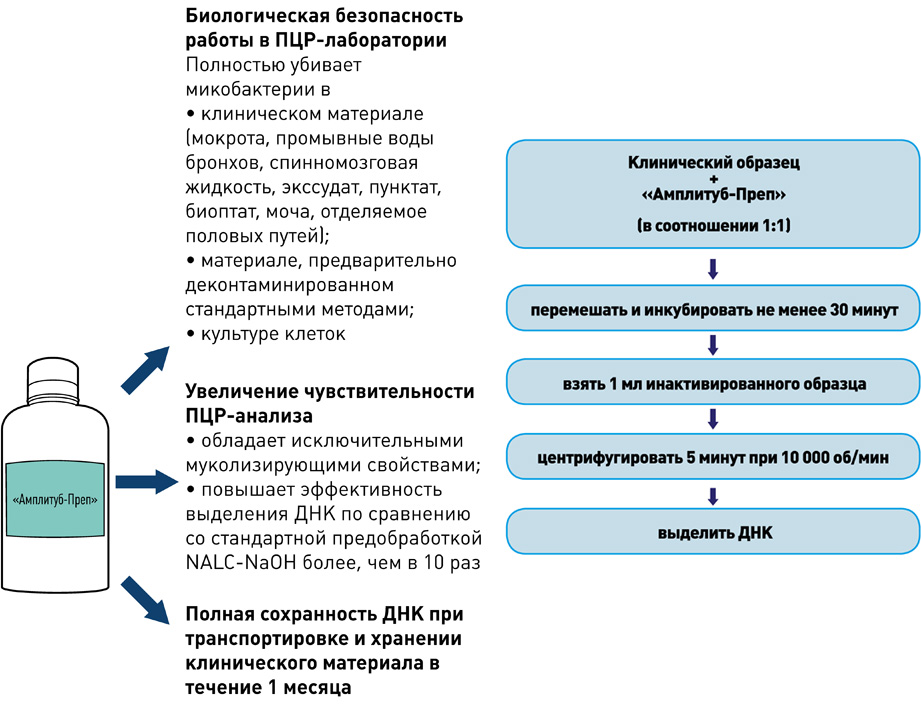
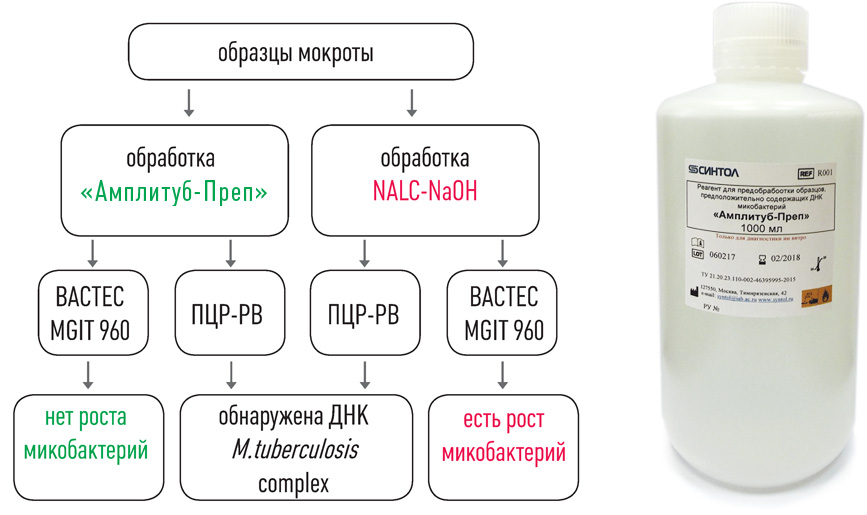
II этап – Выделение ДНК
набор реагентов для выделения ДНК (на магнитных частицах)
набор реагентов для выделения ДНК микобактерий из клинических образцов и культур клеток на автоматизированных станциях TECAN

- Снижение риска контаминации во время выделения ДНК практически до нуля.
- Значительное уменьшение трудоёмкости процесса выделения ДНК.
- Стандартизированное выделение ДНК из клинических образцов.
- Экономическая выгода: низкий расход пластика и реактивов.
набор реагентов для ускоренной пробоподготовки и выделения ДНК микобактерий из образцов мокроты
III этап – ПЦР в реальном времени
Обнаружение и количественное определение комплекса МБТ
Набор реагентов АМПЛИТУБ-РВ — это:
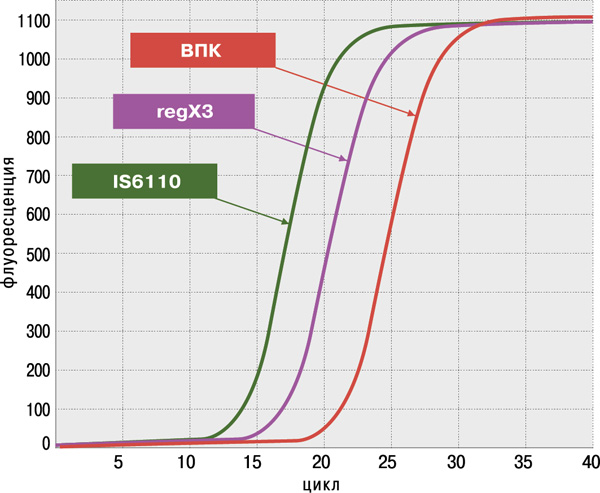
- высокая достоверность анализа благодаря одновременному обнаружению двух специфичных генов M.tuberculosis complex: IS6110 и regX3;
- оценка пригодности образца ДНК для определения антибиотикоустойчивости;
- высокая чувствительность (не более 100 КОЕ/мл мокроты или 1–10 копий фрагментов ДНК в реакции) и 100%‑ая специфичность, подтверждённые на панели QCMD (Quality Control for Molecular Diagnostics) Mtb EQA (UK).
Определение антибиотикоустойчивости МБТ к препаратам I и II ряда
Наборы реагентов АМПЛИТУБ-МЛУ-РВ, АМПЛИТУБ-FQ-РВ — это:
- диагностика форм туберкулеза с лекарственной устойчивостью, в том числе множественной лекарственной устойчивостью (МЛУ) и широкой лекарственной устойчивостью (ШЛУ);
- быстрая детекция мутаций M.tuberculosis, ассоциирующихся с устойчивостью к антибиотикам первого и второго ряда (рифампицину, изониазиду, этамбутолу, фторхинолонам);
- достоверность результатов, ежегодно подтверждаемая при проведении Федеральной службой внешней оценки качества (ФСВОК) Росздравнадзора испытаний шифрованных тест-культур и образцов.
Наборы АМПЛИТУБ-МЛУ-РВ и АМПЛИТУБ-FQ-РВ основаны на использовании оригинальной мультиконкурентной аллель-специфичной методики ПЦР в реальном времени, позволяющей выявлять мутации в генах микобактерий туберкулеза, ответственных за устойчивость к конкретным антибиотикам.

Принцип мультиконкурентной аллель-специфичной методики ПЦР в реальном времени
- В формате одной пробирки используются 5’-флуоресцентно-меченые аллель-специфичные праймеры с общим комплементарным им 3’-меченым олигонуклеотидом-гасителем и контрольный флуоресцентный зонд, комплементарный участку ДНК без мутаций.
- При отсутствии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается только по флуорофору зонда.
- При наличии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается как по флуорофору зонда, так и по флуорофору 5’-флуоресцентно-меченого аллель-специфичного праймера. Данный метод позволяет определить не только точку мутации, но и процент устойчивого мутантного штамма МБТ на фоне дикого.
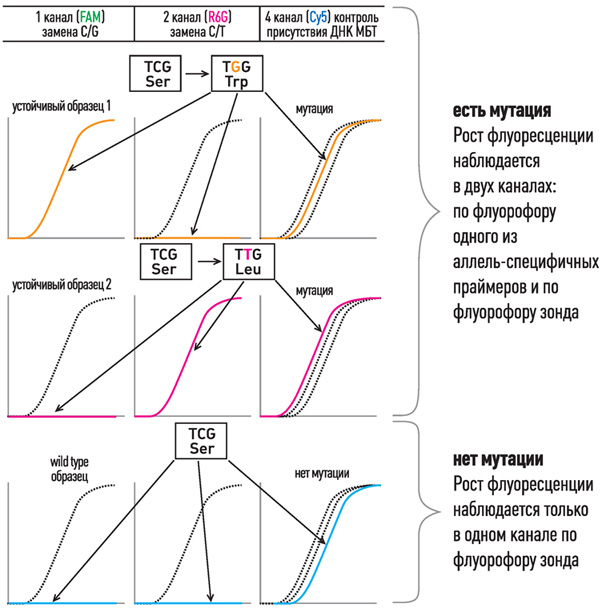
Интерпретация результатов выявления мутаций на примере
531 кодона rpoB гена M.tuberculosis
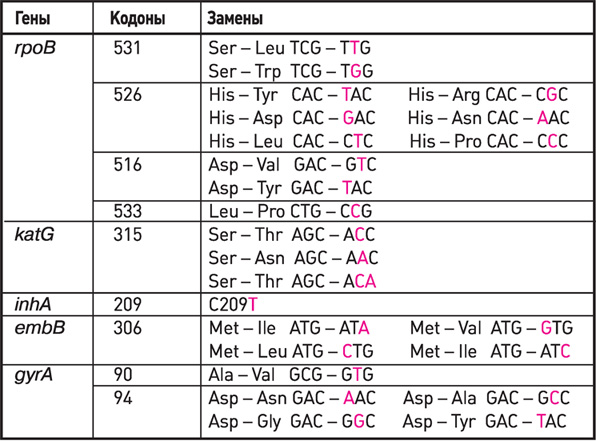
Гены, кодоны, замены, используемые в наборах реагентов
АМПЛИТУБ-МЛУ-РВ при определении антибиотикоустойчивости
Использование автоматизированных станций Freedom EVO (TECAN, Швейцария) для молекулярно-генетической диагностики туберкулёза
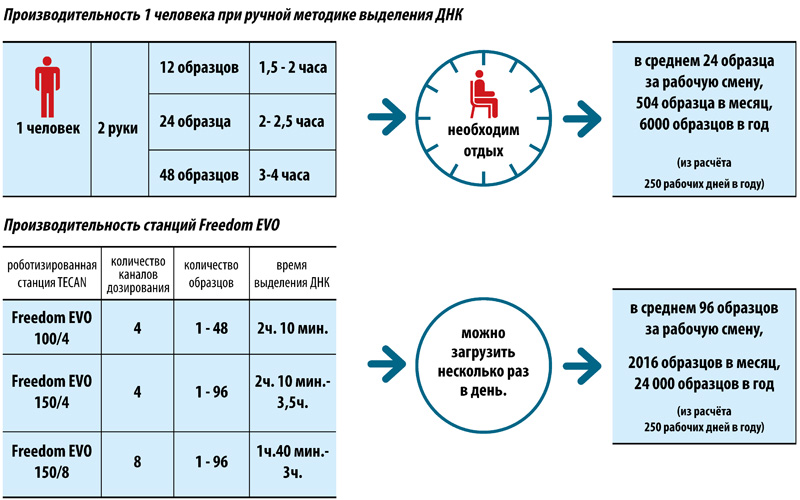

Трудозатраты — 1 час
Продолжительность выделения ДНК — не более 2 часов
Подготовка к амплификации и ПЦР-РВ — 1,5 часа
ИТОГО: результаты анализа будут готовы через 3,5 часа
Оператор затратит 1 час своего рабочего времени.
М. А. ВЛАДИМИРСКИЙ, Ю. С. АЛЯПКИНА, Д. А. ВАРЛАМОВ, Я. И. АЛЕКСЕЕВ, Л. К. ШИПИНА, М. В. ШУЛЬГИНА, Л. В. ДОМОТЕНКО, К. Р. БЫКАДОРОВА, Н. Н. ГАЩЕНКО, Б. ЕНДОУРОВА, Б.. В. ИВАНОВА, Е. А. ИЛЬИНА, О. А. ЛЕВКОВА, . В. МАРКОВА, В. П. НАЗЕМЦЕВА, Е. П. ПАВЛОВА,4А. И. ПОЛОЗОВ, Н. В. ШИШКИНА
НИИ фтизиопульмонологии ММА им. И. М. Сеченова, ЗАО "Синтол", Москва, НП Центр внешнего контроля качества лабораторных исследований, Москва, 4НИИ прикладной микробиологии, Оболенск, ОПТД, Ростов-на-Дону, КПТД Краснодар, ОПТД Мурманск, ОПТД, Кемерово, 9ОПТД, Нижний Новгород, ОПТД, Воронеж, ПТД № 4, Москва, 2ОПТД, Калининград, 3ОГТТД, Псков, ОПТД,Брянск, ОПТД, Саратов
Распространение лекарственно-устойчивых штаммов микобактерий туберкулеза (МБТ) является одной из наиболее серьезных проблем борьбы с туберкулезом во всем мире, в частности в России [1, 32], Оно в значительной степени связано с низкой эффективностью, точнее длительностью проведения, анализа лекарственной чувствительности МБТ при использовании традиционных микробиологических методов.
Развитие молекулярно-биологических методов быстрого определения чувствительности МБТ к противотуберкулезным препаратам основано на амплификации с использованием полимеразноцепной реакции (ПЦР) специфических участков генов, кодирующих мишени лекарственных веществ, с определением мутаций, связанных с возникновением устойчивости. Основные методы анализа: определение мутаций с помощью секвенирования (определение нуклеотидных последовательностей) полученных ампликонов [13, 18]; гибридизация ампликонов на полосках (стрипах) с олигонуклеотидными ДНК-зондами, комплементарными к известным мутациям, — метод line probe assay (LPA) [6, 8]; гибридизация с ДНК-зондами в формате микробиочипа [2—5, 9], технологии, основанные на ПЦР в реальном времени (ПЦР-РВ) [11, 15, 17, 19, 23].
Наиболее часто встречающиеся мутации, связанные с возникновением устойчивости МБТ к рифампицину в гене гроВ, а для изониазида — в генах katG и inhA, хорошо изучены и установлены [18].
Возможности практического применения этих методов активно обсуждаются в научной литературе [16, 18, 19, 21]. В клинической практике эти методы могут использоваться для быстрого (2 дня) определения лекарственной устойчивости к соответствующим препаратам и своевременной коррекции лечения, а также служить средством контроля за распространением лекарственно-устойчивых штаммов, своевременного эпидемиологического расследования их трансмиссии.
Изучение эффективности применения молекулярно-биологических методов, позволяющих быстро обнаруживать лекарственную устойчивость МБТ, должно, безусловно, быть основано и на сопоставлении с методами золотого стандарта, т. е. общепризнанными методами культурального (фенотипического) исследования для определения лекарственной чувствительности или устойчивости МБТ.
Мы разработали на основе технологии ПЦР-РВ эффективный и технически доступный с использованием одностадийного анализа метод быстрого определения лекарственной устойчивости к основным противотуберкулезным препаратам (изониазид, рифампицин, этамбутол).
Этот метод мы применяли для широкого исследования распространенности штаммов МБТ, особенно среди больных с впервые установленным диагнозом туберкулеза, устойчивых к основным противотуберкулезным препаратам — рифампицину и изониазиду — в 24 регионах Российской Федерации. При этом было проведено сопоставление результатов определения лекарственной устойчивости изучаемых (более 2 тыс.) штаммов МБТ, полученных методом ПЦР-РВ с результатами анализа тех же штаммов методами традиционного исследования в региональных микробиологических лабораториях. Кроме того, 100 штаммов МБТ, случайно выбранных из общего числа исследованных, были повторно тестированы с помощью культурального исследования методом пропорций в независимой лаборатории (НИИ прикладной микробиологии, Оболенск Московской области), неоднократно и успешно участвовавшей в тестировании внешнего контроля качества лабораторных исследований.
Штаммы МБТ. 22 референтных клинических штамма с известной характеристикой в отношении их устойчивости к рифампицину (12 штаммов были устойчивы к рифампицину при исследовании в жидкой культуре с помощью Bactec MGIT 960) любезно предоставлены ведущим научным сотрудником лаборатории микробиологии Центрального НИИ туберкулеза РАМН О. А. Иртугановой. 20 штаммов МБТ были получены из супранациональной референс-лаборатории в Швеции от проф. С. Хоффнера в рамках реализации программы внешней оценки качества лабораторных исследований.
С целью изучения распространенности лекарственной устойчивости МБТ в регионах Российской Федерации были изучены 2002 клинических штамма, полученных из 24 областных и краевых противотуберкулезных диспансеров, расположенных в основных географических регионах РФ. Культуры МБТ были собраны по мере их получения в региональной лаборатории по случайной выборке в объеме 60—100 штаммов в зависимости от размеров обслуживаемого региона, исходя из принципа 1 пациент — 1 культура. При этом 70% или основная часть культур МБТ принадлежали пациентам, впервые выявленным, леченным не более 1 мес.
В исследовании были отражены все основные федеральные округа РФ: Северо-Восток (Мурманск, Псков, Калининград) — 281 культура; Центральный федеральный округ (Москва, Брянск, Калуга, Владимир, Рязань, Смоленск, Воронеж, Ярославль) — 534 культуры; Поволжье (Нижний Новгород, Саратов, Самара, Волгоград) — 354 культуры; Южный федеральный округ (Ростов, Ставропольский и Краснодарский края) — 339 штаммов: Урал, Сибирь и Дальний Восток (Екатеринбург, Кемерово, Новосибирск, Иркутск, Красноярск, Якутск) — 494 культуры.
Основная часть культур клинических штаммов МБТ была получена при культивировании на среде Левенштейна-Йенсепа, и лекарственная чувствительность к рифампицину и изониазиду изучена стандартным методом абсолютных концентраций с определением роста микобактерий при критической концентрации 40 и 1 мкг/мл соответственно.
Определение лекарственной чувствительности 100 случайно выбранных культур МБТ методом пропорций проводили на агаре Миддлбрука 7H10 ("Difco") с критическими концентрациями рифампицина (3 мкг/мл) и изониазида (0,2 и 1 мкг/мл). Культуру считали устойчивой к препарату, если число МБТ, выросших на среде с препаратом, было выше 1%.
Пробоподготовка образцов и экстракция ДНК. Образцы ДНК выделяли из культур МБТ и образцов мокроты с помощью модифицированного метода R. Boom и соавт. [8] с использованием кремниевых частиц с магнитным ядром.
К полученному объему осадков (образцы мокроты) или суспензии клеток МБТ добавляли 2 объема 6 М раствора гуанидина тиоцианата и инкубировали при встряхивании 10 мин. Затем центрифугировали на микроцентрифуге при 12 000 об/мин в течение 3 мин. В супернатапт вносили 50 мкл магнитных кремниевых микрочастиц в концентрации 10 мг/мл. Инкубировали с микрочастицами при легком встряхивании в течение 15—20 мин. Частицы осаждали и отмывали дважды в 2,5 М растворе гуанидина тиоцианата с использованием специального магнитного штатива. Затем микрочастицы дважды отмывали в 70% растворе этанола и подсушивали при 60°С.
Элюировали ДНК с поверхности частиц 80 мкл дистиллированной воды при 60°С в течение 10 мин. Собирали водные растворы образцов ДНК и хранили при -20°С до использования.
Определение мутаций в генах rpoB, katG и inliA проводили с помощью модифицированной аллель- специфичной ПЦР-РВ. Амилифицировали фрагменты ДНК указанных выше генов: 195 п. н. для гроВ; 217 и 248 п. н. для katG и inliA соответственно. Фрагменты включали участки с известными мутациями, ассоциированными с лекарственной устойчивостью. Система праймеров и флюорогенных зондов для проведения ПЦР-РВ с определением мутаций в этих генах описана в нашей статье, направленной в печать.
Принцип метода состоит в использовании наряду с линейным флюорогенным ДНК-зондом (TaqMan) [17], детектирующим наличие ДНК МБТ, системы из 3 специальным образом сконструированных аллель-специфичных праймеров, меченных различными флюоресцентными метками на 5'-конце, комплементарных олигонуклеотиду, содержащему гаситель флюоресценции на 3'- конце. При отсутствии мутации в реакции срабатывают немеченные праймеры и линейный флюо- рогенный TaqMan-зонд. При наличии одной из мутаций в анализируемом фрагменте соответствующего гена встраивается аллель-специфичный праймер с освобождением гасителя, в результате чего фиксируется рост флюоресценции соответствующей метки, что регистрируется в соответствующем окне измерения флюоресценции. Таким образом, в одной пробирке наблюдается до 3 точек мутации.
Амплификацию проводили по программе: 10 мин — 94°С; 50 циклов:20 с — 94°С, 50 с — 58°С (гроВ) или 62°С (katG, inhA) с помощью прибора АНК-32 (Институт аналитического приборостроения, Санкт-Петербург), обладающего возможностью измерения флюоресценции в 4 различных каналах.
1. Разработан новый молекулярно-генетический метод быстрого определения лекарственной устойчивости МБТ в клинических штаммах и образцах мокроты на основе мультиплексной аллельспеци- фической ПЦР-РВ; метод отличается относительной технологической простотой и по предварительным расчетам не превышает стоимость традиционного определения лекарственной чувствительности МБТ.
2. Совпадаемость результатов ПЦР-анализа и культурального микробиологического исследования 1092 клинических штаммов, анализированных в 11 региональных лабораториях, в среднем составила 94%; совпадаемость результатов повторного тестирования в независимой лаборатории случайно избранных 100 штаммов МБТ культуральным методом пропорций составила 99% для изониазида и 100% для рифампицина.
3.При анализе распространения лекарственной устойчивости к рифампицину и изониазиду в 24 субъектах различных географических зон РФ установлен в среднем очень высокий уровень распространения штаммов МБТ с МЛУ среди впервые выявленных больных туберкулезом — 21,9%. Кроме того, у 13% больных этой группы установлены также лекарственная устойчивость к изониазиду. Моноустойчивость к рифампицину обнаружена лишь у 3,5% штаммов МБТ с лекарственной устойчивостью. В штаммах, полученных от больных, ранее леченных, либо от пациентов с хроническим течением туберкулеза, МЛУ установлена в 58,5% случаев, устойчивость только к изониазиду — в 19,8% случаев. Лишь в 2 территориях (Москва и Волгоград) уровень МЛУ среди вновь выявленных пациентов был относительно невысоким — 6,6 и 7,7% соответственно.
1. Балабанова Я. М., Рэдди М., Грэмм К. и др. Анализ факторов риска возникновения лекарственной устойчивости у больных туберкулезом гражданского и пенитенциарного секторов в Самарской области // Пробл. туб. — 2005. — № 5. —С. 25-3.
2. Михайлович В- М., Лапа С. А., Грядупов Д. А. и др. Использование методов гибридизации и ПЦР на специализированном ТБ-микробиочипе для обнаружения рифампицин- резистентных штаммов Mycobacterium tuberculosis // Бюл. экспер. биол. — 2001. — Т. 131, № 1. — С. 112—117.
3.Поляков А. Е., Сафонова С. Г., Скотпикова О. И. Определение множественной лекарственной устойчивости М. tuber culosis различными методами jI Пробл. туб. — 2006. — № 6.- С. 40-42.
4. Скотникова О. И., Носова Е. Ю., Галкина К. Ю. Определение множественной лекарственной устойчивости М. tuberculosis молекулярно-биологическими методами: Метод, рекомендации // Пробл. туб. — 2006. — № 7. — С. 57—60.
5. Фирсова В. А., Полуэктова Ф. Г., Кузьмин А. В., Черноусова Л. Н. Роль метода биологических микрочипов в определении устойчивости микобактерий туберкулеза к рифампицину у подростков с активным туберкулезом легких // Пробл. туб. - 2006. - № 8. - С. 28-30.
6. Bang D., Bengard Andersen A., Thomsen V. О. Rapid genotypic detection of rifampin- and izoniazid-resistant Mycobacterium tuberculosis directly in clinical specimens // J. Clin. Microbiol.- 2006. - Vol. 44, N 7. - P. 2605-2608.
7. Boom R., Sol C. A., Salimans М. M. et al. Rapid and simple method for purification of nucleic acids j I J. Clin. Microbiol. — 1990. - Vol. 28. - P. 495-503.
8. Brossier P., Veziris N., Truffot-Pernot C. et al. Perfomance of the genotype MTBDR line probe assay for detection of resistance to rifampin and isoniazid in strains of Mycobacterium tuberculosis with low- and high-level resistance // J. Clin. Microbiol. — 2006. - Vol. 44, N 10. - P. 3659-3664.
9. Caoili J. C., Mayorova A., Sikes D. et al. Evaluation of the TB- Biochip oligonucleotide microarray system for rapid detection of rifampin resistance in Mycobacterium tuberculosis // J. Clin. Microbiol. - 2006. - Vol. 44, N 7. - P. 2378-2381.
10. Espasa, Gonzalez-Martin Julian, Alcaide Fernando et al. Direct detection in clinical samples of multiple gene mutations causing resistance of Mycobacterium tuberculosis to isoniazid and ri- fampicin using fluorogenic probes // J. Antimicrob. Chemother.- 2005. - Vol. 55, N 6. - P. 860-865.
11. Garcia de Viedma D., del Sol Diaz Inf antes М., Lasala F. et al. New real-time PCR able to detect in a single tube multiple rifampin resistance mutations and high-level isoniazid resistance mutations in Mycobacterium tuberculosis // J. Clin. Microbiol.- 2002. - Vol. 40. - P. 988-995.
12. Herrera-Leon Laura, Molina Tamara, Saiz Pilar et al. New Multiplex PCR for rapid detection of isoniazid-resistant Mycobacterium tuberculosis clinical isolates // Antimicrob. Agents Chemother. - 2005. - Vol. 49, N 1. - P. 144-147.
13. Jureen P., Engstrand L., Eriksson S. et al. Rapid detection of rifampin resistance in Mycobacterium tuberculosis by Pyrose- quencing technology // J. Clin. Microbiol. — 2006. — Vol. 44, N 6. - P. 1925-1929.
14. Mokrousov I., Otten Т., Vyazovaya A. et al. PCR-bascd methodology for detecting multidrug-resistant strains of Mycobacterium tuberculosis Beijing family circulating in Russia // Eur. J. Clin. Microbiol. Infect. Dis. — 2003. — Vol. 22. — P. 342—348.
15. Parashar D., Chauhan D. S., Sharma V. D., Katoch V. M. Applications of real-time PCR technology to mycobacterial research I I Indian J. Med. Res. — 2006. — Vol. 124. — P. 385— 398.
16. Ramaswamy S., MusserJ. M. Molecular genetic basis of antimicrobial agent resistance in Mycobacterium tuberculosis: 1998 update //Tuberc. Lung Dis. — 1998. — Vol. 79, N 1. — P. 23— 29.
17. Ruiz М., Torres M. J., Llanos A. C. et al. Direct detection of rifampin- and isoniazid-resistant Mycobacterium tiberculosis in auramine-rhodamine-positive sputum specimens by real-time PCR // J. Clin. Microbiol. — 2004. — Vol. 42. — N 4. — P. 1585-1589
18. Augustynowicz-Kope Ewa, Sekiguchi Jun-ichiro, Miyoshi-Akiyama Tohru et al. Detection of multidrug resistance in Mycobacterium tuberculosis // J. Clin. Microbiol. — 2007. — Vol. 45, N 1. — P. 179-192.
19. Torres M. J., Criado A., Palomares J. C., Aznar J. Use of realtime PCR and fluorimetry for rapid detection of rifampin and isoniazid resistance-associated mutations in Mycobacterium tuberculosis//J. Clin. Microbiol. — 2000. — Vol. 38. — P. 3194— 3199.
20. van Doom H. R., de Haas P. E., Kremer K. et al. Public health impact of isoniazid-resistant Mycobacterium tuberculosis strains with a mutation at amino-acid position 315 of katG: a decade of experience in The Netherlands // Clin. Microbiol. Infect. — 2006, - Vol. 12, N 8. - P. 769-775.
21. Mycobacterium tuberculosis // J. Clin. Microbiol. — 2007. — Vol. 45, N 1. - P. 179-192.
22. World Health Organization. Anti-tuberculosis drug resistance in the world. Report N 3. (WHO/CTS/TB/2004). — Geneva, 2004.
23. Yesilkaya Hasan, Meaca Francesca, Niemann Stefan et al. Eval- H uation of molecular-beacon, TaqMan, and fluorescence resonance energy transfer probes for detection of antibiotic resistance-conferring single nucleotide polymorphisms in mixed Mycobacterium tuberculosis DNA extracts //J. Clin. Microbiol. — 2006. - Vol. 44, N 10. - P. 3826-3829.
М. А. Владимирский, Ю. С. Аляпкина, Д. А. Варламов. Я. И. Алексеев, Л. К. Шипина, М. В. Шульгина, Л. В. Домотенко, К. Р. Быкадорова, Н. Н. Гащенко, Л. Б. Ендоурова, О. В. Иванова, Е. А. Ильина, О. А. Левкова, Т. В. Маркова, В. П. Наземцева, Е. П. Павлова, А. И. Полозов, Н. В. Шишкино. — ПРИМЕНЕНИЕ МЕТОДА ПЦР В РЕАЛЬНОМ ВРЕМЕНИ ДЛЯ ОПРЕДЕЛЕНИЯ И КОНТРОЛЯ ЗА РАСПРОСТРАНЕНИЕМ ЛЕКАРСТВЕННО-УСТОЙЧИВЫХ ШТАММОВ МИКОБАКТЕРИЙ ТУБЕРКУЛЕЗА
С помощью технологии ПЦР-РВ разработан одностадийный метод молекулярно-генетического анализа ДНК МБТ для определения мутаций, ассоциированных с лекарственной устойчивостью к противотуберкулезным препаратам: изониазиду и рифампицину. С целью анализа распространенности лекарственной устойчивости возбудителя туберкулеза в России проведено исследование 2000 штаммов МБТ в 24 регионах из всех федеральных округов. При исследовании 1406 штаммов МБТ, выделяемых впервые диагностированными, нелечеными пациентами, МЛУ выявлена в 21,9% случаев. У ранее лечившихся больных туберкулезом МЛУ констатирована в 58,5% случаев. Совпадаемость молекулярно-генетического анализа лекарственной устойчивости с результатами культуральных исследований при анализе 1096 штаммов составила 94%.
Читайте также:


