Серологический метод исследования на туберкулез
Универсальный альтернативный вариант иммунологического исследования in vitro диагностики туберкулезного процесса путем количественного определения мононуклеарных клеток периферической крови, продуцирующих ИФН-γ в ответ на присутствие белков CFP-10 и ESAT-6 M. tuberculosis.
Иммунологический тест на туберкулез
Синонимы английские
Testing for tuberculosis infection
Прямая оценка функции T-клеток энзим-связывающий иммуноспотингом (ELISPOT).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 2-3 часов до исследования, можно пить чистую негазированную воду.
Общая информация об исследовании
Возбудителем туберкулёза является микобактерия туберкулеза (МБТ, палочка Коха, Mycobacterium tuberculosis) – высокоустойчивый микроорганизм. В настоящее время описано около 150 видов микобактерий, но клинически значимыми признаны М. tuberculosis (более 90 % всех случаев туберкулезной инфекции), М. bovis (5 %) и М. africanum (около 3 % – главным образом среди населения стран тропической Африки).
Источником инфекции являются больные люди и животные. Наиболее распространен воздушно-капельный путь заражения, при котором возбудитель проникает в организм через верхние дыхательные пути, иногда через слизистые оболочки пищеварительного тракта или через поврежденную кожу.
Попадая в окружающую среду, возбудитель способен длительно сохраняться: в высохшей мокроте он выживают до 10 месяцев, на предметах, окружающих больного (белье, книги), – более 3 месяцев, в воде – более года, в почве – до 6 месяцев.
В настоящее время описаны следующие варианты развития ситуации после проникновения МБТ в организм человека: [1]
- полная элиминация (удаление) возбудителя из организма;
- развитие первичного туберкулеза (при быстром росте и размножении МБТ);
- инфицирование, или "латентная туберкулезная инфекция" (ЛТИ), [2] – состояние стойкого иммунного ответа на антигены МБТ при отсутствии клинических проявлений активной формы туберкулеза.
Присутствующий в организме возбудитель способен не только длительно бессимптомно персистировать в организме, но при определенных обстоятельствах (интенсивное размножение МБТ на фоне малоэффективного иммунитета и т.д.) реактивироваться и вызвать развитие заболевания. В настоящее время установлено, что с момента инфицирования МБТ в течение первого года заболевание развивается у 5 % инфицированных людей, в течение всей оставшейся жизни туберкулез развивается еще у 5 %, то есть пожизненный риск заболевания туберкулезом среди инфицированных составляет 10 %.
Вместе с тем наличие различных факторов может способствовать повышению риска развития локального туберкулеза: так, при ВИЧ-инфицировании ежегодный риск заболевания туберкулезом на фоне ЛТИ составляет 10 %, а пожизненный риск – 50 %.
Диагностика туберкулеза является комплексной и включает, согласно регламентирующим документам, [3] аллергические внутрикожные пробы (реакция Манту и "Диаскинтест"), инструментальное обследование (ФЛГ, рентген) и лабораторные – направленные как на выявление и идентификацию возбудителя с определением спектра его чувствительности к препаратам этиотропной терапии, так и на изучение выраженности иммунологической реакции на патоген.
Одним из современных и высокоинформативных методов определения специфической иммунной реакции на МБТ, особенно при отсутствии или минимальных клинико-инструментальных признаках инфекции и сомнительных результатах общепринятых методов лабораторной диагностики туберкулеза, является тест T-SPOT.
Исследование иммунного Т-клеточно-опосредованного ответа: количественное определение в крови эффекторных Т-клеток (CD4 и CD8), вырабатывающих ИФН-ɣ (гамма-интерферон), который продуцируется в ответ на стимуляцию специально подобранными антигенами ESAT-6 и CFP10. Эти белки входят в состав клинически значимых МБТ (М. tuberculosis, М. bovis, М. africanum) и отсутствуют у бактерий, используемых при производстве вакцины БЦЖ и у непатогенных для человека микобактерий.
Преимущества теста Т- SPOT:
- высокая специфичность и чувствительность метода (87-97 %);
- безопасность, отсутствие побочных реакций;
- отсутствие ложноположительных результатов;
- результат исследования не зависит от наличия вакцинации БЦЖ;
- не имеет противопоказаний и ограничений по времени проведения;
- позволяет диагностировать внелегочные формы туберкулеза;
- позволяет диагностировать инфекцию у пациентов с ВИЧ и низкими показателями уровня CD4. [4]
Для чего используется исследование?
- Диагностика туберкулезной инфекции.
Когда назначается исследование?
- Пациентам, у которых в связи с основным заболеванием (эпилепсия, хронические заболевания в стадии обострения и др.) затруднено проведение внутрикожных тестов.
- При наличии в анамнезе пациента токсико-аллергических реакций на туберкулин.
- Детям, привитым БЦЖ, у которых выявлена ложноположительная реакция Манту, – до проведения инструментального обследования легких. [5]
- По эпидемиологическим показаниям – пациентам, прибывшим из стран с высоким уровнем заболеваемости туберкулезом (Африка, Азия) и/или находившимся в контакте с лицами с диагностированным заболеванием.
- Пациентам с аутоиммунными и др. заболеваниями (силикоз), ведущими к снижению системного иммунитета.
- Пациентам, получающим системное лечение глюкокортикоидами или иммуносупрессивную терапию.
- Онкологическим пациентам, получающим лучевую и химиотерапию.
- Пациентам на диализе или готовящимся к трансплантации органов или переливанию крови.
- ВИЧ-инфицированным, особенно со снижением количества СD4-клеток.
- При подозрении на внелегочные формы туберкулеза.

Самый распространенный метод, с помощью которого проводится проверка на туберкулез, — реакция Манту.

Флюорография — метод скринингового обследования, позволяющий выявить туберкулез на ранней стадии.

Анализ крови и мочи на микобактерии туберкулеза позволяет выявить патологию, когда реакция Манту неточная.

Микроскопия мазка подразумевает поиск возбудителя туберкулеза в отделяемой при кашле жидкости — мокроте.
Метод ИФА подходит в качестве уточняющего шага, а также для диагностики скрыто протекающего и внелегочного туберкулеза.

Метод ПЦР позволяет обнаружить туберкулез даже тогда, когда все другие методики показывают отрицательный результат.

Спецпредложения, скидки и акции помогут существенно сэкономить на медицинском обследовании.
Эксперты констатируют: туберкулез в России — больше, чем просто болезнь. Это — неприятное социальное клеймо, которое, помимо физических страданий, становится для заболевшего человека источником серьезного психологического дискомфорта, а иногда и вынуждает на долгие месяцы и годы отказаться от привычного образа жизни, карьеры и планов на будущее.
Лечение туберкулеза — процесс сложный и длительный, а успех во многом определяется тем, насколько своевременно было выявлено заболевание. С учетом того, что никто из нас не застрахован от заражения, крайне важно регулярно проходить профилактическое скрининговое обследование, а при малейших подозрениях на недуг — обращаться к уточняющим анализам. Лишь такое ответственное поведение убережет вас от беды.
Когда сдать анализы на туберкулез и почему не стоит с этим медлить
По мнению обывателей, туберкулезом страдают лишь неблагополучные люди, проживающие на грани нищеты, а также выходцы из мест лишения свободы. Однако такой взгляд, как отмечают врачи, не имеет ничего общего с реальностью. Пациентами фтизиатров нередко становятся и учителя, и бизнесмены, и чиновники, и даже сами доктора. Ведь ключевой фактор, приводящий к развитию заболевания, — это отнюдь не финансовое благополучие, а состояние иммунитета. Если по каким-то причинам (стресс, сопутствующее заболевание, беременность, перенесенная операция, погрешности в питании) организм ослаблен — туберкулезная палочка не упустит шанса для атаки.
Болезнь развивается постепенно, начинаясь в лимфатических узлах, а затем распространяясь по органам и тканям организма. Чаще туберкулез поражает легкие, однако в некоторых случаях, а также при отсутствии лечения бактерии размножаются в пищеварительном тракте, органах мочеполовой системы, костях, коже, оболочках головного и спинного мозга и даже в глазах.
Коварная особенность возбудителя заболевания — микобактерии туберкулеза — умение быстро приобретать устойчивость к антибактериальным препаратам, без которых невозможно успешное лечение. Ученые вынуждены разрабатывать все новые и новые лекарства, что в конечном итоге делает терапию дорогой, а также приводит к неизбежным побочным эффектам, таким как поражение печени. Поэтому важным этапом диагностики туберкулеза является определение чувствительности выявленного возбудителя к различным антибиотикам, это помогает врачам подобрать эффективное лечение.
В силу широкого распространения туберкулеза в нашей стране (70% от общего числа российских больных инфекционными и паразитарными заболеваниями умирают именно из-за такого диагноза) выявление зараженных микобактериями среди детей и взрослых организовано достаточно хорошо.
Так, детям и подросткам до 18-ти лет время от времени проводят туберкулиновые пробы, знакомые нам всем как реакция Манту. После достижения совершеннолетия основным методом диагностики становится флюорография, которую каждый гражданин РФ обязан проходить раз в два года, а определенные категории людей — каждый год. Без такого рентгеновского снимка вас, скорее всего, не допустят к работе: результаты флюорографии необходимо предъявлять при трудоустройстве, а в дальнейшем — повторять процедуру в ходе регулярных медосмотров. Таким образом медики стараются минимизировать количество больных туберкулезом, которые не получают лечение и заражают окружающих.
Помимо этих правил, провериться на туберкулез нужно в случаях, если у вас появились симптомы, указывающие на вероятность развития заболевания (слабость, ночное потоотделение, необъяснимая потеря веса, небольшое повышение температуры по вечерам, увеличение лимфоузлов, хронический кашель). Иногда догадка о возможной причине такого недомогания возникает у врача, но вы и сами можете пройти обследование и сдать анализы, чтобы исключить вероятность инфекции.
Выявить туберкулез можно несколькими путями. Основной задачей диагностики в детском возрасте является определение самого факта инфицирования, ведь в этот период вероятность, что бактерия, попавшая в организм, сразу вызовет патологический процесс, значительно выше, чем у взрослых. По этой причине ведущей методикой первичного скрининга остается туберкулиновая проба.
Оценить признаки поражения легких — наиболее типичное клиническое свидетельство начала заболевания — позволяет флюорография. В случае сомнений для уточняющей диагностики врач назначит рентген — развернутую визуализацию легочной ткани.
Туберкулин — это смесь белков, выделенных из погибших возбудителей туберкулеза. Введение небольшого количества такого препарата под кожу вызывает реакцию иммунитета у всех людей, однако в зависимости от состояния их здоровья она проявится по-разному. Так, у пациентов, в организме которых отсутствует микобактерия туберкулеза, через двое суток после пробы останется лишь незначительный след от укола (или его не будет вовсе). Если же размер красной отметины в месте введения туберкулина больше сантиметра или в этой области на коже появился гнойник — высока вероятность, что человек заражен.
Напомним, реакция Манту — метод первичной диагностики, он не может со 100%-ной вероятностью ответить на вопрос, болен ли человек туберкулезом, но позволяет выделить группу риска, которой предстоит пройти дополнительные обследования.
Поскольку степень инфицирования населения в России микобактериями туберкулеза очень высока, у лиц старше 18-ти лет врачи по умолчанию допускают контакт с инфекцией. Задачей становится поиск больных со скрыто протекающей инфекцией, которые не знают о своем состоянии.
- Флюорография
Оптимальным методом массовой диагностики в этом случае была и остается флюорография. Это — фотоснимок экрана рентгеновского аппарата, который можно получить очень быстро, не подвергая при этом человека значительной лучевой нагрузке. Поэтому кабинеты флюорографии есть практически во всех населенных пунктах нашей страны, а пройти процедуру можно за считанные минуты. - Рентген и КТ
В случае если человек не предъявляет никаких жалоб на самочувствие, а флюорография не выявила признаков изменения легочной ткани, врачи делают заключение, что туберкулеза у пациента нет. Но для более тщательной проверки легких может быть назначено развернутое рентгенографическое исследование (когда снимки делаются не только в прямой, но и в боковой проекции, а специалист лучевой диагностики тщательно изучает каждый сантиметр изображения), а также компьютерная томография (КТ), позволяющая с наибольшей степенью достоверности выявить визуальные признаки туберкулеза и оценить степень распространения патологического процесса.
Некоторые из лабораторных анализов, назначаемых при подозрении на туберкулез, являются специфическими — они проводятся только при этом заболевании. Другие же вы можете пройти в рамках общего медицинского осмотра: это ценный источник информации о вашем состоянии здоровья, который способен указать на наличие инфекционного процесса.
- Общий анализ крови/мочи является диагностическим стандартом при самых разных патологиях. В случае с туберкулезом исследование крови покажет повышение уровня лейкоцитов (сдвиг лейкоцитарной формулы влево) и ускоренную скорость оседания эритроцитов (СОЭ). Изменения в анализе мочи будут наблюдаться при поражении микобактериями почек и мочевыводящих путей — в этом случае в образце обнаружатся признаки амилоидоза.
- Микроскопия мазка подразумевает поиск возбудителя туберкулеза в отделяемой при кашле жидкости — мокроте. Пациенты с подозрением на заболевание особым образом собирают мокроту в стерильную банку, после чего доставляют анализ в лабораторию. Там частицы мокроты переносят на предметное стекло и окрашивают методом по Цилю-Нильсену (при этом микобактерии туберкулеза приобретают хорошо различимый под микроскопом красный цвет, а большинство остальных микроорганизмов — синий).
- Классический культуральный метод. Если в ходе микроскопии лаборант выявил в мокроте микобактерии в достаточном количестве (более 5-ти в поле зрения), то следующим этапом лабораторной диагностики туберкулеза становится бактериологический посев образца в питательную среду. Будучи помещенными в оптимальные температурные условия, микроорганизмы быстро растут, что позволяет уточнить их вид и провести оценку чувствительности к различным типам антибиотиков.
- ИФА (метод иммуноферментного анализа) обнаруживает в крови у пациента антитела к туберкулезу, что указывает на инфицированность (но не обязательно на заболевание). Данный метод подходит в качестве уточняющего шага, а также для диагностики скрыто протекающего и внелегочного туберкулеза.
- ПЦР (метод полимеразной цепной реакции) выявляет ДНК микобактерий в различных средах — в сыворотке крови, моче, мокроте, спинномозговой жидкости и так далее. Это крайне точный метод, который с достоверностью в 100% может дать ответ на вопрос о том, присутствует ли возбудитель в конкретном органе человека. Чувствительность ПЦР так высока, что в некоторых случаях этот анализ позволяет обнаружить туберкулез даже тогда, когда все другие методики показывают отрицательный результат.
- Гистологические анализы (биопсия) подразумевают изъятие маленького фрагмента ткани из тела пациента с целью его обстоятельного микроскопического изучения. Биопсия является важным методом диагностики, особенно в ситуациях, когда исследовать биологические жидкости при помощи других анализов не представляется возможным (например, в случае вялотекущего туберкулеза костей).
Как правило, если вы или ваши дети проходите стандартный медицинский осмотр, диагностикой туберкулеза занимаются государственные медицинские организации — поликлиники и центры здоровья. Однако иногда имеет смысл обратиться в частную лабораторию.
Туберкулез – широко распространенное инфекционное заболевание человека и жи-вотных, вызываемое микобактериями туберкулезного комплекса (Mycobacterium tubercu-losis complex – MTBC). От больных туберкулезом животных могут заражаться люди, для них наиболее опасны Mycobacterium bovis (микобактерии туберкулеза бычьего). От лю-дей, больных туберкулезом, микобактериями туберкулеза человека – Mycobacterium tu-berculosis может заражаться крупный рогатый скот. Диагноз на туберкулез у крупного ро-гатого скота ставят на основании результатов аллергических, патолого-анатомических, гистологических и бактериологических исследований с учетом эпизоотологических данных и клинических признаков.
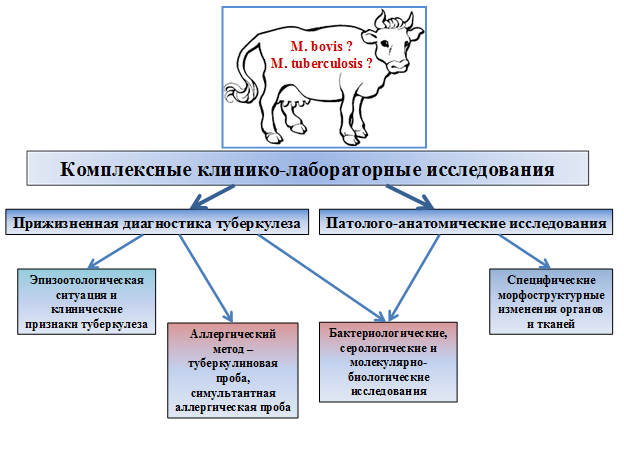
Рис. 1. Схема комплексных исследований крупного рогатого скота на туберкулез
Прижизненная диагностика туберкулеза у крупного рогатого скота проводится аллергическим методом.
Аллергический метод – внутрикожная туберкулиновая проба с применением Пурифиед Протеин Дериватив – туберкулина (ППД-туберкулин) для млекопитающих. Туберкулин вводят крупному рогатому скоту в середину шеи (рис. 2). Учет и оценку реакции на введение туберкулина проводят через 72 часа. Животных считают положительно реагирующими на туберкулин при утолщении кожной складки на 3 мм и более. Толщину кожной складки в месте введения туберкулина измеряют кутиметром, а полученный показатель сравнивают с толщиной кожной складки рядом с местом введения препарата [3, 4].

Рис. 2. Туберкулиновая проба у крупного рогатого скота [6]
Для дифференциации парааллергических реакций у крупного рогатого скота используется симультанная проба с одновременным применением двух туберкулинов – для млекопитающих и для птиц или туберкулина для млекопитающих и комплексного аллергена из атипичных микобактерий (КАМ).
Симультанная проба проводится в том же порядке, что и туберкулиновая (рис. 3). Проба является групповой и дает возможность оценить ситуацию по туберкулезу лишь в целом по стаду или по группе (не менее 6 голов) обследуемых животных. Под достоверностью различия понимают такое различие в величине показателей интенсивности реакций на туберкулин и КАМ, которое дает возможность с уверенностью не менее чем на 95 % сделать заключение о состоянии по туберкулезу обследуемой группы животных [3].
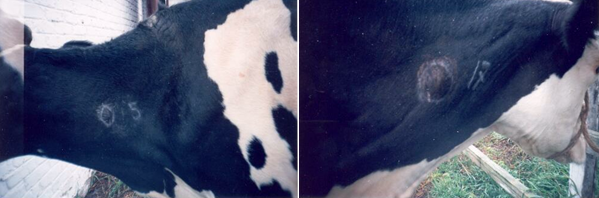
Рис. 3. Симультанная аллергическая проба с использованием ППД-туберкулина и комплексного аллергена из атипичных микобактерий [11]
Офтальмопроба на туберкулез (глазной метод туберкулинизации).
Туберкулин в количестве 3–5 капель наносится на конъюнктиву нижнего века или на поверхность роговицы глаза животного. Проводится офтальмопроба двукратно с 5–6-дневным интервалом [2, 4, 5]. Результаты офтальмопробы оценивают через 6, 9, 12 и 24 часа после первого и через 3, 6, 9 и 12 часов после повторного введения туберкулина. Реакция считается положительной, если образуется гнойный или слизисто-гнойный секрет, который накапливается в конъюнктивальном мешке или вытекает в виде шнура из внутреннего угла глаза. Кратковременная гиперемия слизистых оболочек глаза и слезотечение с образованием небольшого количества слизистого секрета рассматриваются как отрицательная реакция [3].
Факторы, обуславливающие проявление неспецифических реак-ций на туберкулин у КРС
В многочисленных исследованиях было показано, что проявления неспецифических реакций на туберкулин у крупного рогатого скота обусловлены многочисленными факторами внешней среды и индивидуальными особенностями организма животного [2, 3, 5]. Неспецифические реакции подразделяются на две основные группы: парааллергические и псевдоаллергические (см. таблицу).
Причины возникновения неспецифических реакций у крупного рогатого скота на введение туберкулина
| Неспецифическая реакция | Фактор, обуславливающий проявление неспецифической реакции | Особенности неспецифической реакции |
|---|---|---|
| Парааллергическая | Атипичные (нетуберкулезные) виды микобактерий и их ассоциации.
Mycobacterium tuberculosis (микобактерии туберкулеза человека). Mycobacterium avium (микобактерии туберкулеза птичьего) | Непостоянство реакции на туберкулин.
Сенсибилизация организма животного сохраняется от 1 до 3 месяцев после инфицирования [5]. Выявление наибольшего количества животных с выраженными реакциями на КАМ |
| Псевдоаллергическая | Наличие гельминтов (фасциол, дикроцелий, эхинококков). Актиномикоз. Микологические поражения легких. Гнойные или гнойно-некротические процессы во внутренних органах. Нарушения обмена веществ | В благополучных по туберкулезу стадах у отдельных животных регистрируется увеличение толщины кожной складки на месте введения туберкулина на 3–4 мм, признаки воспаления отсутствуют |
Лабораторные методы диагностики туберкулеза КРС
К лабораторным методам диагностики туберкулеза относятся бакте-риологическое исследование, серологическое исследование и молеку-лярно-биологическое исследование.
Бактериологическое исследование проводится с целью выделения возбудителя туберкулеза (рис. 4).
Отбор проб биоматериалов для бактериологического исследования производят как от животных с клиническими признаками туберкулеза, так и от животных, вызывающих подозрение на туберкулез. Исследуют молоко, мокроту, мочу. От павших и убитых животных для исследования отбирают пораженные участки органов на границе со здоровой тканью и измененные лимфатические уз-лы.
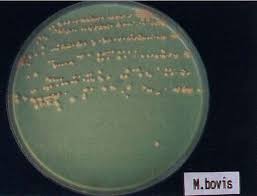
Рис. 4. Культура Mycobacterium bovis. Среда роста Гельберга [10]
При наличии характерных для туберкулеза изменений исследуются портальные, предлопаточные, надвыменные, поверхностные паховые лимфатические узлы и фрагменты внутренних органов – легких, печени, почек.
Бактериологическое исследование биоматериалов на туберкулез за-нимает срок до 3 месяцев. Заболевание животных туберкулезом считается установленным в случаях выделения микобактерий туберкулеза бычьего или человеческого из материала от убитых животных [3, 4, 8].
Серологическое исследование на туберкулез проводится в реакции связывания комплемента (РСК).
РСК применяется в двух вариантах:
1) для обнаружения в сыворотке больного животного специфических антител к возбудителю туберкулеза;
2) для выявления и идентификации в исследуемом материале антигена возбудителя туберкулеза.
Молекулярно-биологическое исследование на туберкулез.
Полимеразная цепная реакция (ПЦР) является одним из высокочувствительных и специфичных методов диагностики туберкулеза. Чувствительность метода ПЦР – от 10 до 100 микроорганизмов в пробе (чувствительность микроскопического метода – от 103 до 105 микроорганизмов). В основе метода лежит амплификация специфических участков ДНК возбудителя, которые содержатся в исследуемой пробе. В настоящее время в лабораторной практике применяются тест-системы как для выявления ДНК конкретного вида, так и для дифференцирования видов, входящих в Mycobacterium tuberculosis complex: микобактерий человеческого вида (M. tuberculosis), бычьего вида (M. bovis) и вакцинного штамма микобактерий бычьего вида (M. bovis BCG). Для проведения анализа используют следующие образцы биопроб от крупного рогатого скота: цельную кровь, молоко, фарингеальные смывы, мочу, фекалии, носовую слизь и биопсийные материалы, в том числе лимфатические узлы [3].
Молекулярно-биологическое исследование позволяет значительно ускорить раннюю диагностику туберкулеза, дифференцировать пара- и псевдоаллергические реакции на туберкулин, снизить количество подозреваемых в заражении туберкулезом и подвергаемых диагностическому убою животных [4, 5].
Патолого-анатомические исследования
Для убоя с диагностической целью отбирают животных по результатам вышеизложенных методов исследования.
Патолого-анатомические изменения в организме больного туберкулезом животного зависят как от его возраста, так и от стадии инфекционного процесса.
В начальных стадиях инфекционного процесса туберкулы имеют вид серых полупрозрачных узелков размером от булавочной головки до чечевичного зерна. Затем они становятся мутными, приобретают бело-желтый цвет, заполняются некротизированной сухой творожистой массой. В легких туберкулезные очаги поражения чаще выделяются над плеврой по тупому краю органа (рис. 5).
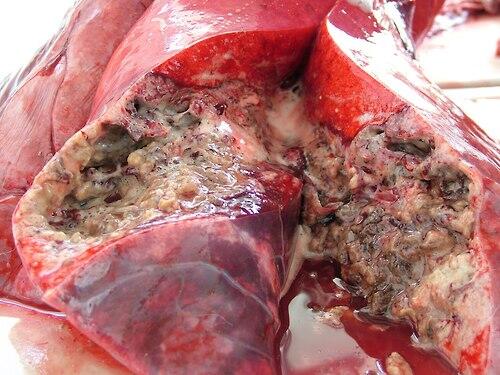
Рис. 5. Легкое крупного рогатого скота при туберкулезном поражении тканей [9]
Гистологические исследования проводят для дифференциации туберкулезных патолого-анатомических изменений от сходных изменений, наблюдаемых при других заболеваниях, например для дифференциации от гранулем паразитарного и микотического происхождения. В положительных случаях в гистологических препаратах, окрашенных по Цилю – Нильсену, находят гранулемы с некротизированным центром, окруженные зоной эпителоидных, отдельных гигантских лимфоидных клеток и соединительно-тканной капсулой.
Вместо заключения
Осуществление плановых профилактических диагностических иссле-дований на туберкулез способствует снижению риска инфицирования людей туберкулезом, ограничению распространения возбудителя из очагов инфекции, раннему выявлению неблагополучных по туберкулезу населенных пунктов.
Диагностика инфекционных заболеваний является одной из самых сложных проблем в клинической медицине. Лабораторные методы исследования при ряде нозологических форм играют ведущую, а в целом ряде клинических ситуаций решающую роль не только в диагностике, но и в определении конечного исхода заболевания.
Диагностика инфекционных заболеваний почти всегда предусматривает использование комплекса лабораторных методов.

- бактериологические;
- серологические;
- метод полимеразной цепной реакции (ПЦР) для обнаружения ДНК или РНК возбудителя инфекционного заболевания в исследуемом материале.
У одних пациентов для диагностики этиологии инфекционно-воспалительного процесса достаточно провести бактериологическое исследование, в других клинических ситуациях решающее значение имеют данные серологических исследований, в третьих, предоставить полезную информацию может только метод ПЦР. Однако наиболее часто в клинической практике врачу-клиницисту необходимо использовать данные различных методов лабораторных исследований.
Бактериологические методы исследования
Бактериологические исследования наиболее часто проводят при подозрении на гнойно-воспалительные заболевания (составляют 40-60% в структуре хирургических заболеваний) с целью их диагностики, изучения этиологической структуры, определения чувствительности возбудителей к антибактериальным препаратам. Результаты бактериологических анализов способствуют выбору наиболее эффективного препарата для антибактериальной терапии, своевременному проведению мероприятий для профилактики внутрибольничных инфекций.
Возбудителями гнойно-воспалительных заболеваний являются истинно-патогенные бактерии, но наиболее часто условно-патогенные микроорганизмы, входящие в состав естественной микрофлоры человека или попадающие в организм извне. Истинно-патогенные бактерии в большинстве случаев способствуют развитию инфекционного заболевания у любого здорового человека. Условно-патогенные микроорганизмы вызывают заболевания преимущественно у людей с нарушенным иммунитетом.
Бактериологические исследования при заболеваниях, вызываемых условно-патогенными микроорганизмами, направлены на выделение всех микроорганизмов, находящихся в патологическом материале, что существенно отличает их от аналогичных исследований при заболеваниях, вызванных истинно патогенными микроорганизмами, когда проводится поиск определенного возбудителя.
Для получения адекватных результатов бактериологического исследования при гнойно-воспалительных заболеваниях особенно важно соблюдать ряд требований при взятии биоматериала для анализа, его транспортировки в лабораторию, проведения исследования и оценки его результатов.
Для идентификации вида возбудителя гнойно-воспалительных заболеваний и определения чувствительности к антибактериальным препаратам бактериологические лаборатории используют комплекс методов. Они включают:
- микроскопическое исследование мазка (бактериоскопия) из доставленного биоматериала;
- выращивание культуры микроорганизмов (культивирование);
- идентификацию бактерий;
- определение чувствительности к антимикробным препаратам и оценку результатов исследования.
Доставленный в бактериологическую лабораторию биоматериал первоначально подвергается микроскопическому исследованию.
Микроскопическое исследование мазка (бактериоскопия), окрашенного по Граму или другими красителями, проводят при исследовании мокроты, гноя, отделяемого из ран, слизистых оболочек (мазок из цервикального канала, зева, носа, глаза и т.д.). Результаты микроскопии позволяют ориентировочно судить о характере микрофлоры, ее количественном содержании и соотношении различных видом микроорганизмов в биологическом материале, а также дает предварительную информации об обнаружении этиологически значимого инфекционного агента в данном биоматериале, что позволяет врачу сразу начать лечение (эмпирическое). Иногда микроскопия позволяет выявить микроорганизмы, плохо растущие на питательных средах. На основании данных микроскопии проводят выбор питательных сред для выращивания микробов, обнаруженных в мазке.
Культивирование микроорганизмов. Посев исследуемого биоматериала на питательные среды производят с целью выделения чистых культур микроорганизмов, установления их вида и определения чувствительности к антибактериальным препаратам. Для этих целей используют различные питательные среды, позволяющие выделить наибольшее количество видов микроорганизмов. Оптимальными являются питательные среды, содержащие кровь животного или человека, а также сахарный бульон, среды для анаэробов. Одновременно производят посев на дифференциально-диагностические и селективные (предназначенные для определенного вида микроорганизмов) среды. Посев осуществляют на стерильные чашки Петри, в которые предварительно заливают питательную среду для роста микроорганизмов.

Микроскопия мазков, окрашенных по Граму
1 - стрептококки; 2 - стафилококки; 3 - диплобактерии Фридленда; 4 - пневмококки
Чашки Петри с посевами инкубируют в термостате при определенных температурных, а для ряда микроорганизмов газовых (например, для выращивания анаэробов создают условия с низким содержанием кислорода) режимах в течение 18-24 ч. Затем чашки Петри просматривают. Количественную обсемененность доставленного биоматериала микрофлорой определяют по числу колониеобразующих единиц (КОЕ) в 1 мл или 1 мг исследуемого образца. При просмотре чашек Петри выявляют некоторые особенности изменения цвета среды, ее просветления в процессе роста культуры. Многие группы бактерий образуют характерные формы колоний, выделяют пигменты, которые окрашивают колонии или среду вокруг них. Из каждой колонии делают мазки, окрашивают по Граму и микроскопируют. Оценивают однородность бактерий, форму и размер, наличие спор или других включений, капсулы, расположение бактерий, отношение к окраске по Граму. Вся эта информация служит важнейшей составляющей для выбора сред и получения в дальнейшем чистой культуры каждого микроорганизма.
Колонии отсевают на плотные, жидкие, полужидкие питательные среды, оптимальные для культивирования определенного вида бактерий.
Выделенные чистые культуры микроорганизмов подвергают дальнейшему изучению в диагностических тестах, основанных на морфологических, ферментативных, биологических свойствах и антигенных особенностях, характеризующих бактерий соответствующего вида или варианта.
Определение чувствительности к антибактериальным препаратам. Чувствительность к антимикробным препаратам изучают у выделенных чистых культур микроорганизмов имеющих этиологическое значение для данного заболевания. Поэтому в направлении на бактериологические анализы требуется указать диагноз заболевания у больного. Определение чувствительности бактерий к спектру антибиотиков помогает лечащему врачу правильно выбрать препарат для лечения больного.
Оценка результатов исследования. Принадлежность условно-патогенных микроорганизмов к естественной микрофлоре организма человека создает ряд трудностей при оценке их этиологической роли в развитии гнойно-воспалительных заболеваний. Условно-патогенные микроорганизмы могут представлять нормальную микрофлору исследуемых жидкостей и тканей или контаминировать их из окружающей среды. Поэтому для правильной оценки результатов бактериологических исследований необходимо знать состав естественной микрофлоры изучаемого образца. В тех случаях, когда исследуемый биоматериал в норме стерилен, как, например, спинномозговая жидкость, экссудаты, все выделенные из него микроорганизмы могут считаться возбудителями заболевания. В тех случаях, когда исследуемый материал имеет собственную микрофлору, как, например, отделяемое влагалища, кал, мокрота, нужно учитывать изменения ее качественного и количественного состава, появление несвойственных ему видов бактерий, количественную обсемененность биоматериала. Так, например, при бактериологическом исследовании мочи степень бактериурии (число бактерий в 1 мл мочи), равная и выше 10 5 , свидетельствует об инфекции мочевых путей. Более низкая степень бактериурии встречается у здоровых людей и является следствием загрязнения мочи естественной микрофлорой мочевых путей.
Установить этиологическую роль условно-патогенной микрофлоры помогают также нарастание количества и повторность выделения бактерий одного вида от больного в процессе заболевания.
Врач-клиницист должен знать, что положительный результат бактериологического исследования в отношении биологического материала, полученного из в норме стерильного очага (кровь, плевральная жидкость, спинномозговая жидкость, пунктат органа или ткани), всегда тревожный результат, требующий немедленных действий по оказанию медицинской помощи.
Серологические методы исследования
В основе всех серологических реакций лежит взаимодействие антигена и антитела. Серологические реакции используются в двух направлениях.
С внедрением в практику лабораторий метода иммуноферментного анализа (ИФА) стало возможным определять в крови больных антитела, относящиеся к различным классам иммуноглобулинов (IgM и IgG), что существенным образом повысило информативность серологических методов диагностики. При первичном иммунном ответе, когда иммунная система человека взаимодействует с инфекционным агентов в первый раз, синтезируются преимущественно антитела, относящиеся к иммуноглобулинам класса М. Лишь позднее, на 8-12 день после попадания антигена в организм, в крови начинают накапливаться антитела иммуноглобулинов класса G. При иммунном ответе на инфекционные агенты вырабатываются также и антитела класса А (IgA), которые играют важную роль в защите от инфекционных агентов кожи и слизистых оболочек.
2. Установление родовой и видовой принадлежности микроба или вируса. В этом случае неизвестным компонентом реакции является антиген. Такое исследование требует постановки реакции с заведомо известными иммунными сыворотками.
Серологические исследования не обладают 100 % чувствительностью и специфич-ностью в отношении диагностики инфекционных заболеваний, могут давать перекрестные реакции с антителами, направленными к антигенам других возбудителей. В связи с этим оценивать результаты серологических исследований необходимо с большой осторожностью и учетом клинической картины заболевания. Именно этим обусловлено использование для диагностики одной инфекции множества тестов, а также применение метода Western-blot для подтверждения результатов скрининговых методов.
В последние годы прогресс в области серологических исследований связан с разработкой тест-систем для определения авидности специфических антител к возбудителям различных инфекционных заболеваний.
Авидность - характеристика прочности связи специфических антител с соответствующими антигенами. В ходе иммунного ответа организма на проникновение инфекционного агента стимулированный клон лимфоцитов начинает вырабатывать сначала специфические IgM-антитела, а несколько позже и специфические IgG-антитела. IgG-антитела обладают поначалу низкой авидностью, то есть достаточно слабо связывают антиген. Затем развитие иммунного процесса постепенно (это могут быть недели или месяцы) идет в сторону синтеза лимфоцитами высокоспецифичных (высокоавидных) IgG-антител, более прочно связывающихся с соответствующими антигенами. На основании этих закономерностей иммунного ответа организма в настоящее время разработаны тест-системы для определения авидности специфических IgG-антител при различных инфекционных заболеваниях. Высокая авидность специфических IgG-антител позволяет исключить недавнее первичное инфицирование и тем самым с помощью серологических методов установить период инфицирования пациента. В клинической практике наиболее широкое распространение нашло определение авидности антител класса IgG при токсоплазмозе и цитомегаловирусной инфекции, что дает дополнительную информацию, полезную в диагностическом и прогностическом плане при подозрении на эти инфекции, в особенности при беременности или планировании беременности.
Метод полимеразной цепной реакции
Полимеразная цепная реакция (ПЦР) являющаяся одним из методов ДНК-диагностики, позволяет увеличить число копий детектируемого участка генома (ДНК) бактерий или вирусов в миллионы раз с использованием фермента ДНК-полимеразы. Тестируемый специфический для данного генома отрезок нуклеиновой кислоты многократно умножается (амплифицируется), что позволяет его идентифицировать. Сначала молекула ДНК бактерий или вирусов нагреванием разделяется на 2 цепи, затем в присутствии синтезированных ДНК-праймеров (последовательность нуклеотидов специфична для определяемого генома) происходит связывание их с комплементарными участками ДНК, синтезируется вторая цепь нуклеиновой кислоты вслед за каждым праймером в присутствии термостабильной ДНК-полимеразы. Получается две молекулы ДНК. Процесс многократно повторяется. Для диагностики достаточно одной молекулы ДНК, то есть одной бактерии или вирусной частицы. Введение в реакцию дополнительного этапа - синтеза ДНК на молекуле РНК при помощи фермента обратной транскриптазы - позволило тестировать РНК-вирусы, например, вирус гепатита С. ПЦР - это трехступенчатый процесс, повторяющийся циклично: денатурация, отжиг праймеров, синтез ДНК (полимеризация). Синтезированное количество ДНК идентифицируют методом иммуноферментного анализа или электрофореза.
В ПЦР может быть использован различный биологический материал - сыворотка или плазма крови, соскоб из уретры, биоптат, плевральная или спинномозговая жидкость и т.д. В первую очередь ЦПР применяют для диагностики инфекционных болезней, таких как вирусные гепатиты В, С, D, цитомегаловирусная инфекция, инфекционные заболевания, передающиеся половым путем (гонорея, хламидийная, микоплазменная, уреаплазменная инфекции), туберкулез, ВИЧ-инфекция и т.д.
Преимущество ПЦР в диагностике инфекционных заболеваний перед другими методами исследований заключается в следующем:
- возбудитель инфекции может быть обнаружен в любой биологической среде организма, в т.ч. и материале, получаемом при биопсии;
- возможна диагностика инфекционных болезней на самых ранних стадиях заболевания;
- возможность количественной оценки результатов исследований (сколько вирусов или бактерий содержится в исследуемом материале);
- высокая чувствительность метода; например чувствительность ПЦР для выявления ДНК вируса гепатита В в крови составляет 0,001 пг/мл (приблизительно 4,0 . 10 2 копий/мл), в то время как метода гибридизации ДНК с использованием разветвленных зондов - 2,1 пг/мл (приблизительно 7,0 . 10 5 копий/мл).
Читайте также:


