Роль гзт в патогенезе и иммунитете при туберкулезе

Этиология и иммунитет туберкулеза
В.А. Кошечкин, З.А. Иванова
Морфологические и биохимические компоненты микробной клетки вызывают различные реакции в организме.
Основными биохимическими компонентами МБТ являются белки, углеводы, липиды.
Белки (туберкулопротеиды) являются основными носителями антигенных свойств МВТ.
Туберкулин — один из туберкулопротеидов, широко используемый в практике для выявления инфицирования.
Гиперчувствительность замедленного типа (ГЧЗТ)
Вещества, входящие в состав внешней оболочки МБТ, индуцируют специфическую тканевую воспалительную реакцию макроорганизма и образование гранулемы. Одновременно появляется гиперчувствительность замедленного типа (ГЧЗТ), определяемая по реакции на туберкулиновые пробы, и слабое антителообразование.
В основном ГЧЗТ используется для характеристики иммунного ответа IV типа (наличие индурации, развившейся через 48 ч, на участке внутрикожного введения туберкулина) у индивидов, инфицированных МБТ. Вместе с тем ГЧЗТ связывают с иммунной реакцией на факторы, повреждающие ткани.
Связь между иммунным ответом и патогенезом
Локальные и генерализованные туберкулезные повреждения в организме определяются защитными реакциями, которые производит иммунная система организма против МБТ.
При описании этого сложнейшего процесса ограничимся простым перечислением событий, происходящих с момента первичного проникновения МБТ в альвеолы до результатов естественной борьбы между макроорганизмом и МБТ. Этот процесс определяет судьбу, по крайней мере, трети населения мира, которое инфицировано микобактериями туберкулеза.
Цикл развития туберкулеза от инфицирования организма микобактериями туберкулеза до клинических проявлений болезни и распространения МБТ в окружающей среде можно условно разделить на 5 этапов.
Этапы развития туберкулеза
- Распространение инфекции (инфицирование).
- Начало инфекции, пролиферация и диссеминация в инфицированном организме.
- Развитие иммунной реакции организма.
- Казеация (развитие казеозного некроза) и ускоренное размножение МБТ.
- Вторичное распространение инфекции (способность инфицировать, заражать).
Этап 1. Распространение инфекции.
1.1. Больной туберкулезом продуцирует аэрозоли, в которых содержатся МБТ.
1.2. Мелкие частицы аэрозоля высыхают и становятся пылевыми частицами.
1.3. Пылевые частицы, содержащие микобактерии, вдыхаются человеком.
1.4. Частицы проникают через бронхи и скапливаются в альвеолах.
1.5. Микобактерии поглощаются альвеолярными макрофагами неиммунизированного организма.
1.6. Если альвеолярные макрофаги способны уничтожить МБТ, инфекция не развивается.
Этап 2. Начало инфекции, пролиферация и диссеминация.
2.1. МБТ выживают и размножаются в альвеолярных макрофагах.
2.2. Размножающиеся МБТ убивают альвеолярные макрофаги, макрофаги распадаются, высвобожденные хемокины и МБТ взаимодействуют с новыми клетками.
2.3. Вновь сформированные макрофаги и моноциты захватывают и переваривают МБТ.
2.4. Киллерные клетки и Т-лимфоциты начинают накапливаться в поврежденных участках.
2.5. МБТ продолжают размножаться, убивая клетки макроорганизма, и распространяться локально (в участке своего первоначального внедрения).
2.6. МБТ транспортируются во внутригрудные лимфатические узлы, откуда распространяются в системные органы.
Этап 3. Развитие иммунного ответа макроорганизма.
Развитие туберкулезного процесса в течение 3-го этапа может происходить в двух вариантах.
Вариант 3.1. У большинства пациентов в течение 3-го этапа появляется достаточная устойчивость, чтобы подавлять развитие туберкулеза на протяжении всей жизни.
3.1.1. Размножение МБТ останавливается, а их количество резко уменьшается.
3.1.2. Первичный фокус и его дочерние фокусы оставляют после себя минимальные остаточные проявления.
3.1.3. Туберкулиновый кожный тест становится положительным.
Вариант 3.2 (неблагоприятный). При недостаточно активной
иммунной реакции происходит прогрессирование туберкулезного процесса. Оно чаще наблюдается среди ВИЧ-инфицированных, детей, а также у лиц, предрасположенных к туберкулезу.
У некоторых пациентов возникает реактивация скрытой туберкулезной инфекции. Реактивация может происходить вне легких или в самом легком и закончиться тканевым повреждением, формированием полости распада и вторичным размножением МБТ.
На клеточном уровне неблагоприятный вариант 3-го этапа характеризуется следующими процессами.
3.2.1. Макрофаги передают туберкулезные антигены Т-лимфоцитам; Т-лимфоциты высвобождают цитокины.
3.2.2. Цитокины стимулируют продуцирование и активацию макрофагов. В результате формируется защита от повреждения клеток и тканей.
3.2.3. Указанные реакции ограничивают быстрое размножение и/ или уничтожают МБТ, заканчиваются формированием первичного легочного фокуса.
3.2.4. Если макроорганизм не способен создать эффективную защиту от МБТ, первичный очаг прогрессирует.
Этап 4. Казеация и ускоренное размножение МБТ.
4.1. Туберкулезный фокус в легком реактивируется, подвергается некротизированию (казеации) с последующим формированием полости.
4.2. В этот период МБТ, находящиеся во внеклеточном пространстве, размножаются экспоненциально.
Этап 5. Вторичное распространение инфекции.
Пациент откашливает мокроту, содержащую МБТ, другой человек вдыхает их. Таким образом, процесс заражения человека в некоторых случаях приводит к выделению МБТ в окружающую среду, тем самым продолжается распространение МБТ среди окружающих.
Для развития клинических проявлений туберкулеза необходим комплекс факторов. Известно, что у здоровых людей весьма часто обнаруживаются вирулентные микобактерии туберкулеза, однако заболевают туберкулезом далеко не все их носители.
Только при наличии сложной комбинации неблагоприятных внешних и внутренних предрасполагающих факторов, резко снижающих сопротивляемость организма, заражение туберкулезными микобактериями может перейти в заболевание туберкулезом. Вместе с тем заражение туберкулезными микобактериями может закончиться так называемой скрытой инфекцией без серьезных последствий.
Скрытая инфекция
Скрытой инфекцией принято считать такой инфекционный процесс, при котором отсутствуют клинические проявления болезни при наличии жизнеспособных микробов в организме. Существование процесса при скрытой инфекции может быть установлено посредством патоморфологического исследования или при помощи иммунобиологических реакций.
Скрытая инфекция при туберкулезе является:
1) следствием неразвившейся первичной инфекции, при которой МБТ продолжают оставаться в организме;
2) результатом незаконченного процесса после перенесенного туберкулеза.
В обоих случаях в организме находятся туберкулезные микобактерии, но условия возникновения скрытой инфекции разные. В первом случае скрытая инфекция возникает при наличии некоторой врожденной устойчивости организма, благодаря чему инфекционный очаг не развивается.
Во втором — она наступает вследствие приобретения организмом иммунитета в процессе болезни, когда остается латентный очаг. В обоих случаях способность организма недостаточна, чтобы уничтожить МБТ.
Следовательно, возникновение скрытой инфекции при туберкулезе зависит как от степени вирулентности туберкулезных микобактерий, так и состояния сопротивляемости и иммунобиологической реактивности макроорганизма. Имеет значение и влияние внешней среды на организм.
Заражение человека туберкулезом происходит в большинстве случаев (в 90—95 %) через дыхательные пути (аэрогенный путь) реже — через желудочно-кишечный тракт (алиментарным путь). Наблюдаются случаи заражения через поврежденную кожу и слизистые оболочки (контактный путь). Возможно и внутриутробное заражение плода у больной туберкулезом матери в результате его инфицирования через сосуды плаценты и пупочную вену.
Для инфицирования и развития заболевания туберкулезом имеют значение доза МБТ и продолжительность контакта с больным туберкулезом. Заболевание наблюдается чаще при семейном контакте с больным с массивным бактериовыделением, который в течение длительного времени не изолируется от здоровых членов семьи, реже — при контакте с больным туберкулезом, у которого в мокроте не обнаруживают МБТ.
МБТ проникшие в дыхательные пути вместе с капельками мокроты, слизи, слюны, с частицами пыли, системой мукоцилиарного клиренса — мерцательным эпителием, током секретируемой слизи — могут выводиться из бронхов, что препятствует их контакту с альвеолярными макрофагами.

При первичном инфицировании, т. е. заражении лиц, ранее неинфицированных МБТ или не вакцинированных БЦЖ, микобактерии встречаются с полинуклеарами и фагоцитами, распознаются ими как инородные тела и подвергаются фагоцитозу. Макрофаги фиксируют микобактерии на клеточной мембране, затем погружают (инвагинируют) их в клетку с образованием фагосомы Фагосома, сливаясь с лизосомой, образует фаголизо-сому в которой происходит разрушение (переваривание) микобактерий с помощью ферментов (рис. 3). Переваривающая активность макрофагов зависит от состояния макроорганизма его возраста пола, наследственности и от вирулентности микобактерий Попадая в макрофаг, МБТ могут сохранять жизнеспособность и при высокой вирулентности размножаться. В результате макрофаг разрушается и микобактерии оказываются вне клеток. Дальнейшая судьба микобактерий будет зависеть от способности организма активировать макрофаги.
Ведущая роль в сопротивляемости организма туберкулезу отводится приобретенному клеточному иммунитету. В его основе лежат активация макрофагов и эффекторное воздействие их на Т-лимфоциты. Макрофаги, фагоцитировавшие МБТ, при разрушении выделяют во внеклеточное пространство частицы микобактерий соединенные с la-белком, и ферменты — медиаторы (интерлейкин-1) активирующие Т-лимфоциты. Т-лимфоциты в свою очередь выделяют медиаторы — лимфокины (интерлеикин-2), которые активируют миграцию макрофагов, их ферментативную активность в отношении МБТ. Выделяемые макрофагами медиаторы активируют и В-лимфоциты, ответственные за синтез иммуноглобулинов. Однако накопление в крови того или иного класса иммуноглобулинов не стимулирует иммунный ответ.
При повышении ферментативной активности макрофаги выделяют вещества, способствующие развитию воспалительной реакции, повышению сосудистой проницаемости, появлению ГЗТ и положительной кожной туберкулиновой реакции.
Среди Т-лимфоцитов существуют популяции клеток с различным функциональным значением в иммунном ответе макрофагов. Т-хелперы активируют макрофаги, Т-супрессоры их угнетают.
Часть иммунных лимфоцитов (Т-киллеры) совместно с макрофагами обеспечивают развитие ГЗТ — одного из основных феноменов клеточного противотуберкулезного иммунитета. К ГЗТ относят все реакции взаимодействия клеток с антигенами микобактерий. Для выявления ГЗТ в иммунологии применяют реакции бласттрансформации лимфоцитов, торможения миграции лейкоцитов и др. В широкой практике для выявления ГЗТ используют туберкулиновые пробы.
В защите от туберкулеза определенное значение имеют и гуморальные факторы естественной резистентности (комплемент, лизоцим, пропердин, интерферон и др.), которые приобретают существенное значение у новорожденных детей, имеющих физиологическую недостаточность иммунной системы. У взрослых роль гуморальных факторов защиты от туберкулеза неясна.
Формирование иммунитета на первичное инфицирование МБТ, вакцинацию БЦЖ происходит параллельно размножению микобактерий и развитию специфической воспалительной реакции. По мере нарастания иммунного ответа размножение микобактерий замедляется, уменьшается вызванная ими воспалительная реакция.
Реакции ГЗТ выявляются через 2—3 нед после инфицирования или вакцинации, а достаточно выраженный иммунитет формируется через 8 нед.
Формирование иммунных реакций происходит под сдерживающим влиянием компонентов микобактерий. Кордфактор, определяющий вирулентность микобактерий, тормозит образование фаголизосом и лизис микобактерий. При большой популяции микобактерий и их интенсивном размножении увеличивается количество Т-супрессоров, уменьшается иммунологическая активность Т-хелперов, угнетается ГЗТ, что ведет к прогрессированию туберкулезного процесса, формированию некротических гранулем При небольшой популяции микобактерий после развития ГЗТ макрофаги под действием медиаторных субстанции Т-лимфоцитов направляются на место действия антигена и создают условия для образования экссудативно-продуктивнои или продуктивной гранулемы. Макрофаги под влиянием фосфатидов фагоцитированных в них микобактерий трансформируются в эпи-телиоидные клетки и гигантские многоядерные клетки Пирогова — Лангханса, которые ограничивают очаг воспаления. Формирование гранулемы следует рассматривать как иммунологическую реакцию организма на туберкулезную инфекцию.
В иммунизированном вакциной БЦЖ организме макрофаги быстрее мигрируют к месту внедрения МБТ, обладают большей переваривающей способностью, чем в неиммунизированном.
Для вторичного туберкулеза характерно наличие приобретенного при первичном инфицировании иммунитета. Его выраженность определяет развитие и течение туберкулеза. Иммунное состояние организма поддерживает сохраняющаяся после первичного заражения инфекция, которая в виде типичных или L-форм находится в очагах, оставшихся после первичного инфицирования МБТ или излеченного первичного туберкулеза. Вторичный туберкулез преимущественно органный, возникает в результате поступления МБТ из заживших очагов первичного туберкулеза (эндогенная реактивация) или повторного аэрогенного или алиментарного заражения (экзогенная суперинфекция). В иммунном ответе при вторичном туберкулезе основное значение также принадлежит макрофагам, которые вместе с Т-лимфоцитами препятствуют генерализации инфекции и распространению туберкулезного воспаления. Инфекционный процесс при вторичном туберкулезе характеризуется воспалением и некрозом ткани, возникающими вследствие разрушения макрофагов. Некроз поражает сосуды, препятствует проникновению к микобактериям лимфоцитов и макрофагов, в результате чего казеоз не рассасывается и микобактерии не фагоцитируются.
Приобретенный иммунитет снижается при заболеваниях лимфатической системы, беременности, голодании, приеме иммунодепрессантных средств, у лиц, злоупотребляющих алкоголем, наркоманов, больных раком, сахарным диабетом. На ответ иммунной системы при внедрении МБТ оказывают влияние и генетические факторы. Установлена связь заболевания туберкулезом с наличием в генотипе тех или иных HLA-антигенов. Они оказывают влияние на функциональную активность макрофагов, Т- и В-лимфоцитов и тем самым индуцируют или замедляют развитие туберкулезного процесса. У лиц — носителей антигенов HLA — DR2 и В7 не наблюдается развития клеточного иммунитета при вакцинации БЦЖ.
Морфологические изменения при туберкулезе многообразны — от остронекротических казеозных очагов до малых изменений, параспецифических и неспецифических реакций тканей на МБТ.
Туберкулез начинается с воспалительной реакции неспецифического характера. В эксперименте при внутрилегочном заражении вирулентной культурой МБТ животных уже через сутки возникает пролиферация клеток гистиоцитарного ряда; межаль-веолярлые перегородки инфильтрируются мононуклеарами, лимфоцитами, сегментоядерными лейкоцитами. В дальнейшем вокруг полнокровных отечных сосудов обнаруживаются скопления лимфоцитов, в просветах альвеол — макрофагов. Формируются лим-фоплазмоцитарные и гистиомакрофагальные бугорки, в которых появляются скопления эпителиоидных клеток. Через 1 — 1,5 мес определяются специфичные для туберкулеза эпителиоидноклеточные бугорки с многоядерными клетками и некротическими участками в центре. В зависимости от массивности, вирулентности инфекции и реактивности макроорганизма бугорки могут быть преимущественно экссудативными, лимфоцитарными, продуктивными, эпителиоидно-гигантоклеточными и некротическими. Вокруг сосудов и бронхов видны большие скопления лимфоид-ных элементов. При прогрессировании туберкулеза бугорки сливаются в крупные очаги, из которых формируются пневмонические фокусы с участками казеоза (инфильтраты). Воспаление может распространяться и переходить на бронхи. При инфильтрации казеоза лейкоцитами, выделяющими протеолигические ферменты, казеоз может расплавляться и перфорировать в просвет бронха. Образовавшаяся при распаде инфильтрата каверна будет служить источником поступления МБТ в другие отделы легких и образования новых очагов, инфильтратов, каверн (рис. 4). Каверна может образовываться и при изъязвлении инфильтрата в стенке бронха.

Заживление туберкулезного очага сопровождается рассасыванием экссудата, уплотнением казеоза и формированием вокруг него соединительнотканной капсулы. Рассасывание экссудата, клеточных элементов, грануляций может приводить к формированию фиброза (цирроза). По мере регрессирования такого очага коллагеновые волокна капсулы подвергаются гиалинозу, в капсуле и вокруг появляются скопления лимфоцитов, которые характеризуют выраженность иммунологических реакций. Отсутствие специфической грануляционной ткани в осумкован-ных очагах свидетельствует о формировании остаточных изменений после излеченного туберкулеза.
Интенсивность развития туберкулезного воспаления, выраженность и смена воспалительных тканевых реакций — альтерации, экссудации и пролиферации — в значительной степени зависят также от количества МБТ, попавших в организм, и их вирулентности. В эксперименте установлено, что туберкулезный бугорок в легком животного (собаки) формируется при введении 10, крупный очаг— 106, каверна — 108 микобактерий.
Выделение в течении туберкулеза двух последовательных периодов — первичного и вторичного — находит отражение и в особенностях патоморфологической картины.
В первичный период туберкулеза поражается преимущественно лимфатическая система, в связи с чем постоянно обнаруживается распространенный, или тотальный, казеоз лимфатических узлов. В результате бактериемии, характерной для этого периода, в легких и других органах определяются гематогенные очаги. Типичным для морфологических изменений при первичном туберкулезе является наличие обширных перифокальных реакций вокруг основного воспалительного очага и распространенных параспецифических реакций в легких и других органах в виде лим-фоидных и лимфогистиоцитарных узелков, инфильтратов и пролиферации макрофагов.
После первичного туберкулеза может возникнуть форма туберкулезного поражения, проявляющаяся распространенной гематогенной или лимфогенной диссеминацией. Наряду с очагами с преимущественно продуктивной воспалительной реакцией в легких обнаруживаются диффузные васкулиты, а при хроническом течении — и интерстициальный сетчатый склероз. Диссеми-нированный туберкулез генетически связан или с прогресси-рованием первичной туберкулезной инфекции, или с реактивацией послепервичных очагов. При прогрессирующем течении дис-семинированный туберкулез является исходный формой для вторичного туберкулеза.
Вторичный туберкулез характеризуется наличием остаточных послепервичных очагов (кальцинированные лимфатические узлы, очаги-отсевы), имеющих важное значение в патогенезе этой формы. Развиваясь в иммунном организме, воспалительный процесс приобретает характер органного поражения в виде очага, инфильтрата, каверны без большого перифокального воспаления и вовлечения в процесс лимфатических узлов.
Инфицирование МБТ сниженной вирулентности L-формами может вызвать воспалительные реакции в виде пролиферации ретикулогистиоцитарных, лимфоидных клеток и макрофагов в легких и лимфатических узлах. В связи с отсутствием характерных для туберкулеза эпителиоидно-клеточной реакции и казеоза такие реакции называют параспецифическими, они обычно наблюдаются при первичном туберкулезе.
Неспецифическое воспаление в виде перифокальнои реакции вокруг туберкулезных очагов отражает экссудативную фазу воспаления и морфологически представлено зоной экссудации, характеризующейся отеком, полнокровием сосудов и лимфоцитар-ной инфильтрацией.
Гиперчувствительность клеточного типа лежит в основе развития ряда инфекционных заболеваний (туберкулеза, бруцеллеза, сальмонеллеза, дифтерии, герпеса, кори, грибковой инфекции), трансплантационного иммунитета, противоопухолевого иммунитета, аутоиммунных заболеваний, контактного дерматита.
Антигенами-аллергенами, индуцирующими реакции клеточного типа, являются бактерии, грибы, простейшие, паразиты, вирусы, клетки собственных тканей организма с измененной антигенной структурой, антигены гистосовместимости, специфические антигены опухолей, комплексные антигены, образующиеся при участии гаптенов.
Взаимодействие антигенов-аллергенов с антигенпрезентирующими клетками обеспечивается при участии Tool-рецепторов (TLR4, TLR5, TLR6, TLR62), экспрессируемых на их мембранах.
В механизмах индукции гиперчувствительности IV типа важная роль отводится антигенпрезентирующим макрофагам, дендритным и другим клеткам, обеспечивающим фагоцитирование и комплексирование негидролизованной части антигена-аллергена с белками II класса молекул МНС, а также презентацию антигена комплементарному клону Тh0. Одновременно антигенпрезентирующие клетки продуцируют цитокины (IL-12, IL-23, IL-27), обеспечивающие пролиферацию и дифференцировку антигенчувствительных клонов Th1.
Полагают, что главным цитокином в реакциях IV типа является гамма-интерферон, продуцируемый Тh1, который вызывает активацию макрофагов, вовлечение их в иммунный ответ за счет их фагоцитарной активности и уничтожения клеток-мишеней в процессе фагоцитоза, а также за счет усиления продукции монокинов с полимодальной направленностью действия.
Интерлейкин-2, продуцируемый Тh1, обеспечивает аутокринную активацию этих клеток лимфоцитов и паракринную неспецифическую пролиферацию Т-эффекторов. Антигенстимулированные Т-лимфоциты-хелперы и Т-лимфоциты-эффекторы обеспечивают продукцию медиаторов аллергии клеточного или замедленного типа, получивших название лимфокинов (рисунок).
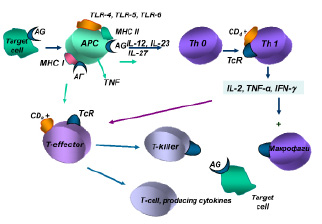
Индукция иммунного ответа при клеточно-опосредованных реакциях
В настоящее время выделено несколько десятков лимфокинов, которые в соответствии с особенностями их биологического действия могут быть разделены на следующие группы:
1. Факторы, влияющие на лимфоциты (фактор переноса Лоуренса, митогенный фактор, фактор, стимулирующий Т- и В-лимфоциты).
2. Факторы, влияющие на макрофаги (миграцию ингибирующий фактор; фактор, активирующий макрофаги; фактор, усиливающий пролиферацию макрофагов).
3. Цитотоксические факторы (лимфотоксин; фактор, тормозящий синтез ДНК; фактор, ингибирующий гемопоэтические стволовые клетки).
4. Факторы хемотаксиса макрофагов, нейтрофилов, лимфоцитов и эозинофилов.
5. Антивирусные и антимикробные факторы.
Многие лимфокины обладают дистантным биологическим эффектом.
Цитотоксические CD8-Т-лимфоциты оказывают прямое действие. CD8-Т-лимфоциты обеспечивают развитие цитолиза клетки-мишени, на мембране которой фиксирован антиген, в три стадии:
I стадия – двойного распознавания антигена в комплексе с белками МНС I класса, экспрессированными на клетке-мишени.
II стадия – летального удара возникает в процессе контакта Т-лимфоцита-эффектора с клеткой-мишенью при участии белка перфорина, лимфотоксина или индуктора апоптоза, получаемых клеткой мишенью при межклеточном контакте.
III стадия – стадия коллоидно-осмотического лизиса, возникающего вслед за перфорацией мембраны и пассивной диффузией ионов, а затем и высокомолекулярных соединений по осмотическому градиенту через поврежденную мембрану.
Описание отдельных форм аллергических реакций
Контактные дерматиты. Аллергия этого типа чаще возникает к низкомолекулярным веществам органического и неорганического происхождения: различным химическим веществам, краскам, лакам, косметическим препаратам, антибиотикам, пестицидам, соединениям мышьяка, кобальта, платины, воздействующим на кожу. Контактные дерматиты могут вызывать также вещества растительного происхождения – семена хлопка, цитрусовые. Аллергены, проникая в кожу, образуют стабильные ковалентные связи с SH- и NН2-группами протеинов кожи. Эти конъюгаты обладают сенсибилизирующими свойствами.
Сенсибилизация обычно возникает в результате длительного контакта с аллергеном. При контактных дерматитах патологические изменения наблюдаются в поверхностных слоях кожи. Отмечаются инфильтрация воспалительными клеточными элементами, дегенерация и отслойка эпидермиса, нарушение целостности базальной мембраны.
Морфологические изменения при контактных дерматитах обусловлены фазным характером инфильтрации. Через 2-3 часа после инъекции антигена-аллергена возникает инфильтрация тканей сегментоядерными нейтрофилами. Через 5-6 часов в периваскулярной области появляются моноциты. Через 8 часов инфильтрация моноцитами становится интенсивной. К 24–72 часам она уменьшается. Клеточные элементы, содержащиеся в очаге воспаления, представлены в основном лимфоцитами и макрофагами.
Инфекционная аллергия. ГЗТ развивается при хронических бактериальных, вызванных грибами и вирусами инфекциях (туберкулезе, бруцеллезе, туляремии, сифилисе, бронхиальной астме, стрептококковой, стафилококковой и пневмококковой инфекциях, аспергиллезе, бластомикозе), а также при заболеваниях, вызываемых простейшими (токсоплазмоз), при глистных инвазиях.
Сенсибилизация к микробным антигенам обычно развивается при воспалении. Не исключена возможность сенсибилизации организма некоторыми представителями нормальной микрофлоры (нейссерии, кишечная палочка) или патогенными микробами при их носительстве.
Сенсибилизация к микробным антигенам в определенных условиях благоприятствует ликвидации патологического процесса. Одним из механизмов повышения устойчивости при ГЗТ может служить повышение неспецифической резистентности (усиление метаболической активности и фагоцитарной способности макрофагов, повышение активности лизоцима).
Отторжение трансплантата. При трансплантации организм реципиента распознает чужеродные трансплантационные антигены (антигены гистосовместимости) и осуществляет иммунные реакции, ведущие к отторжению трансплантата. Антигены главного комплекса гистосовместимости I класса локусов А, В и С есть на всех ядросодержащих клетках, а локуса G – лишь на трофобласте. Эти антигены распознаются CD8-лимфоцитами.
Антигены ГКГС II класса локусов DR, DP, DQ экспрессированы на лимфоидных, макрофагальных и эндотелиальных клетках. Они распознаются CD4-лимфоцитами.
Кроме того, на эритроцитах имеются антигены системы АВО и Rh, в почках – системы АВО. Названные антигены тоже играют определенную роль в индукции отторжения трансплантата.
Виды трансплантатов. Различают сингенные, аллогенные и ксеногенные трансплантаты.
Аллогенные и ксеногенные трансплантаты без применения иммуносупрессивной терапии отторгаются. Несмотря на появление новых, более селективных в отношении трансплантационного иммунитета иммуносупрессоров – грибковых макролидных антибиотиков (циклоспорины, FK506, рапамицин) проблема иммунологического конфликта трансплантата и реципиента еще не решена.
Механизмы отторжения трансплантата. При отторжении трансплантата наблюдается как гуморальный, так и клеточный иммунный ответ, в частности, механизмы ГЗТ, цитотоксические и иммунокомплексные реакции.
В зависимости от сроков отторжение трансплантата может быть сверхострым, острым и хроническим. Сверхострое отторжение возможно при наличии предсуществующих антител, то есть при повторной пересадке тканей от одного и того же донора, и происходит в течение первых 5 дней, а иногда в первые минуты и часы.
При остром отторжении предсуществующих антител нет. Острое отторжение – это классический вариант отторжения, в основе которого лежат как гуморальные, так и клеточные механизмы. Такой вариант отторжения наблюдается при отсутствии или прекращении иммуносупрессирующей терапии. Начало острого отторжения может быть отложено на несколько недель или даже месяцы, но начавшись, процесс заканчивается за несколько дней.
Отторжение считается хроническим, если в случае погрешностей в проведении иммуносупрессирующей терапии наблюдаются повторные эпизоды начинающегося отторжения трансплантата. В основе такого отторжения также лежат реакции гуморального и клеточного иммунитета. Острое и хроническое отторжение отличаются исходом – степенью облитерации сосудов.
Наиболее активны, как стимуляторы отторжения, ФНО и γ-ИФН, которые не только угнетают жизнедеятельность клеток трансплантата и активируют эффекторы цитотоксичности, но и усиливают экспрессию трансплантационных антигенов на клетках, вовлекая цитотоксические эффекторы. При отторжении активны цитотоксические CD4-положительные лимфоциты, их роль даже более значительна, чем CD8-киллеров.
При аллотрансплантации кожи, костного мозга, почки образуются гемагглютинины, гемолизины, лейкотоксины и антитела к лейкоцитам и тромбоцитам. При реакции антиген-антитело образуются биологически активные вещества, повышающие проницаемость сосудов, что облегчает миграцию Т-киллеров в пересаженную ткань. Лизис эндотелиальных клеток в сосудах трансплантата приводит к активации процессов свертывания крови. Кроме того, происходит активация различных фракций комплемента:
• хемотаксические фракции – привлекают полиморфноядерные лейкоциты, которые разрушают трансплантат с помощью лизосомальных ферментов;
• С6 компонент комплемента – активирует свертывающую систему крови;
• С3b фракция – вызывает агрегацию тромбоцитов.
Активация гуморального ответа в виде иммунокомплексных реакций приводит к возникновению васкулита, тромбоза и ишемического некроза.
γ-ИФН привлекает макрофаги, которые также выделяют цитотоксические факторы.
При отторжении по первичному типу участвуют в основном мононуклеары и лишь немного полиморфноядерных гранулоцитов, при отторжении по вторичному типу в качестве эффекторов выступают и мононуклеары, и полиморфноядерные гранулоциты.
Аутоиммунные заболевания. Развитие аутоиммунных заболеваний обусловлено сложным взаимодействием аллергических реакций клеточного и гуморального типа с преобладанием той или иной реакции в зависимости от характера аутоиммунного заболевания.
Аутоиммунные болезни представляют собой гетерогенную группу заболеваний, развитие которых связано или с доминирующей ролью цитолитических антител в механизмах деструкции клеток, или сочетанное патогенное воздействие на клетки-мишени CD8+-Т-лимфоцитов-киллеров, продуцентов лимфокинов с цитолитическими органоспецифическими или неспецифическими антителами.
Преимущественный цитотоксический эффект комплементсвязующих органоспецифических антител имеет место при аутоиммунных гемолитических анемиях, лейкопениях, тромбоцитопениях, тиреоидите Хашимото, пернициозной анемии, болезни Аддисона и других.
Между тем, в патогенезе системной и дискоидной красной волчанки, ревматоидного артрита, дерматомиозита, склеродермии, синдрома Шегрена и других форм патологии, ранее именуемых коллагенозами, ведущая роль в развитии воспалительно-деструктивных процессов в тканях отводится клеточному иммунитету. При этом антителозависимый и комплементзависимый цитолиз, патогенное действие токсических иммунных комплексов на различные органы и ткани потенцируют клеточно-опосредованные реакции.
В индукции аутоиммунных заболеваний выделяют несколько возможных механизмов:
1. Аутоиммунные поражения могут возникать в результате срыва иммунологической толерантности к собственным неизмененным тканям. Срыв иммунологической толерантности может быть обусловлен соматическими мутациями лимфоидных клеток, что приводит либо к появлению мутантных запретных клонов Т-хелперов, обеспечивающих развитие иммунного ответа на собственные неизменные антигены. В ряде случаев возможно образование костимулирующих молекул, модифицирующих структуру МНС антигенов, воспринимаемых лимфоидной системой как генетически чужеродное образование.
2. В последние годы важная роль в развитии аутоиммунных реакций отводится Тh17, синтезирующим ряд про- и противовоспалительных цитокинов, в частности, IL-17, GCSF, TNFα, IL-6, IL-10, IL-12 и др..
3. Образование аутоантител против естественных, первичных, антигенов-аллергенов иммунологически забарьерных тканей (нервной, хрусталика, щитовидной железы, яичек, спермы). В эмбриональный период забарьерные антигены отделены от крови гистогематическими барьерами, препятствующими их контакту с иммунокомпетентными клетками. В результате к забарьерным антигенам не формируется иммунологическая толерантность. При появлении в крови забарьерных антигенов против них начинают вырабатываться аутоантитела и возникает аутоиммунное поражение.
4. Образование аутоантител против приобретенных, вторичных, антигенов, образующихся под влиянием повреждающего воздействия на органы и ткани патогенных факторов неинфекционной (тепло, холод, ионизирующее излучение) и инфекционной (микробных токсинов, вирусов, бактерий) природы.
5. Образование аутоантител против перекрестно-реагирующих или гетерогенных антигенов. Мембраны некоторых разновидностей стрептококка имеют антигенное сходство с сердечными тканевыми антигенами и антигенами базальной мембраны почечных клубочков. В связи с этим антитела к названным микроорганизмам при стрептококковых инфекциях реагируют с тканевыми антигенами сердца и почек, приводя к развитию аутоиммунного поражения.
Разделение аллергических реакций на несколько основных типов в определенной степени условно, поскольку многие антигены-аллергены, воздействующие на организм, являются комплексными и одномоментно вовлекают в иммунный ответ и В-систему лимфоцитов, и Т-лимфоциты-эффекторы.
Преобладание того или иного типа аллергических реакций в патогенезе аллергического заболевания позволяет отнести его к реакциям гуморального или клеточного типов.
Некоторые виды аутоиммунных заболеваний являются классическим примером одномоментного взаимодействия или последовательного развития аллергических реакций гуморального и клеточного типов, лежащих в основе системного или локального воспалительно-деструктивного повреждения тканей.
Читайте также:


