Окраска по цилю-нильсену на микобактерии туберкулеза
Консультант по гематологии,
цитохимии и микробиологии
Важное место в общем комплексе клинико-лабораторных исследований, применяемых для профилактики, диагностики и лечения гнойно-воспалительных заболеваний и осложнений у больных в лечебно-профилактических учреждениях занимают микробиологические исследования. Современная клиническая медицина предъявляет к микробиологическим (бактериологическим) исследованиям возрастающие требования по увеличению объема, повышению качества исследований, разработке и внедрению новых более совершенных методов. Это связано как с новыми научными достижениями в области эпидемиологии и бактериологии, так и с увеличением гнойно-воспалительных заболеваний, ростом госпитальных инфекций.
Материалом для изучения этиологии заболеваний дыхательных путей служат: отделяемое зева и носа; мокрота; содержимое бронхов, полученное при бронхоскопии или при отсасывании через трахеостому (у больных, находящихся на аппаратном дыхании); экссудаты; резецированные ткани и др. Материал собирают с соблюдением правил асептики в предварительно простерилизованные баночки или пробирки и доставляют в лабораторию. Хранение материала способствует размножению сапрофитирующей микрофлоры, развитию процессов гниения и брожения, что искажает результаты анализа. Интервал между взятием материала и его посевом не должен превышать 1-2 часа. Самым простым методом выявления микобактерий туберкулеза в выделениях больных является микроскопия мазка, приготовленного из мокроты. При бактериоскопии мазка, окрашенного по Цилю-Нильсену, микобактерии туберкулеза могут быть обнаружены при наличии не менее 100 000 - 1 000 000 бактериальных клеток в 1 мл патологического материала (мокроты). Такое большое количество микобактерий встречается у больных с далеко зашедшими прогрессирующими формами заболевания (диссеминированными и фиброзно-кавернозными). У значительно большего числа больных количество выделяемых ими микобактерий ниже предела метода бактериоскопии.
Чувствительность метода люминесцентной микроскопии значительно выше - от 10 000 до 100 000 микобактерий в 1 мл материала, кроме того, этот метод дает возможность за значительно более короткое время просмотреть необходимое количество препаратов. Эффективность бактериоскопии повышается также при передаче изображения на компьютер при помощи присоединенной к микроскопу видеокамеры.
Чтобы диагностировать туберкулез, необходимо сделать все возможное для выявления возбудителя заболевания. Микробиологически диагноз может быть подтвержден на основе результатов культурального исследования на комплекс M. tuberculosis (или, при возможности, путем идентификации специфических последовательностей нуклеиновых кислот) в пробах, взятых в месте локализации патологического процесса. Однако на практике в настоящее время многие лаборатории не располагают материально-технической базой для проведения культуральных исследований. К счастью, микроскопия окрашенных препаратов мокроты доступна практически везде, поэтому диагностика туберкулеза может проводиться на основе выявления кислотоустойчивых микобактерий. На территориях с высокой распространенностью туберкулеза выявление кислотоустойчивых микобактерий в окрашенных препаратах мокроты демонстрирует высокую специфичность, поэтому положительный результат микроскопии мокроты можно рассматривать как подтверждение диагноза. Кроме высокой специфичности к комплексу M. tuberculosis, выявление кислотоустойчивых микобактерий при микроскопии играет важную роль по трем причинам: это – наиболее быстрый метод диагностики туберкулеза; позволяет выявить больных с тяжелым развитием патологии, чреватым высоким риском летального исхода; дает возможность выявить больных, являющихся распространителями инфекции.
Оценка качества работы лабораторий микроскопии должна проводиться соответствующим государственными органом (как правило, представителями национальной программы борьбы с туберкулезом).
Неправильный диагноз, поставленный перед началом лечения, приводит к риску ненужного, неправильного или неудачного лечения. Более того, подобный подход чреват несвоевременной постановкой правильного диагноза и назначением соответствующего лечения. При надлежащем подходе и контроле в большинстве случаев у детей в возрасте пяти лет и старше могут быть получены образцы мокроты. У подростков (хотя они часто относятся к детской возрастной группе, по крайней мере, до 15 лет) получить пробы мокроты не составляет большого труда. Поэтому фактор возраста не может рассматриваться как препятствие для сбора проб мокроты у детей и подростков.
Исходя из имеющихся данных, можно прийти к заключению, что для диагностики туберкулеза необходимо взять не менее двух проб мокроты. В случаях, когда имеются соответствующие возможности, можно направлять для лабораторного исследования еще и третью пробу, но исследование более трех проб мокроты вряд ли целесообразно, поскольку не может в значительной мере повысить эффективность диагностики. Кроме того, исследование третьей пробы может оказаться полезным только для подтверждения диагноза, если одна или две предыдущие пробы дали положительный результат. Крайне желательно, чтобы результаты микроскопии мокроты направлялись лечащему врачу в течение одного рабочего дня с момента отправки проб. Не меньшее значение имеет также и время сбора проб. Результаты исследований показывают, что эффективность лабораторных анализов максимальна, если пробы мокроты получены утром, после пробуждения от ночного сна. Возможно, совершенно необязательно собирать только утренние пробы, но, про крайней мере, одна из них должна быть получена утром.
Как правило, внелегочные очаги туберкулезного процесса содержат гораздо меньшее количество M. tuberculosis, поэтому микроскопическое выявление кислотоустойчивых микобактерий в пробах из внелегочных очагов весьма затруднено, и в таких случаях результаты культуральных исследований приобретают большое значение. Учитывая низкую результативность микроскопии, при внелегочном туберкулезе культуральные и морфологические исследования приобретают особое значение, например, в диагностическом исследовании проб ткани лимфатических узлов, полученных при помощи игловой биопсии.
Лечение пациентов, у которых наблюдаются тяжелое или быстро развивающееся заболевания, ассоциированные с туберкулезом, необходимо начинать немедленно, даже до лабораторного подтверждения диагноза. Лечение следует начинать до получения результатов лабораторного исследования и лишь позднее внести необходимые поправки и изменения в схему лечения с учетом результатов микроскопии.
Хотя микроскопия мокроты является наиболее доступным бактериологическим тестом, там, где ресурсы позволяют и имеются условия для качественной лабораторной диагностики, в диагностический алгоритм необходимо включать культуральные исследования мокроты, в случаях отрицательных результатов микроскопии. Правильное проведение культуральных исследований связано с определенными трудностями и дополнительными затратами, но этот метод отличается более высокой чувствительностью и повышает вероятность раннего выявления больных туберкулезом.
Микроскопия мазков мокроты по Циль-Нильсену является важнейшим элементом диагностики туберкулеза. Исследование 3 мазков мокроты позволяет выявить более 60% случаев туберкулеза легких и 95% наиболее заразных случаев (исследование одного мазка мокроты выявляет 75% наиболее заразных случаев, исследование второго мазка мокроты добавляет еще 20%, а исследование третьего - еще 5%).
Микроскопия мазков мокроты по Циль-Нильсену позволяет быстро получить результаты, выявить основные источники инфекции, является менее дорогостоящей, чем посев мокроты и широко доступна для применения. Но она должна быть надежной и хорошо контролироваться. Вероятность обнаружения МБТ при бактериоскопии мазков мокроты прямо пропорциональна концентрации возбудителя в исследуемом материале. Например, когда в 1 мл мокроты содержится от 1000 до 10000 МБТ, то вероятность получения положительного результата составляет около 40-50%. При концентрации МБТ менее 1000 в 1 мл мокроты вероятность их обнаружения резко снижается – отрицательные результаты получаются примерно в 96% случаев.
Основным и наиболее часто изучаемым биоматериалом в пульмонологической практике является мокрота. Требования к забору и качеству мокроты следующие:
1) первую пробу мокроты желательно получить до начала курса антибиотикотерапии;
2) мокроту оптимально собирать утром, до приема пищи, после тщательного туалета полости рта (полоскание кипяченой водой);
3) больным нужно доступно объяснить, что требуется получить именно содержимое нижних отделов дыхательных путей, а не ротоглотки, и, по возможности, проконтролировать их действия;
4) забор материала проводить в стерильные интактные контейнеры;
5) продолжительность хранения мокроты в контейнерах не должна превышать 2 ч (в летнее время желательно не более 1 ч);
6) в условиях лаборатории качество мокроты оценивается после окрашивания мазка по Граму (при наличии в мазке менее 25 лейкоцитов и более 10 эпителиальных клеток, при просмотре не менее 8-10 полей зрения при малом увеличении, мокрота признается некачественной, дальнейшее ее исследование нецелесообразно, так как, скорее всего, материал получен из ротовой полости);
7) высокая диагностическая ценность исследования признается при выделении возбудителя в концентрации і106 КОЕ/мл.
Вообще, в диагностике заболеваний туберкулезом можно выделить несколько этапов:
· Преаналитический этап (предварительный диагноз, выбор материала и метода исследования, забор биомтериала и его транспортировка)
· Аналитический этап (непосредственно проведение анализа)
· Постаналитический этап (оценка результатов)
Часть этих этапов проводится вне лаборатории, поэтому очень важна согласованная и качественная работа всех специалистов, привлеченных в этот процесс. Важен правильный выбор исследуемого материала. Важным этапом диагностики являются процедуры взятия и доставки материала в лабораторию.При взятии всех видов исследуемого материала следует ориентироваться на стандартные системы для этой цели: тампоны, цитощетки, тубсеры, контейнеры и т.п. Эффективность аналитического этапа во многом определяется уровнем технического оснащения лабораторий. Постаналитический этап исследования включает две составляющие: проверку достоверности полученного результата и оценку этиологической значимости выделенных штаммов. В лаборатории должен осуществляться строгий внутренний контроль качества исследований, важной составляющей которого является проверка полученных результатов на достоверность. Оценка этиологической значимости выделенных микроорганизмов принципиальна для выбора адекватной терапии. Процедура приготовления мазков начинается с подготовки предметных стекол. Необходимо использовать только новые, отмытые и обезжиренные в спирте или смеси для обезжиривания предметных стекол (производство АБРИС+) стекла без царапин и сколов. При повторном использовании стекла могут быть недостаточно хорошо отмыты от предыдущего материала, что может привести к получению ложноположительных результатов. Не рекомендуется использовать саморезанные стекла, которые приводят к значительным аберрациям исследуемого изображения. Стекла должны соответствовать ГОСТу. Стекла, на которых при микроскопическом исследовании были обнаружены кислотоустойчивые микобактерии, сохраняются в лаборатории в течение 1 года, а затем подлежат обязательному уничтожению и не должны использоваться повторно. Новые предметные стекла кипятят 15 минут в 1% растворе питьевой соды (10 г двууглекислого натрия на 1 л воды), промывают в 1% растворе соляной кислоты (к 1 л воды добавляют 10 мл концентрированной соляной кислоты), а затем промывают в проточной воде и протирают насухо.

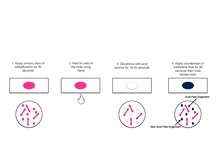
Некислотоустойчивые пятно , впервые д - р Пол Эрлих, также известный как окрашивание по Цилю-Нильсену , является бактериологическим пятно , используемый для идентификации кислотоустойчивых организмов, в основном микобактерии . Она названа в честь двух немецких врачей , которые модифицировали его: бактериолог Циль (1859-1926) и патолог Фридрих Нильсен (1854-1898).
Микобактерий туберкулеза является наиболее важным из этой группыпотому что она несет ответственность за туберкулез (ТБ). Другие важные виды микобактерийучаствующие в болезни человека являются микобактерии лепры , Mycobacterium kansasii , Mycobacterium Маринум , Mycobacterium Бови , Mycobacterium Africanum и члены Mycobacterium Авиум комплекса. Кислотно-организмытакие как Mycobacterium содержат большое количество липидных веществпределах их клеточных стенокназываемых миколиновыми кислотами. Эти кислоты сопротивляются окрашиваниепомощью обычных способовтаких как окрашивание по Граму . Она также может быть использована для окраски некоторых других бактерий, таких как Nocardia . Реагентыиспользуемые для Цилю-Нильсену окрашивания являются - ФУКОРЦИН , кислотный спирт и метиленовый синий . Кислотоустойчивые бациллы яркокрасный после окрашивания.
Разновидность этого метода окрашивания используется в микологии дифференцированно пятна некислотоустойчивых инкрустаций в кутикулярном гиф некоторых видах грибов из рода Russula . Это также полезно в идентификации некоторых простейших, а именно Cryptosporidium и Isospora . Окраска по Цилю-Нильсену может также препятствовать диагнозу в случае парагонимоза , потому что яйца в образце яйцеклетки и паразит мокроты (ОНП) могут быть растворены с помощью красителя, и часто используется в клинических условиях , так как признаки и симптомы парагонимоза близко напоминают те , туберкулеза.
содержание
Процедура
Типичная процедура включает в себя краситель КУМ отбрасывания клеток в суспензии на слайд, а затем сушка на воздухе жидкость и тепло фиксации клеток. Слайд залита ФУКОРЦИН, который затем нагревают, чтобы высушить и смыть в водопроводной воде. Слайд затем вливают 1% -ным раствором соляной кислоты в изопропиловом спирте (или метанол), чтобы удалить ФУКОРЦИН, таким образом, удаляя пятна от клеток, которые не защищены восковым липидным слоем. После этого клетки окрашивают в метиленовом синем и под микроскопом под масляной иммерсией.
| Резюме кислотоустойчивых пятна (Циля-Нильсен) | |||||
|---|---|---|---|---|---|
| применение | реактив | сотовый цвет | |||
| кислота быстро | Non-кислота быстро | ||||
| Первичный краситель | ФУКОРЦИН | красный | красный | ||
| Decolorizer | Кислотный спирт | красный | бесцветный | ||
| Счетчик пятно | метиленовый синий | красный | синий | ||
Исследования показали, что КУМ краситель без культуры имеет плохую отрицательную прогностическую ценность. КУМ культура должна быть выполнена вместе с AFB пятна; это имеет гораздо большее отрицательное прогностическое значение.

Механизм объяснения
Первоначально ФУКОРЦИН окрашивает каждую клетку. Когда они де-окрашивали кислоты спирта, только без кислотоустойчивые бактерии получают де пятнах, так как они не имеют толстый, восковой липидный слой, как кислотоустойчивые бактерии. Когда счетчик пятно наносится, не кислотоустойчивые бактерии поднять его и стать голубой (метиленовый синий) или зеленый (малахитовый зеленый), если смотреть под микроскопом. Кислотостойкие бактерии сохраняют ФУКОРЦИН так они выглядят красными.

Метод окраски по Цилю — Нильсену (по Цилю — Нельсену [1] ) — метод окраски микроорганизмов для выявления кислотоустойчивых микобактерий (возбудителей туберкулёза, микобактериозов, лепры), актиномицетов и других кислотоустойчивых микроорганизмов. Кислотоустойчивость микроорганизмов обусловлена наличием в их клетках липидов, воска и оксикислот. Такие микроорганизмы плохо окрашиваются разведёнными растворами красителей. Для облегчения проникновения красителя в клетки микроорганизмов нанесённый на препарат карболовый фуксин Циля подогревают над пламенем горелки. Окрашенные микроорганизмы не обесцвечиваются слабыми растворами минеральных кислот и спирта.
Метод назван именами немецких медиков — микробиолога Франца Циля и патологоанатома Фридриха Нельсена (Нильсена), которые разработали его в 1882—1883 гг.
- спирт этиловый 96- марки ОП-2, ТУ 6-09-4512-77;
- кислота соляная концентрированная, ГОСТ 3118-77;
- кислота серная концентрированная, ГОСТ 4204-77;
- фенол кристаллический (карболовая кислота), ГОСТ 6417-72;
- фуксин основной, ТУ 6-09-3804-82;
- метиленовый синий хлорид, ТУ 6-09-945-75;
- глицерин, ЧДА, ГОСТ 6259-75;
- вода дистиллированная, ГОСТ 6709-72.
- Раствор 1. Насыщенный спиртовой раствор фуксина:
растереть в ступке 0,3 г основного фуксина с 2 — 3 каплями глицерина, добавить по каплям 10 мл 96- этилового спирта.
- Раствор 2. Рабочий раствор фенола (5 % водный раствор):
расплавить 5 г кристаллического фенола путём легкого подогревания на водяной бане (температура плавления фенола 41 °C). Добавить слегка подогретую дистиллированную воду до объема 100 мл.
- Раствор 3. Рабочий раствор карболового фуксина:
в 90 мл полученного раствора фенола (2) добавить 10 мл насыщенного раствора фуксина (1).
- Раствор 4. Обесцвечивающие растворы:
а) Раствор серной кислоты
К 75 мл дистиллированной воды осторожно долить 25 мл
концентрированной серной кислоты, постепенно наслаивая её по стенкам
сосуда. Смешать. Содержимое нагреется.
Никогда не добавляйте воду в кислоту!
б) Раствор солянокислого спирта
Вместо раствора серной кислоты для обесцвечивания можно
использовать 3% солянокислый спирт: Этиловый спирт 96- 97 мл Концентрированная соляная кислота 3 мл. К 97 мл спирта осторожно добавляют 3 мл концентрированной соляной кислоты.
Всегда осторожно вливайте кислоту в спирт, но не наоборот.
- Раствор 5. Рабочий раствор метиленового синего:
растворить 0,3 г хлорида метиленового синего в 100 мл дистиллированной воды.
1. Фиксированный мазок, депарафинизированный срез, покрывают плоской фильтровальной бумагой и наливают на неё карболовый фуксин Циля. Мазок подогревают над пламенем горелки до появления паров, затем отводят для охлаждения и добавляют новую порцию красителя. Подогревание повторяют 2—3 раза. После охлаждения снимают фильтровальную бумагу и промывают препарат водой.
2. Препарат обесцвечивают путём погружения или нанесения на него 25%-го раствора серной кислоты или 3 % солянокислого спирта в течение 3-х минут, и промывают несколько раз водой [2] [3] .
3. Окрашивают препараты водно-спиртовым раствором метиленового синего 1 минуту, промывают водой и высушивают.
При окраске по этому методу кислотоустойчивые бактерии приобретают интенсивно красный цвет, остальная микрофлора окрашивается в светло-синий цвет [3] .
Некоторые другие микроорганизмы, не относящиеся к М.tuberculosis, могут иметь различные формы — от длинных палочек до кокковидных форм с различной интенсивностью окрашивания. Различную степень кислотоустойчивой окраски можно наблюдать не только у микобактерий, но и у других микроорганизмов. Это могут быть Rhodococcus, Nocardia, Legionella, а также цисты Cryptosporidium и Isospora. Быстрорастущие микобактерии могут отличаться по степени кислотоустойчивой окраски — при частичной потере кислотоустойчивой окраски они приобретают фиолетово-малиновый цвет.
При микроскопическом исследовании мазка следует просматривать не менее 100 полей зрения, чтобы дать количественную оценку препарату и обнаружить единичные микобактерии. В том случае, если результат такого исследования оказывается отрицательным, для подтверждения просматривают дополнительно 200 полей зрения. При значительном количестве кислотоустойчивых микобактерий достаточно исследовать 20 — 50 полей зрения как при окраске по Циль-Нильсену, так и при люминесцентной микроскопии (см. таблицу). При микроскопическом исследовании препарата необходимо быть уверенным, что ни одно поле зрения препарата не просматривается повторно, поэтому рекомендуется просматривать препарат всегда по одной и той же схеме:
- либо 3 параллельных прохода по длине препарата;
- либо 9 параллельных проходов по ширине.
Просматривать препарат начинают с левого верхнего выбранного в мазке поля зрения, постепенно передвигаясь либо вдоль продольной оси препарата до конца мазка, либо смещаясь вниз и затем вновь поднимаясь вверх и т. д., проходя все поля зрения до границы мазка. При увеличении микроскопа 1000x, то есть 100x для масляно-иммерсионного объектива и 10x для окуляра, при исследовании одной длины мазка (
20 мм) за один продольный проход просматривается около 100—120 полей зрения (диаметр поля зрения — 0,16 — 0,2 мм).
Микобактериозы – группа инфекционных заболеваний человека и животных, включая все виды птиц, вызываемая бактериями рода Mycobacterium.
Большинство видов микобактерий
птиц вызывают хроническую (зачастую без проявления внешней симптоматики в течение длительного периода времени) полиорганную инфекцию с поражением печени, селезенки, легких, кишечника, суставной и костной ткани.
Также процесс может протекать локально, с поражением отдельных участков кожи и прилежащих тканей (чаще в области головы либо конечностей).
Некоторые виды возбудителя являются зооантропонозными, т.е.заразны для животных и человека. К ним относятся в том числе Mycobacterium tuberculosis, M.bovis и M.avium, вызывающие у людей туберкулёз. Передача возбудителя может происходить от птицы человеку и наоборот – в равной степени и люди, болеющие туберкулёзом, несут опасность заражения для домашних птиц, проживающих с ними.
Помимо трех вышеобозначенных видов, есть и другие микобактерии (M.fortuitum, M. scrofulaceum, M. intracellulare и др.), встречающиеся у птиц и потенциально опасные для людей. Чаще они не вызывают системных поражений (тубёркулеза), однако могут провоцировать очаговые хронические дерматиты с образованием абсцессов; главным образом, к группе риска по подобным атипичным микобактериозам относятся дети младшего возраста, пожилые люди, ВИЧ-положительные, онко-больные, а также люди, проходящие химиотерапию или иммуносупрессивную терапию.
Проблема постановки диагноза на микобактериоз и лабораторной диагностики данного заболевания у птиц стоит весьма остро, и на то есть несколько причин:
1. неравномерное выделение возбудителя из организма больного животного – не каждая проба помета может нести в себе микобактерии или содержать достаточное их количество для диагностики. Отсюда вытекает две сопутствующие проблемы:
1.1 необходимость проведения серий анализов – окраска по Цилю-Нильсену, ПЦР, посевы на питательные среды– для постановки окончательного диагноза;
1.2 зачастую требуется концентрация микобактерий в материале (методом флотации) перед проведением анализа, что в разы повышает эффективность обнаружения возбудителя при любом методе диагностики (окраске, ПЦР, посевах).
2. необходимость концентрации материала приводит к последующей сложности: соответствующее оснащение лабораторий для безопасной работы с концентрированным зооантропонозным возбудителем в материале для проведения анализов. Именно за счёт повышенного риска для сотрудников при работе с концентрированными пробами единицы лабораторий (как правило, это государственные лаборатории на базе НИИ) ведут данную деятельность.
[немаловажно: риск заражения владельца прямо пропорционален длительности его проживания с зараженной птицей, т.к.птица-бактериовыделитель способствует поддержанию высокой, нарастающей концентрации микобактерий в помещении, особенно при отсутствии регулярной уборки со специфическими дез.средствами, т.к.микобактерии являются кислото-, спирто-, щёлоче-устойчивыми микроорганизмами, длительно сохраняющимися в окружающей среде]
Для диагностики микобактериозов у содержащихся в неволе птиц в России доступны следующие методы:
Окраска по методу Циля-Нильсена:
Материал: помет, мокрота, мазки со слизистых оболочек и из очагов поражения кожи, синовиальная и перитонеальная жидкость, мазки-отпечатки органов при посмертной диагностике.
Принцип метода основан на обнаружении микобактерий при микроскопии материала – в готовом мазке они окрашены в красный цвет красителем фуксином Циля, т.к.являются кислотоустойчивыми, большинство же других микроорганизмов обесцвечивается (на этапе промывания мазка серной кислотой после фуксина) и затем окрашивается в синий (на этапе завершающей окраски метиленовой синью).
| Преимущества: | Недостатки: | ||||||||||||
|
Окрашенные по методу Циля-Нильсена помёт жако – слева (более 40 микобактерий в поле зрения микроскопа), помёт сизого голубя – по центру (единичные микобактерии в поле зрения), помёт кореллы – справа (более 100 микобактерий в поле зрения). Фото автора. При последующей сдаче помёта от данных пациентов на ПЦР-диагностику только от жако с первого же раза была получена положительная ПЦР и подтвержден возбудитель M.bovis. Две другие птицы прореагировали ложно-отрицательно. Корелла прореагировала положительно при повторной ПЦР по помёту. Голубь прореагировал ложно-отрицательно при повторной ПЦР по помёту, но диагноз был подтвержден по ПЦР крови. ПЦР (полимеразная цепная реакция):Материал: кровь, помет, мокрота, мазки со слизистых оболочек и из очагов поражения кожи, синовиальная и перитонеальная жидкость, кусочки органов при посмертной диагностике.
Посевы на питательные среды:Материал: помет, мокрота, мазки со слизистых оболочек и из очагов поражения кожи, синовиальная и перитонеальная жидкость, кусочки органов при посмертной диагностике. Метод основан на культивировании (высевании) бактерий из материала на специальных питательных средах (наиболее часто используемой является среда Левенштейна-Йенсена), с целью обнаружения роста возбудителя и дальнейшего получения чистой культуры микобактерий для проведения последующей типизации.
|


