Молекулярно-генетические методы исследования при диагностике туберкулеза
С целью разработки комплекса диагностических тест-систем для быстрого выявления микобактерий туберкулеза и определения их устойчивых к антибиотикам форм создан международный консорциум, в котором Россию представляют компания "Центр перспективных технологий", МГУ им. М.В.Ломоносова и ЦНИИ туберкулеза. Планируется разработать несколько тест-систем для комплексной диагностики с применением молекулярно-генетических и иммунологических методов мультианализа микобактерий на биочипах.
Последние десятилетия во многих странах мира, независимо от их экономического статуса и уровня жизни населения, отмечается неуклонный рост заболеваемости туберкулезом (ТБ). Поэтому разработка новых методов диагностики и лечения ТБ продолжает оставаться актуальной. По данным ВОЗ [1, 2] совершенствование этих методов позволило добиться снижения смертности на 45% за период с 1990 по 2013 годы, что в абсолютных значениях составляет десятки миллионов спасенных человеческих жизней. Однако показатели по-прежнему угрожающие: по оценкам ВОЗ в 2013 году 9 млн. человек заболели туберкулезом, причем около 64% случаев заболевания были выявлены впервые. Смертность в 2013 году составила 1,5 млн. человек. Особую опасность представляют сочетание ТБ- и ВИЧ-инфекций, которые сложнее диагностировать и лечить. Около 1,1 млн. (13%) всех ТБ-больных инфицированы ВИЧ.
Существенной проблемой является устойчивость микобактерий ТБ (M.tuberculosis) к действию антибиотиков – основного средства лечения этого заболевания [3, 4]. В настоящее время выделяют следующие виды устойчивости: •множественную лекарственную устойчивость (МЛУ, англ. – multiple drug resistance, MDR) – устойчивость возбудителя ТБ к основным антибиотикам первого ряда (изониазид, рифампицин);
•широкую лекарственную устойчивость (ШЛУ, англ. – extensively drug resistance, XDR) – сочетанную устойчивость к антибиотикам первого и второго ряда (изониазид, рифампицин, фторхинолоны, аминогликозиды и др.).
Устойчивость связана с мутациями в определенных генах микобактерий, причем каждый конкретный тип устойчивости обусловлен наличием нескольких мутаций.
Исследование в разных регионах мира обнаружило более половины устойчивых возбудителей ТБ в трех странах: Индии, Китае и России. Неадекватное лечение может вызвать селективный отбор резистентных штаммов. С клинической точки зрения причинами возникновения резистентных штаммов являются поздняя диагностика первичной лекарственной устойчивости возбудителя, неадекватное или незавершенное предыдущее лечение. ШЛУ ТБ – наиболее сложный для лечения вид резистентности. Факторами риска развития ШЛУ являются первичная МЛУ, распространенный двухсторонний процесс в легких, более трех курсов химиотерапии туберкулеза в анамнезе и применение противотуберкулезных препаратов резервного ряда в предыдущих курсах химиотерапии.
Россия относится к странам с высокой заболеваемостью ТБ. Существенной и наиболее важной проблемой в развитии туберкулезной эпидемии являются распространяющиеся среди населения штаммы, устойчивые к большинству препаратов, применяемых в противотуберкулезной терапии. Особую опасность представляет рост доли ШЛУ ТБ с 4,9 до 20% [1]. Эти пациенты представляют собой опасный "резервуар" устойчивых инфекций, на которые не действуют известные антибиотики. Возникает серьезная угроза неконтролируемого распространения штаммов микобактерий, обладающих ШЛУ. Заболевание передается воздушно-капельным путем, что создает угрозу его распространения в крупных городах с высокой плотностью населения и большими потоками мигрантов, значительная часть которых не обследована. Поэтому так важно воспрепятствовать увеличению случаев заболевания тяжелыми формами ТБ, которые характеризуются высокой смертностью.
Поскольку лекарственная резистентность обусловлена мутациями в генах микобактерий ТБ, перспективным является применение методов молекулярно-генетического анализа. В последние годы активно развиваются технологии секвенирования и мультиплексного молекулярно-генетического анализа: мультиплексная ПЦР, ПЦР в режиме реального времени, ПЦР с дальнейшей гибридизацией на биочипах различного типа [5–7]. Секвенирование в основном используется в научных исследованиях, так как для практического применения в клинических лабораториях эта технология сложна, характеризуется высокой стоимостью оборудования и имеет ограничения, связанные с вероятностью ложных результатов.
Разнообразие форм устойчивости и наличие штаммов, резистентных одновременно к нескольким препаратам, требуют развития технологий мультианализа микобактерий туберкулеза на биочипах для ускоренного обнаружения возбудителя и определения его устойчивости к антибиотикам как первого, так и второго ряда в одном анализе. Мультиплексный анализ на биочипах позволяет выявить десятки, сотни и даже тысячи видоспецифичных генетических последовательностей, а также генетических вариаций, определяющих резистентность микобактерий к антибактериальной терапии.
Компания "Центр перспективных технологий", МГУ им. М.В. Ломоносова и ЦНИИ туберкулеза участвуют в международном проекте "Мульти-ТБ" по созданию биочипа, позволяющего идентифицировать множество генов и наличие мутаций в них в одном анализе. Иностранные партнеры проекта представлены немецкой научной группой биоаналитики и биопроцессов Института клеточной терапии и иммунологии общества Фраунхофера (Fraunhofer Institute for Cell Therapy and Immunology, Branch Bioanalytics and Bioprocesses) и немецкой компанией LIONEX Diagnostics & Therapeutics. Задачей международного консорциума является разработка комплекса диагностических тест-систем для быстрого выявления микобактерий ТБ и определения их устойчивых к антибиотикам форм на основе молекулярно-генетической и иммунологической диагностики. В рамках проекта предполагается создать несколько типов диагностических систем.
Все разработанные к настоящему времени и зарегистрированные для практического применения методы имеют ограничения, связанные с недостаточной мультиплексностью или сложностью и высокой стоимостью анализа. Ни один из методов не позволяет одновременно выявлять микобактерии ТБ и определять их устойчивость к препаратам как первого, так и второго ряда. Как правило, технологии, обеспечивающие высокую мультиплексность, являются трудоемкими, длительными по времени и требуют дорогостоящих компонентов и оборудования, что ограничивает их применение в реальной практике.
В проекте "Мульти-ТБ" планируется разработать несколько диагностических тест-систем, которые позволят проводить комплексную диагностику в три этапа. Первый этап предполагает быстрый анализ мокроты, который позволит обнаружить микобактерии в течение нескольких минут с использованием специфических антител, меченных наночастицами золота. Для подтверждения положительных результатов будет разработана тест-система на основе биочип-картриджа, сочетающего мультианализ на биочипе и флюидные технологии. В качестве специфических реагентов для определения специфического паттерна антител пациента будут использованы белковые маркеры-антигены. На этот же биочип будут добавляться антигены ВИЧ для одновременного обнаружения ко-инфекции ТБ и ВИЧ. Для третьего этапа диагностики будут разработаны молекулярно-генетические методы обнаружения генетических маркеров лекарственной устойчивости микобактерий на основе мультианализа на биочипах.
В связи с необходимостью проведения масштабных скрининговых исследований распространения возбудителей ТБ и его антибиотикоустойчивых форм при выработке стратегии основное внимание будет уделяться производительности технологий, времени проведения анализа и возможности внедрения в диагностические лаборатории различного уровня.
Российскими партнерами будет разработана диагностическая тест-система молекулярно-генетического мультианализа для ускоренного обнаружения микобактерий ТБ и определения их устойчивости к препаратам как первого, так и второго ряда в одном анализе. Технологическое решение будет основано на колориметрической детекции, преимущества которой были показаны при идентификации устойчивости бактерий к бета-лактамным антибиотикам [8]. Качественное изменение по сравнению с существующими в настоящее время молекулярно-генетическими методами будет заключаться в принципиальном расширении набора генетических маркеров для идентификации типа устойчивости одновременно к антибиотикам первого и второго ряда. Качественное изменение технологии биочипов будет состоять в выборе способов их изготовления, проведения гибридизационного анализа и детекции. Для упрощения методики, сокращения времени анализа и его адаптации к возможностям клинических лабораторий биочипы будут нанесены методом контактной печати в лунки 96-луночных планшетов (рис.1), разделенных на 8-луночные стрипы. Это позволит упростить стадии гибридизации, детекции и отмывки, которые могут быть выполнены с использованием стандартного оборудования для иммуноферментного анализа, доступного для лабораторий различного уровня. Будет проведена оптимизация условий гибридизационного анализа с целью сокращения времени при сохранении необходимых чувствительности и специфичности. Возможность автоматизации различных стадий анализа способствует сокращению общего времени анализа.
Колориметрическая система детекции будет основана на использовании биотина в качестве метки ДНК и выявлении его конъюгатом стрептавидина с ферментом пероксидазой. О положительном результате комплементарной гибридизации будет свидетельствовать окрашивание зоны биочипа (рис.2), регистрируемое оптическим методом. Это позволит разработать более дешевую систему детекции по сравнению с часто используемой в настоящее время флуоресцентной.
Для оптимизации технологии молекулярно-генетической идентификации туберкулеза эффективным инструментом является сканирующая зондовая микроскопия, которая позволяет прямым образом наблюдать состояние поверхности биочипа как при его производстве, так и в процессе его использования для диагностики (рис.3, 4). В работах [9, 10] представлен краткий обзор применения атомно-силовой микроскопии (АСМ) для изучения поверхности микрочипов с иммобилизованными олигонуклеотидными зондами и анализа результатов гибридизации ДНК-мишени; развиты подходы для основанного на АСМ количественного анализа ДНК на микрочипах с использованием таких параметров как высота, площадь и объем объектов на АСМ-изображениях; рассмотрены результаты АСМ-исследований поверхности ДНК-микрочипов до и после гибридизации, а также по детектированию ДНК с использованием золотых наночастиц в качестве метки.
К прямым методам обнаружения микобактерий туберкулеза можно отнести и бурно развивающиеся в последние годы подходы, сущность которых состоит в выявлении в исследуемых образцах диагностического материала специфических фрагментов цепи ДНК возбудителя. Среди применяемых для этого молекулярно-биологических методик наиболее широкое распространение получил метод полимеразной цепной реакции (ПЦР), в основе которого лежит многократное увеличение числа копий специфического участка ДНК (так называемая направленная амплификация ДНК): 20 циклов ПЦР приводят к увеличению исходной ДНК в 1 миллион раз, что позволяет визуализировать результаты методом электрофореза в агарозном геле. Очень высокий уровень чувствительности (95 % и более), являющийся главным достоинством метода, достигается за счет того, что в результате многократного копирования уровень специфической олигонуклеотидной последовательности в редакционной пробе возрастает в 106 раз. По своей чувствительности метод ПЦР при туберкулезе органов дыхания в два раза превосходит эффективность культуральной диагностики.
Метод особенно актуален для туберкулеза, поскольку эффективен в отношении возбудителей с высокой антигенной изменчивостью, определение которых требует длительного культивирования или сложных питательных сред.
ПЦР-диагностика туберкулеза, как правило, строится на использовании последовательностей ДНК специфичных для всех 4 видов группы туберкулеза. Часто для этих целей используют праймеры для выявления последовательностей IS-элементов, например, IS-986 или IS-6110, поскольку данные мигрирующие элементы характерны только для видов микобактерий группы туберкулеза и присутствуют в геноме микобактерий в числе нескольких копий. Выделение ДНК из чистых культур и клинических образцов (мокроты больных) возможно осуществлять любым приемлемым методом, например, методом Boom с использованием лизирующего буфера на основе гуанидина, тиоционата и двуокиси кремния в качестве носителя ДНК.
Проведение ПЦР-диагностики туберкулеза
В качестве примера праймеров [49] для идентификации микобактерий группы туберкулеза можно привести праймеры, фланкирующие фрагмент размером 245 пар нуклеотидов мигрирующего элемента IS-986, содержащегося в геноме M.tuberculosis в числе 2-8 копий.
Амплифицированный фрагмент выявляют электрофорезом в 1,6 % агарозном геле.
Данная пара праймеров была проверена на специфичность с использованием в качестве контроля 100 нг/проба ДНК близкородственных микроорганизмов; ДНК возбудителей легочных заболеваний; ДНК микроорганизмов, входящих в микрофлору человека (например, E.coli, S. aureus и др.); образцов ДНК человека.
Испытания данной пары праймеров с параллельным бактериоскопическим и культуральным обследоваванием были проведены на клинических образцах мокроты, полученных от больных с различными клиническими формами туберкулеза. Методом ПЦР возбудитель был выявлен у 90,6% больных туберкулезом, в то время как значительно более длительными по времени микробиологическими методами микобактерии были выявлены только у 39,6% больного.
Роль молекулярной диагностики в клинической практике повышается, поскольку увеличивается число больных со скудным бактериовыделением.
Однако применение метода ПЦР чревато получением большого количества ложноположительных результатов, обусловленных как техническими погрешностями, так и особенностями самого метода. Кроме того, метод не позволяет определять степень жизнеспособности выявляемых микобактерий.
Основным недостатком ПЦР является опасность лабораторной контаминации микобактериальной ДНК. Поэтому в настоящее время разработаны достаточно жесткие сертификационные требования для ПЦР-лабораторий, предусматриваюшие наличие трех изолированных помещений. ПЦР - это сложная современная технология, использование которой требует помимо соответствующей аппаратуры наличия высококвалифицированного персонала.
Таким образом, при постановке диагноза результаты ПЦР являются дополнительными и должны сопоставляться с данными клинического обследования, рентгенографии, микроскопии мазка, посева и даже ответа на специфическое лечение.
Похожие темы научных работ по фундаментальной медицине , автор научной работы — Журавлев Вячеслав Юрьевич, Арчакова Л.И., Маничева О.А., Виноградова Т.И., Елькин А.В.
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ В ДИАГНОСТИКЕ И ТЕРАПИИ ТУБЕРКУЛЕЗА ЛЕГКИХ
В. Ю. Журавлев, Л. И. Арчакова, О. А. Маничева, Т. И. Виноградова, А. В. Елькин,
Санкт-Петербургский НИИ фтизиопульмонологии, г. Санкт-Петербург
Напряженная эпидемическая ситуация по туберкулезу в Российской Федерации обусловлена несколькими факторами, а именно поздней диагностикой специфического поражения, циркуляцией в популяции штаммов возбудителя с множественной резистентностью к противотуберкулезным препаратам, высокой заболеваемостью лекарственно-резистентными формами, недооценкой наследственной предрасположенности к туберкулезу и, как следствие, низкой эффективностью терапии.
Целью нашего исследования была оценка молекулярно-генетических методов в опти-100
мизации этиологической диагностики, химиотерапии туберкулезного процесса и изучении наследственной предрасположенности к туберкулезу органов дыхания.
Материал и методы
Рис. Схема размещения дискриминирующих олигонуклеотидов для одновременного обнаружения возбудителя туберкулеза и выявления мутаций, приводящих к устойчивости к рифампицину и изониазиду. ТБ-БИОЧИП (МДР)
ли славянской национальности, проживали в северо-западном регионе России.
Результаты подвергнуты обработке с помощью непараметрического критерия %2 с поправкой Йетса. Показатель относительного риска развития заболевания (RR) определяли методом Вульфа. Показатель RR выше 1 принимали за значимый, если RR был меньше 0,5 — ассоциацию расценивали как достоверно отрицательную.
Результаты и их обсуждение
Наиболее опасными в клиническом и эпидемиологическом плане являются штаммы МБТ с множественной лекарственной устойчивостью, характеризуемые одновременным наличием лекарственной устойчивости к наиболее эффективным противотуберкулезным препаратам первого ряда — рифам-пицину и изониазиду.
Мишенью рифампицина (R) является РНК-полимераза. В присутствии рифампицина РНК-полимераза не в состоянии удлинять дочернюю цепочку РНК после присоединения нескольких первых рибонуклеотидов. Таким образом, синтезируются только очень короткие олигомеры. Мутации, вызывающие устойчивость к рифампицину, расположены в гене rpoB [9]. Несмотря на довольно значительный размер белка — 1172 аминокислоты,— у M. tuberculosis почти все мутации происходят в сегменте гена rpoB, состоящем из 81 основания и кодирующем аминокислоты 507—533.
Мутации в гене rpoB определены в 323 (67%) случаях. При этом чаще всего определяли замену в кодоне 531 у 164 (50,8%), в том числе Ser531-Leu — у 136 (42,3%) пациентов. Данная мутация наиболее распространена среди устойчивых к R штаммов в мире и чаще всего связана с генотипом Beijing [5].
Другие вариации мутаций в этом кодоне встречались значительно реже (p Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Определение групп риска по параметрам возникновения и неблагоприятного течения туберкулеза органов дыхания очень важно и связано с идентификацией генов, от которых зависит восприимчивость или резистентность организма человека к туберкулезной инфекции, в частности генов II класса главного комплекса гистосовместимости локусов HLA-DRB1* и HLA-DQB1*.
Для локуса HLA-DRB1* известно 13 типов аллелей, распределение которых изучено у пациентов с туберкулезом легких (n=114) и здоровых доноров (n=434). Анализируя результаты, полученные при проведении исследования, можно констатировать, что 16 аллель достоверно более часто фиксировался у больных туберкулезом органов дыхания (17,5% против 6,9% у здоровых; р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
ahpC-oxyR genes), and rifampicin (rpoB gene) was studied. Hereditary predisposition to tuberculosis of the lungs on the basis of molecular genetic typing of class II genes of the main HLA-DRB1* and HLA-DQB1* loci histocompatibility complex was investigated. Application of molecular genetic technologies permits to identify simultaneously mutations responsible for sensitivity of tuberculosis agent to the basic antituberculous preparations, to form the groups with elevated risk of unfavourable effect of tuberculous lesion, to fulfill intensive individualized therapy and to raise efficiency of treatment.
Keywords: tuberculosis, diagnosis, nano-chips, resistance, HLA-typing, hereditary predisposition.
Контактная информация: Журавлев Вячеслав Юрьевич, канд. мед. наук, доцент, зав. лабораторией молекулярно-генетических исследований Санкт-Петербургского НИИ фтизиопульмонологии, 191036, г. Санкт-Петербург, Лиговский пр, 2/4, тел. 8 (812) 950-25-84
К прямым методам обнаружения микобактерий туберкулеза можно отнести и бурно развивающиеся в последние годы подходы, сущность которых состоит в выявлении в исследуемых образцах диагностического материала специфических фрагментов цепи ДНК возбудителя. Среди применяемых для этого молекулярно-биологических методик наиболее широкое распространение получил метод полимеразной цепной реакции (ПЦР), в основе которого лежит многократное увеличение числа копий специфического участка ДНК (так называемая направленная амплификация ДНК): 20 циклов ПЦР приводят к увеличению исходной ДНК в 1 миллион раз, что позволяет визуализировать результаты методом электрофореза в агарозном геле. Очень высокий уровень чувствительности (95 % и более), являющийся главным достоинством метода, достигается за счет того, что в результате многократного копирования уровень специфической олигонуклеотидной последовательности в редакционной пробе возрастает в 106 раз. По своей чувствительности метод ПЦР при туберкулезе органов дыхания в два раза превосходит эффективность культуральной диагностики.
Метод особенно актуален для туберкулеза, поскольку эффективен в отношении возбудителей с высокой антигенной изменчивостью, определение которых требует длительного культивирования или сложных питательных сред.
ПЦР-диагностика туберкулеза, как правило, строится на использовании последовательностей ДНК специфичных для всех 4 видов группы туберкулеза. Часто для этих целей используют праймеры для выявления последовательностей IS-элементов, например, IS-986 или IS-6110, поскольку данные мигрирующие элементы характерны только для видов микобактерий группы туберкулеза и присутствуют в геноме микобактерий в числе нескольких копий. Выделение ДНК из чистых культур и клинических образцов (мокроты больных) возможно осуществлять любым приемлемым методом, например, методом Boom с использованием лизирующего буфера на основе гуанидина, тиоционата и двуокиси кремния в качестве носителя ДНК.
29. Лучевые методы исследования туберкулеза.
В развитии фтизиатрии лучевые методы исследования обогатили знания клиницистов в отношении развития, проявления и течения чрезвычайно разнообразных форм туберкулеза и помогли решить ряд практических задач в области борьбы с данным заболеванием.
Распознавание большинства форм туберкулеза в основном основывается на результатах рентгенологического метода исследования, который является связующим звеном между клиникой и патологической анатомией, обладает документальностью и обеспечивает возможность динамического наблюдения.
К методам лучевой диагностики при туберкулезе легких относятся:
цифровая малодозная флюорография;
различные виды томографии, в том числе компьютерная томография (КТ);
ультразвуковое исследование (УЗИ) грудной клетки.
Крупнокадровая флюорография (размер кадров 70×70,100×100 и 110×110 мм), широко использовавшаяся ранее при массовых флюорографических обследованиях населения, уступает место прогрессивным высокотехнологичным цифровым методам исследования.
Цифровая малодозная флюорография. За последнее десятилетие в нашей стране создано несколько типов цифровых флюорографов, в которых с помощью ЭВМ цифровое изображение органов грудной клетки выводится на экран видеомонитора для визуального анализа. Цифровой метод позволяет получить снимок на экране уже через несколько секунд после экспозиции, которая имеет длительность всего лишь 0,01 — 0,05 с.
Рентгеноскопия относится к методам углубленного рентгенологического исследования, проводится строго по показаниям и его объем определяется характером патологического процесса и поставленной задачей.
Особенностью рентгеноскопии является возможность обзора всех образований грудной полости: легких, сердца, крупных сосудов, диафрагмы. Она играет важную роль не только в уточнении топографии патологических образований (отношение к костным компонентам грудной клетки, плевральным листкам, легочной ткани или органам средостения), но и в оценке функции органов.
Рентгенография. В большинстве случаев прямую обзорную рентгенограмму дополняют рентгенографическим исследованием в боковой проекции, что позволяет выявлять изменения в междолевых плевральных пространствах, в области корней легких.
Рентгенограммы в боковых проекциях позволяют определить локализацию патологического процесса по долям и сегментам и служат основой для назначения глубины оптимальных срезов при проведении томографического исследования.
На рентгенограммах грудной клетки, выполненных в косых проекциях (при повороте больного относительно фронтальной плоскости на 30—45°), отчетливее выделяются изменения реберной, верхушечной, междолевой и средостенной плевры, поражения нижних отделов легких.
Томография — послойное рентгенологическое исследование грудной клетки, дающее возможность получения снимков без суммационного эффекта, поскольку элементы других слоев легочной ткани при съемке меняют свое проекционное положение на пленке и не дают четкого изображения. Разработаны различные виды томографии: линейная томография с различной толщиной выделяемого слоя, зависящая от угла поворота рентгеновской трубки; томография с размазыванием — продольным, косым, поперечным. Томографическое исследование можно проводить в вертикальном и горизонтальном положениях и в различных проекциях — прямой, боковой, косых.
Рентгеноконтрастные методы. Для исследования применяют в основном водорастворимые рентгеноконтрастные вещества.
Бронхография — специальный метод получения изображения бронхиального дерева; может быть общей и селективной (осуществляется с помощью направленного введения катетера). Бронхография позволяет получать изображения мелких бронхов до уровня деления бронхов 3-5-го порядка и выявлять их деформацию: расширение, сужение, искривление, изменение топографии; уточнять наличие связи полостных образований с дренажными бронхами.
Фистулографию и плеврографию применяют в клинике грудной хирургии после резекций легких различного объема в случаях осложнений: бронхоторакальный, бронхоплевроторакальный свищ, остаточная плевральная полость, бронхо- и плевропищеводный свищ.
Ангиопульмонография применяется для уточнении морфологии и функции сосудов малого круга: выявления артериовенозных аневризм, варикозного расширения легочных вен, исследования бронхиальных артерий, определения источника кровохарканья. Во фтизиатрической клинике метод имеет наибольшее значение при так называемом разрушенном легком, фиброзно-кавернозном и цирротическом туберкулезе.
Рентгенологическое исследование с использованием в виде контрастного вещества воздуха (пневмомедиастинография) производится для диагностики поражений средостения (опухоли, кисты) или для уточнения отношения патологического образования к легочной ткани, грудной клетке или диафрагме (диагностический пневмоторакс).
Диагностика с помощью КТ основана на прямых рентгенологических симптомах, т. е. определении точной локализации, формы, размеров отдельных органов и патологических очагов, и, что особенно существенно, на показателях их плотности.
Компьютерные томографы 5-го поколения позволяют оценивать состояние легочной паренхимы на уровне дольковых и внутридольковых структур, а спиральная КТ дает трехмерное объемное изображение органа, приближенное к его реальной морфофункциональной характеристике.
Радионуклидная пневмосцинтиграфия применяется в основном у взрослых пациентов для выявления функциональных нарушений регионарного капиллярного кровотока и вентиляции легких.
Ультразвуковое исследование (УЗИ) дает информацию о состоянии плевры, плевральной полости, субплевральных отделах легочной ткани, диафрагмы, синусов.
Метод допплерэхокардиографии является наиболее распространенным непрямым методом измерения давления в легочной артерии; его результаты хорошо коррелируют с данными, полученными при катетеризации правых отделов сердца. С помощью допплерографии можно определить систолическое и диастолическое давление в легочной артерии (непрерывноволновой допплер); или среднее давление (допплер — эхокардиография в импульсном режиме).

В 2004 году по инициативе д.м.н., профессора Михаила Александровича Владимирского, заведующего сектором молекулярной диагностики туберкулёза НИИ Фтизиопульмонологии Первого МГМУ им. И.М.Сеченова, мы начали разработки в области ПЦР-диагностики туберкулёза.
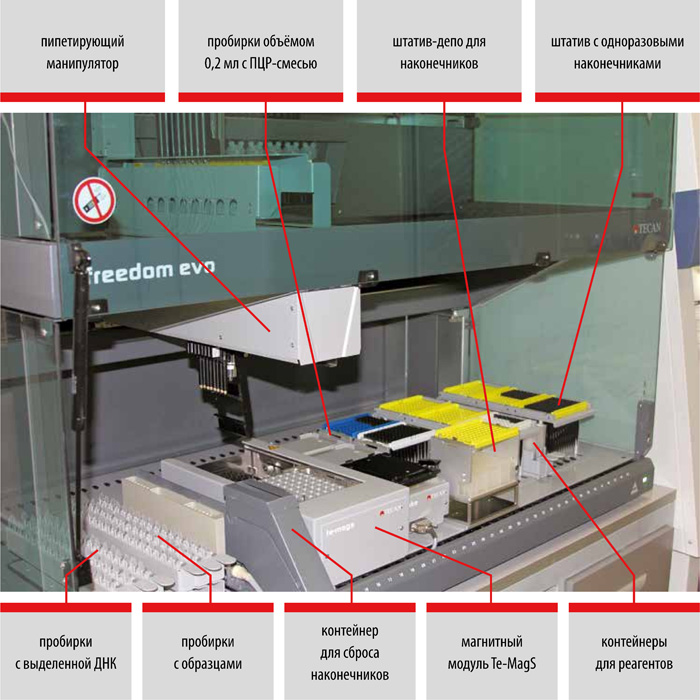
Выделение ДНК: использование оригинальных реагентов и магнитных частиц обеспечивает получение максимального количества чистой ДНК и позволяет автоматизировать процесс выделения ДНК.
ПЦР в реальном времени: одновременная детекция нескольких различных участков генома комплекса микобактерий туберкулёза (МБТ) увеличивает информативность и достоверность анализа.
I этап – Пробоподготовка, инактивация
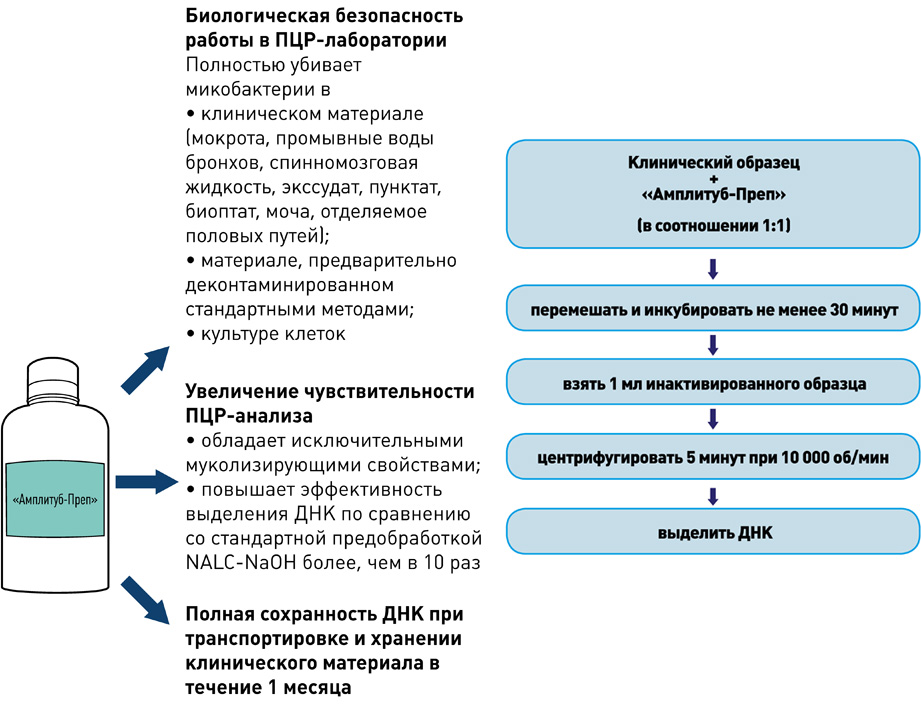
II этап – Выделение ДНК
набор реагентов для выделения ДНК (на магнитных частицах)
набор реагентов для выделения ДНК микобактерий из клинических образцов и культур клеток на автоматизированных станциях TECAN

- Снижение риска контаминации во время выделения ДНК практически до нуля.
- Значительное уменьшение трудоёмкости процесса выделения ДНК.
- Стандартизированное выделение ДНК из клинических образцов.
- Экономическая выгода: низкий расход пластика и реактивов.
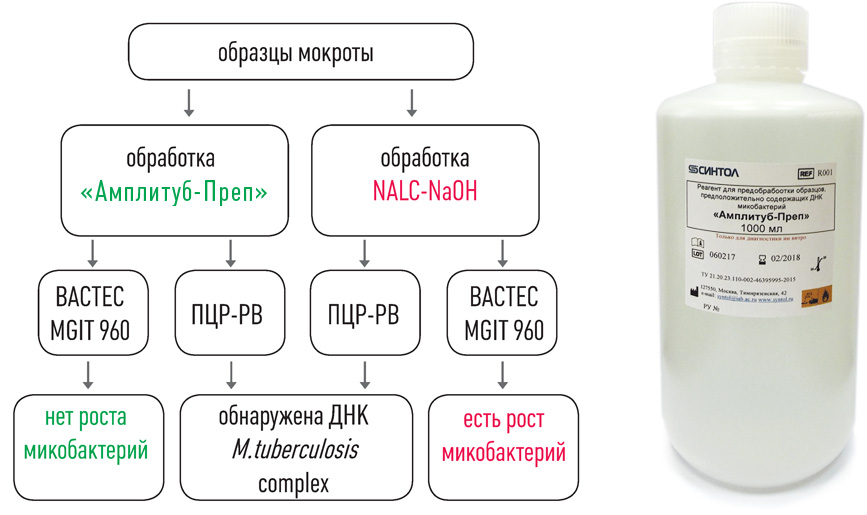
набор реагентов для ускоренной пробоподготовки и выделения ДНК микобактерий из образцов мокроты
III этап – ПЦР в реальном времени
Обнаружение и количественное определение комплекса МБТ
Набор реагентов АМПЛИТУБ-РВ — это:
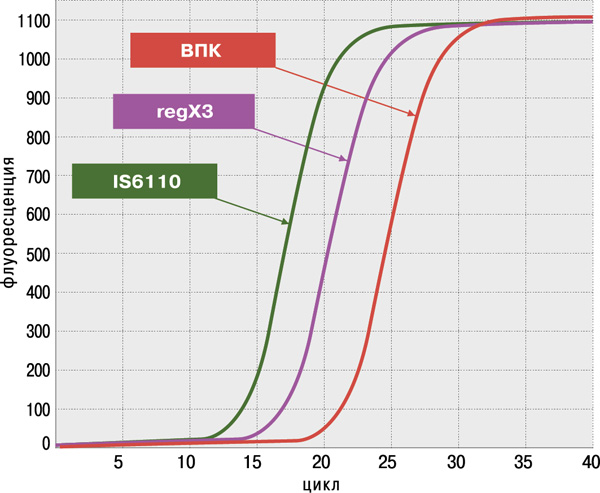
- высокая достоверность анализа благодаря одновременному обнаружению двух специфичных генов M.tuberculosis complex: IS6110 и regX3;
- оценка пригодности образца ДНК для определения антибиотикоустойчивости;
- высокая чувствительность (не более 100 КОЕ/мл мокроты или 1–10 копий фрагментов ДНК в реакции) и 100%‑ая специфичность, подтверждённые на панели QCMD (Quality Control for Molecular Diagnostics) Mtb EQA (UK).
Определение антибиотикоустойчивости МБТ к препаратам I и II ряда
Наборы реагентов АМПЛИТУБ-МЛУ-РВ, АМПЛИТУБ-FQ-РВ — это:
- диагностика форм туберкулеза с лекарственной устойчивостью, в том числе множественной лекарственной устойчивостью (МЛУ) и широкой лекарственной устойчивостью (ШЛУ);
- быстрая детекция мутаций M.tuberculosis, ассоциирующихся с устойчивостью к антибиотикам первого и второго ряда (рифампицину, изониазиду, этамбутолу, фторхинолонам);
- достоверность результатов, ежегодно подтверждаемая при проведении Федеральной службой внешней оценки качества (ФСВОК) Росздравнадзора испытаний шифрованных тест-культур и образцов.
Наборы АМПЛИТУБ-МЛУ-РВ и АМПЛИТУБ-FQ-РВ основаны на использовании оригинальной мультиконкурентной аллель-специфичной методики ПЦР в реальном времени, позволяющей выявлять мутации в генах микобактерий туберкулеза, ответственных за устойчивость к конкретным антибиотикам.

Принцип мультиконкурентной аллель-специфичной методики ПЦР в реальном времени
- В формате одной пробирки используются 5’-флуоресцентно-меченые аллель-специфичные праймеры с общим комплементарным им 3’-меченым олигонуклеотидом-гасителем и контрольный флуоресцентный зонд, комплементарный участку ДНК без мутаций.
- При отсутствии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается только по флуорофору зонда.
- При наличии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается как по флуорофору зонда, так и по флуорофору 5’-флуоресцентно-меченого аллель-специфичного праймера. Данный метод позволяет определить не только точку мутации, но и процент устойчивого мутантного штамма МБТ на фоне дикого.
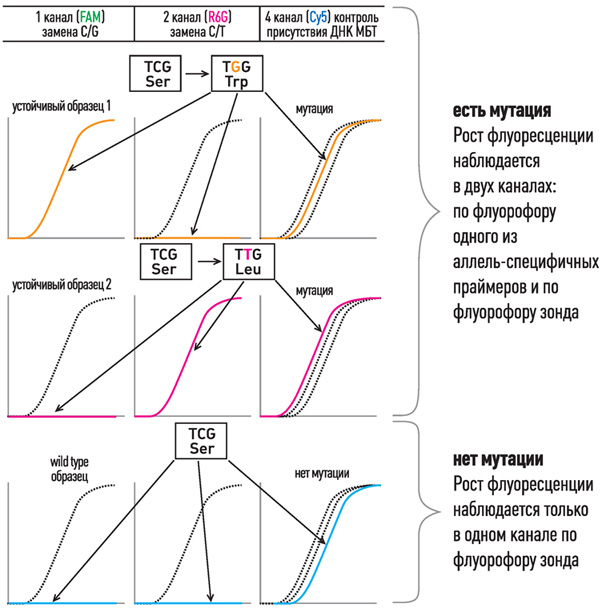
Интерпретация результатов выявления мутаций на примере
531 кодона rpoB гена M.tuberculosis
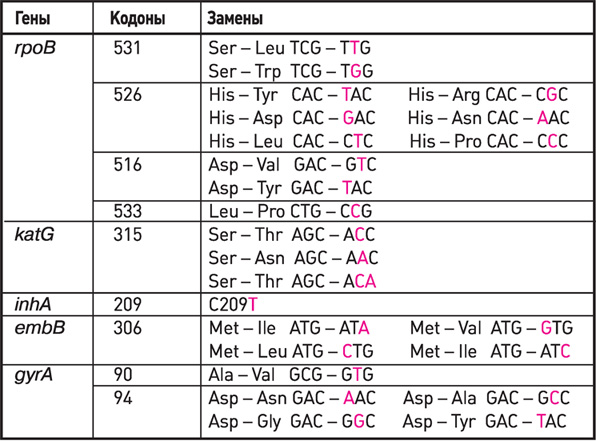
Гены, кодоны, замены, используемые в наборах реагентов
АМПЛИТУБ-МЛУ-РВ при определении антибиотикоустойчивости
Использование автоматизированных станций Freedom EVO (TECAN, Швейцария) для молекулярно-генетической диагностики туберкулёза
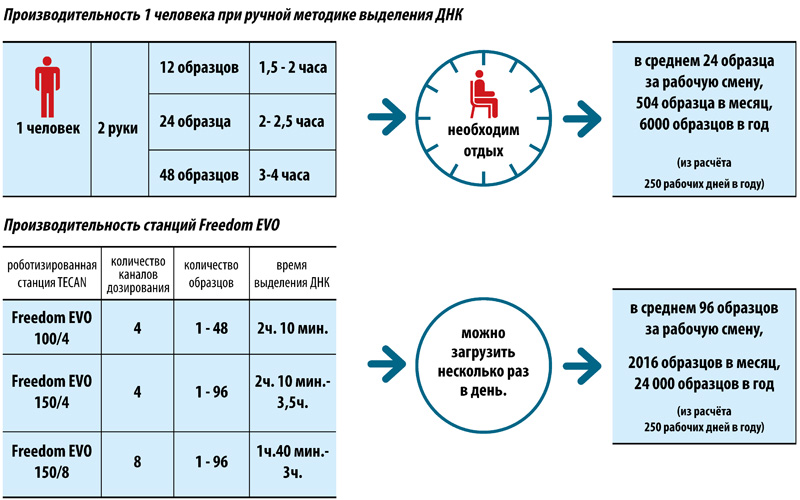

Трудозатраты — 1 час
Продолжительность выделения ДНК — не более 2 часов
Подготовка к амплификации и ПЦР-РВ — 1,5 часа
ИТОГО: результаты анализа будут готовы через 3,5 часа
Оператор затратит 1 час своего рабочего времени.
Читайте также:


