Интоксикационный синдром при туберкулезе органов дыхания
Туберкулез – это инфекционное заболевание вызываемое микобактерией туберкулеза (Mycobacterium tuberculosis) палочкой Коха. Возбудитель туберкулеза был открыт Робертом Кохом в 1882 году.
Туберкулез легких наносит существенный экономический урон населению. Это связано с увеличением количества больных и умерших от туберкулеза в связи с миграцией населения (незаконные мигранты, беженцы), голодом и засухой в ряде стран, перенаселением, появлением лекарственно устойчивых форм возбудителя.
В России туберкулез выявляют у 80 человек на 100 тысяч населения. Смертность от туберкулеза составляет в России около 16-18%.
Пути инфицирования и механизм развития болезни
Основной путь передачи возбудителя – воздушно-капельный. При разговоре, кашле, чихании из дыхательных путей больного туберкулезом во внешнюю среду выбрасывается аэрозоль (слизь и слюна) содержащий возбудителя - Mycobacterium tuberculosis . Палочка туберкулеза попадает на слизистые оболочки и либо вдыхается в легкие, либо проглатывается. Процесс занесения инфекции в данном случае называется первичное тубинфицирование. При попадании Mycobacterium tuberculosis непосредственно в легкие вероятность заболеть у здорового человека в несколько раз выше, чем при попадании в желудочно - кишечный тракт. Это объясняется в первую очередь агрессивной средой желудка, через которую Mycobacterium tuberculosis обычно пройти без разрушения не может.
В первое время палочка туберкулеза остается незамеченной иммунной системой, что позволяет ей беспрепятственно размножаться в больших количествах.
Mycobacterium tuberculosis хорошо размножается и расселяется в тканях с богатой микроциркуляцией и хорошим лимфообращением. К таким органам относят легкие, почки, эпифизы костей, лимфатические узлы. Именно по этой причине чаще всего встречается туберкулезное поражение этих органов. Дальнейшая судьба пациента определяется состоянием его иммунной системы. При нормальной фагоцитирующей активности макрофагов, развитие туберкулеза удается остановить. При дефиците иммунитета в т.ч. вызванном алиментарными факторами (голод, авитаминоз, сахарный диабет, ВИЧ и т.д.) – болезнь начинает развиваться.
В пораженных органах образуются особые шарообразные очаги воспаления состоящие из характерных гранулем. В центре гранулем содержится казеозный (творожистый) некроз и большое количество возбудителей - Mycobacterium tuberculosis. При распаде гранулем возможен выход Mycobacterium tuberculosis во внешнюю среду – это т.н. открытая форма туберкулеза. Больной с открытой формой опасен для окружающих. При сохранении целостности гранулем и тканей пораженных туберкулезом – пациент не выделяет палочку туберкулеза и такая форма называется закрытой.
Существует множество вариантов туберкулезного поражения легких, однако, для широкого круга читателей они малопонятны.
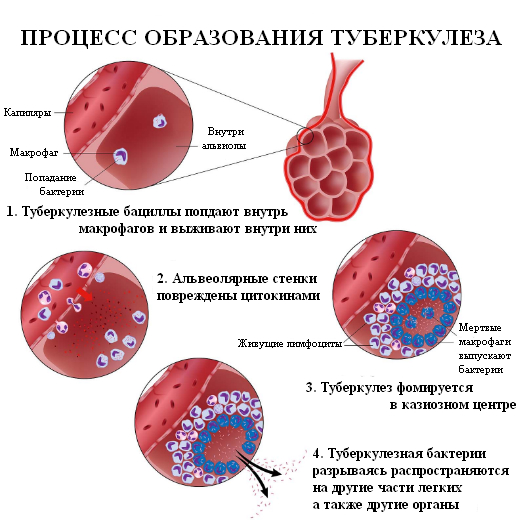
Признаки и симптомы туберкулеза (клинические проявления)
Характерных только для туберкулеза легких симптомов нет. Наиболее часто встречаются кашель, одышка, кровохарканье и проявления туберкулезной интоксикации.
Кашель связан с воспалением в легких больного, а так же с вовлечением в процесс внутригрудных лимфатических узлов. Кашель может быть сухим надсадным, может быть с мокротой обычно слизистого характера.
При деструктивных (распадающихся) и запущенных формах туберкулеза легких часто встречается кровохарканье. Кровохарканье обычно бывает незначительным, но может принимать характер легочного кровотечения с развитием анемии.
Одышка часто встречающийся симптом при обширном поражении легких, при запущенных формах туберкулеза. Одышка является следствием недостатка кислорода и может приводить к полному ограничению физической активности больного.
Важным симптомокомплексом при туберкулезе легких является – синдром интоксикации. Интоксикация развивается в следствии всасывания в кровь продуктов распада тканей и воспаления.
Симптомами хронической туберкулезной интоксикации становятся:
- Снижение массы тела
- Бледность кожного покрова
- Румянец на щеках
- Сонливость (интоксикация и гипоксия мозга)
- Субфебрильная температура тела
- Потливость по ночам
- Нарушения аппетита
Диагностика туберкулеза легких
Различают инструментальные, лабораторные и иммунологические методы диагностики туберкулеза. В современной медицинской практике используют все методы одновременно.
Инструментальный метод:
Кроме того используют фибробронхоскопию со смывами с бронхиального дерева и (или) биопсией слизистой оболочки.
В отдельных случаях используют видеоторакоскопию и биопсию легкого и (или) плевры, внутригрудных лимфатических узлов.
Лабораторные методы диагностики туберкулеза:
Бактериоскопия мокроты и промывных вод бронхов. Метод позволяет при окрашивании материала по Цилю-Нильсену (специальная методика окраски, при которой Mycobacterium tuberculosis приобретаех характерный вид) обнаружить возбудителя туберкулеза.
Исследование плевральной жидкости на Mycobacterium tuberculosis
Исследование биопсийного материала легкого, плевры, лимфатических узлов – после соответствующей окраски по обнаружению в них либо Mycobacterium tuberculosis либо специфических туберкулезных гранулем.
Иммунологические методы диагностики туберкулеза
В настоящее время в комплексной диагностике туберкулеза легких используют:
Современным методом диагностики является Диаскинтест. Он представляет собой экспресс метод диагностики туберкулеза. Выполняется похожим на пробу Манту образом внутрикожная инъекция специального раствора, который содержит белки, характерные только для возбудителей туберкулеза. Диаскинтест дает положительный результат только у зараженных и больных туберкулезом. Диаскинтест более специфичным и эффективным методом диагностики туберкулеза легких, чем проба Манту.
Лечение туберкулеза легких
Базисную терапию составляют многокомпонентные схемы противотуберкулезных антибактериальных препаратов (три, четыре, пять), которые применяются длительно. Особую проблему составляют ежегодно увеличивающиеся резистентные штаммы, нечувствительные ни к каким противотуберкулезным препаратам.
Второй компонент лечения туберкулеза – это хирургия. Хирургическое лечение применяют при деструктивных формах туберкулеза, при осложнениях (эмпиема, кровотечение, пневмоторакс и т.д.).
Третий компонент – борьба с интоксикацией, в т.ч. от применения антибактериальных противотуберкулезных препаратов. Для этой цели используют сорбенты, витамины, инфузионную терапию, гепатопротекторы и т.д.
Четвертый компонент – борьба с дыхательной недостаточностью. Тяжелое поражение легких и интоксикация приводят к смешанной форме кислородной недостаточности (гипоксии). Гипоксия существенно осложняет течение болезни и лечение. Для борьбы с гипоксией используют кислородотерапию . Для подачи увлажненного кислорода в организм больного используют кислородный аппарат - кислородные концентраторы для дома или в стационаре. Доказано, что длительная кислородотерапия улучшает течение и прогноз бронхо-легочных заболеваний сопровождающихся гипоксией, в т.ч. и туберкулеза легких. Следует иметь ввиду, что при использовании концентратора кислорода, у пациентов с туберкулезом легких, необходимо чаще проводить замену фильтров у аппарата и назальных канюль.
Какой кислородный концентратор выбрать для кислородной терапии при туберкулезе легких?
Абсолютными лидерами по классу надежности и доверия опытных врачей-специалистов являются кислородные концентраторы, произведенные в Германии.
Основными достоинствами этих аппаратов являются: высокая надежность, стабильность работы, продолжительный срок службы, самый низкий уровень шума, высококачественная система фильтрации, наличие самых последних разработок в системе сигнального оповещения.
Условно, на второе место можно поставить кислородные аппараты, производимые в США. Они мало чем уступают по основным характеристикам немецким аппаратам, но, пожалуй, самый главный их минус – это цена покупки. Хотя нельзя не отметить вес американских приборов, они самые легкие в классе стационарных кислородных концентраторов (вес некоторых моделей аппаратов достигает всего лишь 13,6 кг.).
Из числа бюджетных моделей кислородных концентраторов, рекомендуем обратить внимание на надежные приборы, разработанные и произведенные в Китае торговой марки Армед (Armed).
Главный плюс этих аппаратов – это их низкая цена по сравнению с западными кислородными аппаратами.
Для ценителей дополнительного комфорта перемещения и желания к максимально мобильному образу жизни, рекомендуем обратить внимание на приобретение самых удобных и компактных портативных кислородных концентраторов.
Пациенты, которые используют эти портативные кислородные концентраторы, имеют полную свободу передвижений. Аппарат можно повесить на плечо, либо перевозить при помощи удобной тележки. Портативные кислородные концентраторы так же используются как автономный источник подачи кислорода пациенту на дому, который нуждается в непрерывной кислородной терапии, но по каким то причинам у него дома возникают перебои с электроэнергией. На западе многие пациенты уже постепенно отказываются от стационарных кислородных концентраторов, предпочтя им данные аппараты:
Статью подготовил Гершевич Вадим Михайлович
(врач пульмонолог, торакальный хирург, кандидат медицинских наук).
Просто позвоните нам сейчас по телефону бесплатной линии 8 800 100 75 76 и мы с радостью поможем Вам в выборе аппарата, квалифицированно проконсультируем и ответим на все интересующие Вас вопросы.
(информационное письмо для врачей)
М.Г. Романцов, Д.С. Суханов, А.Ю. Петров
Туберкулез до сих пор остается сложной социально-экономической и медико-биологической проблемой, характеризуется высокой тенденцией к прогрессированию, полирезистентностью возбудителя болезни к противотуберкулезным лекарственным препаратам. В мире насчитывется около 20 млн больных туберкулезом; каждый год заболевает около 3.5 млн человек и более 1 млн умирает от него. Ежегодно, у 8-10 миллионов людей, инфицированность туберкулезом переходит в заболевание, причем 75% больных, составляют лица трудоспособного возраста. Ежегодно в России от туберкулеза умирает в среднем около 22 тыс.человек.
Основой терапии туберкулеза является химиотерапия, которая проводится не менее 8-10 месяцев.Первые два месяца, когда терапия наиболее эффективна лечение проводится 5 препаратами, далее 4-мя препаратами. Длительное лечение антибактериальными препаратами не эффективно (Л.К.Богуш) т.к. насыщение организма антибактериальными препаратами подавляет иммунные реакции организма.
Для лечения больных туберкулезом легких, как в условиях стационара, так и амбулаторно, в основном, используется 17 наименований противотуберкулезных лекарственных средств специфического действия (Н.М. Бат, 2004).
Из всех препаратов, разделенных по результатам VEN-анализа, к категории жизненной важности отнесено 13 лекарственных средств (табл.1).
Таблица 1. Распределение противотуберкулезных препаратов
по степени жизненной важности
(цит.по Н.М.Бат, 2004).
Категория жизненной важности
Лечение туберкулеза проводится строго индивидуально в зависимости от характера туберкулезного процесса и общего состояния больного. Ведущим методом лечения является полихимиотерапия, обеспечивая излечение больных с бактериовыделением в 85% случаев.
На начальном этапе (до 2-3 месяцев) обязательно используют не менее 4-х активных противотуберкулезных средств (изониазид, рифампицин, пиразинамид, стрептомицин (этамбутол).
На втором этапе (с длительностью лечения до 6 месяцев) используют тиоацетазон, изониазид, рифампицин в дозах, которые зависят от массы тела, возраста больного и режима лечения.
При наличии лекарственной полирезистентности, в схему лечения одновременно включают 5-6 антибактериальных препаратов (в т.ч. офлоксацин, ципрофлоксацин или ломефлоксацин) до 2-х раз в сутки.
Возрастает риск гепатотоксического действия, особенно у людей с нарушениями функции печени. Частота возникновения гепатита от 0.3 до 2.6%. По данным В.Г. Мясникова у 15.8% больных, принимавших изониазид, отмечалась медикаментозная реакция. Изониазид оказывает нейротоксическое действие (смазанная речь, вялость, дезоринтировка, гиперрефлексия), вызывая судороги; возможен неврит зрительного нерва. При передозировке возникает нарушение функции желудочно-кишечного тракта, метаболический ацидоз.
Возможен риск возникновения гриппоподобного синдрома; появление продромальных симптомов гепатита; острый гемолиз; повышенная чувствительность, а также интерситициальный нефрит. Возможно нарушение функций желудочно-кишечного тракта, чрезмерный рост грибов, реже встречается красновато-оранжевое окрашивание кала, мочи, слюны, мокроты, пота, слез.
Обращается внимание на возможность возникновения неврита зрительного нерва и артритов (боль, отечность суставов, напряжение кожи над пораженным суставом: голеностопный, коленный).
Необходимо помнить о повышенной чувствительности к препарату (кожная сыпь, температура, боль в суставах); о периферическом неврите (онемение, покалывание, слабость в кистях, стопах); спутанность сознания, дезориентирвка, нарушение функций желудочно-кишечного тракта.
К побочным/неблагоприятным реакциям следует отнести – появление артралгии, артритов, гепатотоксическое действие препарата.
Гинцбург Т.С. (1983) указывает на то, что действие специфических лекарственных препаратов, не снижает в организме токсических свойств возбудителя туберкулеза, которые сохраняются при различной устойчивости к противотуберкулезным препаратам.
Часто (в 65% случаев) встречаются побочные реакции на протионамид, на этионамид (в 45.2% случаев). Отдельное место по частоте и выраженности отрицательных реакций занимает продолжительность применения туберкулостатиков, около 2/3 осложнений развиваются впервые 3 месяца терапии. У 27 больных, получавших по два препарата, побочные реакции развивались в 52% случаев, а у 236 пациентов, лечившихся тремя препаратами, отрицательные реакции встречались в 62.0% случаев. Появление побочных реакций зависит и от наличия сопутствующей патологии (лекарственные осложнения наблюдаются в 69-82% случаев)
В исследованиях Горбач Л.А. и Солонко И.И. (2002) проанализирована группа больных туберкулезом женщин [с невысоким уровнем образования (высшее образование и незаконченное высшее имели лишь 12.8% пациентов)], в возрасте от 27 лет до 31 года.
При выявлении заболевания основная часть (77,8%) заболевших женщин жаловалась на повышенную утомляемость, слабость, потливость, субфебрилитет, кашель с мокротой. У 56% женщин отмечались симптомы интоксикации по данным клинического анализа крови (повышенная СОЭ, лейкоцитоз). У 64% пациенток выявлено баквыделение, причем уровень лекарственной устойчивости микобактерий к антибактериальным препаратам установлен в 42.4% случаев, а полирезистентность отмечалась у 27.8% больных. Большинство пациентов имело сопутствующую патологию: заболевания сердечно-сосудистой системы – у 31.0%, желудочно-кишечного тракта – у 23.0%, неспецифические заболевания легких у 12.5%, а эндокринная патология отмечена у 7.5% лиц.
Большинство больных, страдающих туберкулезом легких, по мнению Л.П. Рынко, находятся в состоянии тяжелой интоксикации, истощения функциональных и метаболических резервов. Среди больных туберкулезом, наличие нежелательных побочных реакций на специфическую противотуберкулезную терапию, синдром дыхательной недостаточности часто осложняют течение заболевания и усложняет выбор адекватной лечебной тактики (В.А. Юхимец).
В настоящее время практически отсутствуют лекарственные препараты, воздействующие на механизм транспорта кислорода, обладающие антигипоксической и антиоксидантной активностью, позволяющие нивелировать побочные реакции полихимиотерапии, применяемой у больных туберкулезом.
Туберкулезная интоксикация (А.Е. Дорошенкова, 1990) проявляется слабостью, недомоганием, повышением температуры тела до субфебрильных цифр (15.5% больных). Симптомы поражения бронхов, легких и плевры отмечены у 44.3.% больных, из них у 72.0% наблюдался кашель с выделением мокроты, у 46.5% – непостоянные боли в грудной клетке.
В.С. Деркач отмечал осложнения токсического характера (гепатотоксические у (19.2% пациентов). Нейротоксические, ухудшение зрения, аллергические реакции (зуд, кожные высыпания) выявлены у получавших специфическую терапию в 8.3% случаев.
По данным А.Б. Инсанова с соавт. (2003) хронический туберкулез протекает на фоне высокой степени эндогенной интоксикации. Деструкция легочной ткани наблюдается в условиях интенсивного протеолиза, избыточного образования иммунных комплексов, при отсутствии антипротеолитического ингибитора. Фактор интоксикации существенную роль играет и в формировании туберкулинонегативного туберкулеза. По мнению М.С. Беленького (1983) в этой группе больных выявляются запущенные и распространенные формы заболевания (11.0%, против 2.0%); у этих пациентов более высокие показатели интоксикации, СОЭ более 30 мм/час.
Частоту возникновения симптомов интоксикации у больных туберкулезом легких описывает в статье Г.Б. Соколова с соавт. (2002). Туберкулезная интоксикация (повышение температуры тела, изменение гемограммы, дефицит массы тела) среди больных с распространенным лекарственно чувствительным туберкулезом легких наблюдалась у 83-88% больных, а у пациентов, с распространенным лекарственно-резистентным туберкулезом, клинические проявления туберкулезной интоксикации отмечены у 90-92% больных, при ограниченном туберкулезе симптомы интоксикации отмечались у 66-68% пациентов. Следует заметить, что туберкулезная интоксикация сопровождает и локальные процессы, являясь производным от основного заболевания: чем тяжелее основной процесс, тем тяжелее интоксикация.
В.Г. Гончаров (1983) указывает на некоторые особенности водно-солевого обмена у больных с туберкулезом легких на фоне хронической легочной недостаточности. Показано снижение (на -34%) уровня клубочковой фильтрации, обусловившей падение уровня Na+ и CL- (соответственно на -28 и на -31%).
Патогенетическая (адекватная, рациональная) терапия заключается в проведении больным дезинтоксикационных мероприятий, устраняющих напряженность интоксикационного синдрома, мультиорганные нарушения, обусловленные интоксикацией. Кроме этого, дезинтоксикационная терапия способствует быстрому устранению токсико-аллергических реакций со стороны противотуберкулезной полихимиотерапии. Также патогенетически обоснован алгоритм терапии больных препаратами, обладающими антиоксидантной активностью, нормализующими нарушения метаболизма в органах и тканях больных туберкулезом.
Туберкулезную интоксикацию можно предотвратить соответствующим правильным и длительно проводимым лечением. К настоящему времени накопилось большое количество данных, свидетельствующих об участии свободно-радикальных процессов в патогенезе ряда инфекционных болезней; так в динамике развития туберкулеза легких наблюдается активация свободно-радикального окисления в легочной ткани, плазме крови, при этом интенсивность перекисного окисления липидов зависит от степени выраженности воспалительного процесса, а избыток продуктов перекисного окисления липидов, являясь токсичным для тканей биологической системы, характеризует патогенез хронических воспалительных заболеваний.
Для пополнения пула всех органических кислот цикла Кребса у человека достаточно введение лишь одного сукцината, который является стимулятором синтеза восстановительных эквивалентов в клетке. Биологическое значение проявляется в быстром ресинтезе клетками АТФ и в повышении их антиоксидантной резистентности, а в основе лечебного действия, лежит модифицирующее влияние на процессы тканевого метаболизма – клеточное дыхание, ионный транспорт, синтез белков.
В ранее проведенных исследованиях (1983,1990) была показана эффективность различных препаратов, в состав которых включен сукцинат. Так, О.И. Беляковой (1983) проведены исследования по оценке влияния сукцината натрия на эффективность лечения экспериментального туберкулеза, с применением изониазида и рифампицина, Применение сукцината натрия способствовало нормализации параметров системы специфической реактивности и показателей иммунного ответа у животных уже к третьему месяцу терапии, способствуя повышению эффективности лечения.
Т.А. Сокирко, изучая влияние сукцината натрия, на окислительное фосфорилирование в митохондриях печени морских свинок, показал нормализацию параметров окислительного фосфорилирования в митохондриях печени.
В.С. Деркач, указывал на выраженное лечебное и профилактическое действие сукцината натрия при побочных реакциях на антибактериальные препараты у больных с туберкулезом легких. Устранение побочных реакций с помощью сукцината натрия, как утверждает автор, возможно без перерыва курса полихимиотерапии.
В.А. Рущак использовал препараты янтарной кислоты (сукцинат натрия, сукцинат калия) у больных подростков с впервые выявленными формами туберкулеза органов дыхания. Длительность терапии колебалась от 2-х до 4-х месяцев. Применение препаратов янтарной кислоты способствовало исчезновению симптомов туберкулезной интоксикации, рассасыванию инфильтратов и заживлению деструктивных изменений в легких, лучшей переносимости полихимиотерапии, а Ж.З. Характер, показал нормализацию изоферментного спектра лактат-малатдегидрогеназ, под воздействием сукцината натрия, у больных туберкулезом и раком легких, в периоде предоперационной подготовки. Послеоперационный период у этих больных протекал гладко, без каких либо осложнений.
В связи с вышеизложенным, целесообразно, и патогенетически оправдано, применение в комплексной терапии туберкулеза легких, на фоне стандартной противотуберкулезной лекарственной терапии препаратов, с антигипоксантным/ антиоксидантным эффектом [1,5% РАСТВОРА РЕАМБЕРИНА ДЛЯ ИНФУЗИЙ], который устранит синдром интоксикации и побочные токсические реакции от применения антибактериальных препаратов, а также проведет коррекцию метаболических нарушений в органах и тканях. Это обеспечит улучшение эффективности стандартной противотуберкулезной лекарственной терапии и качества жизни больных и сведет к минимуму, а в ряде случаев, полному отсутствию побочных эффектов, от проведения базовой терапии антибиотиками.
Реамберин, 1.5% раствор для инфузий, представляет собой сбалансированный полиионный раствор с добавлением смешанной соли N-метиламония натрия сукцината. Включение соли янтарной кислоты в состав раствора определяет его основополагающие свойства метаболического и энергетического корректора, поскольку окисление сукцината является необходимым условием каталитического действия любой другой из карбоновых кислот для усвоения тканью кислорода (цикл три- и дикарбоновых кислот) [Л.В. Усенко с соавт..2004]. Ионный состав раствора включает – натрий 142 ммоль; калий – 4.0 ммоль; магний – 1.2 ммоль; хлорид – 109.0 ммоль; сукцинат- N-метилглюкаммония – 44.7 ммоль.
Янтарная кислота является метаболитом организма человека и животных, эндогенный уровень которой в плазме крови человека колеблется от 1 до 6 мкг/мл.
Реамберин как субстрат, содержащий N-метиламония натрия сукцинат, активирует процессы окисления, поставляющие электроны для дыхательной цепи митохондрий. Реамберин, в виде 1.5% раствора, является сбалансированным препаратом с осмолярностью приближенной к нормальной осмолярности плазмы крови человека, т.е. изотоническим раствором.
Одним из ведущих синдромов интоксикации является гипоксия. Как известно печень является основным местом метаболизма ксенобиотиков, поэтому становится мишенью токсического действия.
Гепатотропное действие реамберина обусловлено повышением соотношения НАДН+/НАД, энергетического обмена в гепатоцитах. Активация сукцинат дегидрогеназы в митохондриях гепатоцитов нормализует печеночный холестаз и препятствует жировой дистрофии печени и образованию коллагеновой ткани. При поражении печени ксенобиотиками наблюдается стимуляция янтарной кислотой ее метаболизирующей функции с одновременным повышением устойчивости мембран гепатоцитов к радикальному окислению, за счет увеличения концентрации восстановленного глутатиона и усиления устойчивости митохондрий к перекисной деградации, стимулированной ксенобиотиками. Препарат способствует процессам репаративной регенерации гепатоцитов, что проявляется снижением уровня в крови маркерных ферментов поражения ткани печени.
У больных с нарушением пигментного обмена ("механическая желтуха") (у 75% больных) наступает нормализация размеров печени, исчезновение диспептического синдрома (80-90%), холестатического компонента и интоксикационного синдрома. При этом улучшается функциональная активность печени, что подтверждено положительной динамикой внутриклеточных ферментов печени. Уменьшение интоксикационных проявлений наблюдалось к 3-5 дню лечения и отмечено у 80-85% больных. У наркозависимых лиц с проявлениями поражения печени выявлен отчетливый дезинтоксикационный эффект с благоприятным исходом крайне тяжелых состояний (печеночная кома).
К другим фармакологическим эффектам раствора реамберина следует отнести:
Препарат эффективно снижает метаболический ацидоз, что позволяет рекомендовать его, как не имеющее аналогов средство, для предотвращения поражений тканей при накоплении молочной кислоты и снижении внутриклеточного рН.
Базируется на низкой чувствительности системы окисления янтарной кислоты к недостатку кислорода.
Связано с энергетической поддержкой системы янтарной кислотой процессов дезинтоксикации и выведения чужеродных веществ. Препарат купирует токсическое действие анестетиков, противосудорожных средств, туберкулостатиков, гормонов, алкоголя, снижает кетоз и уровень сахара при диабете, улучшает показатели микроциркуляции, биоэлектрической активности и внутрисердечной гемодинамики.
Таким образом, реамберин 1.5% раствор для инфузий, относящийся к группе антигипоксантов/антиоксидантов, является эффективным лекарственным средством для коррекции метаболических нарушений, возникающих при различных патологических состояниях. Янтарная кислота относится к субстратным антигипоксантам и ее соль, N - метиламония – натрия сукцинат, является активным соединением, нормализует энергетический обмен, повышая резистентность организма к гипоксии, вызываемой тяжелыми заболеваниями, побочными действиями разного вида лекарств, и в первую очередь, высокотоксичными препаратами, применяемыми в пульмонологии, фтизиатрии, онкологии и других областях клинической медицины.
- Реамберин в комплексной терапии полиорганной дисфункции-недостаточности (методические рекомендации).-Днепропетровск.-2004.
Соколова Г.В. Методика применения комбинированных противотуберкулезных препаратов у больных туберкулезом легких //Consilum Medicum.-2002.-№4.
Старостенко Е.В. Обоснование дифференцированого использования патогенетических средств в комплексном лечении больных туберкулезом легких // Пульмонология.-2001.-№11.
Инсанов А.Б. Оценка степени эндотоксикоза при туберкулезе легких //Материалы 7 съезда фтизиатров России.-2003.
Хроническая туберкулезная интоксикация // med.pfu.edu.ru/tub2002/04.
Актуальные вопросы фтизиопульмонологии / Тезисы докладов научной конференции.-Киев.-1983.
Актуальные вопросы хирургии легких на современном этапе // Тезисы докладов 9 научно-практической конференции по грудной хирургии.-Киев.-1990.
Бат Н.М. Создание формуляра противотуберкулезных лекарственных средств в Республике Адыгея // Фармация.-2004.-;5.-С.23-27.
Изменение общественно-политического строя России привело не только к серьезному ухудшению эпидемиологической ситуации по туберкулезу, но и к резкому ухудшению структуры впервые выявленного туберкулеза легких. В клиническую классификацию туберкулеза в 1994 году вновь внесены тяжелые его формы, многие годы не встречавшиеся среди населения. Это казеозная пневмония и миллиарный туберкулез легких, характеризующиеся остропрогрессирующим течением и неблагоприятным прогнозом. Среди различных факторов, обуславливающих появление таких форм, наряду со снижением общей реактивности организма и изменением биологических свойств микобактерий туберкулеза, определенную роль играет снижение объема профилактических мероприятий и выполнения целевых флюорографических осмотров населения. Последнее способствовало значительному увеличению числа больных туберкулезом, выявляемых по обращаемости в лечебно-профилактические учреждения с разнообразными жалобами, свидетельствующими о значительной давности заболевания. Следует обратить особое внимание на выявление остропрогрессирующих форм туберкулеза, так как подавляющее большинство больных первоначально госпитализируются в соматические больницы по поводу различных острых респираторных заболеваний или пневмонии. Несвоевременная диагностика туберкулеза у них создает неблагоприятные эпидемиологические условия для окружающих больных, что может привести к госпитальной вспышке туберкулеза и требует проведения противотуберкулезных мероприятий в отделениях, где выявляются больные туберкулезом, а также детального анализа причин несвоевременной диагностики заболевания. Контроль за выполнением этих необходимых мер должны осуществлять участковые фтизиатры и служба СЭС. Одновременно необходимо постоянно повышать уровень знаний среди врачей общей лечебной сети об основных принципах диагностики туберкулеза.
(Профессор М.С. Греймер Кафедра фтизиатрии медицинской академии последипломного образования, г. Санкт-Петербург)
Концепция туберкулеза как исчезающей болезни оказалась глубоко ошибочной как в России, так и во многих зарубежных странах. В конце века туберкулез встал как тень прошлого и вновь сохраняет за собой лидерство среди инфекционных болезней, представляя опасность многим миллионам людей. 1/3 населения земного шара инфицирована туберкулезом. Ежегодно у 8-10 миллионов людей (по некоторым данным - у 20 миллионов) инфицированность переходит в заболевание, причем 75% больных составляют лица трудоспособного возраста.
В России с конца 80-х - начала 90-х годов отмечается неуклонный рост основных показателей по туберкулезу. Изменение социально-экономического курса в стране, повсеместное снижение качества жизни привело к прогрессирующему распространению инфекции. Заболеваемость среди взрослого населения за период 1991-1997 гг. увеличилась в 1,9 раза, смертность - в 2 раза. Инфицированность среди детей возросла в 15 раз, и как следствие растет детская заболеваемость. Ежегодно 12 тысяч детей болеют туберкулезом.
Эти новые реалии жизни послужили основой для отрицательного патоморфоза туберкулезного процесса, когда казеозный вариант воспаления стал доминировать в течении туберкулеза. Вновь, как много лет назад, регистрируются распространенные, острые, генерализованные формы, т.е. клинически тяжелый и трудно излечиваемый туберкулез. Частота выявления подобных форм туберкулеза колеблется от 60 до 81%.
Такое течение процесса стали диагностировать не только при классических острых формах туберкулеза (миллиарном туберкулезе и казеозной пневмонии), которые спустя 20 лет (в 1994 г.) были повторно включены в клиническую классификацию туберкулеза, но и при других формах. Это послужило основанием для объединения больных с подобным течением туберкулезного процесса под единым названием "остропрогрессирующий туберкулез легких" (ОПТЛ).
Прогрессирующее течение туберкулеза стало основной причиной смерти больных. Смерть в течение первого года выявления болезни, в основном, происходит по причине развития остропрогрессирующего процесса. Среди больных ОПТЛ показатели смертности также высоки - 67%.
Постепенно термин "остропрогрессирующий туберкулез" стал как бы размываться, рамки остротекущего процесса стали искусственно расширяться. Поэтому возникла необходимость определить границы и признаки, по которым туберкулезный процесс можно считать остропрогрессирующим, дать четкое определение ОПТЛ.
"Остропрогрессирующий туберкулез легких - это понятие, объединяющее различные клинические формы туберкулеза органов дыхания, характеризующиеся острым началом заболевания и тяжелым прогрессирующим течением с резко выраженным интоксикационным синдромом, преобладанием эксудативно-казеозной тканевой реакции, обширными поражениями и быстрым образованием деструкций".
Социально-эпидемиологическая оценка ОПТЛ отражает все негативные тенденции нашей современной общественной жизни. Болеют ОПТЛ в основном мужчины (7:1), социально-дезадаптированные лица, лица-БОМЖ, прибывшие из мест лишения свободы. Только 31,2% больных имеют трудовую занятость, 53,5% страдают алкоголизмом или бытовым пьянством и т.д.
Остропрогреесирующее течение туберкулеза обуславливает развитие целого ряда патогенетических нарушений (рис. 1).
Это в первую очередь - интоксикационный синдром. Проявления интоксикации доминируют в клинической картине. Интоксикация приводит к тяжелым расстройствам гомеостаза и является основной причиной летального исхода. Эндотоксины активизируют множественные биологические системы с инициированием освобождения биологически активных веществ, что образно названо в литературе "метаболической анархией". Это приводит к дезорганизации организма как единого целого с развитием полиорганной недостаточности.
ОПТЛ сопровождается нарушениями коагуляции. Гиперкоагуляция провоцирует нарушения микроциркуляции. Возникает тромбоз сосудов, и развивается ДВС-синдром.
Синдром дыхательных расстройств проявляется кашлем с мокротой, зачастую гнойного характера, одышкой, цианозом, болями в грудной клетке, нарушениями внешнего дыхания, газообмена. В зависимости от выраженности изменений у больных регистрируется респираторный синдром, дыхательная или легочно-сердечная недостаточность.
ОПТЛ сопровождается выраженными нарушениями иммунитета. Иммунодефицит проявляется в виде глубоких структурно-метаболических и функциональных нарушений и повышенной гибели иммунокомпетентных клеток (ИКК). Развиваются разнообразные нарушения цитокинового комплекса.
Важным аспектом патогенеза ОПТЛ является бактериовыделение. У половины больных бактериовыделение массивное; микробы быстрорастущие, вирулентные, жизнеспособные. При ОПТЛ выделяют типичные и резистентные МВТ, причем лекарственная устойчивость (ЛУ) является как причиной, так и следствием развития туберкулезного процесса по остропрогрессирующему варианту. Первичная ЛУ регистрируется у 20-35% больных, вторичная - у 25,4-41,5%. МВТ обнаруживают не только традиционно в мокроте, промывных водах бронхов, но и в крови. Бактериемия составляет от 48 до 63%.
В последнее время появилась тенденция считать всех больных ОПТЛ больными одной клинической формой с едиными однотипными нарушениями. В то же время это понятие объединяет различные клинические формы туберкулеза: казеозную пневмонию, варианты диссеминированного туберкулеза, включая милиарный, остротекущий инфильтративный туберкулез, фиброзно-кавернозный туберкулез при развитии казеозной пневмонии в интактных участках легочной ткани (рис. 2).
Несмотря на то, что казеозное воспаление доминирует у больных ОПТЛ, не следует все случаи остротекушего туберкулеза считать казеозной пневмонией. Как показали углубленные клинико-рентгенологические, биохимические и иммунологические исследования, каждая из форм, входящая в ОПТЛ, имеет наряду со сходством определенные различия, которые необходимо учитывать в оценке патогенеза и при назначении терапии.
Казеозная пневмония (КП) - пожалуй, самая яркая форма ОПТЛ.
Частота регистрации такого диагноза отражает тенденции, указанные выше - от 4,7% до 45%. КП - одна из наиболее тяжелых форм ОПТЛ. Она может возникать самостоятельно и как финал прогрессирования при других формах. Это, так сказать, признак злокачественного течения туберкулезного процесса. КП, как правило, двухсторонняя, в 32% - тотальная.
Процесс характеризуется наличием многообразных разноплановых патогенетических сдвигов. При КП отмечается выраженный интоксикационный синдром, развивается дыхательная и легочно-сердечная недостаточность, ДВС-синдром. 54%-82% больных выделяют лекарственно устойчивые МБТ. Исследование иммунного статуса выявило глубокие нарушения иммунитета как по количеству ИКК, так и их функциональной активности. Кроме того, у больных этой группы отмечается наиболее низкий уровень иммунных комплексов.
Объяснить это явление можно, вспомнив предположение М.М. Авербаха, что именно фиксация циркулирующих иммунных комплексов (ЦИК) в легочной ткани обуславливает развитие туберкулезного процесса по казеозному варианту, гибель больных КП составляет от 15,3 до 30%, у остальных больных процесс переходит в фиброзно-кавернозный туберкулез.
Диссеминированный туберкулез (ДТ), по данным некоторых авторов, составляет от 16 до 34,5% ОПТЛ. В условиях снижения иммунитета ДТ приобретает острое прогрессирующее течение. Классической острой формой ДТ является острый гематогенный диссеминированный туберкулез, т.е. милиарный туберкулез. Изучение клинической картины современного МТ выявило некоторые особенности, отличающие его от классических описаний 40-50-х годов. Заболевание протекает не классически остро, а с постепенным в течение 1-3 месяцев ухудшением состояния, после чего появляется острая вспышка болезни. Интоксикационный синдром, будучи ярко выраженным, не манифестирует по тифоидному варианту. Процесс протекает в основном генерализованно с внелегочными проявлениями, иногда множественными. Причем внелегочные симптомы поражения приводят к ошибкам в диагностике МТ.
Все чаще диагностируется лимфобронхогенный вариант ДТ, ранее почти не определяемый. ДТ в условиях снижения иммунитета развивается по варианту экссудативно-некротического воспаления с образованием ацинозно-лобулярных, сливных лобулярных и сегментарных фокусов КП с расплавлением и образованием пневмониогенных каверн. При несвоевременной и неадекватной терапии процесс переходит в КП.
Остропрогрессирующий инфильтративный туберкулез легких (ИТ) - это, как правило, лобит с очагами и фокусами бронхогенного обсеменения. ИТ - наиболее благоприятная форма ОПТЛ, при длительной химиотерапии у 84,3% больных наступает клиническое излечение в виде прекращения бактериовыделения и закрытия полостей распада.
Существует несправедливое мнение, что лечение больных ОПТЛ бесперспективно, такие больные некурабельны. Безусловно, лечение этих пациентов представляет большие сложности. С одной стороны, ОПТЛ обусловлен существенными изменениями характеристик микроба (МВТ вирулентные полирезистентные, популяция массивна, часто присоединяется сопутствующая инфекция), а с другой стороны - остропрогрессирующее течение туберкулезного процесса провоцируется изменениями в макроорганизме (иммунодефицит, разрегулирование дезинтоксикационной системы, метаболические нарушения). Поэтому лечение должно быть обязательно комплексным этиопатогенетическим, основанным на клинико-лабораторных и рентгенологических данных и предусматривающим особенности каждой клинической формы ОПТЛ (рис. 3).
Основой лечения является химиотерапия. Терапия должна проводиться не менее 8-10 месяцев: первые 2 месяца, когда лечение наиболее эффективно, - 5 препаратами, далее - 4 препаратами. Более длительное лечение, как предупреждал Л.К. Богуш (1978 г.), неэффективно, т.к. насыщение антибактериальными препаратами подавляет естественные иммунные реакции, при этом активизируется неспицифическая флора. Следует выбирать не только адекватные противотуберкулезные препараты, но и наиболее эффективные методы введения лекарств. Для больных ОПТЛ особенно важно определение степени активации ГИНК, т.к. при выраженной интоксикации быстрая активация ГИНК требует альтернативных методов введения (минуя печень).
Химиотерапия назначается с учетом ЛУ, т.к. именно ЛУ - одна из причин не успеха в лечении больных ОПТЛ. Учитывая высокую частоту выявления полирезистентных МВТ, показано применение резервных антибиотиков широкого спектра действия, часть из которых действует непосредственно на микроб, часть - потенцирует действие противотуберкулезных препаратов. Терапия ЛУ ОПТЛ осложняется низкой БАК крови. Резервные антибиотики повышают БАК.
Патогенетическое лечение должно заключаться в проведении в первую очередь дезинтоксикационной терапии, которая помогает снять напряженность интоксикационного синдрома, устранить мультиорганные нарушения, обусловленные интоксикацией, и предупредить развитие синдрома Ляриша. Дезинтоксикационная терапия включает в себя инфузионные методы, внутривенную лазеро-терапию, плазмаферез, УФО крови.
Учитывая глубокие нарушения метаболизма при ОПТЛ, важным разделом лечения следует считать метаболическую патогенетическую терапию, включающую: витамины, антигипоксанты, антиоксиданты.
Одной из серьезных проблем химиотерапии у больных ОПТЛ является быстрое появление токсических побочных реакций, причем у 7,7% больных они становятся неустранимыми и требуют отмены препарата навсегда. Побочные реакции провоцируются в значительной мере интоксикацией, а также методами введения противотуберкулезных препаратов. Учитывая нежелательность их развития (необходимость отмены препарата, риск развития ЛУ и ауто-инфекций), патогенетическая терапия должна предусматривать профилактику побочных реакций и их быстрое устранения.
Излечение при ОПТЛ зависит от целого комплекса факторов, в первую очередь от того, какой клинической формой представлен ОПТЛ. При ИТ излечение составляет 88,9%, ДТ - 76,5%, КП - 30-45%. У 20-28% больных химиотерапия неэффективна.
Таким образом, характерной особенностью патоморфоза туберкулеза в последние годы можно считать возвращение остропрогрессирующих форм туберкулеза легких. В рамках остропрогрессирующего процесса ведущим является казеозный тип воспаления с быстрым распространением инфекции, расплавлением легочной ткани и образованием множественных деструкций. Это приводит к развитию целого каскада патогенетических нарушений, основополагающими из которых является интоксикация и иммунодефицит. В то же время каждая форма ОПТЛ сохраняет свои особенности, что обуславливает разноплановые биохимические и иммунные сдвиги.
Лечение больных ОПТЛ должно учитывать все эти нюансы, однако в первую очередь оно должно основываться на необходимости элиминации микробной популяции и устранения интоксикационных и метаболических нарушений.
Читайте также:


