Инактивирующий реагент а для безопасной работы с микобактериями туберкулеза

В 2004 году по инициативе д.м.н., профессора Михаила Александровича Владимирского, заведующего сектором молекулярной диагностики туберкулёза НИИ Фтизиопульмонологии Первого МГМУ им. И.М.Сеченова, мы начали разработки в области ПЦР-диагностики туберкулёза.
Выделение ДНК: использование оригинальных реагентов и магнитных частиц обеспечивает получение максимального количества чистой ДНК и позволяет автоматизировать процесс выделения ДНК.
ПЦР в реальном времени: одновременная детекция нескольких различных участков генома комплекса микобактерий туберкулёза (МБТ) увеличивает информативность и достоверность анализа.
I этап – Пробоподготовка, инактивация
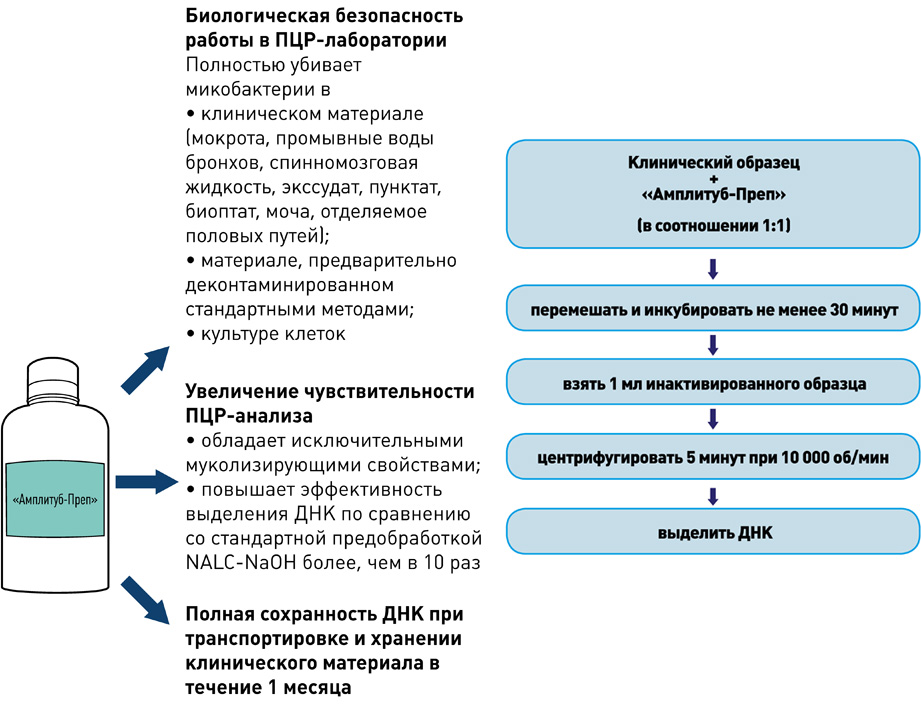
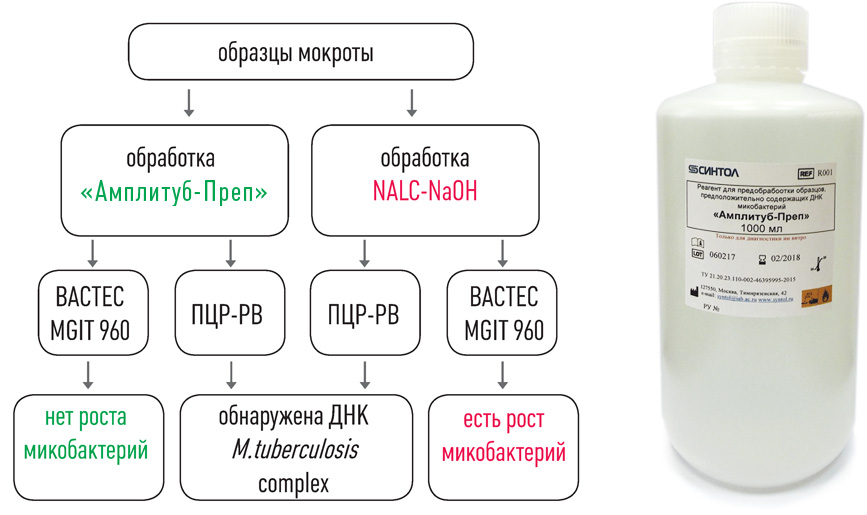
II этап – Выделение ДНК
набор реагентов для выделения ДНК (на магнитных частицах)
набор реагентов для выделения ДНК микобактерий из клинических образцов и культур клеток на автоматизированных станциях TECAN

- Снижение риска контаминации во время выделения ДНК практически до нуля.
- Значительное уменьшение трудоёмкости процесса выделения ДНК.
- Стандартизированное выделение ДНК из клинических образцов.
- Экономическая выгода: низкий расход пластика и реактивов.
набор реагентов для ускоренной пробоподготовки и выделения ДНК микобактерий из образцов мокроты
III этап – ПЦР в реальном времени
Обнаружение и количественное определение комплекса МБТ
Набор реагентов АМПЛИТУБ-РВ — это:
- высокая достоверность анализа благодаря одновременному обнаружению двух специфичных генов M.tuberculosis complex: IS6110 и regX3;
- оценка пригодности образца ДНК для определения антибиотикоустойчивости;
- высокая чувствительность (не более 100 КОЕ/мл мокроты или 1–10 копий фрагментов ДНК в реакции) и 100%‑ая специфичность, подтверждённые на панели QCMD (Quality Control for Molecular Diagnostics) Mtb EQA (UK).
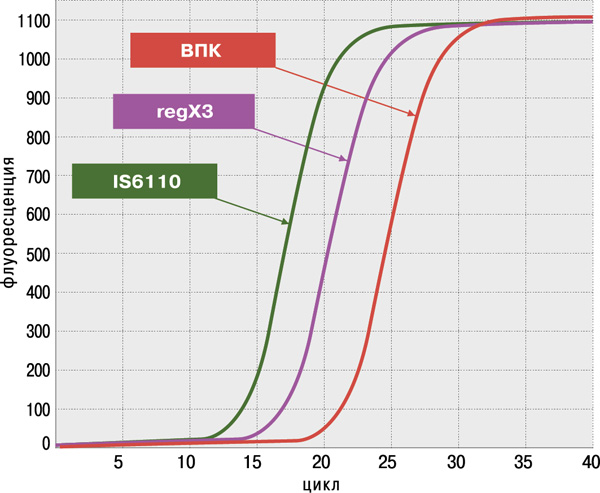
Определение антибиотикоустойчивости МБТ к препаратам I и II ряда
Наборы реагентов АМПЛИТУБ-МЛУ-РВ, АМПЛИТУБ-FQ-РВ — это:
- диагностика форм туберкулеза с лекарственной устойчивостью, в том числе множественной лекарственной устойчивостью (МЛУ) и широкой лекарственной устойчивостью (ШЛУ);
- быстрая детекция мутаций M.tuberculosis, ассоциирующихся с устойчивостью к антибиотикам первого и второго ряда (рифампицину, изониазиду, этамбутолу, фторхинолонам);
- достоверность результатов, ежегодно подтверждаемая при проведении Федеральной службой внешней оценки качества (ФСВОК) Росздравнадзора испытаний шифрованных тест-культур и образцов.
Наборы АМПЛИТУБ-МЛУ-РВ и АМПЛИТУБ-FQ-РВ основаны на использовании оригинальной мультиконкурентной аллель-специфичной методики ПЦР в реальном времени, позволяющей выявлять мутации в генах микобактерий туберкулеза, ответственных за устойчивость к конкретным антибиотикам.

Принцип мультиконкурентной аллель-специфичной методики ПЦР в реальном времени
- В формате одной пробирки используются 5’-флуоресцентно-меченые аллель-специфичные праймеры с общим комплементарным им 3’-меченым олигонуклеотидом-гасителем и контрольный флуоресцентный зонд, комплементарный участку ДНК без мутаций.
- При отсутствии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается только по флуорофору зонда.
- При наличии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается как по флуорофору зонда, так и по флуорофору 5’-флуоресцентно-меченого аллель-специфичного праймера. Данный метод позволяет определить не только точку мутации, но и процент устойчивого мутантного штамма МБТ на фоне дикого.
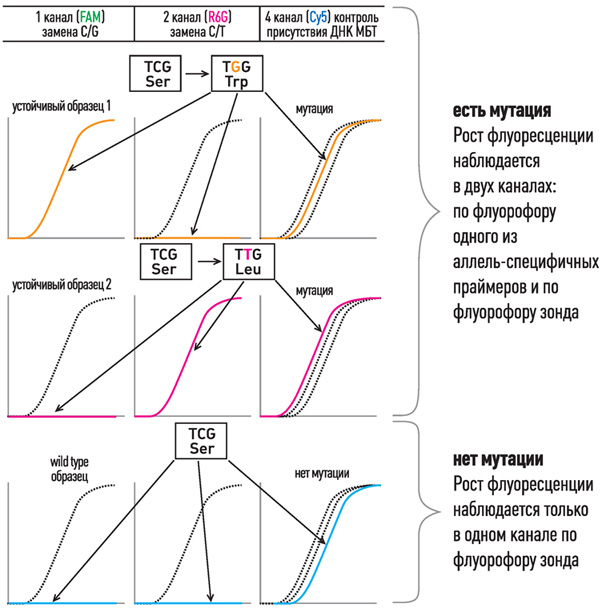
Интерпретация результатов выявления мутаций на примере
531 кодона rpoB гена M.tuberculosis
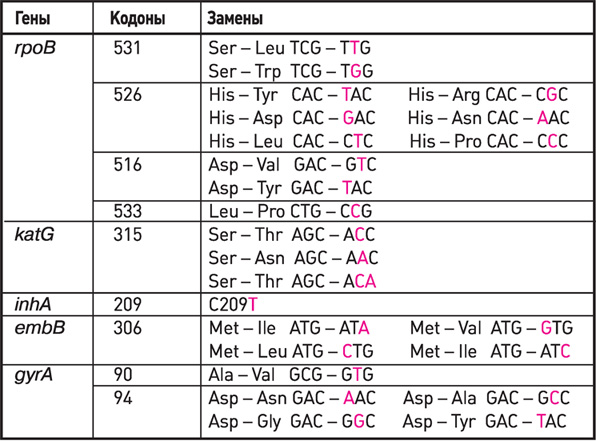
Гены, кодоны, замены, используемые в наборах реагентов
АМПЛИТУБ-МЛУ-РВ при определении антибиотикоустойчивости
Использование автоматизированных станций Freedom EVO (TECAN, Швейцария) для молекулярно-генетической диагностики туберкулёза
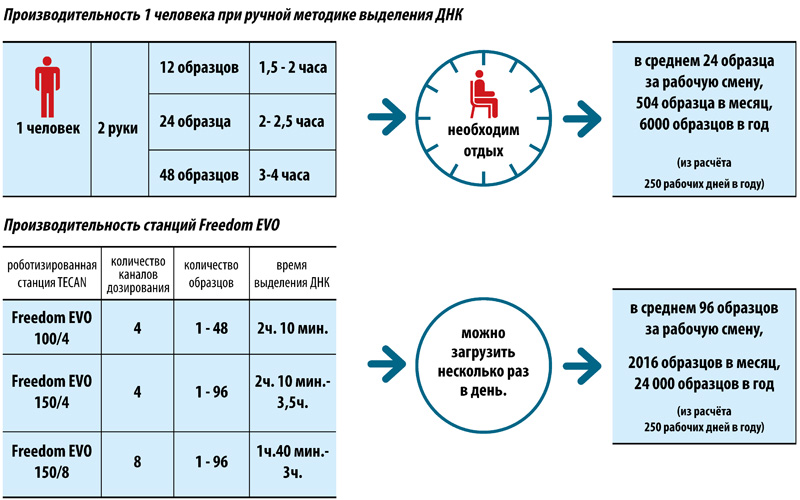

Трудозатраты — 1 час
Продолжительность выделения ДНК — не более 2 часов
Подготовка к амплификации и ПЦР-РВ — 1,5 часа
ИТОГО: результаты анализа будут готовы через 3,5 часа
Оператор затратит 1 час своего рабочего времени.
Аннотация научной статьи по ветеринарным наукам, автор научной работы — Першикова Н. Л., Донченко Н. А.
В статье выявлено, что полимеразную цепную реакцию целесообразно применять для лабораторной диагностики туберкулеза крупного рогатого скота и как дополнительный экспресс-метод для изучения патолологического материала от животных, убитых с диагностической целью.
Похожие темы научных работ по ветеринарным наукам , автор научной работы — Першикова Н. Л., Донченко Н. А.
УДК 619:616.982.21:636 НЛ. Першикова, Н.А. Донченко
ИСПОЛЬЗОВАНИЕ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ ДЛЯ ОБНАРУЖЕНИЯ ДНК МИКОБАКТЕРИЙ ТУБЕРКУЛЕЗА
В статье выявлено, что полимеразную цепную реакцию целесообразно применять для лабораторной диагностики туберкулеза крупного рогатого скота и как дополнительный экспресс-метод для изучения патолологического материала от животных, убитых с диагностической целью.
Туберкулез - инфекционное заболевание многих видов животных, птиц и человека, характеризующееся поражением различных органов (легкие, печень, почки, селезенка и др.) с образованием в них специфических бугорков-туберкулов, подвергающихся казеозному некрозу. Болезнь протекает в хронической форме.
Возбудитель туберкулеза - микроорганизмы рода Mycobacterium (mycos - гриб, bacterium - палочка), который включает в себя более 38 самостоятельных видов. Болезнь у животных вызывают микобактерии туберкулеза бычьего (M.bovis), человеческого (M.tuberculosis) и птичьего (M.avium) видов [2].
В настоящее время основным способом диагностики туберкулеза остается внутрикожная туберкулиновая проба, а также бактериологическое исследование с постановкой биопробы на лабораторных животных [4, 5]. Однако данные методы диагностики туберкулеза занимают много времени, достаточно трудоемки и не всегда дают положительный результат. В последние годы для выявления возбудителей инфекционных болезней наиболее чувствительными и специфичными предлагаются методы, основанные на выявлении фрагментов генома возбудителя в биологическом материале с помощью молекулярной гибридизации и полимеразной цепной реакции (ПЦР). Освоение методов молекулярного анализа радикально расширило возможности изучения патогенеза инфекционных болезней и принципиально усовершенствовало диагностику [1, 3].
Наиболее перспективна ПЦР в определении некультивируемых и персистирующих форм возбудителей, патогенов, вызывающих хронические инфекции, и с выраженной антигенной изменчивостью внутриклеточных паразитов [2].
Целью наших исследований явилось использование полимеразной цепной реакции для обнаружения ДНК микобактерий в биоматериале животных.
Материалы и методы исследования. С использованием базы данных Medline и PubMed провели поиск литературы по изучению генетической структуры микобактерий, характеристике наиболее употребляемых молекулярно-генетических методов индивидуальной идентификации штаммов и культур микобактерий.
Хромосомную ДНК выделяли несколькими способами. Процедура подготовки пробы включала лизис микроба и экстракцию нуклеиновой кислоты. Выбор метода диктовался природой исследуемого образца, необходимостью предотвращать влияние ингибиторов ПЦР, сконцентрировать нуклеиновую кислоту в объеме, соответствующем формату ПЦР, и предотвратить действие ДНКаз и РНКаз.
1. К пробам добавляли по 500 мкл гуанидин-феноловой смеси, перемешивали. Экспозиция при комнатной температуре 10-15 мин.
2. Добавляли в пробы и в чистые пробирки по 100 мкл хлороформа, перемешивали и оставляли при комнатной температуре на 10-15 мин.
3. Центрифугировали 15 мин на максимальных оборотах и отбирали верхнюю фазу в пробирки, содержащие 100 мкл хлороформа. Перемешивали и 10-15 мин держали при комнатной температуре.
4. Центрифугировали 15 мин при максимальных оборотах, отбирали верхнюю фазу в пробирки, содержащие 4 мкл декстрана. Добавляли по 500 мкл изопропилового спирта и оставляли при +4оС на 40-60 мин.
Центрифугировали 15 мин при максимальных оборотах. Супернатант отбрасывали и промывали 2 раза 70%-м этанолом. Оставшийся осадок содержал выделенную ДНК, пригодную для дальнейших манипуляций.
Выделение микобактериальной ДНК из биоматериала проводили, основываясь на принципе седиментации дисперсных систем под действием силы тяжести с отделением дисперсной фазы в виде осадка, необходимого для обогащения жидкодисперсной части гомогенизата микобактериями туберкулеза, высвобожденных из тканей органов. Для этого ткани органов разрезали ножницами на кусочки и заливали 6%-м раствором щавелевой кислоты в соотношении 1:6, прикрывали фильтровальной бумагой и выдерживали 20-30 мин. После этого кислоту сливали, а биоматериал трижды промывали стерильной дистиллированной водой, растирали пестиком, добавляя стерильный песок до гомогенной массы. Гомогенизат разбавляли физиологическим раствором 1:5, взбалтывали и проводили седиментацию в течение 5 мин.
Чтобы освободиться от большого количества примесей проводили вторичную седиментацию. Для этого жидкодисперсную часть взвеси, полученную после седиментации в ступке, переносили в бактериологические пробирки, где и проводили вторичную седиментацию в течение 3 мин. Жидкодисперсную часть, полученную в пробирках, центрифугировали при 3500 оборотах в течение 20 мин. Надосадочную жидкость сливали, а осадок использовали для выделения микобактериальной ДНК.
Подбор праймеров. Для работы праймеров были подобраны такие фрагменты молекулы ДНК, которые отличались генетической консервативностью и присутствовали только у интересующего вида микроорганизмов или в исследуемом гене. Анализ последовательностей белков и генов, депонированных к настоящему времени штаммов микобактерий, проводили с использованием международных баз данных при помощи компьютерных программ PC-gene, Aligment-serves, CLUSTAL.
Компоненты полимеразной цепной реакции (ПЦР). Реакционная смесь для проведения ПЦР содержала в 25 мкл: 10*буфер рН 8,8, 2,5 мкл смеси четырех дезоксинуклеотидтрифосфатов, 5 мкл смеси праймеров, 0,5 мкл Тад-полимеразы, объем пробы доводили деионизованной (или поставляемой в наборе) водой. Исследуемую ДНК вносили в количестве 2,5 мкл. На поверхность наслаивали 1 каплю (20-25 мкл) минерального масла для ПЦР.
Второй вариант соотношения компонентов реакции соответствовал Протоколу проведения ПЦР для набора реагентов GenePak PCR Core.
Полимеразную цепную реакцию для выявления Mycobacterium tuberculosis - специфической ДНК, проводили с использованием пар праймеров 5'-CGCCTAGGCTCAAACTGCTG-3' и 5'-CAATACCCGGCGGATCTACC-3'. Параметры ПЦР (Терцик, ДНК-Технология, Москва): 95°С х 5 мин (1 цикл), 95°С х 30 с, 50°С х 30 с, 72°С х 1 мин (40 циклов), 72°С х 5 мин. При использовании такого режима амплификации получали искомый фрагмент в 80 п.н.
Полимеразную цепную реакцию (ПЦР) для выявления M.avium complex - специфической ДНК, проводили с использованием пар праймеров, синтезированных на район гена IS 1245: 5'-
CCCGTTCAACGTCAACTTCC-3' и 5'-GGGCTCGCCGGTCATCAGGT -3'. Параметры ПЦР (Терцик, ДНК-Технология, Москва): 95°С х 5 мин (1 цикл), 95°С х 30 с, 68°С х 2 мин, 72°С х 5 мин (30 циклов), 72°С х 4 мин. При использовании такого режима амплификации получается искомый фрагмент в 373 п.н.
Полимеразную цепную реакцию для выявления некоторых клинически значимых атипичных видов микобактерий - специфической ДНК, проводили с использованием пар праймеров, кодирующих повторяющиеся последовательности гена hsp 65: 5'-ACCAACGATGGTGTGTCCAT -3' и 5'-CTTGTCGAACCGCATACCCT -3'. Параметры ПЦР (Терцик, ДНК-Технология, Москва): 94°С х 5 мин (1 цикл), 94°С х 1 мин, 60°С х 1 мин, 72°С х 1 мин (25 циклов), 72°С х 10 мин. При использовании такого режима амплификации получали искомый фрагмент в 440 п.н.
Результаты исследований. В опыте по выделению ДНК микобактерий были использованы пробы биоматериала (лимфатические узлы, печень, селезенка) от коров неблагополучного хозяйства Новосибирской области, органы от птиц и полевые культуры микобактерий, выделенные в различное время от коров из хозяйств Новосибирской области. В качестве положительного контроля использовали ДНК M.bovis, M. tuberculosis, M.avium и M. smegmatis, в качестве отрицательного контроля - органы от здоровых животных или
ДНК атипичных микобактерий. Для наработки инфицированного микобактериями биоматериала заражали морских свинок.
После убоя фиксировали видимые изменения внутренних органов и проводили бактериологическое исследование биоматериала.
Из результатов бактериологических исследований следует, что из 11 биологических образцов было выделено на питательных средах 8 изолятов микобактерий. Положительный или отрицательный сигнал при бактериологическом исследовании на наличие или отсутствие микобактерий совпал с результатами ПЦР в девяти и не совпал в двух случаях из одиннадцати исследованных образцов (табл.).
Результаты исследования биоматериала
№ опыта Бактериологическое исследование ПЦР Вид микобактерий
1 + + M. tuberculosis
7 + + Атипичные микобактерии
11 - + Атипичные микобактерии
Несовпадение результатов бактериологического анализа и метода ПЦР можно объяснить незначительным количеством микобактерий, обсеменивших биоматериал, или слабой жизнеспособностью микобактерий, а также возможным обсеменением биоматериала культурами сапрофитной микрофлоры.
Исследования показали эффективность ПЦР-анализа при обнаружении ДНК микобактерий туберкулеза и указывают на целесообразность более широкого применения этого метода в лабораторной диагностике туберкулеза сельскохозяйственных животных.
Применение комбинированных методов исследования позволяет получить более полную максимально достоверную характеристику изолятов.
1. Молекулярная характеристика полирезистентных клинических штаммов Mycobacterium tuberculosis из России I Э.В. ГeHepo3oe [и др.] II Молекулярная генетика, микробиология и вирусология. - 2000. - №1. -C. 11-16.
2. Дончєнко, А.С. Диагностика туберкулеза крупного рогатого скота I А.С. Дончєнко, Н.П. OedueHKO, Н.А. Дончєнко. - Новосибирск, 2004. - C. 3.
3. Макаров. В.В. ПЦР в диагностике лейкоза крупного рогатого скота I В.В. Макаров, Д.П. Гринишин II Ветеринария. - 2005. - №4. - С. 9-10.
4. Наставление по диагностике туберкулеза животных: утв. Департаментом ветеринарии Министерства с.х. РФ 18.11.2002 г.
5. Эффективность методов прижизненной диагностики туберкулеза I А.Н. Шаров [и др.] II Ветеринария. -2000. - № 2. - С. 16-18.
Читайте также:


