Чувствительность микобактерий туберкулеза к антибиотикам

Микобактериями туберкулеза в ходе эволюционного развития были выработаны механизмы защиты от факторов внешней среды, такие как толстая клеточная стенка, богатые метаболические возможности, которые способны обезвреживать многие клеточные токсины и вещества (альдегиды, перекиси), повреждающие клеточную стенку, также можно упомянуть способность к трансформации(переход в L-форму, образование доминантных клеток) [8].
Выделяют несколько классификаций лекарственной устойчивости микобактерии туберкулеза:
I. По чувствительности к противотуберкулезным препаратам [6, 8]
Истинная генетическая устойчивость – это видовой признак микроорганизмов, который связан с отсутствием точки приложения антибиотика с МБТ, ее недоступностью из-за плохой проницаемости клеточной стенки или разрушения ферментами.
МБТ обладают истинной генетической устойчивостью ко многим неспецифическим антимикробным препаратам, относящимся к семействам пенициллинов, β-лактамов, макролидов, карбапенемов, цефалоспоринов, тетрациклинов. Однако чувствительны к аминогликозидам (стрептомицин, канамицин, амикацин), полипептидам (капреомицин), рифампицинам (рифампицин, рифабутин) и фторхинолонам (ципрофлоксацин, ломефлоксацин, офлоксацин, левофлоксацин, моксифлоксацин, спарфлоксацин) [5].
Приобретенная лекарственная устойчивость МБТ проявляется в возможности размножаться при воздействии на них противотуберкулезных препаратов по средствам развития точечных мутаций [7] в хромосомах и формировании новых генов, контролирующих синтез новых белков-ферментов, разрушающих или инактивирующие конкретные противотуберкулезные препараты. Приобретенную лекарственную устойчивость подразделяют на первичную и вторичную. Первичная ЛУ определяется у больных, заразившихся лекарственно-устойчивыми МБТ. Эти пациенты ранее не принимали противотуберкулезные препараты [6]. Вторичная ЛУ развивается в процессе самого лечения больного туберкулезом. Устойчивость МБТ развивается через 3-6 месяцев с начала лечения [6].
II. По спонтанности возникновения мутаций (спонтанные и индуцированные)
В большой и активно размножающейся микобактериальной популяции всегда имеется небольшое количество лекарственно-устойчивых спонтанных мутантов в соотношениях:
1 клетка-мутант на 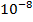
устойчивых к рифампицину;
1 клетка-мутант на 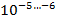
устойчивых к изониазиду, этамбутолу, стрептомицину, канамицину, фторхинолонам;
1 клетка-мутант на 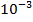
устойчивых к пиразинамиду, этионамиду, капреомицину и циклосерину.
С учётом того что в каверне величина микобактериальной популяции составляет 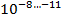
, там имеются мутанты ко всем противотуберкулезным препаратам; в очагах и осумкованных казеозных фокусах эта величина составляет 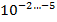
. Спонтанные мутации устойчивы только к одному препарату (спонтанная или эндогенная ЛУ) [6].
При экзогенной (индуцированной) ЛУ происходит естественный отбор в пользу мутантов с естественной ЛУ к противотуберкулезным препаратам. В дальнейшем это приводит к изменению в геноме, что приводит к увеличению бактериальной популяции с лекарственно-устойчивыми микобактериями. Этому способствует проведение неадекватной химиотерапии, при этом пациенту назначается неправильный режим, несбалансированное сочетание и дозы противотуберкулезных лекарственных средств [6].
По эпидемиологической классификации ВОЗ (2008) МБТ могут быть:
- монорезистентными (МР) – к одному противотуберкулезному препарату;
- полирезистентными (ПР) – к двум и более противотуберкулезным препаратам, но не к сочетанию изониазида и рифампицина;
- множественно лекарственно-устойчивыми (МЛУ) – как минимум к сочетанию изониазида и рифампицина. Такие больные обладают высокой эпидемиологической опасностью вследствие высокой вирулентности и контагиозности, длительного периода бактериовыделения. К группам повышенного риска относятся ВИЧ-инфицированные больные и ранее неправильно лечившиеся пациенты с туберкулезом [4]. При анализе заболеваемости туберкулёзом среди ВИЧ-инфицированных г. Краснокамска была выявлена МЛУ у 60% больных с впервые выявленным туберкулезом [1].
- широко лекарственно-устойчивыми (ШЛУ) – как минимум к сочетанию изониазида, рифампицина, фторхинолонов и инъекционных препаратов (канамицина, амикацина, капреомицина). Так как ШЛУ проявляет ЛУ к препаратам I ряда, а противотуберкулезные препараты II ряда не обладают выраженным антибактериальным действием, то можно утверждать, что такие штаммы опасны для жизни пациентов [4].
Генетические основы резистентности ко многим антибиотикам изучены недостаточно хорошо. По имеющимся данным в приобретении лекарственно-устойчивого фенотипа МБТ плазмиды и траспозоны особой роли не играют. Причиной возникновения лекарственно-устойчивых штаммов являются точечные мутации [7] и небольшие инсерции/делеции в геноме микроорганизма [2, 3].
Выделяют следующие механизмы лекарственной устойчивости микобактерий туберкулёза [8]: инактивация антибиотика ферментами, (например, β-лактамазами); изменение мишени (в результате мутации соответствующего участка генома происходит модификация белковой структуры); избыточное образование мишени, которое приводит к нарушению соотношения агент-мишень, в результате чего высвобождаются белки, необходимые для жизнедеятельности бактерии; выведение лекарственного вещества из бактериальной клетки (эффлюкс) по средствам включения стрессорных механизмов защиты; уменьшение проницаемости клеточной стенки, вследствие чего антибиотик не может проникнуть внутрь бактерии; появление дополнительного (обходного) пути обмена веществ.
Помимо прямого воздействия на метаболизм микробных клеток многие антибактериальные препараты (бензилпенициллин. стрептомицин, рифампицин) и другие неблагоприятные факторы (биоциды иммунной системы) приводят к появлению изменённых форм микобактерий (протопласты, L-формы), а также переводят клетки в дормантное состояние: интенсивность обмена клетки снижается и бактерия становится невосприимчивой к действию антибиотика [8].
Выделяют основные противотуберкулезные препараты I ряда: рифампицин, изониазид, этамбутол, стрептомицин, пиразинамид. Препараты II ряда являются резервными и используются для лечения полирезистентного туберкулеза, к ним относятся: этионамид, циклосерин, канамицин, виомицин, амикацин и др. [3, 5]
Механизм рифампицина основан на взаимодействии с β-субъединицей РНК-полимеразы (ген rpoB), в результате чего происходит ингибирование инициации транскрипции. МБТ устойчивы к рифампицину благодаря мутации в фрагменте β-субъединицы (27 кодонов – 507-533) этого фермента (более 95%штаммов). При мутации в кодонах 526 (36%) и 531 (43%) [3, 10] обнаруживают высокий уровень резистентности к антибиотику, в то время как, в кодонах 511, 516, 518 и 522 – низкий. У 4%штаммов механизм резистентности неизвестен, так как они не несут мутаций в данном гене [3, 6].
Изониазид является пролекарством. Молекула препарата активируется внутри микробной клетки под действием фермента каталазы-пероксидазы (ген katG). Мутации в гене katG (в положении 315) приводят к снижению активности фермента примерно на 50%. Также ферменты, участвующие в метаболизме миколевой кислоты (основной компонент клеточной стенки МБТ), являются мишенями для активированного изониазида: ацетилированный белок-носитель (ген acpM), синтетаза (ген kasA) и редуктаза (ген inhA) белка-носителя. Мутации, возникшие в этих генах, вызывают устойчивость, связанную с гиперпродукцией мишеней. Уровень устойчивости при этом ниже, чем при мутации в гене katG [3, 10].
О механизмах действия пиразинамида известно мало. Он также является пролекарством. Пиразинамид по средствам пассивной диффузии проникает в бактериальную клетку, где под действием фермента пиразинамидазы переходит в активную форму – пиразиноевую кислоту (ген pncA), которая блокирует ферменты биосинтеза жирных кислот. 72% изолятов, устойчивых к пиразинамиду, имеют мутации в гене pncA. У пиразинамидустойчивых МБТ выявляют также отсутствие АТФ-зависимого транспорта этого препарата в клетку [3, 6].
Стрептомицин приводит к ингибированию синтеза белка, связываясь с 16S рРНК (rrs). Мутации, ассоциированные с устойчивостью к стрептомицину, идентифицированы в генах, кодирующих 16S РНК (rrs) и белок малой рибосомной субъединицы 12S (rpsL). Есть данные о мутации, которая ведет к повышению устойчивости МБТ к стрептомицину – эти штаммы плохо растут, пока в их питательную среду не добавить данный антибиотик (стрептомицинзависимые штаммы) [6].
Этамбутол осуществляет свое влияние через белок embB (арабинозилотрансфераза), принимающий участие в синтезе структурных элементов клеточной стенки МБТ. Устойчивость к этому препарату появляется вследствие точечной мутации в 306-м кодоне [10].
Этионамид (протионамид) также способствует появлению мутаций в гене inhA, поэтому резистентность к этионамиду иногда возникает вместе с резистентностью к изониазиду, так как эти препараты имеют общего предшественника – никотинамид. Этионамид является пролекарством и для его активирования необходим фермент, который в настоящее время еще не установлен [3, 6].
Канамицин (амикацин) вызывает мутации в 16S рРНК (1400 позиция) – замена аденина на гуанин [6].
Фторхинолоны вызывают мутации в генах gyrA и gyrB ДНК-гиразы. Вследствие этого нарушается процесс репликации ДНК [9].
Представленная информация призвана способствовать формированию целенаправленной деятельности для контроля лекарственной устойчивости в интересах совершенствования лечебно-профилактических мероприятий у больных туберкулезом.
VI. ОПРЕДЕЛЕНИЕ ЛЕКАРСТВЕННОЙ УСТОЙЧИВОСТИ МИКОБАКТЕРИЙ К ПРОТИВОТУБЕРКУЛЕЗНЫМ ПРЕПАРАТАМ
Определение спектра и степени устойчивости микобактерий к противотуберкулезным препаратам имеет важное значение для тактики химиотерапии больных, контроля за эффективностью лечения, определения прогноза заболевания и проведения эпидемиологического мониторинга лекарственной устойчивости микобактерий в пределах отдельной территории, страны и мирового сообщества. Степень лекарственной устойчивости микобактерий определяется в соответствии с установленными критериями, которые зависят как от противотуберкулезной активности лекарственного препарата, так и его концентрации в очаге поражения, величины максимальной терапевтической дозы, фармакокинетики препарата и многих других факторов.
В настоящее время для определения лекарственной устойчивости микобактерий к противотуберкулезным препаратам в международной практике используются следующие методы:
- метод пропорций на среде Левенштейна-Йенсена или на среде Миддлбрука 7Н10;
- метод абсолютных концентраций на плотной яичной среде Левенштейна-Йенсена;
- метод коэффициента резистентности;
- радиометрический метод Bactec R 460.
Выбор того или иного метода определяется традиционно сложившимися методическими подходами, используемыми в данной стране. Однако необходимо иметь в виду, что обязательным условием эффективного мониторинга, обеспечения эпидемиологического надзора за лекарственной устойчивостью микобактерий и распространением лекарственно-устойчивых штаммов возбудителя, а также сопоставления результатов исследований и эффективности лечения в масштабах страны должен использоваться только один из предложенных унифицированных методов.
В нашей стране получило распространение определение лекарственной устойчивости методом абсолютных концентраций на среде Левенштейна-Йенсена.
При всех методах определения лекарственной устойчивости необходимым звеном в деятельности лаборатории является обеспечение контроля качества исследований.
Чувствительность микобактерий к противотуберкулезным препаратам определяется неспособностью штамма расти на среде, содержащей препарат, при стандартных условиях постановки опыта. Чувствительными к данному препарату считаются те штаммы микобактерий, на которые этот препарат в критической концентрации оказывает бактерицидное или бактериостатическое действие в соответствии с принятым критерием устойчивости.
Устойчивость (резистентность) определяется как снижение чувствительности до такой степени, что данный штамм микобактерий способен размножаться при воздействии на него препарата в критической или более высокой концентрации.
Наряду с понятиями "чувствительность" и "устойчивость" к противотуберкулезным препаратам в настоящее время используются также термины, определяющие различные аспекты лекарственной устойчивости. Так, в случае наличия лекарственной устойчивости к двум или более лекарственным препаратам данный штамм микобактерий определяется как полирезистентный.
Особое место среди полирезистентных занимают микобактерии, у которых обнаруживается лекарственная устойчивость к двум основным противотуберкулезным препаратам (изониазиду и рифампицину) - штаммы, обладающие лекарственной устойчивостью одновременно к изониазиду и рифампицину, независимо от наличия устойчивости к другим противотуберкулезным препаратам, обозначаются как штаммы с множественной лекарственной устойчивостью (или штаммы с МЛУ).
Этим штаммам уделяется особое внимание, так как лечение пациентов, у которых процесс вызван такими штаммами, представляет большие трудности. Оно является длительным, дорогостоящим и требует использования препаратов резервного ряда, многие из которых дорогостоящие и могут вызывать тяжелые побочные реакции. Кроме того, некоторые штаммы с множественной лекарственной устойчивостью обладают повышенной способностью к распространению (трансмиссивностью) и вызывают тяжелые прогрессирующие формы заболевания, нередко приводящие к неблагоприятным исходам.
Наряду с перечисленными определениями различных видов спектра лекарственной устойчивости микобактерий, в международной практике принято различать первичную и приобретенную лекарственную устойчивость.
Первичная лекарственная устойчивость определяется как устойчивость, обнаруженная у микобактерий, выделенных от пациента, никогда не принимавшего противотуберкулезные препараты или получавшего такое лечение менее одного месяца. В данном случае подразумевается, что больной заразился лекарственно-устойчивым штаммом микобактерий. Первичная лекарственная устойчивость характеризует состояние микобактериальной популяции, циркулирующей в данной территории, и ее показатели важны для оценки степени напряженности эпидемической ситуации.
Приобретенная (вторичная) лекарственная устойчивость определяется как устойчивость микобактерий, выявленных у больного туберкулезом, получавшего лечение противотуберкулезными препаратами в течение месяца и более. Вторичная лекарственная устойчивость является косвенным показателем эффективности проводимой химиотерапии.
Уровень устойчивости данного штамма в целом выражается той максимальной концентрацией препарата (количество мкг в 1 мл питательной среды), при которой еще наблюдается размножение микобактерий (по числу колоний на плотных средах).
Лекарственно-устойчивые микроорганизмы способны размножаться при таком содержании препарата в среде, которое оказывает на чувствительные особи бактериостатическое или бактерицидное воздействие.
Критические концентрации. Критерии лекарственной устойчивости.
Для различных препаратов установлена определенная критическая концентрация. Она имеет клиническое значение, так как отражает воздействие препарата на микобактерии туберкулеза в условиях макроорганизма.
КРИТЕРИЕМ УСТОЙЧИВОСТИ МИКОБАКТЕРИАЛЬНОЙ ПОПУЛЯЦИИ НАЗЫВАЮТ ПОКАЗАТЕЛЬ РОСТА МИКОБАКТЕРИАЛЬНОГО ПУЛА, ВЫРАЖЕННЫЙ В АБСОЛЮТНЫХ (ЧИСЛО КОЕ) ИЛИ ОТНОСИТЕЛЬНЫХ ЕДИНИЦАХ (ПРОПОРЦИЯ КОЕ), НА ПИТАТЕЛЬНОЙ СРЕДЕ, СОДЕРЖАЩЕЙ ПРОТИВОТУБЕРКУЛЕЗНЫЙ ПРЕПАРАТ В КРИТИЧЕСКОЙ КОНЦЕНТРАЦИИ, ПРЕВЫШЕНИЕ КОТОРОГО СЧИТАЕТСЯ НАЛИЧИЕМ ПРИЗНАКА УСТОЙЧИВОСТИ МИКОБАКТЕРИЙ.
Для метода абсолютных концентраций появление более 20 КОЕ микобактерий на питательной среде, содержащей лекарственный препарат в критической концентрации, свидетельствует о том, что данный штамм микобактерий обладает лекарственной устойчивостью. При этом необходимо иметь в виду, что объем засеваемой суспензии клеток стандартизован и соответствует 1 x 10(7) микробных тел.
Для разных по составу питательных сред критическая концентрация одного и того же препарата различна. Значения критических концентраций существенно отличаются также при использовании разных методов определения лекарственной чувствительности.
КРИТИЧЕСКИЕ КОНЦЕНТРАЦИИ ПРОТИВОТУБЕРКУЛЕЗНЫХ ПРЕПАРАТОВ ДЛЯ ОПРЕДЕЛЕНИЯ ЛЕКАРСТВЕННОЙ УСТОЙЧИВОСТИ МЕТОДОМ АБСОЛЮТНЫХ КОНЦЕНТРАЦИЙ НА СРЕДЕ ЛЕВЕНШТЕЙНА-ЙЕНСЕНА
| Название препарата | Концентрация в мкг/мл |
| Препараты основного ряда | |
| Стрептомицин | 10 |
| Изониазид | 1 |
| Рифампицин | 40 |
| Этамбутол | 2 |
| Препараты резервного ряда | |
| Канамицин | 30 |
| Протионамид (этионамид) | 30 |
| Циклосерин | 30 |
| Капреомицин | 30 |
| Офлоксацин | 2 |
| ПАСК | 1 |
| Пиразинамид | 200 |
Критические концентрации препаратов II ряда носят ориентировочный характер и будут окончательно установлены после дополнительных исследований.
В питательную среду Левенштейна-Йенсена, не содержащую крахмала (крахмал адсорбирует лекарственные препараты), непосредственно перед свертыванием добавляют рабочие разведения различных противотуберкулезных препаратов.
Для приготовления питательных сред с целью определения лекарственной устойчивости микобактерий должны использоваться химически чистые субстанции противотуберкулезных препаратов.
ДЛЯ ПРИГОТОВЛЕНИЯ ИЗ ХИМИЧЕСКИ ЧИСТОЙ ПОРОШКОВИДНОЙ ФОРМЫ ПРЕПАРАТА РАБОЧИХ РАСТВОРОВ, СОДЕРЖАЩИХ НЕОБХОДИМЫЕ ДЛЯ ИССЛЕДОВАНИЯ КОНЦЕНТРАЦИИ АКТИВНОЙ СУБСТАНЦИИ, РАСЧЕТЫ ПРОИЗВОДЯТ С УЧЕТОМ ПРОЦЕНТА АКТИВНОСТИ ПРЕПАРАТА.
Активность препарата может варьировать от одной его серии к другой серии. Сведения об активности приводятся на этикетках или упаковках лекарственных препаратов и могут быть получены от компании-изготовителя.
Наряду с непрямым определением лекарственной устойчивости микобактерий в ряде случаев при наличии у больного массивного бактериовыделения (значительное или умеренное количество микобактерий - см. таблицу 3), выявляемого при микроскопическом исследовании мазка нативного материала или осадка, можно использовать метод прямого определения лекарственной устойчивости. В таких случаях производится прямой посев осадка обработанного детергентами диагностического материала на набор питательных сред с противотуберкулезными препаратами. Параллельно, чтобы не упустить возможность выделения культуры микобактерий, обязательно производится посев материала на стандартные питательные среды. Метод прямого определения лекарственной устойчивости может (в случае положительного результата) значительно ускорить получение ответа о лекарственной устойчивости возбудителя. Однако следует иметь в виду, что при его выполнении (в отличие от непрямого метода) производится недозированный засев микобактерий, что значительно затрудняет интерпретацию результатов.
6.4.2. Метод пропорций
Метод основан на сравнении числа микобактерий выделенной культуры, выросших в отсутствии препарата и в его присутствии в критических концентрациях. Для этого приготовленную, как описано выше, суспензию микобактерий, содержащую 1 мг/мл влажного веса микобактерий, разводят до концентрации 10(-4) и 10(-6). Оба разведения суспензии засевают на питательную среду без препарата и на набор сред с разными препаратами. Если на среде с препаратом вырастают колонии, составляющие более 1% от числа выросших на среде без препарата, культура считается устойчивой к данному препарату. Если количество КОЕ, устойчивых к данному препарату, менее 1%, культура считается чувствительной.
6.4.3. Метод коэффициента резистентности
Этот метод основан на определении соотношения минимальной ингибирующей концентрации (МИК), определяемой для данного штамма конкретного больного, к МИК лекарственно-чувствительного стандартного штамма H37Rv, испытываемых в одном и том же эксперименте. В данном случае штамм H37Rv используется не для контроля опыта, а для определения возможных вариаций при постановке теста. С этой точки зрения данный метод является наиболее точным из трех вышеперечисленных, однако в силу необходимости использовать большое количество пробирок с питательной средой он является и наиболее дорогим. Последнее обстоятельство резко ограничивает его применение.
Кроме описанных выше классических методов культивирования микобактерий туберкулеза на плотных питательных средах, в настоящее время нашли свое применение следующие системы культуральной диагностики микобактерий и определения лекарственной устойчивости.
Полуавтоматизированная радиометрическая система для выявления микобактерий в диагностическом материале и определения лекарственной устойчивости к основным противотуберкулезным препаратам. Для роста микобактерий в системе используются флаконы с жидкой питательной средой, которая представляет собой обогащенную бульонную основу, содержащую C(14) - меченый субстрат. По мере роста микобактерий утилизируют меченый субстрат и выделяют радиоактивный углекислый газ C(14)O2 в пространство над средой во флаконе. В процессе тестирования газ автоматически забирается из флакона, уровень радиоактивности измеряется и регистрируется в виде индекса роста по шкале от 0 до 999. Результат посева считается положительным, если индекс роста превышает заданный порог. Ежедневное изменение индекса роста пропорционально степени роста микобактерий туберкулеза в среде. Наличие роста микобактерий может быть зафиксировано начиная с 4 - 5 суток от момента посева, учет результатов производят в течение 6 недель.
Для выделения микобактерий и определения лекарственной устойчивости может быть использована система с индикацией роста по флюоресценции в ультрафиолетовом свете. Пробирки с индикатором роста содержат модифицированный бульон. В пробирки с питательной средой вносят обогатитель и смесь антибиотиков, подавляющую рост посторонней микрофлоры. Встроенный в силикон дна пробирок флюоресцентный компонент чувствителен к присутствию кислорода, растворенного в бульоне. Высокие начальные концентрации растворенного кислорода гасят эмиссию этого вещества, и регистрируется очень низкий уровень флюоресценции. Позднее активно размножающиеся микобактерии поглощают кислород, что позволяет наблюдать более интенсивную флюоресценцию при использовании ультрафиолетового трансиллюминатора. Рост также может быть зафиксирован по наличию негомогенной замутненности - мелких зерен или хлопьев в культуральной среде. Учет результатов производится в течение 8-ми недель от момента посева. Для определения лекарственной устойчивости требуется от 3-х до 14-ти дней.
ВО ВСЕХ СЛУЧАЯХ ИССЛЕДОВАНИЯ ЛЕКАРСТВЕННОЙ РЕЗИСТЕНТНОСТИ ПОЛОЖИТЕЛЬНЫЙ РЕЗУЛЬТАТ АНАЛИЗА ДОЛЖЕН ОБЯЗАТЕЛЬНО ПОДТВЕРЖДАТЬСЯ ПРИ КОНТРОЛЬНОМ МИКРОСКОПИЧЕСКОМ ИССЛЕДОВАНИИ НА НАЛИЧИЕ КИСЛОТОУСТОЙЧИВЫХ БАКТЕРИЙ И ОТСУТСТВИЕ РОСТА ЗАГРЯЗНЯЮЩЕЙ МИКРОФЛОРЫ.
Метод, основанный на технологии колориметрического детектирования продукции CO2 как продукта метаболизма субстратов среды развивающимися в ней микроорганизмами. Он обеспечивает уровень чувствительности, ранее достижимый только с помощью радиометрических методик, при высоком уровне безопасности, сокращении времени анализа и трудозатрат.
Система включает флаконы с питательной средой и реагенты, детекторно-инкубационные модули и компьютерную систему учета. В системе используется питательная среда с добавками факторов роста. Система совмещает 3 функции: выделение микроорганизмов из крови; выделение микобактерий из различного диагностического материала; проверка стерильности.
Последняя разработка, используемая для определения лекарственной чувствительности микобактерий к критическим концентрациям 5 противотуберкулезных препаратов (стрептомицин, изониазид, рифампицин, этамбутол и пиразинамид), основана на сочетании агарового метода пропорций с радиометрическими методами, использующими жидкие питательные среды.
Приложение N 12
к Приказу Минздрава России
от 21 марта 2003 г. N 109
М. А. ВЛАДИМИРСКИЙ, Ю. С. АЛЯПКИНА, Д. А. ВАРЛАМОВ, Я. И. АЛЕКСЕЕВ, Л. К. ШИПИНА, М. В. ШУЛЬГИНА, Л. В. ДОМОТЕНКО, К. Р. БЫКАДОРОВА, Н. Н. ГАЩЕНКО, Б. ЕНДОУРОВА, Б.. В. ИВАНОВА, Е. А. ИЛЬИНА, О. А. ЛЕВКОВА, . В. МАРКОВА, В. П. НАЗЕМЦЕВА, Е. П. ПАВЛОВА,4А. И. ПОЛОЗОВ, Н. В. ШИШКИНА
НИИ фтизиопульмонологии ММА им. И. М. Сеченова, ЗАО "Синтол", Москва, НП Центр внешнего контроля качества лабораторных исследований, Москва, 4НИИ прикладной микробиологии, Оболенск, ОПТД, Ростов-на-Дону, КПТД Краснодар, ОПТД Мурманск, ОПТД, Кемерово, 9ОПТД, Нижний Новгород, ОПТД, Воронеж, ПТД № 4, Москва, 2ОПТД, Калининград, 3ОГТТД, Псков, ОПТД,Брянск, ОПТД, Саратов
Распространение лекарственно-устойчивых штаммов микобактерий туберкулеза (МБТ) является одной из наиболее серьезных проблем борьбы с туберкулезом во всем мире, в частности в России [1, 32], Оно в значительной степени связано с низкой эффективностью, точнее длительностью проведения, анализа лекарственной чувствительности МБТ при использовании традиционных микробиологических методов.
Развитие молекулярно-биологических методов быстрого определения чувствительности МБТ к противотуберкулезным препаратам основано на амплификации с использованием полимеразноцепной реакции (ПЦР) специфических участков генов, кодирующих мишени лекарственных веществ, с определением мутаций, связанных с возникновением устойчивости. Основные методы анализа: определение мутаций с помощью секвенирования (определение нуклеотидных последовательностей) полученных ампликонов [13, 18]; гибридизация ампликонов на полосках (стрипах) с олигонуклеотидными ДНК-зондами, комплементарными к известным мутациям, — метод line probe assay (LPA) [6, 8]; гибридизация с ДНК-зондами в формате микробиочипа [2—5, 9], технологии, основанные на ПЦР в реальном времени (ПЦР-РВ) [11, 15, 17, 19, 23].
Наиболее часто встречающиеся мутации, связанные с возникновением устойчивости МБТ к рифампицину в гене гроВ, а для изониазида — в генах katG и inhA, хорошо изучены и установлены [18].
Возможности практического применения этих методов активно обсуждаются в научной литературе [16, 18, 19, 21]. В клинической практике эти методы могут использоваться для быстрого (2 дня) определения лекарственной устойчивости к соответствующим препаратам и своевременной коррекции лечения, а также служить средством контроля за распространением лекарственно-устойчивых штаммов, своевременного эпидемиологического расследования их трансмиссии.
Изучение эффективности применения молекулярно-биологических методов, позволяющих быстро обнаруживать лекарственную устойчивость МБТ, должно, безусловно, быть основано и на сопоставлении с методами золотого стандарта, т. е. общепризнанными методами культурального (фенотипического) исследования для определения лекарственной чувствительности или устойчивости МБТ.
Мы разработали на основе технологии ПЦР-РВ эффективный и технически доступный с использованием одностадийного анализа метод быстрого определения лекарственной устойчивости к основным противотуберкулезным препаратам (изониазид, рифампицин, этамбутол).
Этот метод мы применяли для широкого исследования распространенности штаммов МБТ, особенно среди больных с впервые установленным диагнозом туберкулеза, устойчивых к основным противотуберкулезным препаратам — рифампицину и изониазиду — в 24 регионах Российской Федерации. При этом было проведено сопоставление результатов определения лекарственной устойчивости изучаемых (более 2 тыс.) штаммов МБТ, полученных методом ПЦР-РВ с результатами анализа тех же штаммов методами традиционного исследования в региональных микробиологических лабораториях. Кроме того, 100 штаммов МБТ, случайно выбранных из общего числа исследованных, были повторно тестированы с помощью культурального исследования методом пропорций в независимой лаборатории (НИИ прикладной микробиологии, Оболенск Московской области), неоднократно и успешно участвовавшей в тестировании внешнего контроля качества лабораторных исследований.
Штаммы МБТ. 22 референтных клинических штамма с известной характеристикой в отношении их устойчивости к рифампицину (12 штаммов были устойчивы к рифампицину при исследовании в жидкой культуре с помощью Bactec MGIT 960) любезно предоставлены ведущим научным сотрудником лаборатории микробиологии Центрального НИИ туберкулеза РАМН О. А. Иртугановой. 20 штаммов МБТ были получены из супранациональной референс-лаборатории в Швеции от проф. С. Хоффнера в рамках реализации программы внешней оценки качества лабораторных исследований.
С целью изучения распространенности лекарственной устойчивости МБТ в регионах Российской Федерации были изучены 2002 клинических штамма, полученных из 24 областных и краевых противотуберкулезных диспансеров, расположенных в основных географических регионах РФ. Культуры МБТ были собраны по мере их получения в региональной лаборатории по случайной выборке в объеме 60—100 штаммов в зависимости от размеров обслуживаемого региона, исходя из принципа 1 пациент — 1 культура. При этом 70% или основная часть культур МБТ принадлежали пациентам, впервые выявленным, леченным не более 1 мес.
В исследовании были отражены все основные федеральные округа РФ: Северо-Восток (Мурманск, Псков, Калининград) — 281 культура; Центральный федеральный округ (Москва, Брянск, Калуга, Владимир, Рязань, Смоленск, Воронеж, Ярославль) — 534 культуры; Поволжье (Нижний Новгород, Саратов, Самара, Волгоград) — 354 культуры; Южный федеральный округ (Ростов, Ставропольский и Краснодарский края) — 339 штаммов: Урал, Сибирь и Дальний Восток (Екатеринбург, Кемерово, Новосибирск, Иркутск, Красноярск, Якутск) — 494 культуры.
Основная часть культур клинических штаммов МБТ была получена при культивировании на среде Левенштейна-Йенсепа, и лекарственная чувствительность к рифампицину и изониазиду изучена стандартным методом абсолютных концентраций с определением роста микобактерий при критической концентрации 40 и 1 мкг/мл соответственно.
Определение лекарственной чувствительности 100 случайно выбранных культур МБТ методом пропорций проводили на агаре Миддлбрука 7H10 ("Difco") с критическими концентрациями рифампицина (3 мкг/мл) и изониазида (0,2 и 1 мкг/мл). Культуру считали устойчивой к препарату, если число МБТ, выросших на среде с препаратом, было выше 1%.
Пробоподготовка образцов и экстракция ДНК. Образцы ДНК выделяли из культур МБТ и образцов мокроты с помощью модифицированного метода R. Boom и соавт. [8] с использованием кремниевых частиц с магнитным ядром.
К полученному объему осадков (образцы мокроты) или суспензии клеток МБТ добавляли 2 объема 6 М раствора гуанидина тиоцианата и инкубировали при встряхивании 10 мин. Затем центрифугировали на микроцентрифуге при 12 000 об/мин в течение 3 мин. В супернатапт вносили 50 мкл магнитных кремниевых микрочастиц в концентрации 10 мг/мл. Инкубировали с микрочастицами при легком встряхивании в течение 15—20 мин. Частицы осаждали и отмывали дважды в 2,5 М растворе гуанидина тиоцианата с использованием специального магнитного штатива. Затем микрочастицы дважды отмывали в 70% растворе этанола и подсушивали при 60°С.
Элюировали ДНК с поверхности частиц 80 мкл дистиллированной воды при 60°С в течение 10 мин. Собирали водные растворы образцов ДНК и хранили при -20°С до использования.
Определение мутаций в генах rpoB, katG и inliA проводили с помощью модифицированной аллель- специфичной ПЦР-РВ. Амилифицировали фрагменты ДНК указанных выше генов: 195 п. н. для гроВ; 217 и 248 п. н. для katG и inliA соответственно. Фрагменты включали участки с известными мутациями, ассоциированными с лекарственной устойчивостью. Система праймеров и флюорогенных зондов для проведения ПЦР-РВ с определением мутаций в этих генах описана в нашей статье, направленной в печать.
Принцип метода состоит в использовании наряду с линейным флюорогенным ДНК-зондом (TaqMan) [17], детектирующим наличие ДНК МБТ, системы из 3 специальным образом сконструированных аллель-специфичных праймеров, меченных различными флюоресцентными метками на 5'-конце, комплементарных олигонуклеотиду, содержащему гаситель флюоресценции на 3'- конце. При отсутствии мутации в реакции срабатывают немеченные праймеры и линейный флюо- рогенный TaqMan-зонд. При наличии одной из мутаций в анализируемом фрагменте соответствующего гена встраивается аллель-специфичный праймер с освобождением гасителя, в результате чего фиксируется рост флюоресценции соответствующей метки, что регистрируется в соответствующем окне измерения флюоресценции. Таким образом, в одной пробирке наблюдается до 3 точек мутации.
Амплификацию проводили по программе: 10 мин — 94°С; 50 циклов:20 с — 94°С, 50 с — 58°С (гроВ) или 62°С (katG, inhA) с помощью прибора АНК-32 (Институт аналитического приборостроения, Санкт-Петербург), обладающего возможностью измерения флюоресценции в 4 различных каналах.
1. Разработан новый молекулярно-генетический метод быстрого определения лекарственной устойчивости МБТ в клинических штаммах и образцах мокроты на основе мультиплексной аллельспеци- фической ПЦР-РВ; метод отличается относительной технологической простотой и по предварительным расчетам не превышает стоимость традиционного определения лекарственной чувствительности МБТ.
2. Совпадаемость результатов ПЦР-анализа и культурального микробиологического исследования 1092 клинических штаммов, анализированных в 11 региональных лабораториях, в среднем составила 94%; совпадаемость результатов повторного тестирования в независимой лаборатории случайно избранных 100 штаммов МБТ культуральным методом пропорций составила 99% для изониазида и 100% для рифампицина.
3.При анализе распространения лекарственной устойчивости к рифампицину и изониазиду в 24 субъектах различных географических зон РФ установлен в среднем очень высокий уровень распространения штаммов МБТ с МЛУ среди впервые выявленных больных туберкулезом — 21,9%. Кроме того, у 13% больных этой группы установлены также лекарственная устойчивость к изониазиду. Моноустойчивость к рифампицину обнаружена лишь у 3,5% штаммов МБТ с лекарственной устойчивостью. В штаммах, полученных от больных, ранее леченных, либо от пациентов с хроническим течением туберкулеза, МЛУ установлена в 58,5% случаев, устойчивость только к изониазиду — в 19,8% случаев. Лишь в 2 территориях (Москва и Волгоград) уровень МЛУ среди вновь выявленных пациентов был относительно невысоким — 6,6 и 7,7% соответственно.
1. Балабанова Я. М., Рэдди М., Грэмм К. и др. Анализ факторов риска возникновения лекарственной устойчивости у больных туберкулезом гражданского и пенитенциарного секторов в Самарской области // Пробл. туб. — 2005. — № 5. —С. 25-3.
2. Михайлович В- М., Лапа С. А., Грядупов Д. А. и др. Использование методов гибридизации и ПЦР на специализированном ТБ-микробиочипе для обнаружения рифампицин- резистентных штаммов Mycobacterium tuberculosis // Бюл. экспер. биол. — 2001. — Т. 131, № 1. — С. 112—117.
3.Поляков А. Е., Сафонова С. Г., Скотпикова О. И. Определение множественной лекарственной устойчивости М. tuber culosis различными методами jI Пробл. туб. — 2006. — № 6.- С. 40-42.
4. Скотникова О. И., Носова Е. Ю., Галкина К. Ю. Определение множественной лекарственной устойчивости М. tuberculosis молекулярно-биологическими методами: Метод, рекомендации // Пробл. туб. — 2006. — № 7. — С. 57—60.
5. Фирсова В. А., Полуэктова Ф. Г., Кузьмин А. В., Черноусова Л. Н. Роль метода биологических микрочипов в определении устойчивости микобактерий туберкулеза к рифампицину у подростков с активным туберкулезом легких // Пробл. туб. - 2006. - № 8. - С. 28-30.
6. Bang D., Bengard Andersen A., Thomsen V. О. Rapid genotypic detection of rifampin- and izoniazid-resistant Mycobacterium tuberculosis directly in clinical specimens // J. Clin. Microbiol.- 2006. - Vol. 44, N 7. - P. 2605-2608.
7. Boom R., Sol C. A., Salimans М. M. et al. Rapid and simple method for purification of nucleic acids j I J. Clin. Microbiol. — 1990. - Vol. 28. - P. 495-503.
8. Brossier P., Veziris N., Truffot-Pernot C. et al. Perfomance of the genotype MTBDR line probe assay for detection of resistance to rifampin and isoniazid in strains of Mycobacterium tuberculosis with low- and high-level resistance // J. Clin. Microbiol. — 2006. - Vol. 44, N 10. - P. 3659-3664.
9. Caoili J. C., Mayorova A., Sikes D. et al. Evaluation of the TB- Biochip oligonucleotide microarray system for rapid detection of rifampin resistance in Mycobacterium tuberculosis // J. Clin. Microbiol. - 2006. - Vol. 44, N 7. - P. 2378-2381.
10. Espasa, Gonzalez-Martin Julian, Alcaide Fernando et al. Direct detection in clinical samples of multiple gene mutations causing resistance of Mycobacterium tuberculosis to isoniazid and ri- fampicin using fluorogenic probes // J. Antimicrob. Chemother.- 2005. - Vol. 55, N 6. - P. 860-865.
11. Garcia de Viedma D., del Sol Diaz Inf antes М., Lasala F. et al. New real-time PCR able to detect in a single tube multiple rifampin resistance mutations and high-level isoniazid resistance mutations in Mycobacterium tuberculosis // J. Clin. Microbiol.- 2002. - Vol. 40. - P. 988-995.
12. Herrera-Leon Laura, Molina Tamara, Saiz Pilar et al. New Multiplex PCR for rapid detection of isoniazid-resistant Mycobacterium tuberculosis clinical isolates // Antimicrob. Agents Chemother. - 2005. - Vol. 49, N 1. - P. 144-147.
13. Jureen P., Engstrand L., Eriksson S. et al. Rapid detection of rifampin resistance in Mycobacterium tuberculosis by Pyrose- quencing technology // J. Clin. Microbiol. — 2006. — Vol. 44, N 6. - P. 1925-1929.
14. Mokrousov I., Otten Т., Vyazovaya A. et al. PCR-bascd methodology for detecting multidrug-resistant strains of Mycobacterium tuberculosis Beijing family circulating in Russia // Eur. J. Clin. Microbiol. Infect. Dis. — 2003. — Vol. 22. — P. 342—348.
15. Parashar D., Chauhan D. S., Sharma V. D., Katoch V. M. Applications of real-time PCR technology to mycobacterial research I I Indian J. Med. Res. — 2006. — Vol. 124. — P. 385— 398.
16. Ramaswamy S., MusserJ. M. Molecular genetic basis of antimicrobial agent resistance in Mycobacterium tuberculosis: 1998 update //Tuberc. Lung Dis. — 1998. — Vol. 79, N 1. — P. 23— 29.
17. Ruiz М., Torres M. J., Llanos A. C. et al. Direct detection of rifampin- and isoniazid-resistant Mycobacterium tiberculosis in auramine-rhodamine-positive sputum specimens by real-time PCR // J. Clin. Microbiol. — 2004. — Vol. 42. — N 4. — P. 1585-1589
18. Augustynowicz-Kope Ewa, Sekiguchi Jun-ichiro, Miyoshi-Akiyama Tohru et al. Detection of multidrug resistance in Mycobacterium tuberculosis // J. Clin. Microbiol. — 2007. — Vol. 45, N 1. — P. 179-192.
19. Torres M. J., Criado A., Palomares J. C., Aznar J. Use of realtime PCR and fluorimetry for rapid detection of rifampin and isoniazid resistance-associated mutations in Mycobacterium tuberculosis//J. Clin. Microbiol. — 2000. — Vol. 38. — P. 3194— 3199.
20. van Doom H. R., de Haas P. E., Kremer K. et al. Public health impact of isoniazid-resistant Mycobacterium tuberculosis strains with a mutation at amino-acid position 315 of katG: a decade of experience in The Netherlands // Clin. Microbiol. Infect. — 2006, - Vol. 12, N 8. - P. 769-775.
21. Mycobacterium tuberculosis // J. Clin. Microbiol. — 2007. — Vol. 45, N 1. - P. 179-192.
22. World Health Organization. Anti-tuberculosis drug resistance in the world. Report N 3. (WHO/CTS/TB/2004). — Geneva, 2004.
23. Yesilkaya Hasan, Meaca Francesca, Niemann Stefan et al. Eval- H uation of molecular-beacon, TaqMan, and fluorescence resonance energy transfer probes for detection of antibiotic resistance-conferring single nucleotide polymorphisms in mixed Mycobacterium tuberculosis DNA extracts //J. Clin. Microbiol. — 2006. - Vol. 44, N 10. - P. 3826-3829.
М. А. Владимирский, Ю. С. Аляпкина, Д. А. Варламов. Я. И. Алексеев, Л. К. Шипина, М. В. Шульгина, Л. В. Домотенко, К. Р. Быкадорова, Н. Н. Гащенко, Л. Б. Ендоурова, О. В. Иванова, Е. А. Ильина, О. А. Левкова, Т. В. Маркова, В. П. Наземцева, Е. П. Павлова, А. И. Полозов, Н. В. Шишкино. — ПРИМЕНЕНИЕ МЕТОДА ПЦР В РЕАЛЬНОМ ВРЕМЕНИ ДЛЯ ОПРЕДЕЛЕНИЯ И КОНТРОЛЯ ЗА РАСПРОСТРАНЕНИЕМ ЛЕКАРСТВЕННО-УСТОЙЧИВЫХ ШТАММОВ МИКОБАКТЕРИЙ ТУБЕРКУЛЕЗА
С помощью технологии ПЦР-РВ разработан одностадийный метод молекулярно-генетического анализа ДНК МБТ для определения мутаций, ассоциированных с лекарственной устойчивостью к противотуберкулезным препаратам: изониазиду и рифампицину. С целью анализа распространенности лекарственной устойчивости возбудителя туберкулеза в России проведено исследование 2000 штаммов МБТ в 24 регионах из всех федеральных округов. При исследовании 1406 штаммов МБТ, выделяемых впервые диагностированными, нелечеными пациентами, МЛУ выявлена в 21,9% случаев. У ранее лечившихся больных туберкулезом МЛУ констатирована в 58,5% случаев. Совпадаемость молекулярно-генетического анализа лекарственной устойчивости с результатами культуральных исследований при анализе 1096 штаммов составила 94%.
Читайте также:


