Бактериофаги при лечении туберкулеза

Dedrick, R. M. et al. / Nature, 2019
Ученые впервые применили бактериофаги для лечения микобактериальной инфекции у человека. В статье, опубликованной в Nature, говорится, что это первый случай медицинского использования генно-модифицированных бактериофагов. В описанном клиническом случае состояние пятнадцатилетней пациентки, больной муковисцидозом и хронически инфицированной Mycobacterium abscessus, существенно улучшилось после новаторского лечения.
Устойчивость патогенов к противомикробным препаратам уносит не менее 700000 жизней в год, без эффективной борьбы с этой проблемой к 2050 году эта цифра может вырасти до миллиона смертей ежегодно. Микобактериальные инфекции вносят существенный вклад в инфекционную заболеваемость и смертность: например, от полирезистентного туберкулеза умирает около 230000 человек в год. Антибиотикорезистентные нетуберкулезные микобактериальные болезни также широко распространены, в частности, от них часто страдают больные муковисцидозом. Хронические инфекции могут быть причиной осложнений и смерти после трансплантации легких, которая часто требуется таким пациентам.
Бактериофаги (вирусы, поражающие бактерии) – могут стать альтернативой антибиотикам, однако они ранее не применялись для лечения микобактериальных инфекций у людей. В то же время, персонализированная внутривенная фаговая терапия для других инфекций уже была описана (1, 2).
Ребека Дедрик (Rebekah M. Dedrick) и Карлос Гуерреро-Бустаманте (Carlos A. Guerrero-Bustamante) из Питтсбургского университета вместе с коллегами описали клинический случай пятнадцатилетней девушки, больной муковисцидозом и хронически инфицированной антибиотикорезистентным штаммом Mycobacterium abscessus подвида massiliense. Болезнь сопровождалась несколькими сопутствующими патологиями, включая недостаточность поджелудочной железы, инсулинозавизимый сахарный диабет и поражения печени, связанные с основным заболеванием.
Пациентке была проведена успешная двухсторонняя трансплантация легких. В течение восьми лет до этой операции она получала специфическую терапию против нетуберкулезной микобактериальной инфекции. Трансплантация прошла без осложнений, после нее девушка получала иммуносупрессивную терапию и антибиотики. После трансплантации в мокроте обнаружилась M.abscessus, печень была увеличена, функциональные печеночные пробы были патологическими. Послеоперационная рана через неделю после завершения курса внутривенного введения антибиотиков была воспалена, на предплечье появились поражения кожи.
Пациентка был выписана из больницы через семь месяцев с диагнозом диссеминированной микобактериальной инфекции. Несмотря на продолжение протвомикробного лечения, на разных частях тела продолжали появляться поражения кожи в виде узелков, состояние хирургической раны ухудшилось.
Поскольку лечение антибиотиками не давало эффекта, ученые решили провести лечение бактериофагами. Чтобы подобрать потенциально подходящие фаги, они использовали культуру штамма GD01 M.Abscessus, выделенную у пациентки через месяц после операции. Они обратились к коллекции, которая включала более 10000 фагов, геном 1800 из которых был известен. Был обнаружен только один бактериофаг, Muddy, который мог эффективно убивать микобактерии штамма GD01. Эффективность второго выбранного бактериофага, ZoeJ, была низкой, поэтому ученые использовали метод генной инженерии Bacteriophage Recombineeringof Electroporated DNA (BRED), чтобы увеличить его терапевтическую силу. Для третьего выбранного фага, BPs, который изначально слабо инфицировал M.Abscessus, авторы выделили мутантов с измененным спектром литического действия (HRM1 и HRM10).
Все три фага относятся к сифовирусам (Siphoviridae). В лабораторных экспериментах ZoeJ и BPs были менее эффективны, чем Muddy, но смесь из трех бактериофагов in vitro не оставляла в живых ни одной M.Abscessus даже при ее высоких концентрациях.
Ученые вводили пациентке приготовленную смесь из трех фагов (109 бляшкообразующих единиц каждого фага) внутривенно каждые 12 часов, лечение было назначено ориентировочно на 32 недели. Больная была выписана из больницы через девять дней, лечение продолжалось дома. Во время первых двух часов лечения у пациентки отмечалась потливость, она испытывала приливы жара, но в остальном лечение переносилось хорошо: другие побочные эффекты зафиксированы не были. Через месяц терапии было добавлено местное лечение бактериофагами в местах поражений кожи.
В течение шести месяцев (к моменту написания статьи) состояние пациентки постепенно улучшалось: послеоперационная рана заживала, улучшались функции легких и печени, она начала набирать вес, хотя рана на грудине затянулась не полностью. Позитронно-эмиссионная томография показала улучшения со стороны внутренних органов и кожных узелков. M.abscessus не обнаруживалась в мокроте и крови начиная с первого дня лечения, но все еще выделялась из кожных узелков.

Снимки, полученные при помощи позитронно-эмиссионной томографии за 12 недель до лечения и спустя шесть недель после него. 1) область грудины и окружающие мягкие ткани, 2) брюшные лимфатические узлы и ворота печени, 3) кожные узелки.
Dedrick, R. M. et al. / Nature, 2019

Снимки, полученные при помощи позитронно-эмиссионной томографии за 12 недель до лечения и спустя шесть недель после него. 1) область грудины и окружающие мягкие ткани, 2) брюшные лимфатические узлы и ворота печени, 3) кожные узелки.

Врачи Центрального военного клинического госпиталя им. А.А. Вишневского Минобороны РФ совместно с учеными восстановили методику создания коктейлей из бактериофагов. Разработанная терапия стала единственным способом вылечить человека с инфекцией, вызванной супербактерией. И это уникальная возможность побороть болезнь, которую не берут никакие антибиотики. Терапия уже перешла в стадию клинической практики.

Вирусы с историей
Устойчивость вредоносных бактерий к антибиотикам является сегодня одной из наиболее серьезных угроз для здоровья человека. Всё больше патологий — пневмония, туберкулез, заражение крови, заболевания пищевого происхождения — одерживают верх из-за снижения эффективности антимикробных препаратов. Поэтому поиск новых способов борьбы с инфекциями — первостепенная задача ученых.
Персональный коктейль
Когда антибиотики уже неэффективны, для больного создается коктейль из бактериофагов. Врачи берут биоматериалы для микробиологического анализа у пациентов, которые находятся на лечении в специализированных отделениях военного госпиталя им. А.А. Вишневского. Затем в институте им. Г.Н. Габричевского, где находится самая большая в стране библиотека бактериофагов, ученые подбирают максимально эффективные штаммы с учетом иммунного ответа конкретного больного.

— Самое страшное для бактериофага — это гуморальный иммунитет, который ответственен за выработку иммуноглобулинов. Дело в том, что нейтрализующие вирус антитела появляются через две-три недели после приема фага. И нам надо быть уверенными, что именно к этому препарату у пациента пока еще нет антител, — отметил Андрей Алешкин.
Оценив иммунную систему больного, специалисты выбирают метод введения бактериофага в организм в каждом конкретном случае: при ИВЛ-ассоциированной пневмонии, например, эффективны ингаляции, а при кожных заражениях — специальные повязки.
Медицина двойного назначения
— Эти препараты назначаются больным с трофическими язвами разной этиологии, пациентам с диабетической стопой, — отметил он. — Используются при хронических остеомиелитах и свищах разного происхождения. Помогают устранять последствия ранений, но не на острой стадии, а на этапе хронических воспалительных заболеваний.
Работа ученых крайне актуальна, уверена заведующая кафедрой микробиологии и вирусологии медицинского института РУДН Ирина Подопригора.
— В научной литературе всё чаще встречаются предостережения о наступлении постантибиотической эры и призывы к поиску альтернативных путей влияния на патологические процессы инфекционной природы, — рассказывает она. — При госпитальных инфекциях, вызванных супербактериями, это может быть единственным возможным решением.

— Персональный подбор коктейлей из бактериофагов для лечения того или иного бактериоза — очень важный шаг вперед, — не сомневается он. — Однако надо понимать, что также как бактерии сумели приспособиться к антибиотикам, так еще раньше они смогли адаптироваться к наличию бактериофагов. Иначе в мире уже не осталось бы бактерий. Поэтому бактериофаги нельзя назвать идеальным оружием. Однако коллеги научились использовать их в нужное время и в нужных локациях, что очень важно.
История массового применения препаратов уходит корнями во времена Великой Отечественной войны. В 1940 году был создан коктейль из нескольких видов бактериофагов, борющихся с бактериями, вызывающими тяжелые раневые инфекции. В СССР приоритет фаготерапии принадлежал Зинаиде Ермольевой, получившей Сталинскую премию за предупреждение вспышки холеры в Советской армии в тяжелейших эпидемиологических условиях Сталинградской битвы. Крупным центром по изучению фагов во времена СССР был научно-исследовательский институт микробиологии, вирусологии и иммунологии им. Г. Элиава в Тбилиси.
Изобретение относится к медицине, к фтизиатрии и может быть использовано для фаготерапии туберкулеза. Используют регионарную лимфогенную доставку липосомальной формы микобактериофага D29. Данное изобретение способствует повышению терапевтического эффекта фаготерапии и снижению токсичности фагового препарата. 1 ил.
Изобретение относится к медицине, а именно к фтизиатрии.
В настоящее время эпидситуация по туберкулезу характеризуется резким увеличением частоты лекарственной устойчивости микобактерий туберкулеза к вновь создаваемым противотуберкулезным препаратам, что требует поиска принципиально иных способов убийства возбудителя туберкулеза в инфицированном организме. Одним из наиболее перспективных подходов является использование естественных врагов (антагонистов) М. tuberculosis среди представителей микромира, каковыми являются литические микобактериофаги [1].
Микобактериофаги - это специфические вирусы, способные избирательно заражать и интенсивно размножаться в бактерии-хозяине, что приводит к гибели (лизису) вирулентных микобактерий в течение 1-3 часов с момента заражения. Со времени открытия в 1954 г. Форманом специфического для вирулентного штамма М.tuberculosis микобактериофага предпринимались попытки использовать способность бактериальных вирусов к лизису возбудителя туберкулеза в качестве терапевтического воздействия. В ранних исследованиях была установлена достаточно высокая эффективность фаготерапии туберкулеза [2, 3, 4, 5]. Однако открытие микобактериофагов совпало во времени с появлением высокоэффективных противотуберкулезных химиопрепаратов и антибиотиков, что и предотвратило детальную проработку возможности использования микобактериофагов в качестве терапевтического агента.
В известных способах фаготерапии туберкулеза использовано парентеральное (подкожное или внутрибрюшинное) введение суспензии литического микобактериофага в физиологическом растворе.
Наиболее близким к заявляемому изобретению по методической сущности и достигаемому эффекту является способ лечения генерализованного хронического туберкулеза с использованием многократного (внутрибрюшинного) парентерального введения суспензии микобактериофага DS6A, представляющей собой фаговый лизат (смесь жизнеспособного фага и разрушенных Mycobacterium tuberculosis H37Rv в питательной среде) [2].
Однако использованному способу фаготерапии свойственен ряд существенных недостатков, препятствующих клиническому использованию его во фтизиатрии. Одной из основных проблем этого плана является развитие гуморального иммунного ответа на парентеральное введение микобактериофага и, как следствие, активная элиминация (разрушение) фага при повторных введениях, что значительно снижает терапевтическую эффективность бактериолизиса [3].
Существенным недостатком описанной в прототипе формы лечебной суспензии микобактериофага является ее токсичность, обусловленная значительной примесью продуктов лизиса микобактерий, использованных для амплификации микобактериофага [1].
Парентеральное введение суспензии микобактериофага сопровождается быстрым неизбирательным захватом фаговых частиц фагоцитирующими элементами ретикулоэндотелия 2.
В предлагаемом способе достигнуто существенное повышение терапевтической эффективности фаготерапии за счет использования регионарной лимфогенной доставки липосомальной формы микобактериофага с избирательным накоплением действующего начала в фагоцитах лимфатической системы пораженного органа.
Проблема снижения токсичности фаговых препаратов, представляющих собой взвесь фагов в лизате микобактерий, на сегодняшний день практически решена путем фракционирования лизата микобактерий в градиенте хлористого цезия, что позволяет получить абсолютно нетоксичные препараты микобактериофагов [1].
Феномен активного поглощения микобактериофагов клетками системы мононуклеарных фагоцитов при фаготерапии внутриклеточных инфекций, каковой является туберкулез, следует рассматривать как положительное свойство. Более того, целенаправленная доставка микобактериофагов в фагосомальную систему мононуклеарных фагоцитов, где сосредоточена основная масса размножающихся микобактерий, является обязательным условием взаимодействия микобактериофага и микобактерий туберкулеза и, как следствие, высокоэффективной элиминации наиболее устойчивой к рутинным противотуберкулезным препаратам субпопуляции микобактерий.
Следовательно, для повышения эффективности фаготерапии туберкулеза необходимо соблюдение следующих условий: а) воспрепятствовать разрушению фага гуморальными антителами в сосудистом русле; б) повысить вероятность взаимодействия микобактериофага с внутриклеточным пулом микобактерий; с) создание нетоксичной формы фагового препарата.
Перечисленные требования к реализации высокоэффективной фаготерапии туберкулеза соответствуют основным принципам адресной терапии внутриклеточных инфекций. Исходя из имеющегося опыта использования принципа "контейнерной доставки" действующего начала в очаг поражения [6, 7], нами разработан метод включения микобактериофага в фосфатидилхолиновые липосомы. Включение микобактериофага в фосфолипидные везикулы препятствует взаимодействию циркулирующих гуморальных антител с микобактериофагом и, следовательно, отменяется его разрушение в сосудистом русле на маршруте поступления в очаг поражения. В связи с лифмотропностью липосомальной формы регионарное введение включенной в водную фазу липосом концентрированной суспензии микобактериофагов обеспечивает избирательное поступление и накопление активного фага в лимфатической системе пораженного органа.
Высокая степень экспрессии скевенжер-рецепторов и рецепторов к липопротеидам в инфицированных макрофагах обеспечивает избирательное поступление содержащих микобактериофага липосом в микроокружение внутриклеточных микобактерий в высоколитическом титре.
Способ осуществляется следующим образом.
Обогащенную суспензию (10 9 бляшкообразующих единиц/мл) литического микобактериофага D29 включают в водную фазу фосфатидилхолиновых липосом и с помощью специального катетера по 0,2 мл полученной липосомальной суспензии вводят ректально зараженным туберкулезом мышам. Лечение осуществляют в течение одного месяца с трехдневными интервалами между введениями липосомальной суспензии фага.
В качестве примера высокой эффективности регионарной лимфотропной фаготерапии с использованием липосомальной формы микобактериофага D29 приводим данные одного из экспериментов.
Исследование проведено на модели генерализованного туберкулеза мышей с преимущественно внелегочной локализацией специфического процесса (селезенка, мезентериальные лимфоузлы). Липосомальная форма препарата получена путем механического диспергирования 1 г высушенной под вакуумом фосфолипидной пленки в 10 мл очищенной суспензии литического микобактериофага D29 в физиологическом растворе (10 9 БОЕ/мл). После интенсивного 30-минутного встряхивания получают стабильную суспензию включенного в фосфолипидные везикулы микобактериофага. По 0,2 мл полученной суспензии липосомального фага (опытная группа) или суспензии свободного фага в физиологическом растворе (контрольная группа) с помощью специального катетера вводили ректально двум группам зараженных туберкулезом мышей. Лечение осуществляли в течение одного месяца с трехдневными интервалами между введениями фага. Эффективность лечения оценивали по Першину Г.Н. и Макеевой O.O. [8].
"РГ" (26.10.2009 г. и 3.09.2010 г.) писала о том, что во время операции по удалению катаракты пациенту был занесен штамм синегнойной палочки. В результате тот ослеп. И он оказался не единственным, кто стал жертвой больничной инфекции.
В статье "Заразились в операционной" доктор медицинских наук профессор Сергей Митрохин ("РГ" за 17.09 с.г.), продолжая разговор, говорил об опасности бесконтрольного применения антибиотиков, о необходимости запрета их продажи без рецепта врача.
Революционерам-антибиотикам пришел конец? А что же защитит нас от инфекций? Как выстоять в борьбе с ними? Инфекции, в том числе и внутрибольничные, сдавать свои позиции не собираются. Особую силу, судя по всему, им придала тропическая жара и смог нынешнего лета. Знаем, что это привело к снижению иммунитета, знаем уже о первых потерях. Но впереди наступление сезонных инфекций. Не далее как вчера в Роспотребнадзоре сообщили, что в России начался рост заболеваемости гриппом. Превышение недельных эпидпорогов отмечено в 26 субъектах РФ. Бежать за антибиотиками и начинать их судорожно глотать без всяких на то предписаний медиков?
В Москве прошла 60-я сессия Европейского регионального бюро Всемирной организации здравоохранения. Одна из главных, пожалуй, даже самых актуальных тем, которые на ней обсуждались, - профилактика инфекционных заболеваний, современные подходы к их лечению. А незадолго до этого в Японии состоялся еще один знаменательный международный форум. Его тема: применение бактериофагов для лечения инфекционных болезней - прежде всего тех, которые обрели устойчивость (резистентность) к их возбудителям.
Обеспокоенность мирового медицинского сообщества данной проблемой не случайна. Инфекции - одна из ведущих причин летальных исходов. И если раньше против них успешно применялись антибиотики, то теперь. По данным 2009 года, более 25 000 пациентов в странах ЕС ежегодно умирают из-за инфекций, вызванных бактериями, устойчивыми ко множеству существующих лекарств. В России от сепсиса погибает людей больше, чем от ишемической болезни сердца. Страдает не только пациент. Существенно возрастают расходы государства на здравоохранение, снижается производительность труда.
Один пример - лечение туберкулеза. Палочка Коха прекрасно адаптировалась к имеющимся антибиотикам, и потому туберкулез так распоясался. Нужны новые антибиотики, которые сумеют эту палочку одолеть? Пока таких нигде в мире нет. Не забудем и о том, что разработка новых видов эффективных препаратов классическим путем требует почти десять лет и очень значительных материальных ресурсов. В прошлом году американское общество специалистов по инфекционным болезням обратилось к президенту страны Бараку Обаме с заявлением о том, что если к 2020 году фармацевтические компании не создадут десять принципиально новых антибиотиков, то мир по борьбе с инфекциями вернется в XIX век.
Об этой проблеме корреспондент "РГ" говорит с заведующим кафедрой дезинфектологии первого Московского государственного медицинского университета имени Сеченова Василием Акимкиным.
Российская газета: Антибиотики появились в середине ХХ века. А до того? Человечество же не вымерло от инфекций? Значит, были иные средства борьбы с ними. Средства естественные, биологические. Они же не исчезли?
Василий Акимкин: Были и не исчезли. И один из таких природных антибиотиков - бактериофаги. Это вирусы, созданные самой природой с единственной целью, единственным предназначением - убивать бактерии. Причем почти на каждую бактерию - свой бактериофаг. В переводе с греческого бактериофаг означает "пожиратель бактерий".
РГ: Как действует этот природный вирус?
Акимкин: Он безошибочно находит свою бактерию-мишень. Бактерии другого рода ему не интересны. Бактериофаг поселяется внутри мишени, начинает в ней размножаться и в конечном итоге уничтожает ее. Бактериофаги были открыты и опробованы до антибиотиков в далеком 1896 году. А началось все со священных вод Ганга. Тогда английский исследователь Эрнест Ханкин задался вопросом: что делает воды Ганга чудотворными, целебными? Почему они умудряются противостоять даже проказе, холере? Что такое есть в воде, способное убивать столь страшные бактерии? Ответил на эти вопросы в 1915 году другой английский ученый Фредерик Творт. Затем исследования переместились во Францию, где в 1917 году микробиолог Феликс д Эрелль дал этим вирусам имя - бактериофаги.
РГ: Ведь советские врачи тоже занимались бактериофагами?
Акимкин: Конечно. Виднейший советский микробиолог Георгий Элиава изучал возможности их применения для лечения различных болезней. Не стану далее вдаваться в подробности исследований и наработок в данной области. Отмечу только, что в 2006 году британское министерство обороны взяло на себя ответственность за дальнейшие исследования, справедливо полагая, что такие наработки важны для медицины и здравоохранения ХХI века. Ведь бактериофаги востребованы не только в медицине, но и в пищевой промышленности для обезвреживания некоторых продуктов питания. Изучается и вопрос их использования для обработки поверхностей и униформы в госпиталях и так далее.
РГ: Бактериофаги свободно продаются в аптеках. Их применяют для борьбы с кишечными инфекциями, дизентерией, сальмонеллой, синегнойной палочкой. Их назначают детям и беременным, советуют брать с собой тем, кто отправляется в экзотические страны. Ими обрабатывают раны, лечат кожные болезни, пневмонию, циститы, отиты, холециститы. Это не опасно? Это не приведет к тому же приручению инфекции, как происходит с антибиотиками?
Акимкин: Думаю, что нет. И главное. Применение антибиотиков неизбежно оставляет после себя следы разрушений разной степени. Бактериофаги в подобном замечены не были.
Первые клинические эксперименты с бактериофагами начались сто лет назад, и казалось, что этот новый метод терапии обречен на успех: с научной точки зрения он выглядел безупречным, и результаты применения выглядели многообещающими.
Почему же в последующие десятилетия интерес к терапевтическому применению бактериофагов в мире упал? Почему он возник вновь, и почему эта замечательная идея до сих пор не реализована в полной мере? И практические врачи, и их пациенты сегодня должны четко представлять не только суть, но и все сильные и слабые стороны этого перспективного вида терапии
Бактериофаги – это не обычные лекарства. Они не являются простыми химическими веществами, как антибиотики и большинство других препаратов, но их вряд ли можно считать и полноценными живыми организмами, так как они, как и все остальные вирусы, могут размножаться только в клетке-хозяине. По сути, это нанороботы с генетической программой, способные проникнуть внутрь бактериальной клетки и там размножиться, разрушив ее.
Поэтому к бактериофагам не всегда применимы стандартные для фармакологии нормы и подходы. И хотя фаговые препараты сегодня производятся и используются в медицине, наши знания о многообразии этих вирусов, механизмах их взаимодействия с бактериями и конкуренции с себе подобными пока недостаточны, чтобы в полной мере использовать их мощный терапевтический потенциал.
Безопасно и эффективно
Фаготерапия родилась едва ли не сразу после открытия самих бактериофагов, однако широкие испытания этих противобактериальных средств начали проводиться в СССР только в конце 1930-х гг. В результате была доказана эффективность препаратов бактериофагов как профилактического средства при борьбе с эпидемиями дизентерии и холеры, а использование их при лечении ран и гнойно-воспалительных процессов показало их потенциал как альтернативы антибиотикам.
Однако результаты исследований тех времен были зачастую противоречивы: иногда фаги сразу подавляли развитие инфекционных процессов, но иногда оказывались бесполезными. Специалисты сразу поняли, в чем причина: лечение было успешным лишь тогда, когда использовались фаги, способные инфицировать именно тот бактериальный штамм, который и вызвал заболевание. Поэтому при возникновении эпидемии требовалось выделить инфекционный агент, проверить на нем имеющиеся фаговые препараты и запустить в производство в качестве препарата наиболее эффективный бактериофаг.
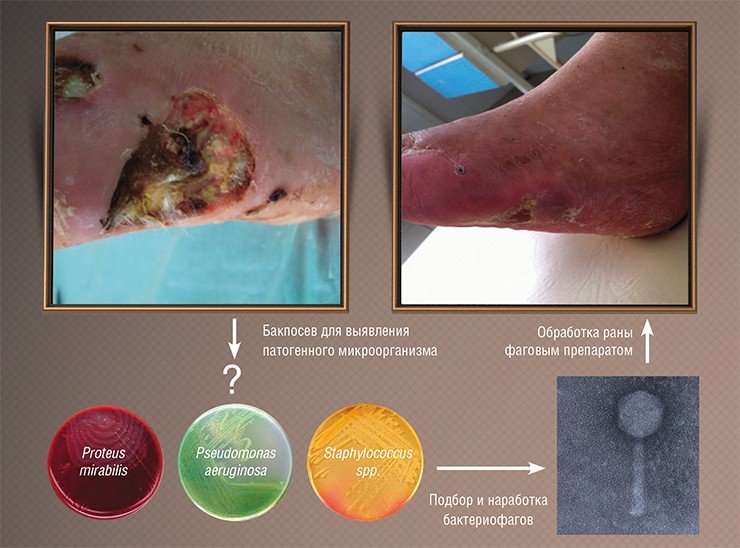
К сожалению, результаты подобных исследований, проводившихся в СССР, не были должным образом документированы и описаны в научной литературе, к тому же они проводились по схемам, не соответствующим принятым на сегодня протоколам клинических испытаний. Тем не менее главные результаты этой работы были бесспорны: фаги доказали свою безопасность и высокую эффективность в реальных условиях и с тех пор используются в нашей стране в клинической практике наряду с обычными лекарственными средствами.

С появлением антибиотиков интерес к фагам на Западе был утрачен, но после появления антибиотикоустойчивых штаммов бактерий в разных странах начали разрабатывать фаговые препараты и проводить испытания, которые, по сути, повторяли исследования, уже проведенные в СССР. Результаты этих работ вновь подтвердили безопасность препаратов бактериофагов, что, в частности, отметило и Управление по контролю за качеством пищевых продуктов и лекарственных препаратов США (FDA).
В Великобритании успешно проведены эксперименты по лечению бактериофагами хронического отита, вызванного нечувствительной к антибиотикам синегнойной палочкой Pseudomonas aeruginosa, а в рамках проекта Phagoburn семь медицинских центров Франции, Бельгии и Швейцарии проводят клинические испытания коктейля фагов для предотвращения инфекций при ожогах. Об испытаниях собственных оригинальных коктейлей фагов для лечения широкого спектра заболеваний сообщает и ряд американских фирм (Intralytix, Enbiotix, AmpliPhi). Правда ни одно из этих масштабных клинических испытаний пока не доведено до конца.
В России препараты бактериофагов можно приобрести в обычной аптеке. Но при этом нужно понимать, что в отличие от других лекарств с точной химической формулой и концентрацией действующих компонентов препарат бактериофага представляет собой нестандартный раствор, содержащий живые вирусные частицы. Даже препарат с одним и тем же названием, но произведенный на разных предприятиях или в разное время, может содержать отличающиеся комбинации и (или) пропорции фагов.
Поэтому покупать препарат бактериофага, чтобы лечиться самостоятельно, не стоит. Назначить лечение и выбрать лекарство должен специалист. Спектр заболеваний, которые можно лечить бактериофагами широк: трофические язвы, ожоговые и раневые инфекции, инфекции органов дыхания, мочеполовой системы и желудочно-кишечного тракта, остеомиелит и т. п. Возбудителями болезней во всех этих случаях служат такие печально известные бактерии, как золотистый стафилококк, включая лекарственно устойчивые штаммы, синегнойная палочка, патогенные формы кишечной палочки, сальмонеллы, протеи, стрептококки и др. В принципе в природе можно найти бактериофаг против любой бактерии, включая возбудителей чумы и сибирской язвы. Можно применять бактериофаги и для профилактики бактериальных инфекционных болезней, например, они были успешно использованы в детских садах и школах для предотвращения эпидемии дизентерии.

Основная же и главная причина неудач – неумелый подбор фагов для лечения конкретных пациентов. Каждый конкретный фаг эффективен против одного или максимум нескольких штаммов бактерий, а у разных пациентов схожая по внешнему проявлению инфекция, например, ангина может быть вызвана разными штаммами стрептококка. Чтобы вылечить больного, необходимо выделить культуру патогена и протестировать ее на чувствительность к конкретным фагам. То есть терапия бактериофагами должна проводиться с использованием принципов персонализированной медицины, к чему современная медицина практически не готова.

На пути к персонализированной Фаготерапии
Опыт СССР, Грузии и Польши показал, что для успешного применения бактериофагов нужны не только клиника, но и производственно-лабораторный участок, располагающий коллекцией фагов и специалистами, способными идентифицировать бактерии, подбирать и выделять бактериофаги для конкретного пациента.
Но в таком случае имеет ли смысл масштабное производство фаговых препаратов? Ответ – да, потому что проблема узкой специфичности фагов частично решается производством фаговых коктейлей из нескольких (иногда десятков) разных фагов, поражающих разные штаммы целевого возбудителя. Ведь подобрать для больного нужный фаговый коктейль быстрее и проще, чем тестировать отдельные фаги из большой коллекции.
И все же не надо думать, что бактериофаги полностью заменят антибиотики – эти препараты дополняют друг друга, и применяться они должны в разных ситуациях. Когда больной находится в тяжелом состоянии, и есть уверенность, что причиной служит бактериальная инфекция, времени на эксперименты и подбор препаратов нет. Единственно правильное решение в этой ситуации – антибиотик широкого спектра действия.
Но в ситуации хронической инфекции или инфекции, вызванной бактериями со множественной устойчивостью к антибиотикам, предпочтение следует отдавать бактериофагу. В случае таких затяжных болезней, как отит, у врача есть время, чтобы использовать фаговый коктейль или специально подобрать фаг. Или же, когда после операции больной поражается антибиотикоустойчивым бактериальным штаммом, и его состояние быстро ухудшается, фаготерапия может стать единственным спасением.
Богатый опыт применения бактериофагов в клинической практике, накопленный за последние сто лет, свидетельствует о перспективности фаговых медицинских технологий. Дальнейшая работа специалистов из множества компаний, работающих сегодня в этой области, и применение методов синтетической биологии обязательно приведут к созданию препаратов с несравненно большей эффективностью по сравнению с современными фаговыми коктейлями.
Тем не менее, биотехнологи, также как ученые и медики, надеются, что безвредные и эффективные препараты все же займут свое законное место в арсенале терапии инфекционных заболеваний.
Алешкин А. В. Бактериофаги в инфекционной патологии: прошлое, настоящее и будущее // Лекции по исследованию и применению бактериофагов. 2016. Ульяновск. С. 11—51.
Козлова Ю. Н., Репин В.Е., Анищенко В.В., Власов В.В. и др. Штамм бактериофага Pseudomonas aeruginosa, используемый в качестве основы для приготовления асептического средства против синегнойной палочки. // Патент РФ №2455355. 2012.
Козлова Ю. Н., Морозова В. В., Тикунова Н. В. и др. Штамм бактериофага Staphylococcus aureus SA20, обеспечивающий разрушение биопленок, образуемых бактериями рода Staphylococcus // Патент РФ № 2565824. 2015.
Морозова В. В., Козлова Ю. Н., Тикунова Н. В. и др. Штамм бактериофага Citrobacter freundii CF17, способный лизировать патогенные штаммы Citrobacter freundii // Патент РФ № 2565559. 2015.
Тикунова Н. В., Морозова В. В. Фаговый дисплей на основе нитчатых бактериофагов: применение для отбора рекомбинантных антител // Аcta Naturae. 2009. № 3. С. 6—15.
Тикунова Н. В. и Власов В. В. Бактериофаги – враги наших врагов // Наука из первых рук. 2013. № 2(50). С. 58—69.
Покровская М. П. Каганова Л. С., Морозенко М. А. и др. Лечение ран бактериофагом. М.: НАРКОМЗДРАВ СССР, МЕДГИЗ. 1941. 57 с
Górski A. et al. Phages targeting infected tissues: novel approach to phage therapy. // Future Microbiol. 2015. V. 10. P. 199—204.
Międzybrodzki R. et al. Clinical aspects of phage therapy // Adv. Virus. Res. 2012. V. 83. P. 73—121.
В публикации использованы иллюстрации из книги Лечение ран бактериофагом. М.: НАРКОМЗДРАВ СССР, МЕДГИЗ. 1941. 57 с.
Читайте также:


