Кишечная палочка это одноклеточный организм
Специалисты из Научно-исследовательского института Скриппса (TSRI) утверждают, что им удалось создать первый жизнеспособный полусинтетический организм с дополнительными азотистыми основаниями, добавленными к его генетическому коду.
Этот одноклеточный организм также способен постоянно копировать синтетическую пару оснований по мере своего деления. Всё это может означать, что в будущем синтетические организмы, возможно, будут способны бесконечно нести дополнительную генетическую информацию в своих последовательностях ДНК.
В рамках исследования специалисты работали с бактерией кишечной палочки (Escherichia coli), именно в её генетический код они добавили два синтетических основания, а затем химически "подправили" её, чтобы та смогла жить и размножаться с дополнительными включениями в ДНК.
Поясним, что каждый живущий на Земле организм формируется согласно ДНК-коду, состоящему из четырёх азотистых оснований (аденина (А), гуанина (Г), тимина (Т) и цитозина (Ц)). Но модифицированная кишечная палочка несёт совершенно новый тип ДНК – с двумя дополнительными основаниями (X и Y), также встроенными в генетический код бактерии.
Ведущий автор исследования профессор Флойд Ромесберг (Floyd Romesberg) из TSRI спроектировал синтетические нуклеотиды (молекулы, которые служат строительными блоками ДНК и РНК), чтобы создать дополнительную пару оснований. И затем специалисты успешно вставили её в генетический код кишечной палочки.
В результате им удалось получить первый в мире полусинтетический организм с генетическим кодом, состоящим из двух естественных пар оснований и дополнительной "чужой" пары оснований. Ромесберг и его коллеги подозревают, что это только начало создания совершенно новой формы жизни.
По мнению специалистов, такие организмы обладают практически неограниченной способностью нести увеличенный объём информации (за счёт новых "букв"). Такие оптимизированные полусинтетические организмы станут подходящей платформой для получения у микроорганизмов признаков и черт, которые нельзя найти нигде в природе.
В своём исследовании специалисты также пишут, что "полусинтетические организмы предоставляют собой устойчивую форму полусинтетической жизни и закладывают основу для стремлений придать жизни новые формы и функции".
Ещё в 2014 году исследовательская группа из TSRI объявила, что им удалось создать синтетическую пару оснований ДНК, собранную при помощи молекул X и Y. Они также тогда предположили, что такие основания можно будет в будущем включить в живой организм.
С тех пор учёные работали над получением модифицированной бактерии E. coli, чтобы не только внедрить синтетическую пару оснований в её ДНК, но и удерживать её там на протяжении всей жизни.
Изначально спроектированные бактерии были достаточно слабыми и болезненными, в ходе экспериментов они и вовсе умирали. Происходило это по той причине, что микроорганизмам дополнительная пара оснований мешала, когда клетка начинала делиться.
В течение следующих нескольких лет команда учёных разработала три метода проектирования новых "версий" бактерий E. coli, которые могли бы бесконечно удерживать свою новую пару оснований. Эти микроорганизмы могли жить нормальной и здоровой жизнью.
Первым шагом на пути биологов стало создание улучшенной версии инструмента, который называется переносчик (транспортёр) нуклеотидов. Он вставляет в нужное место генетического кода синтетическую пару оснований.
"Транспортёр был использован в исследовании 2014 года, но сделал полусинтетический организм очень слабым", — рассказывает один из членов команды Йоркэ Чжан (Yorke Zhang).
Исследователи изменили транспортёр, чтобы тот стал менее токсичным. После этого у бактерий больше не наблюдалось каких-либо неблагоприятных побочных эффектов применения данной методики.
Во-вторых, учёные сделали так, чтобы их "букву" Y было проще копировать. Они заменили первоначальную молекулу Y на ту, которая лучше распознавалась ферментами в бактерии. Последние синтезируют молекулы ДНК во время процесса репликации.
Также биологи использовали революционный инструмент редактирования генов CRISPR-Cas9, чтобы спроектировать бактерию кишечной палочки, которая не будет считать молекулы X и Y чужеродными "захватчиками".
И вот теперь учёные сообщают, что модифицированная бактерия кишечной палочки является здоровой и способна неограниченное время хранить увеличенный объём информации при помощи новой синтетической пары оснований. "Мы сделали полусинтетический организм более жизнестойким", — заключает Ромесберг.
По его словам, бояться таких бактерий не нужно. Пока искусственная пара оснований полностью бесполезна. Их работа всего лишь служит доказательством работоспособности концепции, что учёные могут получить новые формы жизни, используя "внеземную" пару оснований, и сохранить их в ДНК.
Исследователи намерены продолжать свои работы в надежде создать бактерии, которые смогут когда-нибудь произвести новый тип белков, не встречающихся в природе. Последние могли бы использоваться в медицине или в материалах будущего.
Исследование было опубликовано в научном издании Proceedings of the National Academy of Sciences.
Добавим, что ранее исследователи провели радикальную перепись генома кишечной палочки, а также разработали инструмент, который позволяет запрограммировать бактерию любому желающему (или почти любому).
Кишечная палочка – это бактерия, которая может причинить вред вашему здоровью. Если вы узнаете о способах уничтожения и профилактики кишечной палочки, вы сможете снизить риск заражения и не допустить ее распространения.
Кишечная палочка: симптомы
Кишечная палочка — это палочковидная бактерия, которая обитает в кишечнике человека и имеет множество разновидностей. Большинство из них — это безвредные микроорганизмы, но есть и такие, которые влекут за собой серьезные проблемы со здоровьем. Кишечная палочка возникает из-за несоблюдения гигиены и чистоты, поэтому использование хлоросодержащих моющих средств, таких как Domestos, необходимо.
Кишечная палочка: причины
- Зараженная еда: Зараженные бактерии можно обнаружить в мясе крупного рогатого скота, включая говядину и баранину, так как бактерии кишечной палочки могут находиться в кишечнике животных. Кроме того, может быть заражена и фермерская продукция: зелень, фрукты и овощи.
- Зараженная вода: Подхватить кишечную палочку очень просто, выпив воды из зараженного источника.
Кишечная палочка передается?
Присутствие безвредных разновидностей кишечной палочки является нормой для микрофлоры кишечника человека. Такие бактерии полезны для здоровья, так как препятствуют появлению других болезнетворных бактерий в кишечнике. Однако при нарушении работы пищеварительного тракта безвредная норма кишечной палочки может увеличиться и тогда необходима консультация доктора.
К сожалению, кишечная палочка заразна и тем самым еще более опасна. Кишечная палочка передается от человека к человеку воздушно-капельным и половым путем. Помимо прямого контакта с зараженным человеком, инфекция может передаваться путем употребления некачественной еды или загрязненной воды.
Кишечная палочка: профилактика с помощью личной гигиены
Чтобы остановить распространение кишечной палочки, нужно обязательно мыть руки:
- После обращения с животными
- После любого контакта с зараженным человеком
- Перед и после приготовления еды
- После замены подгузников, грязной одежды или постельного белья
- После использования туалета
- После уборки
Кишечная палочка: профилактика дома
Теперь перейдем к домашней уборке – важной части профилактики кишечной палочки. Следуйте этим простым советам, чтобы защитить свой дом:
- Тщательно убирайте ванную комнату и туалет – пользуйтесь хлорсодержащими чистящими средствами при уборке раковин, сантехники и всех твердых поверхностей. Особое внимание стоит уделить туалету, так как он – один из основных источников распространения кишечной палочки. Использование Domestos поможет убить все вредоносные бактерии в вашем туалете и ванной. Такое чистящее средство сэкономит ваше время, а также позаботится о вашем здоровье. Однако, перед использованием любого нового средства, не забудьте его протестировать и внимательно читайте инструкцию.
- Вытирайте все ручки в доме, чтобы не допустить распространения бактерий.
- Протирайте стиральную машину после стирки грязной одежды и постельного белья.
Когда дело касается дезинфекции вашего дома, хлорсодержащие чистящие средства становятся основным способом поддержания гигиены. Многочисленные исследования не раз показывали эффективность геля Domestos, содержащего хлор, в уничтожении вредных бактерий и в борьбе по предотвращению кишечных инфекций.
Не стоит забывать и про использование туалетных блоков, которые помогут поддержать гигиеническую чистоту и предотвратить распространение бактерий. Туалетные блоки Domestos идеально встраиваются под ободок унитаза, плотно прилегая в самом критичном, с точки зрения грязи и микробов, месте.
Максимальный эффект защиты вашего туалета может быть достигнут благодаря совместному использованию чистящего геля и туалетных блоков Domestos. Результат - чистый и опрятный туалет 24/7*!
*Защита от загрязнений (благоприятной среды для микробов) 24 часа в сутки, 7 дней в неделю при использовании согласно инструкции. По результатам инструментальных тестов Unilever, Италия, 2016
03 февраля 2020
- 954
- 0,0
- 0
- 3
Герой февраля: кишечная палочка Escherichia coli
Скромная бактерия за полстолетия с момента ее открытия в конце XIX в. стала настоящей волшебной палочкой для молекулярной биологии. Сейчас результаты опытов с ее использованием занимают главы и тома профессиональных и популярных изданий. Конечно, в нашем путеводителе по модельным организмам E. coli должна была занять свое почетное место.

Двенадцать модельных организмов
Escherichia и Eschrichtius — Болезнь путешественников — Главная модельная бактерия — Учебник молекулярной генетики — Невезение с CRISPR/Cas
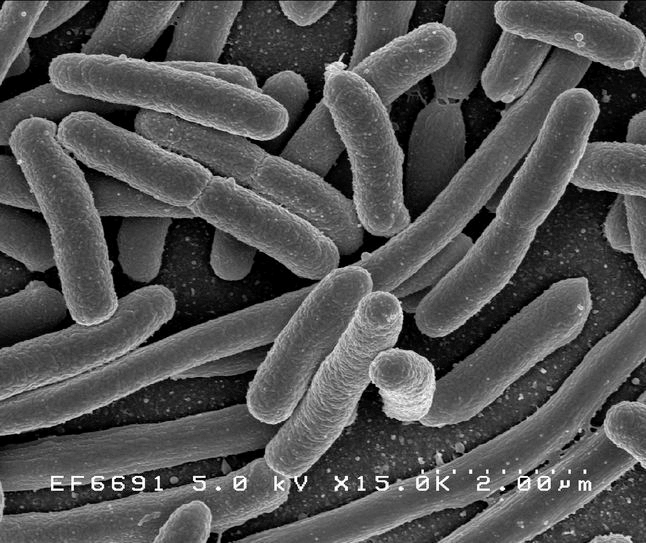
Рисунок 1а. Escherichia длиной 2 мкм

Рисунок 1б. Теодор Эшерих (1857–1911)

Рисунок 1в. Eschrichtius длиной 14 метров

Рисунок 1г. Даниэль Фредрик Эшрихт (1798–1863)
Клетки с относительно тонкой клеточной стенкой, не окрашивающиеся красителем генцианом фиолетовым (окраской бактерий по методу датского микробиолога Кристиана Грама).
Зачем же такую опасную бактерию сделали модельной? Дело в том, что в условиях культивирования кишечная палочка часто теряет патогенность, становится неспособной жить в естественных для себя условиях (то есть одомашнивается). И этим свойством в 1940-е годы воспользовались микробиологи, проведя с лабораторными штаммами E. coli (например, со знаменитым штаммом К12) много прорывных для науки экспериментов.
Так, манипулируя мутированными штаммами кишечной палочки, которые уже научились получать при помощи облучения, Джошуа Ледерберг и Эдуард Лаури Тейтем в 1947 году обнаружили способность разных штаммов обмениваться генетическим материалом и спасать друг друга от образовавшихся дефектов, проявлявшихся в неспособности расти на минимальной питательной среде. Так был открыт процесс конъюгации бактерий, который затем послужил важным инструментом для картирования бактериального генома . Ведь тогда это можно было делать только косвенными, микробиологическими методами — сама природа генетического кода была неизвестна.
Кстати, Джошуа Ледерберг был некоторое время мужем Эстер Ледерберг, первооткрывательницы бактериофага лямбда [3].
С начала 1950-х годов исследования по молекулярной генетике с использованием кишечной палочки и ее вирусов в качестве основного инструмента росли как снежный ком. Не будет преувеличением сказать, что к 70-м годам E. coli написала учебник молекулярной генетики! Вспомним открытие генетического кода, в котором участвовало несколько коллективов физиков и молекулярных биологов, в том числе Френсис Крик, Георгий Гамов и другие выдающиеся люди того времени [6]. Основные эксперименты по расшифровке кода велись на бесклеточных лизатах кишечной палочки.
Позднее обнаружилось, что E. coli хорошо подходит для зародившейся в 1960–1970-е годы биотехнологии [7]. Бактерия хорошо переносит введение в свою клетку гетерологичных (то есть чужеродных) генов и во многих случаях способна синтезировать их продукты без вреда для себя. Белки, полученные таким способом, стали называть рекомбинантными, и теперь они широко используются в медицине и других практических задачах.
Кишечная палочка — возможно, самый исследованный организм с точки зрения молекулярной биологии. Тем не менее у элементов ее генома до сих пор обнаруживают новые свойства. Это одновременно плохо (как же мало мы знаем!) и хорошо (будет чем заняться!). Совсем недавно на защите диссертации я услышал о том, как у одной из генных кассет эшерихии, участвующей в каскаде переработки сульфолипидов, также обнаружена и лактазная активность [8]. До этого такая активность была известна только у знаменитого лактозного оперона Жакоба и Моно, описанного в 1961 году!
Кажется, что E. coli — модельный организм без недостатков. Тем не менее биотехнологам не повезло, что у этой бактерии от природы нет системы бактериального иммунитета CRISPR/Cas [9], о которой я уже упоминал в эссе о бактериофаге лямбда [3]. Именно поэтому эту систему, ныне незаменимую в генной инженерии, открыли относительно поздно.
Кишечная палочка-выручалочка — это здорово (рис. 2). Но теперь пора переместиться в мир ядерных организмов. Удобным инструментом для молекулярной биологии и генетики эукариот оказались одноклеточные грибы — дрожжи — и гаплоидный плесневый гриб — нейроспора. Как они дошли до такой одноклеточной и гаплоидной жизни и что было открыто с их помощью — читайте в следующем материале нашего путеводителя по модельным организмам через месяц.
Благодарность

Любая система, какой бы сложной и многослойной она ни была, имеет свой фундамент — основу, без которой она бы не работала так, как работает. В биосфере нашей планеты также имеются базисные кирпичики, на которых все и держится. Ими являются автотрофы — организмы, способные преобразовывать неорганические соединения в органические. Сегодня мы с вами познакомимся с исследованием, в котором ученые из Израиля создали в лаборатории новый вид бактерий, которые питаются углекислым газом. Какие методы были применены в процессе разработки, как вела себя бактерия, и что данный труд может значить для человечества? Об этом мы узнаем из доклада исследовательской группы. Поехали.
Автотрофы можно назвать одними из самых древних существ на планете. Считается, что первые автотрофы проявились еще два миллиарда лет назад, когда гетеротрофная (не способная синтезировать органику из неорганики) бактерия путем эволюции приобрела способность к фотосинтезу. Сам же термин был предложен в далеком 1892 году немецким ученым Альбертом Бернхардом Франком.

Альберт Бернхард Франк
Некоторые организмы находятся на перекрестке автотрофного и гетеротрофного синтеза, поскольку углерод они получают из органических соединений, а вот энергию из неорганических. Следуя этой логике, автотрофы можно разделить на несколько основных: фототрофы, хемотрофы, радиотрофы, литотрофы и миксотрофы. Существуют также и переходные группы, представителей которых крайне сложно отнести к тому или иному краю спектра синтеза, однако их классификация пока не закончена.
Фототрофы, как намекает нам само название, используют в качестве источника энергии фотоны, точнее солнечную энергии. Именно от этих организмов и происходит такой тип питания как фотосинтез.
Хемотрофам ближе химия, чем физика. Такие организмы используют в качестве источников энергии различные окислительно-восстановительные реакции, т.е. хемосинтез.
Литотрофы перерабатывают неорганические соединения в необходимые им энергию и углерод посредством аэробного или анаэробного дыхания. Хемолитотрофией могут похвастаться только представители архей (одноклеточных без ядра и мембранных органелл) и бактерий.
Миксотрофы являются универсальными солдатами, поскольку могут одновременно (или поочередно, в зависимости от обстоятельств) использовать сразу несколько разных типов питания, т.е. быть одновременно фототрофами и хемотрофами, например.
Авторы рассматриваемого нами сегодня исследования считают, что более детальное понимание процессов жизнедеятельности автотрофов позволит применить полученные знания в крупных масштабах. И по их мнению, самым лучшим способом изучения автотрофии является создание синтетического автотрофного организма. Теоретически, можно создать бактерию, которая будет питаться углекислым газом. Но назвать этот процесс легким язык не поворачивается. Сами исследователи выделяют три основных этапа, которые необходимо пройти, чтобы их труд был реализован.
Во-первых, для полного перехода к автотрофному питанию, организм должен использовать механизм фиксации СО2 на пути, где входящий углерод состоит исключительно из СО2, а выходными являются органические молекулы, которые вступают в центральный углеродный метаболизм и поставляют все 12 основных предшественников биомассы.
Во-вторых, организм должен применять ферментативные механизмы для получения восстановительной мощности путем сбора нехимической энергии (свет, электричество и т.д.) или путем окислительно-восстановительных процессов, которые не являются источниками углерода.
В-третьих, организм должен регулировать и координировать пути сбора энергии и фиксации СО2, чтобы они совместно поддерживали устойчивый рост, когда единственным источником углерода является СО2.
В качестве методологической основы своего исследования ученые использовали цикл Кальвина (цикл Кальвина-Бенсона-Бассама) — серия биохимических реакций при фотосинтезе у растений, цианобактерий и т.д. Этот цикл является самым распространенным механизмом фиксации углекислого газа.
В первую очередь необходимо было провести метаболическую реорганизацию и лабораторную эволюцию организма для реализации перехода к автотрофии. Было рассмотрено несколько соединений-кандидатов, которые могли бы служить донорами электронов для фиксации СО2, что позволило бы бактерии перейти к полной автотрофии.
В качестве источника электронов был выбран формиат*, так как это одноуглеродное органическое соединение может служить источником восстанавливающей части процесса, но не поддерживает рост E. coli естественным образом и не усваивается в биомассу.
Формиаты* — соли и эфиры муравьиной кислоты.
Восстановительный потенциал формиата (E 0 = 420 мВ) достаточно низок, чтобы уменьшить NAD + — основной электронный носитель в клетке (E 0 = 280 мВ в E.coli). Другое преимущество состоит в том, что он может быть электрохимически получен из возобновляемых источников, а биомасса при этом будет углерод-отрицательной.
Чтобы собрать электроны из формиата и направить их в основной клеточный восстановительный энергетический резервуар NADH (никотинамидадениндинуклеотид), была использована NAD + -связанная FDH (формиатдегидрогеназа) из метилотрофной бактерии Pseudomonas sp.
Стехиометрический анализ (анализ по соотношению масс веществ в химическом соединении) метаболической сети в E.coli показал, что добавления FDH, Rubisco (рибулозобисфосфаткарбоксилаза) и Prk (фосфорибулокиназы) в метаболическую сеть E. coli будет достаточно для автотрофного роста (изображение ниже).

Изображение №1: схема лабораторно модифицированной хемотрофной бактерии E. coli.
К сожалению коэкспрессия трех рекомбинантных ферментов в первичном штамме E. coli (BW25113) не привела к росту в автотрофных условиях. Поскольку стехиометрический анализ не учитывает настройку кинетики фермента, уровень экспрессии и регуляции, было решено использовать адаптивную лабораторную эволюцию в качестве инструмента метаболической оптимизации для достижения автотрофного роста.
Данный метод обусловлен тем, что гетерологичная экспрессия чужеродного ферментативного механизма расширяет пространство возможных метаболических реакций для клетки, обеспечивая возможность автотрофного роста. Проблема заключается в том, что нет никаких гарантий, что необходимый поток будет проходить через недавно расширенный набор реакций.
Следовательно, поскольку центральный метаболизм E. coli адаптирован к гетеротрофному росту, вполне вероятно, что распределение потока, которое поддерживает гетеротрофный рост, будет использоваться. Именно потому и была применена лабораторная эволюция, способная перенаправить поток по желаемому метаболическому пути.
Одними из важнейших процессов лабораторной эволюции является перестройка центрального метаболизма для установления зависимости от потока карбоксилирования Rubisco и адаптация среды роста для подавления потока через изначальные гетеротрофные пути (2A). Другими словами необходимо было заставить бактерию перестать использовать гетеротрофные механизмы метаболизма, переходя на автотрофию.

Изображение №2: схема разработанной эволюционной стратегии для преобразования гетеротрофной бактерии E. coli в хемотрофную.
Прежде всего во время искусственной эволюции были исключены три гена, кодирующих два фермента в центральном углеродном обмене: фосфофруктокиназу (Pfk) в гликолизе и глюкозо-6-фосфат-дегидрогеназу (Zwf) в окислительном пентозофосфатном пути. Первый имеет два изофермента, кодируемых двумя генами (pfkA и pfkB). При выращивании клеток на ксилозе* такая перестройка гарантирует, что рост клеток зависит от карбоксилирования по Rubisco, что и необходимо для перехода к хемотрофии.
Хемостат* — метод культивирования микроорганизмов, когда в питательной среде, где они растут, поддерживается оптимальный баланс и концентрация субстратов.
Катаболизм* — метаболический распад сложных веществ на более простые или окисление вещества (энергетический обмен).
Хемостат, где выращивались клетки, также содержал избыток формиата и постоянно продувался обогащенным СО2 воздухом (содержание СО2 10%).
Таким образом, данная среда выращивания замедляет гетеротрофность, заставляя клетки склоняться к автотрофности. Клетки буквально вынуждены уменьшить свою зависимость от внешнего углеродного вклада органического сахара.
Метод выращивания был готов, необходимо было его проверить. Раз в неделю образцы извлекались из хемостатов и проверялись на рост в автотрофных условиях. В частности, это хемоорганоавтотрофные условия для кишечной палочки, которые состоят из среды типа М9 с добавлением 30 мМ (милимоляр) формиата натрия в атмосфере с повышенным содержанием CO2 (10%), но без какого-либо другого источника углерода.
Спустя примерно 200 дней размножения в хемостатах, эквивалентного примерно 150 поколениям, был обнаружен рост в средах, лишенных ксилозы (т.е. в автотрофных условиях). Данный фенотип присутствовал во всех образцах того дня. На 350-ый день ксилоза была полностью исключена из питательной среды (2В). Устойчивый рост и помутнение подразумевали, что в хемостате присутствуют исключительно независимые от ксилозы клетки. Было обнаружено, что образцы нуждались в среде с повышенной концентрацией CO2 для их роста, что предполагает механизм углеродной фиксации.
Далее ученые выбрали один из самых устойчивых в росте клонов* для более глубокого анализа. Было установлено время удвоения* 18 ± 4 часа (2С).
Клон* — в данном случае имеется ввиду группа генетически одинаковых клеток.
Время удвоения* — время, необходимое чему-то увеличиться в размерах в два раза.
Для начала эволюционировавшие клоны были выращены в среде с 13 С-маркированным формиатом и 13 CO2 (10 поколений до получения стабильного изотопного состояния). Далее проводился анализ 13 С-меток для разных метаболитов посредством метода жидкостной хроматографии и тандемной масс-спектрометрии.
13 С* — углерод-13, стабильный изотоп углерода.
Метаболиты* — продукты метаболизма каких-либо соединений.
Метод жидкостной хроматографии и тандемной масс-спектрометрии* — метод химического исследования, объединяющий в себе жидкостную хроматографию, разделяющую смеси нескольких компонентов, и масс-спектрометрию, обеспечивающую структурную идентичность отдельных компонентов.
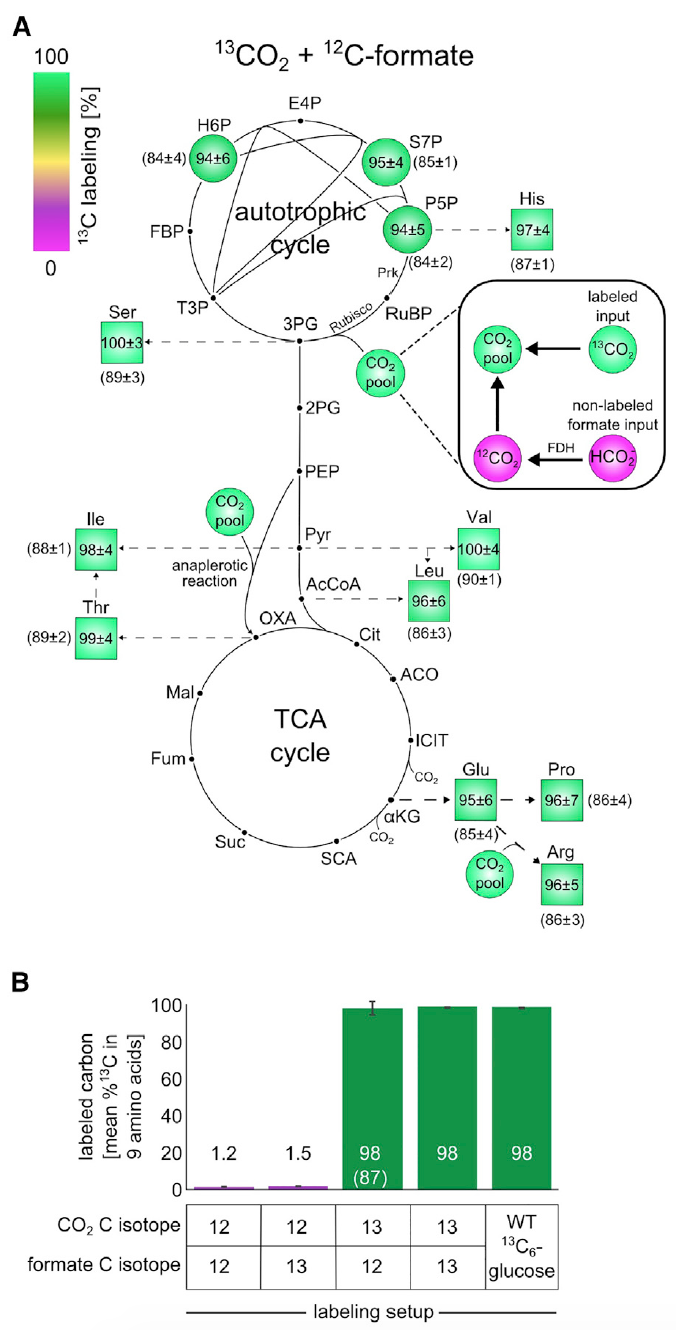
Изображение №3: эксперименты по изотопному маркированию с использованием 13 C показывают, что все компоненты биомассы образуются из CO2 в качестве единственного источника углерода.
Анализ показал, что порядка 98% атомов углерода в строительных блоках биомассы центрального метаболизма были успешно маркированы. Эти данные соответствуют маркированному формиату и CO2, содержащих около 99% 13 C и 1% немаркированного бикарбоната, растворенного в питательной среде.
Данное наблюдение является неопровержимым доказательством того, что углерод в биомассе клеток происходит именно от СО2 и формиата.
Далее проверялось концентрируется ли формиат в биомассе. Для этого клетки выращивали в среде М9 (концентрация СО2 в атмосфере была 10%, как и в предыдущих опытах) с использованием формиата, помеченного углеродом-13.
Схема маркировки 13 С для строительных блоков биомассы после роста в данной среде показали маркировку 13 С в пределах 1-2% (3В), что является ожидаемым значением, основанным на естественном содержании 13 С и незначительном количестве маркированного формиата. Другими словами, результаты показали, что клетки не ассимилируют формиат.
Совокупность результатов вышеописанных опытов уверенно говорит о том, что источником углерода для выращенных культур являются исключительно СО2 и формиат. А это, в свою очередь, говорит о стопроцентной автотрофии клеток E.coli, прошедших лабораторную эволюцию.
Данный опыт показал, что около 85-90% атомов углерода в строительных блоках биомассы центрального метаболизма были успешно маркированы. Как видно на изображения 3А и 3В, если применить корректировку по 13 С-маркированным компонентом, то маркировка атомов в биомассе будет практически 100%, что говорит об автотрофной природе развития бактерии E.coli.
То, что бактерии стали автотрофами, не поддается сомнениям. Осталось выяснить, какие же генетические изменения, то бишь мутации, произошли в процессе лабораторной эволюции.
Для выяснения этого ученые выделили шесть клонов, способных автотрофно расти на формиате, и провели секвенирование их генома и плазмидов*.
Плазмиды* — молекулы ДНК, физически отделенные от хромосом и способные автономно реплицироваться (процесс создания двух дочерних молекул ДНК на основе материнской молекулы ДНК).
Два клона (клон 1 и 2) были выделены, когда ксилоза все еще присутствовала в питательной среде (250-ый день эволюции), три клона (клон 3, 4 и 5) — после того, как ксилоза была исключена из питательной среды хемостата (400-ый день эволюции). Последний клон (клон 6) выделен после размножения одного из ранее выделенных клонов (клон 1) в течение нескольких циклов серийного разведения.
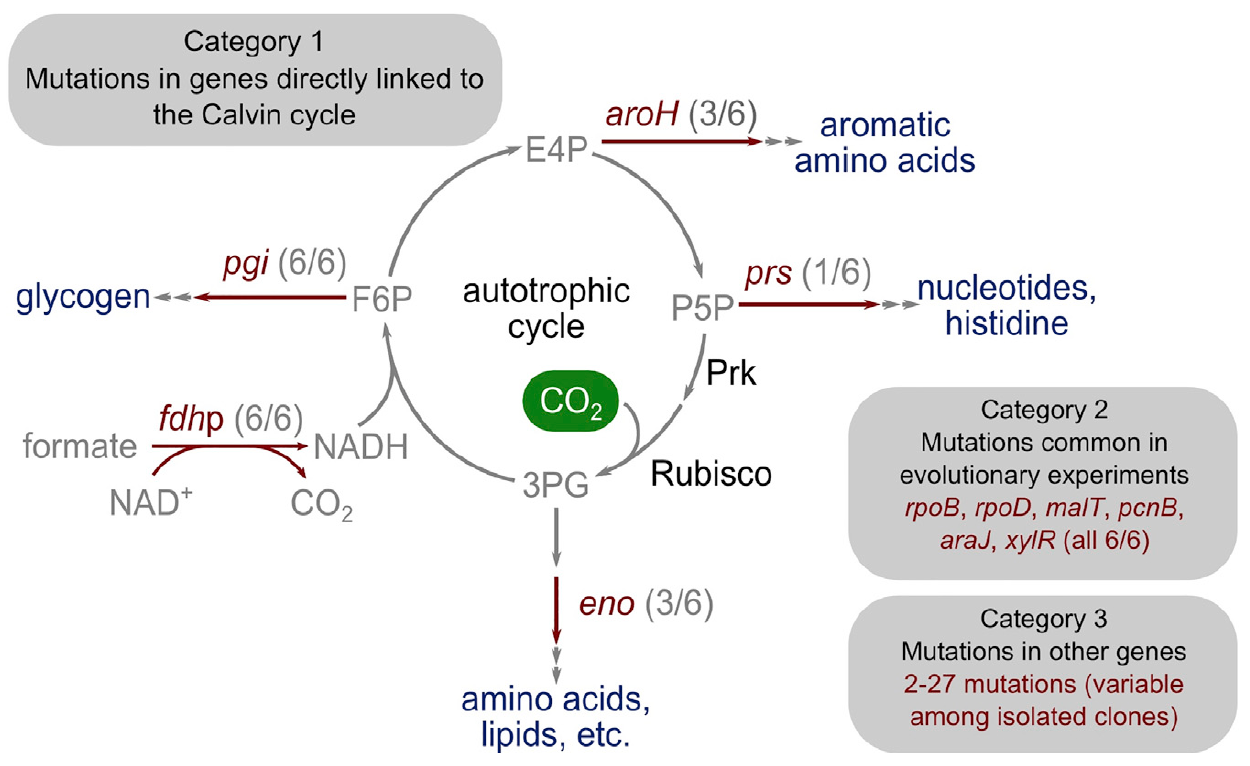
Изображение №4: генетическая основа перехода к автотрофии.
Удивительным было то, что число мутаций было достаточно мало. Исследователи разделили их на три основные категории.
Первая категория состоит из генов, кодирующих ферменты с прямой метаболической связью с функцией цикла Кальвина. Этот ген, который кодирует рибозофосфатедифосфокиназу, направляет рибозофосфат в биомассу.
Вторая категория мутированных генов состоит из тех, которые, мутировали и в предыдущих экспериментах по адаптивной лабораторной эволюции: pcnB (R161P), rpoB (D866E), rpoD (F563S), malT (E359K) и araJ (W156). Данные мутации ученые связывают с самим процессом лабораторной эволюции, то есть они не обязательно связаны с процессом перехода бактерии к автотрофии. Аналогично, была обнаружена мутация в гене xylR, кодирующая регуляторный белок для оперонов, ответственных за катаболизм сахара D-ксилоза (E337K). Она связана с длительным голоданием ксилозы в хемостате во время выращивания, но никак не связана с автотрофией.
В дальнейшем ученые намерены провести дополнительные исследования генетических мутаций, чтобы определить, какие из них являются основными и необходимыми для перехода бактерии к автотрофии.
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых и дополнительные материалы к нему.
Бактерия, которая спасет мир от глобального потепления, это звучит невероятно, даже немного научно-фантастично. Но, даже если такую бактерию и создадут, это не снимает с человека ответственности за экологическую ситуацию на планете. Ибо чисто не там, где убирают, а там, где не мусорят.
Благодарю за внимание, оставайтесь любопытствующими, берегите планету и хорошей всем рабочей недели, ребята. :)
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Equinix Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?
Читайте также:


