Острые производственные отравления происходят при поступлении токсикантов
В самом широком смыслеотравление - это болезнь химической
этиологии(Голиков С.Н. и др., 1986), т.е. заболевание, вызванное поступлением в организм человека химического вещества в столь высокой дозе, которая превышает возможности естественной детоксикации. Одномоментное и массивное поступление вещества вызывает острое отравление, растянутое по времени - хроническое.
Если мы вспомним, что основным свойством химического вещества, определяющим его повреждающее действие, является избирательная токсичность, т.е. способность вызывать нарушение гомеостаза, становится понятным образное выражение одного из основоположников современной клинической токсикологии академика Е.А. Лужникова (2002): «Острое отравление
3.2. Классификация отравлений
В зависимости от причины отравленияделят на случайные и преднамеренные. Случайные отравления возникают независимо от воли пострадавшего, например, при несчастном случае на производстве. Преднамеренные отравления связаны с осознанным применением сверхбольших доз вещества либо самим пострадавшим с целью самоубийства (суицидальные действия), либо другим лицом, с целью убийства или причинение умышленного здоровья потерпевшему (криминальные отравления).
По условиямвозникновения выделяют отравления 1)бытовые,
производственные, 3) криминальные, 4) в результате воздействия химических факторов чрезвычайных ситуаций (мирного времени); 5) в результате применения ОВ; 6) ятрогенные и проч. Таким образом, отравление может быть описано, например, как производственное случайное (при нарушении техники безопасности) или бытовое преднамеренное (при незавершенном суицидальном поступке).
отравления алкоголем и его суррогатами, 4) отравления ядами животных, 5) отравления ядами растений и проч.
Для экстремальнойтоксикологии предметом рассмотрения являются 1) отравления АОХВ, 2) поражения ОВ, 3) отравления ядовитыми техническими жидкостями, 4) отравления продуктами горения при пожарах и др.
Варианты течения клинической картиныотравления позволяют выделить следующие группы: 1) по скорости поступления яда в организм; 2) по тяжести течения отравления; 3) по исходу отравления.
В зависимости от интенсивности поступления яда выделяют:
острые отравления,возникшие в результате одномоментного поступления вещества в токсичной дозе;
хронические отравления,возникающие при длительном поступлении вещества в субтоксической дозе (например, производственные отравления).
По тяжести теченияотравления разделяют на 1) легкие, 2) средне- тяжелые, 3) тяжелые и 4) крайне тяжелые формы.
3.3. Периоды течения острого отравления. Понятие о гоксикогенной и соматогенной фазах
Таким образом, патогенез острого отравления складывается из специфических механизмов, патологических реакций, неспецифических изменений и гипоксического повреждения тканей (рис. 6).
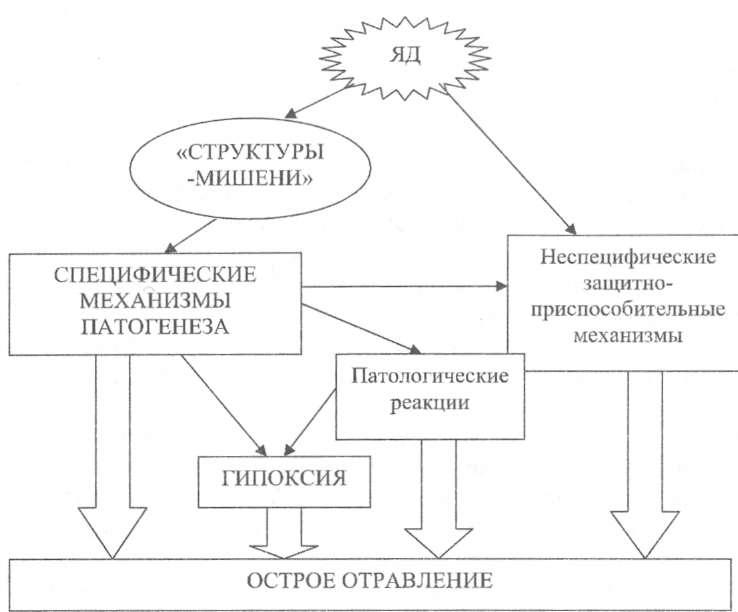
Рисунок 6. Патогенез острого отравления (схема).
Острое отравление - как и любое заболевание, единый процесс, длящийся во времени с момента поступления яда в организм и до исхода заболевания. Условно в течение отравления выделяют следующие периоды:
начальный (инициальный) период - постепенное нарастание явлений интоксикации;
острый период - период, характеризующийся максимальным развитием (манифестацией) симптомов отравления;
2) период исхода - при благоприятном течении отравления период, характеризующийся восстановлением нарущенных функций.

Рисунок 7. Соотношение периодов и фаз в течении острого отравления (схема)
Как следует из характеристики патогенетических механизмов, формирующих токсикогенную и соматогенную фазы отравления (рис. 2), острый период отравления не заканчивается при полной детоксикации. Запустившиеся в токсикогенную фазу нарушения могут еще достаточно долго сохраняться на клинически значимом уровне и угрожать жизни больного.
3.4. Основные синдромы острого отравления. Токсическая гипоксия
Синдромологическая характеристика острого периода отравлений веществами различного механизма действия
Группы веществ по механизму действия
Основные проявления острого отравления
- с раздражающим действием
Раздражение верхних дыхательных путей, глаз; при большой дозе - токсический отек легких
- с прижигающим действием
Химический ожог кожи, верхних дыхательных путей, глаз. Ожоговый шок.
- конвульсанты (судорожные агенты)
Судорожный синдром, кома, острая дыхательная недостаточность
Дозозависимое угнетение сознания (оглушение - сопор - кома), острая дыхательная недостаточность.
- вещества психотропного (психодислептического) действия
Острые психотические состояния (реакции экзогенного типа): делирий, галлюциноз, аменция и др.
Вещества общеядовитого действия
Дозозависимое угнетение сознания (оглушение - сопор - кома), острая дыхательная недостаточность
Вещества пульмонотоксического действия
Токсический отек легких (РДСВ)
Вещества преимущественно цито- токсического действия
Панцитопенический синдром, геморрагический синдром, кахексия, аутоинфекционные осложнения
Вещества кардио- вазотоксического действия
Острая сердечно-сосудистая недостаточность, коллапс
Как видно из перечисления синдромов и состояний при отравлениях различными по механизму действия веществами, уже в токсикогенную фазу возникают типичные (неспецифические) патогенетические процессы, которые приводят к гипоксии: острая дыхательная и сердечно-сосудистая недос-
Различают следующие виды токсических гипоксии(табл. 5):
Циркуляторная гипоксия - критичное нарушение гемодинамики вплоть до коллапса (например, отравление клофеллином, батрахотоксином).
Гемическая гипоксия - нарушение газотранспортной функции крови (например, отравление угарным газом).
Тканевая гипоксия - нарушение процессов окислительного фосфо- рилирования в клетке (например, отравление цианидами).
Характеристика токсических гипоксий
Смешанная - сочетание различных форм гипоксии, которое возникает практически при любом среднетяжелом и тяжелом отравлении.
Механизм развития гипоксии
Тотальный бронхоспазм, бронхорея
Хлор (в большой концентрации); ингаляция кислот, щелочей
Снижение проницаемости аэрогематического барьера
Угнетение стволового дыхательного центра
Фибрилляция, Гиповолюмический шок
Инактивация ферментов дыхательной цепи
Большинство среднетяжелых и тяжелых интоксикаций
При тяжелых отравлениях, как правило, возникают брутальные нарушения жизненно важных функций: сознания, дыхания, кровообращения. В результате формируется так называемое критическое состояние.Критиче
ское состояние — состояние, угрожающее жизни, требующее неотложной токсико-реанимационной помощи.
3.5. Молниеносные формы отравлений: рефлекторное действие
Рефлекторное действие веществ - это формирование защитно- приспособительных или (и) патологических рефлекторных реакций в результате воздействия веществ на рецепторный аппарат рефлексогенных зон соответствующих рефлексов.
Синкопальная форма острейших отравлений по аналогичным механизмам развивается при массивном поступлении в кровь таких веществ, как цианиды и угарный газ.
3.6. Общие принципы лечения острых отравлений. Антидоты
Мероприятия неотложной помощипри острых отравлениях строятся на общих принципах:
Восстановление и поддержание нарушенных жизненно важных функций (дыхания, кровообращения).
Купирование ведущих синдромов интоксикации.
Характеризуя мероприятия, направленные на прекращение поступления токсиканта в организм при ЧС, безусловно, следует иметь в виду использование технических средств защиты (противогазов, защитных костюмов) и проведение специальной (санитарной) обработки. Скорейшая эвакуация пораженных из очага - также преследует цель прекращения дальнейшего воздействия токсиканта.
Кроме этого следует помнить, что токсичное вещество может достаточно длительно находиться в желудочно-кишечном тракте. Поэтому к мероприятиям, направленным на прекращение дальнейшего поступления токсичного вещества в кровь, следует отнести и методы удаления не всосавшегося токсиканта из желудочно-кишечного тракта. К числу таких лечебных мероприятий относятся зондовое промывание желудка с введением сорбента, высокая сифонная клизма, кишечный лаваж.
В токсикологии, как и в других областях клинической медицины, для оказания помощи при острых отравлениях используют этиотропные, патогенетические и симптоматические средства. В токсикологии, термину этио- тропное средство терапии, тождествен термин антидот,т.е. противоядие (Куценко С.А., 2004). Антидотные препараты, введенные в срок и в нужной дозе, порой практически полностью устраняют проявления интоксикации. Патогенетические и симптоматические средства устраняют лишь отдельные синдромы, облегчают течение интоксикации. Специфичность лечебных средств, т.е. их эффективность в плане устранения самой причины острого заболевания (отравления), убывает в ряду: этиотропное - патогенетическое - симптоматическое средство.
Антидот (от antidotum- "даваемое против") - (1) применяемое при лечении острого отравления лекарственное средство, способное (2.1) обезвреживать токсичное вещество, (2.2) предупреждать или (2.3) устранять вызываемый им токсический эффект.
Условно можно выделить следующие механизмы действия антидотов(по С.А. Куценко, 2004): 1) химический, 2) биохимический, 3) физиологический, 4) модификация процессов метаболизма токсичного вещества (ксенобиотика).
Биохимический механизм антидотного действияможно условно разделить на следующие виды: I) вытеснение токсиканта из его связи с биомолекулами-мишенями, что приводит к восстановлению поврежденных биохимических процессов (например, реактиваторы холинэстеразы, используемы при острых отравлениях фосфорорганическими соединениями); 2) поставка ложной мишени (субстрата) для токсиканта (например, использование мет- гемоглобинобразовагелей для создания больших количествFeпри остром отравлении цианидами); 3) компенсация нарушенного токсикантом количества и качества биосубстрата.
Следует помнить, что любой антидот - это химическое веществ, обладающее кроме антидотного и другими эффектами. Поэтому использование антидота должно быть обоснованным и адекватным как по времени назначения с момента отравления, так и по дозе. Использование антидотов при отсутствии в организме специфического токсиканта может привести, по сути, к отравлению антидотом. С другой стороны, наибольшую эффективность антидоты проявляют в ближайшее время с момента острого отравления (поражения). Для максимально быстрого введения антидотов в условиях массовых поражений созданы антидоты первой помощи(само и взаимопомощи). Такие антидоты обладают не только высокой эффективностью, но прекрасной переносимостью, в том числе они не вызывают тяжелой интоксикации при ошибочном их использовании (при отсутствии поражения). Для использования на этапах медицинской эвакуации разработаны врачебные антидоты - более мощные препараты, требующие специальных профессиональных знаний для их применения. Так, например, антидотом первой помощи при поражении фосфорорганическими соединениями является афин, а врачебным антидотом — атропин.
СИНДРОМОЛОГИЯ И ОТДАЛЕННЫЕ ПОСЛЕДСТВИЯ ОСТРОГО ГРУППОВОГО ПЕРОРАЛЬНОГО ОТРАВЛЕНИЯ ГИДРОКСИЛАМИНСУЛЬФАТОМ
Институт экогигиены и токсикологии им. Л.И. Медведя, г. Киев
В последние годы острые пероральные отравления различными химическими соединениями регистрируются значительно чаще [1—3]. Этому способствует прогрессирующее загрязнение окружающей среды, а, следовательно, продуктов питания и питьевой воды, различными ксенобиотиками [2, 4, 5]. Нередко причиной отравления является употребление фальсифицированных продуктов питания, напитков и пищевых добавок. Чаще всего пероральные отравления связаны со случайным (ошибочным) или преднамеренным приемом химических веществ или высоких доз медикаментов [1]. Продолжают регистрироваться острые отравления этиловым спиртом или его суррогатами, групповые пероральные отравления солями тяжелых металлов, особенно талием, мышьяком, медью [1—3].
До настоящего времени распространены отравления веществами, образующими метгемоглобин (MtHb) как при ингаляционном и перкутанном воздействии на производстве [5—8], так и при пероральном, вследствие попадания нитратов и других соединений в продукты питания, питьевую воду [2, 4], при случайном или преднамеренном употреблении MtHb-образователей внутрь [9—13]. Известно, что под влиянием MtHb-образователей двухвалентное железо гема обратимо переходит в трехвалентное. Формирующийся при этом MtHb теряет способность присоединять и трансформировать молекулярный кислород, что вызывает развитие гипоксемии и гемической гипоксии [5, 6, 12]. Эти процессы усугубляются замедлением диссоциации оксигемоглобина в присутствии MtHb [6]. Под влиянием MtHb-образователей, в состав которых входят соединения серы, происходит окисление a -метильной группы порфирина с последующим включением атома серы в пиррольные кольца с образованием патологического деривата гемоглобина — сульфгемоглобина [5, 6]. Последний также не способен присоединять молекулярный кислород. Если MtHb после прекращения действия токсиканта под влиянием внутриэритроцитарных редуцирующих систем и рациональной терапии обычно исчезает из крови в зависимости от степени интоксикации через несколько часов или дней, то сульфгемоглобин сохраняется в эритроцитах до конца их жизненного цикла. В процессе деметгемоглобинизации в эритроцитах на 2—5 день после воздействия большинства MtHb-образователей нередко выявляются белковые гранулы — тельца Гейнца-Эрлиха [5, 6]. Авторы считают, что образованию их обязательно предшествует превращение гемоглобина в MtHb при воздействии экзогенных или эндогенных факторов. При воздействии MtHb-образователей в эксперименте на животных отмечаются общетоксические эффекты с поражением нервной, сердечно-сосудистой систем, печени. Описаны также поражения кожи, почек и мочевых путей [5, 6, 14]. Установлено, что MtHb образуют не столько сами MtHb-образователи, сколько их метаболиты, преимущественно фенил-гидроксиламин и нитробензол [5, 6, 11, 12]. Если симптомы отравлений MtHb-образователями в эксперименте изучены хорошо, то клиническая синдромология представлена недостаточно, особенно в динамике развития интоксикации.
В работе изучены особенности клинических проявлений острого массового перорального отравления MtHb-образователем-гидроксиламинсульфатом (ГС). Сернокислый гидроксиламин относится одновременно к сильным окислителям и восстановителям, представляет собой белые кристаллы, хорошо растворимые в воде, широко используется при производстве капролактама, в фармацевтической промышленности и в ряде органических синтезов [14, 15]. При интенсивном контакте с ГС на производстве, особенно при его расфасовке, у некоторых рабочих к концу смены отмечалось образование MtHb до 10—20% [5].
Известно, что токсикодинамические эффекты ксенобиотиков зависят от стадии (фазы) интоксикации [1, 14]. В токсикогенной фазе, протекающей в присутствии токсической концентрации яда в крови, его эффекты зависят от вида и функциональной роли определенных рецепторов, с которыми взаимодействует токсикант. В свою очередь, для соматогенной фазы, наступающей после выведения яда из организма, характерно появление синдромов, связанных с развившимся поражением определенных органов или систем. В связи с этим представляло интерес изучить особенности клинических проявлений и гематологические сдвиги у больных с острым пероральным отравлением ГС в различные фазы интоксикации в процессе лечения и в отдаленные сроки. Предпринята попытка выявить информативные клинико-лабораторные показатели для оценки степени выраженности интоксикации и прогнозирования отдаленных эффектов.
Материалы и методы исследования
Обследовано 76 больных с острым пероральным отравлением ГС. Отравление возникло после употребления лимонада, приготовленного в домашних условиях с использованием лимонной кислоты, купленной на рынке в пакетиках без этикеток. Группу пострадавших составили 14 детей в возрасте от 3 до 12 лет и 62 взрослых — от 18 до 48 лет. Из одной семьи доставлено 42 человека после приема "лимонада" за праздничным столом, остальные больные — по 2—3 человека из разных семей. При экспертизе остатков белого кристаллического порошка, использованного как лимонная кислота, в лаборатории физико-химического анализа института был идентифицирован ГС. В процессе расследования уголовного дела установлено, что в этот период с шинного завода, расположенного в данном районе, похищено более тонны ГС.
Наряду с общеклиническим обследованием у всех больных определяли содержание MtHb и сульфгемоглобина спектрофотометрическим методом [5, 6], а также оценивали интенсивность образования телец Гейнца-Эрлиха в эритроцитах. Общеклиническое биохимическое обследование с определением билирубина, церулоплазмина, аспартатаминотрансферазы (АСТ), аланинаминотрасферазы (АЛТ), щелочной фосфатазы (ЩФ), уробилина, мочевины, креатинина для оценки состояния эндотоксикоза дополнено определением среднемолекулярных пептидов (СМП) [16] и циркулирующих иммунных комплексов (ЦИК) [17]. Проводили также электрокардиографическое обследование в общепринятых отведениях и ультразвуковое исследование органов брюшной полости. Для уточнения и подтверждения диагноза острого отравления ГС использовали следующие предикты:
- установление факта употребления "лимонада", приготовленного в домашних условиях;
- хронологию возникновения специфических клинических признаков (цианоза, тошноты, рвоты и др.);
- отсутствие другой возможной этиологии;
- результаты лабораторно-инструментальных исследований;
- регресс клинической симптоматики в процессе медикаментозной деметгемоглобинезации.
Исследования проводили в первые сутки после отравления, а также в процессе лечения через 1 и 3 недели. Отдаленные эффекты прослежены при ежегодном наблюдении в течение 3 лет. Всем больным была проведена комплексная детоксикационная терапия с промыванием желудка, кишечника, назначением инфузий 1% раствора метиленовой сини (5,0—10,0 мл внутривенно однократно при MtHb свыше 30%), инфузий и пероральных назначений витамина С, глюкозы, реополиглюкина, а также углеродной энтеросорбции (карболонг по 1 ст.л. 3 раза в день в течение 7—10 дней), ацетилцистеина, ноотропов и антиоксидантов в обычной дозировке. Статистическую обработку результатов проводили с использованием критериев Стьюдента для связанных совокупностей.
Результаты и их обсуждение
Из анамнеза установлено, что все больные употребляли напиток от 100,0 до 600,0 мл. Некоторые пострадавшие отмечали после его употребления отрыжку с легким запахом тухлых яиц. У всех больных через 1—1,5 ч появилась головная боль, головокружение, общая слабость (табл. 1). У большинства пострадавших (90,8%) появились тошнота, рвота, синюшность лица, особенно губ, носа, концевых фаланг пальцев, у 48 — тахикардия, у 28 — одышка. Выраженность клинических проявлений зависела от количества выпитого напитка, частота их отражена в табл. 1.
У больных, выпивших не более 100 мл напитка, наблюдались отдельные симптомы интоксикации (головная боль, головокружение, тошнота), тогда как после употребления напитка свыше 100,0 мл отмечалось сочетание нескольких симптомов в большей степени выраженности. Головная боль, головокружение, гипергидроз, общая слабость, снижение аппетита выявлялись у всех пострадавших. Почти во всех случаях наблюдался акроцианоз разной степени выраженности, лишь у 7 человек, выпивших не более 100 мл напитка, кожа и видимые слизистые оболочки были обычной окраски. Выявлялись тахикардия с частотой пульса до 92—112 в 1 мин (63,2%), боли в правом подреберье (50,0%), одышка (36,8%). Реже наблюдались боли в области сердца, парестезии и боли в пальцах конечностей, иктеричность кожи, увеличение размеров печени на 1—2 см. Увеличение селезенки было отмечено лишь в двух случаях. По степени выраженности клинических проявлений больные были разделены на 2 группы — с легкой степенью (68 больных) и тяжелой — 8 больных. У больных с тяжелой степенью интоксикации отмечались выраженный цианоз до сине-черной окраски губ, носа, ушных раковин, ногтевых лож, языка, слизистой оболочки рта, многократная рвота, одышка, тахикардия, общемозговые явления: заторможенность, сонливость, вялая реакция зрачков, повышение сухожильных рефлексов. Если у больных с легкой степенью интоксикации симптомы заболевания исчезли или значительно уменьшились через 3—7 дней, то у больных с тяжелой степенью они держались до 14—18 дней и более. В двух случаях заболевание осложнилось нижнедолевой пневмонией. У одного из этих больных наряду с пневмонией развился крупный инфаркт селезенки (до 5 см в диаметре), мелкоочаговый инфаркт миокарда и токсический гепатит. Учитывая тяжесть состояния, больной был переведен в реанимационное отделение областной больницы. После трех месяцев консервативной терапии состояние его улучшилось, но трудоспособность не восстановилась, в связи с чем больного направили на МСЭК, где определена II группа инвалидности. Формирование инфарктов в селезенке, почках при воздействии больших доз MtHb-образователей отмечали в эксперименте на животных вследствие повышения вязкости крови и другие авторы [5].
Анализ ЭКГ у обследованных больных выявил нарушения процессов реполяризации в виде высоких остроконечных симметричных зубцов Т (субэндокардиальная гипоксия) у 23 обследованных (30,3%), сглаженность или слабую негативизацию зубца Т с появлением зубца U — у 5 (6,2%) и выраженную инверсию зубца Т с косовосходящей депрессией сегмента ST у одного больного, свидетельствующей о глубоких дистрофических изменениях миокарда с формированием некоронарогенного некроза субэндокардиальной локализации. У 48 пострадавших (63%) имела место синусовая тахикардия, у 6 (7,8%) — регистрировалась частая желудочковая экстрасистолия.
Изучение показателей крови (табл. 2) позволило выявить метгемоглобинемию от 4 до 47% у большинства пострадавших (90,8%). В среднем уровень mthb при поступлении составил 16,2±0,84%, его содержание нормализовалось в течение 2—7 дней. Наряду с метгемоглобинемией выявлялись признаки гемолитической анемии со снижением уровня гемоглобина до 90—100 г/л у большинства пострадавших с легкой степенью интоксикации и до 48 г/л — с тяжелой. Параллельно отмечалось снижение количества эритроцитов (в отдельных случаях до 2,010 12 /л, в среднем до 2,810 12 /л), а у ряда больных — снижение цветового показателя, однако, средний его уровень изменился несущественно. Явления анемии у лиц с легкой степенью отравления регрессировали через 1 нед, а при выраженных формах интоксикации умеренная анемия с признаками гипохромии сохранялась и через 3 недели.
Наряду с метгемоглобинемией у 32 больных (42%) при поступлении обнаружили в эритроцитах тельца Гейнца-Эрлиха — от 0,2 до 500 (в одном случае 50% эритроцитов содержали по несколько крупных гранул). Содержание телец Гейнца-Эрлиха было выше у лиц с более высоким уровнем MtHb. Следует отметить, что интенсивность образования их была больше через 1 нед после отравления и сохранялась в течение 2—3 недель. Параллельно в 47,3% случаев в крови выявлялся сульфгемоглобин. Если у здоровых лиц его содержание почти не определялось, то у 36 из 76 пострадавших его уровень при поступлении колебался от 1 до 12% (в среднем — 6,4±0,44%), почти на таком же уровне и через 1 нед, приближаясь к норме через 3—4 недели.
Анализ биохимических показателей позволил выявить у большинства больных (92,1%) в первые дни после отравления гипербилирубинемию, достигающую 70 мкмоль/л за счет непрямой фракции (табл.3), и повышение уровня уробилина в среднем до 14,8±1,2 ед. Повышенное содержание билирубина и уробилина у большинства больных держалось в течение 7—14 дней. В случаях с выраженной метгемоглобинемией одновременно на фоне болей в правом подреберье, гепатомегалии отмечалось умеренное повышение уровня трансаминаз, ЩФ, креатинина, однако, в среднем эти показатели, а также содержание мочевины, существенно не отличались от нормы. У 40 из 76 больных (52,6%) регистрировали умеренное снижение содержания церулоплазмина в крови, что свидетельствует о некотором угнетении антиоксидантной защиты [1, 14], однако средний его уровень практически не изменялся. Известно, что наибольшей токсичностью обладают не столько низкомолекулярные вещества типа мочевины, креатинина, сколько среднемолекулярные пептиды (СМП) с молекулярной массой 500—5000 Д [1, 16]. У больных повышение их уровня отмечено как на волне 254 нм, так и 280 нм. Восстановление этого показателя в большинстве случаев отмечалось через 2—3 нед, однако у больных с тяжелой степенью интоксикации он был повышен и через 3 недели.
СМП обладают нейротоксичностью, угнетают процессы биосинтеза белка, клеточного дыхания, подавляют активность многих ферментных систем, оказывают токсическое воздействие на эритропоэз [16]. Нельзя исключить, что в выраженности и стойкости клинических проявлений у больных с высоким уровнем MtHb наряду с воздействием ГС определенная роль принадлежит и СМП.
В развитии патологического процесса и отдаленных токсических эффектов при воздействии ксенобиотиков важное значение отводится аутоиммунным реакциям, особенно формированию патогенных циркулирующих иммунных комплексов (ЦИК) [1, 17]. Если формирование ЦИК крупных размеров отражает адаптационные механизмы процессов детоксикации, направленные на выведение чужеродных веществ, то повышение уровня ЦИК мелких размеров свидетельствует преимущественно об активации аутоиммунных реакций, участвующих в прогрессировании патологического процесса. В ранние сроки интоксикации у больных отмечается достоверное повышение уровня ЦИК мелких размеров. При высоком уровне MtHb и сульфгемоглобина через 3 нед, несмотря на определенный регресс клинических проявлений, отмечался дальнейший рост уровня ЦИК мелких размеров.
Сопоставление клинико-лабораторных показателей у пострадавших позволило выделить основные клинические синдромы отравления ГС. Из табл. 4 видно, что превалировали астено-вегетативный синдром и гемолитическая анемия, реже отмечались умеренно-выраженная острая кардиомиопатия и гепатопатия. В 6 случаях при тяжелой степени интоксикации на фоне вышеуказанных синдромов выявлялась вегетативно-сенсорная полиневропатия верхних и нижних конечностей, в двух — нижнедолевая пневмония, у одного — инфаркт селезенки и мелкоочаговый инфаркт миокарда.
Развитие этих синдромов, вероятно, обусловлено гемической гипоксией вследствие образования MtHb и снижения кислородной емкости крови, компенсаторной активацией симпато-адреналовой системы, внутрисосудистым гемолизом эритроцитов, повышением вязкости крови, нарушением микроциркуляции, а также формированием процессов метаболического эндотоксикоза и патогенных ЦИК.
Динамическое наблюдение в течение 3 лет выявило регресс большинства клинических синдромов. Лишь у 12 больных (15,8%) периодически наблюдались рецидивы умеренно-выраженной гипохромной анемии, в 3 случаях сохранялись явления хронического гепатита, в 2 — вегетативно-сенсорной полиневропатии. В острый период у этих больных отмечались наиболее высокие показатели MtHb, эндотоксикоза и мелких ЦИК
Таким образом, пероральное употребление напитка, содержащего ГС, вызвало острое отравление с метгемоглобинемией, сульфгемоглобинемией, гемолитической анемией, острой кардиомиопатией и гепатопатией, в отдельных случаях отмечалось поражение периферической нервной системы. Динамическое наблюдение свидетельствует об обратимости процесса у большинства больных. В хронизации умеренно-выраженной анемии, хронического гепатита и вегетативно-сенсорной полиневропатии нельзя исключить роль СМП и патогенных ЦИК. Сопоставление их уровней с выраженностью клинических проявлений в острый и отдаленный периоды свидетельствует о целесообразности определения данных тестов как для оценки степени выраженности интоксикации, так и для прогнозирования вероятности хронизации основных клинических синдромов.
Gerald F. O’Malley
, DO, Grand Strand Regional Medical Center;
, MD, Albert Einstein Medical Center
Last full review/revision January 2018 by Gerald F. O’Malley, DO; Rika O’Malley, MD
Фосфорорганические и карбаматные соединения, несмотря на различную химическую структуру, угнетают активность холинэстеразы и относятся к группе веществ антихолинэстарзного действия. Некоторые из них используются в медицине с целью реверсии нервно-мышечной блокады (например, неостигмин, пиридостигмин, эдрофониум) или для лечения глаукомы (экотиопат), миастении гравис (пиридостигмин) и болезни Альцгеймера (например, такрин, донепезил).
Карбаматы: Альдикарб и метомил;
ФОС: Хлорпирифос, диазинон, дурсбан, фентион, малатион и паратион
ФОС и карбаматы являются наиболее частыми причинами отравлений и вызванных этими отравлениями смертельных исходов во всем мире (в России эти острые отравления, в том числе со смертельным исходом занимают одно из последних мест в структуре причин насильственной смерти).
Патофизиология
ФОС и карбаматы абсорбируются через ЖКТ, легкие и кожу. Они ингибируют холинэстеразу плазмы и эритроцитов, предотвращая распад ацетихолина, котрый в связи с этим накапливается в синапсах. Карбаматы исчезают из организма самостоятельно примерно через 48 ч после поступления. В то же время, фософорорганические вещества могут необратимо связывать холинэстеразу.
Клинические проявления
Фосфорорганические соединения и карбаматы вызывают аналогичные первоначальные результаты благодаря острому развитию мускарино- и никотино-подобного синдромов интоксикации ( Общие токсические синдромы (токсидромы)). Характерными симптомами являются мышечные фибрилляции и слабость. Респираторные признаки включают хрипы, затрудненное дыхание и гипоксию, которые могут иметь тяжелое течение. У большинтва пациентов отмечается брадикардия, а при тяжелом отравлении гипотензия. Характерным является токсическое поражение ЦНС, иногда сопровождаемое судорогами, раздражимостью, а также частым развитием сопора и комы. Возможно развитие панкреатита, кроме того, ФОС могут вызывать сердечные аритмии, в том числе внутрисердечную блокаду с увеличением интервала QT, увеличение систолического показателя.
Слабость, особенно проксимальных, краниальных и дыхательных мышц может развиться через 1– 3 дня после поступления ФОС и в редких случаях при воздействии карбаматов, несмотря на проводимое лечение (промежуточный синдром); эти симптомы проходят через 2–3 недели. Немногие ФОС (например, хлорпирифос, триортокрезил фосфат) могут вызвать аксональную нейропатию через 1 – 3 нед. после попадания вещества в организм. Механизм этого поражения может не зависеть от холинэстеразы эритроцитов и тяжести отравления. Отдаленные и длительные последствия отравления ФОС могут включать когнитивные расстройства или паркинсонизм.
Диагностика
Мускариновый токсикоз с известными дыхательными нарушениями, точечными зрачками, мышечными фасцикуляциями и слабостью
Иногда измерение уровня холнэстеразы в эритроцитах
Диагноз обычно основывается на характерном синдроме интоксикации мускарином у пациентов с нервно-мышечными и дыхательными нарушениями, особенно у пациентов из группы риска. Если результаты обследования сомнительны (присущи нескольким заболеваниям), обратное развитие или ослабление, мускариновых симптомов после введения 1 мг атропина (0,01–0,02 мг/кг детям) подтверждает диагноз. По возможности следует идентифицировать токсикант. Многие фосфорорганические соединения имеют характерный запах чеснока или нефтепродуктов.
Активность холинэстарзы в эритроцитах, которую могут определять некоторые лаборатории, позволяет оценить тяжесть отравления. При возможности быстрого измерения, полученные значения могут быть использованы для мониторинга эффективности лечения; однако реакции пациента является основным маркером эффективности.
Лечение
Атропин при респираторных проявлениях
Пралидоксим при нервно-мышечных нарушениях (в РФ не зарегистрирован)
Основой является симптоматическое лечение. Необходимо обеспечить тщательное мониторное наблюдение за дыханием пациента из-за слабости дыхательной мускулатуры.
Атропин вводится в количестве, достаточном для снятия бронхоспазма и бронхореи, что предпочтительнее, чем нормализация ширины зрачков или частоты сердечных сокращений. Начальная доза составляет от 2 до 5 мг внутривенно (детям 0,05 мг/кг); эту дозу можно повторять каждые 3–5 минут, по необходимости. При тяжелых отравлениях могут понадобиться граммы атропина.
Деконтаминация (санитарная обработка) должна проводиться как можно быстрее после стабилизации состояния. Персонал, оказывающий помощь, должен принять меры от самозаражения во время оказания помощи. При местном воздействии одежду необходимо снять и тщательно обмыть поверхность тела. Если от попадания внутрь прошло около 1 ч, можно дать активированный уголь. Опорожнение желудка обычно не проводится. Если же оно проводится, то только после интубации трахеи для предотвращения аспирации.
Пралидоксим, 2-ПАМ, (в РФ не зарегистрирован) вводится после атропина для устранения нервно-мышечных симптомов. 2-ПAM (от 1 до 2 г взрослым, 20–40 мг/кг детям) вводится в течение 15–30 минут внутривенно при воздействии фосфорорганических соединений и карбаматов, хотя к моменту лечения часто неизвестно, какой из этих ядов попал в организм. Инфузию можно проводить болюсно (8 мг/кг в час взрослым и 10–20 мг/кг в час детям).
Бензодиазепины используются при судорогах. Профилактическое ведение диазепама может помочь предотвратить нейрокогнитивные последствия в случае отравления ФОС средней и тяжелой степени.
Люди, подвергавшиеся воздействию этих токсикантов, перед госпитализацией могут ввести себе малые дозы атропина, используя коммерчески доступные автоинъекторы (2 мг для взрослых и детей с весом > 41 кг, 1 мг для детей весом от 19 до 41 кг, 0,5 мг для детей с весом 19 кг). Автоинъекцию 10 мг диазепама можно рекомендовать людям, подвергнутым химической атаке.
Ключевые моменты
Фосфорорганические соединения использовались при производстве инсектицидов, в медицинских процедурах и при производстве биологического оружия.
Подозревайте интоксикацию, если у пациентов диагностируется мускариновый холинергической токсикоз с заметными дыхательными и нервно-мышечными нарушениями.
Подтвердите диагноз исследованием реакции на атропин и иногда уровней эритроцитарной холинэстеразы.
Лечение поддерживающие, назначение атропина для облегчения бронхоспазма и выделения бронхиальной слизи и приемом 2-ПAM (в РФ не зарегистрирован) с целью облегчения нервно-мышечных симптомов.
Читайте также:


