Изменения показателей крови при эндогенной интоксикации
Изобретение относится к медицине, в частности к хирургии, и может быть использовано для выявления эндогенной интоксикации и ассоциированных с нею дыхательных расстройств у пациентов, страдающих колоректальным раком.
Синдром эндогенной интоксикации (СЭИ) является типовым системным динамически развивающимся патологическим процессом, склонным к прогрессированию. СЭИ может возникать вследствие сочетания нескольких факторов: усиленного образования продуктов тканевого распада с последующей их резорбцией, в результате смещения баланса обмена веществ в сторону катаболизма и накопления в организме большого количества вторичных метаболитов; при подавлении функциональной активности систем естественной детоксикации; из-за затрудненного выведения и задержки тканевых экскретов, нарушения процессов элиминации из организма конечных продуктов метаболизма; как следствие, накопления токсинов и продуктов жизнедеятельности инфекционных агентов [4,5]. Достоверно установлено, что развитие у пациентов СЭИ приводит к развитию нарушений системы гемостаза, гемодинамическим нарушениям, сопровождающимся снижением уровня доставки кислорода к тканям, развитию нарушений энергетического обмена в клетке и, как следствие, развитию тканевой гипоксии, метаболического ацидоза, что не может не сказаться на прогнозе лечения данной категории пациентов [1, 2, 7].
Поэтому важным является выявление СЭИ и дыхательных расстройств у пациента, оценка их тяжести и своевременная адекватная терапия. В настоящее время для этого используются интегральные индексы, в основе которых лежат гематологические показатели [8].
Так, широко применяется лейкоцитарный индекс интоксикации (ЛИИ), который определяют по формуле Я.Я. Кальф-Калифа [3,8]. Данный индекс показывает количественное выражение сдвига лейкоцитарной формулы в сторону нейтрофилов, в то время как на практике данный сдвиг оценивается врачами приблизительно и лишь констатируется как таковой, зачастую без количественной характеристики. Такая оценка нейтрофильного сдвига весьма субъективна, что снижает ценность этого метода [6]. Кроме того, ЛИИ не учитывает общее количество лейкоцитов, обезличивает уровень гемоглобина и количество эритроцитов, которые характеризуют реакцию организма на наличие токсинов в крови, что указывает на тяжесть ЭИ. В то же время повышение количества лейкоцитов и СОЭ не всегда совпадает с повышением ЛИИ [8].
В связи с этим в настоящее время получает большее значение модифицированный лейкоцитарный индекс интоксикации (ЛИИм) [6]. Данный индекс более приемлем и достоверен, так как использует соотношение уровня всех клеток крови, повышающегося и снижающегося при воспалительных заболеваниях без каких-либо дополнительных коэффициентов, что объективно отражает суть происходящих процессов [8]. Этот способ использован нами в качестве прототипа.
Однако данный способ оценки СЭИ не учитывает параметры транспорта и утилизации кислорода, которые зависят от кислородной емкости крови, изменения показателей которой, в свою очередь, наблюдаются при наличии симптомов ЭИ, как и отрицательную их связь с показателями кислородного гомеостаза.
Задачей изобретения является разработка способа, обеспечивающего высокоточное, чувствительное выявление ЭИ с учетом гематологических показателей, в т.ч кислородной емкости крови, позволяющего оценить развитие, тяжесть, течение воспаления, эндогенной интоксикации и развивающихся на этом фоне дыхательных расстройств, оценить эффективность проводимой терапии и определить стратегию дальнейшей коррекции лечения для достижения лечебного эффекта.
Поставленная задача достигается за счет расчета интегрального показателя интоксикации (ИПИ), включающего в расчет наряду с данными, необходимыми для расчета модифицированного лейкоцитарного индекса интоксикации, число эритроцитов и цветового показателя. Ввиду того, что полученные результаты чаще всего имеют значения меньше единицы, для облегчения интерпретации данного показателя внесен коррегирующий коэффициент, равный 10. При этом при значении ИПИ 4,6 отсутствуют симптомы эндогенной интоксикации, а при ИПИ 10,4 - есть симптомы эндогенной интоксикации
ИПИ определяется по разработанной формуле:
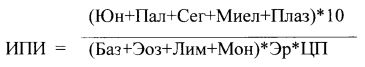
где Юн - юные лейкоциты (%),
Пал - палочкоядерные нейтрофилы (%),
Сег - сегментоядерные нейтрофилы (%),
Плаз - плазматические клетки (%),
Эр - эритроциты (в 10 12 ),
ЦП - цветовой показатель.
Выполнена клиническая апробация предложенного способа.
Исследование проведено у 73 пациентов, оперированных в Амурском областном центре колопроктологии ГБУЗ АО АОКБ в 2010 - 2013 гг. по поводу колоректального рака преимущественно дистальной локализации (Т3-Т4 стадии). Исследование клинического анализа крови проводили на аппарате Drew D3 (Великобритания) с подсчетом клеточной формулы путем световой микроскопии. Расчет модифицированного лейкоцитарного индекса интоксикации (ЛИИм) проводили с помощью разработанной программы на базе пакета MS Office Excel 2007. Всем больным при поступлении в стационар проводили оценку газового состава артериальной и венозной крови. Артериальную кровь забирали из бедренной артерии, смешанную венозную - из подключичной вены после ее катетеризации. Анализ газового состава крови проводили на газоанализаторе AVL - 995 НВ (Австрия). Определялись такие показатели, как парциальное давление кислорода в артериальной и венозной крови (paO2, pvO2), парциальное давление углекислого газа в артериальной и венозной крови (paCO2, pvCO2), сатурация гемоглобина кислородом (SaO2, SvO2), альвеолоартериального градиента кислорода (DA-aO2). Расчет параметров кислородного статуса проводился согласно формул с применением созданного нами приложения (MS Excel 2007): для оценки параметров функции внешнего дыхания и диффузии газов через альвеолокапиллярную мембрану рассчитывали индекс оксигенации (ИО), вентилляционно-перфузионное отношение (V/Q), уровень артериовенозного шунта (QsQt), содержание кислорода в артериальной и венозной крови (CaO2, CvO2). На этапе доставки (DO2) и потребления кислорода (VO2) рассчитывали артериовенозную разницу по кислороду (АВР), коэффициент утилизации кислорода (КУO2). Показатель сердечного выброса (СВ) рассчитывали по формуле Старр (1954 г. ) в модификации Заболотских И.Б., Станченко И.А., Скопец А.А. (2002 г. ).
В зависимости от уровня ЛИИм все пациенты были разделены на 2 группы: I - у которых зарегистрировано повышение данного индекса, II - ЛИИм находился в пределах нормы.
Статистическая обработка полученных данных проводилась с применением программ Microsoft Office Excel 2007 и SPSS Statistics 17.0. Вычисляли среднее значение, стандартное отклонение (СО - для групп параметров с нормальным распределением), 95% доверительный интервал (ДИ - при распределении параметров, отличающихся от нормального), для сравнения групп применяли методы непараметрической статистики (расчет критерия Манна-Уитни - для независимых выборок, критерия Фридмена - для определения достоверности различий в зависимых группах), корреляционный анализ проводили с вычислением критерия Спирмена, регрессионный - построение модели линейной регрессии с вычислением коэффициента автокорелляции Дурбина-Уотсона. Значимыми принимались значения при р
Целью работы явилось установление выраженности синдрома эндогенной интоксикации у больных острым пельвиоперитонитом при различных вариантах хирургической тактики и определение его связи с оксидативным стрессом.
Материалы и методы исследования
В основу работы положены материалы клинико-лабораторных исследований 40 женщин, больных тазовым перитонитом различной этиологии (эндометрит, сальпингит, оофорит, аднексит, вульвовагинит, цервицит и др.), которым произведена экстренная операция. Хирургическое лечение заключалось в удалении гнойного содержимого из таза, во вскрытии гнойников, промывании (санации) полостей, дренировании малого таза. Объем оперативного вмешательства зависел от степени распространения воспалительного процесса, наличия пиосальпинкса или тубоовариального абсцесса и сопутствующей патологии шейки и тела матки, яичников. При одностороннем гнойном воспалительном образовании маточных труб и яичников их удаляли. Операция производилась в экстренном порядке, а также при отсутствии эффекта от интенсивной антибактериальной и дезинтоксикационной терапии через 18–24 ч после ее начала.
Первую группу (n=20) составили пациенты в возрасте от 17 до 45 лет (средний возраст 27,1±4,4 лет). Вторая группа (n=20) включала пациентов в возрасте от 16 до 43 лет (средний возраст 28,7±5,3 лет). В первой группе больных хирургическое вмешательство осуществлялось лапаротомным оперативным доступом, во второй – малотравматичным лапароскопическим. Рандомизированный подбор больных в группы осуществлялся по возрасту, полу, характеру повреждений, общепринятым лабораторным показателям, выраженности эндогенной интоксикации при поступлении больных в клинику.
В раннем послеоперационном периоде проводили базисную комплексную терапию, которая включала в себя дезинтоксикационный, антибактериальный, обезболивающий компоненты; антигистаминные препараты.
Методы исследования
Больным выполняли общеклинические и биохимические исследования (общий анализ крови и мочи, содержание билирубина, общего белка, сахара, мочевины, креатинина, активность трансаминаз в крови и др.). Кроме этих показателей, в работе использованы следующие методы исследования.
Показатели интенсивности перекисного окисления липидов (ПОЛ) в эритроцитах: содержание малонового диальдегида (МДА) оценивали в реакции с 2-тиобарбитуровой кислотой. Активность супероксиддисмутазы (СОД) определяли по способности фермента тормозить аэробное восстановление нитросинего тетразолия до формазана (Гуревич В.С. и др., 1990; Досон Р. и др., 1991). Регистрацию каталитической деятельности фосфолипазы А2 проводили титрометрическим методом по мере образования свободных жирных кислот (Трофимов В.А., 1999). Диеновые и триеновые конъюгаты (ДК и ТК) в липидах определяли спектрофотометрическим методом при длине волны 232 и 275 нм.
Обследование больных обеих групп проводилось при поступлении и в динамике послеоперационного периода (1-е, 3-и, 5-е, 7-е и 10-е сутки после операции). Научные разработки проводились при информированном согласии больного в соответствии с международными нравственными требованиями ВОЗ (правила GCP – Good Clinical Practice), предъявляемыми к медицинским исследованиям с участием человека (Женева, 1993). Для получения данных, которые приняты за физиологическую норму, произведены соответствующие исследования у 12 здоровых добровольцев женского пола.
Полученные цифровые экспериментальные данные обработаны методом вариационной статистики с использованием t-критерия Стьюдента и χ2.
Результаты исследования и их обсуждение
Проведенная сравнительная клинико-лабораторная характеристика больных при поступлении в клинику не выявила значительных различий по возрасту, полу, сопутствующей патологии, показателям общего анализа крови. Больным проведена экстренная операция, при которой диагностирована гнойно-деструктивная форма различных воспалительных заболеваний внутренних половых органов, главным образом сальпингоофорита, сопровождающихся гнойным тазовым перитонитом.
Важнейшим интегральным показателем расстройств гомеостаза является эндоинтоксикация. Нами дана качественная и количественная оценка уровня гидрофильных и гидрофобных токсических продуктов в плазме крови, что позволило провести ее комплексный анализ. Оказалось, что при остром тазовом перитоните до операции эффективная концентрация альбумина уменьшалась на 31,1% (p

Стрептококковая инфекция развивается в ротовой полости, в желудочно-кишечном тракте и в глотке. Бактерии, относящиеся к данному виду, распространены также в области половых органов женщин и дыхательных путях.
Стрептококк вызывает ряд заболеваний, проникая в различные ткани, системы и органы (мочевыводящие пути, мозг, сердце и кровь).
Проявляется стрептококковая инфекция в виде различной симптоматики. Человек может быть носителем инфекции, что в последнее время является очень распространенным. В данном случае носитель не ощущает на себе патогенного воздействия стрептококков, так как его иммунитет способен справляться с данными бактериями.
Стрептококковая инфекция представляет собой группу заболеваний: скарлатина, рожа, генерализованные и местные гнойные и воспалительные процессы (абсцесс, фурункул, флегмона, раневая инфекция, остеомиелит, эндокардит и стрептококковый сепсис). Стрептококки являются причиной возникновения ревматизма и воспалительного процесса в области почек. Болезнетворным воздействием стрептококка является способность произведения ядов (токсинов). Патогенный микроорганизм негативно воздействует на ткани сердца и кровяные клетки, вызывая расширение мелких сосудов.
Клиническая классификация стрептококковых инфекций: первичные – респираторные инфекции (фарингиты, ангина, ОРЗ, отиты), кожные инфекции (эктима, импетиго, стрептодермии), скарлатина, рожа. Вторичные – негнойные, обладающие аутоиммунным механизмом (ревматизм, васкулиты, гломерулонефрит), токсико-септические, не имеющие аутоиммунного компонента (перитонзиллярный и метатонзилярный абсцесс, некротическое поражение тканей, септические осложнения). Редкие – миозит, некротический фасцит, энтерит, синдром токсического шока, первичный перитонит, очаговое поражение внутренних органов, сепсис.
В практике инфекциониста из стрептококковых инфекций наиболее часто встречаются стрептококковые ангины и рожа. Значимость изучения этих заболеваний определяется их нередко тяжелым течением, осложнениями и неблагоприятными последствиями. Острое течение и обострение хронического течения этих заболеваний могут осложниться развитием нагноений, развитием сепсиса и инфекционно-токсического шока [9]. Хроническое рецидивирующее течение рожи может привести к развитию слоновости и инвалидизации пациентов. Перенесенная ангина способствует возникновению так называемых тонзиллярных заболеваний (ревматизм, гломерулонефрит, пиелонефрит, миокардит и др.) [3, 10-12].
Стрептококковые инфекции сопровождаются развитием синдрома интоксикации, степень которой нередко определяет исходы заболеваний и тактику терапии, выбираемую врачом.
Одним из основных показателей тяжести патологического процесса при инфекционной патологии и в частности у больных со стрептококковыми инфекциями, является синдром интоксикации. При его правильной и своевременной оценке в более ранние сроки назначается адекватная терапия и соответственно повышается эффект от проводимого лечения, в более короткие сроки купируются патологические симптомы, уменьшается время пребывания больного в стационаре.
Синдром эндогенной интоксикации играет значительную роль в патогенезе ряда заболеваний ка инфекционной, так и неинфекционной природы и часто определяя их течение и прогноз. Эндогенная интоксикация представляет собой сложный процесс, обусловленный биологической активностью большой и разнообразной группы веществ, в норме вовремя удаляемых из организма (мочевина, креатинин, промежуточные продукты метаболизма, накапливающиеся в повышенной концентрации, продукты свободнорадикального окисления и т.д.). В последние годы эндогенную интоксикацию стали сопоставлять с низко- и среднемолекулярными белками и именно их считают маркерами эндогенной интоксикации [1, 4-7].
Цель исследования. Изучить в патогенезе стрептококковых инфекций роль накопления в биологических жидкостях организма веществ низкой и средней молекулярной массы и стадии интоксикации в зависимости от периода и тяжести течения заболеваний.
Материалы и методы. Было обследовано 38 больных рожей и 25 стрептококковыми ангинами в возрасте от 27 до 62 лет, находившихся на лечении в инфекционном стационаре. У 21 больного ангинами выявлены стрептококки группы А (гемолитический стрептококк и др.), у 4 – одновременно высеяны стрептококк и золотистый стафилококк. У всех больных рожей было диагностировано первичное заболевание, эритематозная и эритематозно-буллезная форма. Все больные ангинами поступили в остром периоде болезни. С учетом местных изменений у 5 больных диагностирована катаральная ангина, у 11 – фолликулярная, у 9 – лакунарная. У всех пациентов заболевания протекали в среднетяжелой и тяжелой форме.
Уровень веществ низкой и средней молекулярной массы определяли по методу М. Я. Малаховой (1996) с использованием подсчета по О. Л. Гребневой с соавт. (2003) [2, 3]. Для характеристики закономерных фаз развития эндогенной интоксикации, заключающихся в количественном нарастании и распределении ВН и СММ между плазмой и эритроцитами и выведении их с мочой у части больныхопределяли коэффициенты интоксикации К1, К2 и К3 [6]. Больные были обследованы в периоде разгара, угасания клинических симптомов и ранней реконвалесценции.
В ходе проведенных исследований было обнаружено максимальное повышение ВН и СММ во всех биологических средах организма в периоде разгара заболевания у всех обследованных больных. Однако у больных с рожей в среднем изменения были выражены больше (при роже в плазме крови значения ВН и СММ в среднем превышали показатели у здоровых в 1,9, в эритроцитах в 1,5, а в моче – в 1,9 раз, тогда как при ангине: в плазме крови в 1,5; в эритроцитах в 1,3, а в моче – в 1,6 раз) (таблица). У незначительного количества больных исследуемые показатели оказались близки к норме.
Содержание ВН и СММ в плазме крови, эритроцитах и моче у больных рожей и стрептококковой ангиной (усл. ед.)
В.С. Рагимов
Кафедра внутренних болезней I и реаниматологии (зав. - проф. А.А. Ахунбейли), АМУ, г. Баку.
Резюме
Среди всех травм черепно-мозговая травма (ЧМТ) является основной причиной смертности. Важность данной проблемы объясняется также тем, что ежегодно регистрируется 2% прирост случаев ЧМТ, а последствия перенесенной ЧМТ, несмотря на доминирование легкой травмы (81-90%), наблюдаются в 70% случаев. В конечном итоге при отдаленных последствиях ЧМТ, в зависимости от механизма, вида и тяжести травмы, регистрируются различные по степени и распространенности структурно-функциональные изменения мозга на молекулярном, субклеточном, клеточном, тканевом и органном уровнях, а также расстройства центральной регуляции всех систем организма. Авторами статьи представлен материал оригинального исследования, оценивающего влияние методики плазмафереза на параметры иммунитета при тяжелой ЧМТ. Исследование проведено у 20 больных с ушибами головного мозга средней и тяжелой степени, в возрасте от 16 до 70 лет. В статье приводятся данные об улучшении некоторых показателей иммунитета, уменьшении количества циркулирующих иммунных комплексов, снижении степени выраженности аутоиммунной агрессии на фоне проведения плазмафереза.
Проблема патогенеза и патогенетической терапии повреждений головного мозга не нова, но все еще далека от своего окончательного решения (15, 19). Патогенез черепно-мозговой травмы (ЧМТ) многообразен и в значительной мере обусловлен эндогенной интоксикацией (ЭИ), возникающей вследствие резорбции продуктов тканевого распада как из контузионных очагов головного мозга (4), так и нарушения обменных процессов в организме в целом. Это ведет к накоплению в организме различных прмежуточных и конечных продуктов метаболизма, в том числе и пептидов средней молекулярной массы или средних молекул (СМ), являющихся вторичными эндогенными токсинами (14, 15, 18). Установлено, что тяжесть повреждения мозговой ткани и течение патологического процесса при ЧМТ коррелируют с количественным содержанием СМ в крови и ликворе (3, 13, 14). Эти вещества и обусловленные ими нарушения гомеостаза усугубляют течение ЧМТ и затрудняют процессы выздоровления (1, 15, 20). Одним из принципиально новых подходов к проблеме лечения больных с ЧМТ являются применение методов детоксикации, а именно мембранный плазмаферез (МПФ) (4, 6).
Важнейшим свойством МПФ является способность не только удалять из организма накапливающиеся в нефизиологических концентрациях промежуточные и конечные продукты обмена веществ, обладающие токсическим влиянием на функцию различных органов и систем, но и влиять на иммунный статус (16). Иммунодепрессия, развивающаяся вследствие травмы, может быть обусловлена как нарастающей ЭИ, так и снижением активности фагоцитов. Это связано с тем, что фагоциты участвуют в элиминации циркулирующих иммунных комплексов (ЦИК) (10), интенсивное поглощение которых может привести к блокаде защитных механизмов иммунитета. Связывание ЦИК приводит к фагоцитозу и внутриклеточной активации, а также секреции гидролитических ферментов, которые оказывают сильное разрушающее действие на ткани (7). Следовательно, возможность направленного воздействия на иммунореактивность организма МПФ осуществляется как за счет удаления комплемента, комплексов антиген-антитело (2, 11), так и путем снижения выраженности ЭИ (5, 6, 12, 17).
Цель исследования.
Изучение действия плазмафереза (ПФ) в отношении иммунной системы у больных с ЧМТ.
Материал и методы.
Исследование проведено у 20 больных с ушибами головного мозга средней и тяжелой степени, в возрасте от 16 до 70 лет. В неврологическом статусе определялась выраженная общемозговая симптоматика в виде нарушения сознания до сопора или комы, у 3 больных степень нарушения сознания оценивалась как глубокое оглушение. У всех больных на фоне общемозговой симптоматики имелась менингеальная и отчетливая очаговая симптоматика в виде парезов, параличей, речевых расстройств.
Показанием к ПФ являлось тяжелое состояние больных с признаками нарастающей ЭИ. Степень ЭИ определяли по клинической картине и дополнительными лабораторными методами исследования: определяли лейкоцитоз, уровень СМ (норма 240+20 усл. ед.), лейкоцитарный индекс интоксикации (ЛИИ) (норма 1,2+0,18). Признаки ЭИ появлялись на 3-5-ые сутки, чаще на фоне присоединившихся бронхолегочных осложнений. В эти сроки в крови больных отмечено нарастание уровня СМ до 580+30,1 усл.ед. и ЛИИ до 4,0+0,3. Также выявлены изменения при исследовании некоторых показателей иммунитета, проявляющиеся снижением относительного числа Т-лимфоцитов до 38,6+1,1 и снижением фагоцитарной активности нейтрофилов (ФАН) до 60,8+1,0. Уровень ЦИК поднимался до 96,4+1,8 усл.ед. ПФ проводили на 5-8-ые сутки, так как в эти сроки отмечены наибольшие изменения показателей ЭИ. Изучение неврологического статуса в динамике и проведение лабораторного контроля показателей иммунитета и ЭИ осуществляли до и после ПФ. Содержание Т-лимфоцитов определяли при помощи теста спонтанного розеткообразования по их чувствительности к теофиллину. После инкубации с теофиллином Т-хелперы образуют розетки с эритроцитами барана, а Т-супрессоры эту способность теряют. ФАН определяли по их поглотительной способности латексных частиц, ЦИК - путем осаждения 3,5% раствором полиэтиленгликоля (ПЭТ-6000) с последующим спектрофотометриванием на спектрофотометре СФ-26. Полученные цифры были статистически обработаны, достоверность результатов была определена с помощью критерия Стьюдента и непараметрического показателя Уайта (W). ПФ был осуществлен с помощью насоса "GAMBRA" швейцарского производства плазмофильтром типа MPF-800. Объем эксфузированной плазмы в основной группе составил 1000-1200 мл на каждый сеанс. Скорость эксфузии в зависимости от состояния гемодинамики регулировался в пределах 50-60 мл/мин. Курс лечения составил 3-4 сеанса с 2-3-х дневными перерывами. С целью предупреждения свертывания в экстракорпоральном контуре внутривенно был введен гепарин в дозе 200-250 ЕД/кг, взятая кровь в количестве 35-40 капель в минуту смешивалась с глюгициром.
Результаты и их обсуждение.
Как показали результаты исследования, у 16 больных в постфильтрационном периоде отмечено клиническое улучшение, что проявлялось стабилизацией уровня сознания и степени тяжести состояния больных. У 4 больных в 1-е сутки после ПФ наблюдалось увеличение степени сознания, а у 5 больных выявлен частичный регресс двигательных нарушений. ПФ способствовал достоверному регрессу менингеальных симптомов у 8 больных уже в 1-ые сутки постфильтрационного периода. Улучшалась дренажная функция бронхов, лучше отходила мокрота, приобретающая слизистый характер, что способствовало более быстрому регрессу пневмонии.
В целях изучения влияния ПФ у больных с ЧМТ проведен анализ динамики некоторых показателей иммунитета и ЭИ. При исследовании детоксицирующего эффекта ПФ выявлено, что в 1-ый день после ПФ наблюдалось достоверное снижение уровня СМ в 2 раза (рис. 1), ЛИИ уменьшался на 16% (рис. 2). К 7-м суткам постфильтрационного периода отмечено незначительное увеличение показателя СМ - на 13%, а ЛИИ снизился на 6,6%, но достоверно превышает нормальные значения (на 37%). Отмечено дальнейшее достоверное Полученные результаты исследования клеточного иммунитета убеждают в том, что ПФ способствует повышению числа Т-лимфоцитов (рис. 3). В 1-ый день после ПФ отмечено достоверное повышение относительного числа Т-лимфоцитов, что было обусловлено достоверным повышением уровня Т-хелперов при незначительном снижении содержания Т-супрессоров. К 7-м и 14-м суткам постфильтрационного периода наблюдались достоверное увеличение относительного числа лимфоцитов. Абсолютное число Т-лимфоцитов также увеличивалось, но несущественно, уровень ФАН в 1-е сутки после ПФ увеличился достоверно. В последующем также недостоверным было его снижение. При этом показатель ФАН не выходит за пределы нормы.
Влияние ПФ на уровень СМ у больных с ЧМТ.
На экспериментальной модели изучалась динамика эндогенной интоксикации для прогноза течения обструктивной уропатии. Для достижения поставленной цели
были сформированы одна контрольная и три опытных группы животных, у которых производился забор крови из краевой ушной вены на 3, 7, 14 и 21‑е сутки эксперимента. В сыворотке крови определяли следующие показатели: мочевину, креатинин, общий белок, альбумин. Уровень эндогенной интоксикации оценивали по показателям молекул средней массы, циркулирующих иммунных комплексов
и малонового диальдегида. Статистический анализ биохимических показателей крови и маркеров эндогенной интоксикации подтверждает возможность использо-
вания данных показателей как маркеров тяжести патологического процесса и морфофункциональных изменений в ткани обструктивного и компенсаторного органов. Полученные данные указывают на перенапряжение адаптационных механизмов, развитие окислительного стресса и демонстрируют высокий уровень эндогенной
интоксикации, приводящей к структурно-метаболическим изменениям как в пораженной, так и в контрлатеральной почке.
Акименко М. А., Тодоров С. С., Колмакова Т. С. Динамика морфологических адаптационно-компенсаторных изменений в ткани почки при обструкции мочеточников в эксперименте // Нефрология. 2017а. Т. 21, № 5. С. 71–75. doi: 24884/1561‑6274‑2017‑21‑5‑100‑108
Акименко М. А., Тодоров С. С., Колмакова Т. С. Динамика морфологических адаптационно-компенсаторных изменений в ткани контрлатеральной почки при обструкции мочеточников в эксперименте // Нефрология. 2017б. Т. 21, № 5. С. 80–84. doi: 10.24884/1561‑6274‑2017‑21‑5‑119‑124
Алексеев А. В., Гильманов А. Ж., Гатиятуллина Р. С., Ракипов И. Г. Современные биомаркеры острого повреждения почек // Практическая медицина. 2014. № 3. С. 22–27.
Антонов А. Г., Годин М. К. Возможности использования маркеров воспаления при мочекаменной болезни, осложненной пиелонефритом // Дальневосточный медицинский журнал. 2017. № 2. С. 93–98.
Габриэлян Н. И., Дмитриев А. А., Кулаков Г. П., Мекикян A. M., Щербанева О. И. Диагностическая ценность определения средних молекул в плазме крови при нефрологических заболеваниях // Клиническая медицина. 1981. № 9. С. 38–42.
Габриэлян Н. И., Липатова В. И. Опыт использования показателя средних молекул в крови для диагностики нефрологических заболеваний у детей // Лабораторное дело. 1984. № 3. С. 138–140.
Икромов Т. Ш., Ибодов Х. И., Ибодов Н. С. Изучение эндогенной интоксикации и ее коррекция у детей с мочекаменной болезнью // Детская хирургия. 2014. № 6. С. 32–34.
Карякина Е. В., Белова С. В. Молекулы средней массы как интегральный показатель метаболических нарушений (обзор литературы) // Клиническая лабораторная диагностика. 2004. № 3. С. 3–8.
Карякина Е. В., Белова С. В. Особенности патогенетических механизмов эндогенной интоксикации у больных ревматоидным артритом // Научно-практическая ревматология. 2001. № 1. С. 5–10.
Обухова Л. М., Ведунова М. В., Конторщикова К. Н., Добротина Н. А. Морфофизиологический анализ плазмы крови при эндогенной интоксикации // Вестник Нижегородского университета им. Н. И. Лобачевского. 2007. № 6. С. 104–107.
Оксенюк О. С., Калмыкова Ю. А., Смирнова О. Б., Пасечник Д. Г. Роль окислительного стресса в развитии хронической болезни почек и способы его оценки // Журнал фундаментальной медицины и биологии. 2016. № 1. С. 15–24.
Сигитова О. Н. Хроническая болезнь почек и хроническая почечная недостаточность: современные подходы к терминологии, классификации и диагностике // Вестник современной клинической медицины. 2008. № 1. С. 83–87.
Стальная И. Д., Гаришвили Т. Г. Метод определения малонового диальдегида с помощью тиобарбитуровой кислоты // Современные методы в биохимии. 1977. С. 66–68.
Топчий К. И., Кириенко А. Н., Щенявская Е. Н., Лесовая А. В., Несен А. А., Гридасова Л. Н. Процессы переписного окисления липидов у больных хронической болезнью почек в динамике лечения ингибиторами АПФ и блокаторами АРА // Научные ведомости. Сер. Медицина. Фармация. 2012. № 10. С. 24–28.
Урология. Национальное руководство / Под ред. Н. А. Лопаткина. М.: ГЭОТАР-Медиа, 2009. С. 370.
Шмойлов Д. К., Каримов И. З., Одинец Т. Н. Патогенетическая роль эндогенной интоксикации // Лабораторная диагностика. 2012. № 2. С. 65–69.
Юрьева Э. А., Сухоруков В. С., Воздвиженская Е. С., Новикова Н. Н., Длин В. В. Эндогенная интоксикация в патогенезе нефропатий // Клиническая лабораторная диагностика. 2015. № 60. С. 22–25.
Alberti C. Congenital ureteropelvic junction obstruction:
physiopathology, decoupling of tout court pelvic dilatation-obstruction semantic connection, biomarkers to predict renal damage evolution // Eur. Rev. Med. Pharmacol. Sci. 2012. No. 16(2). Р. 213–219.
Bone R. S. Sepsis, sepsis syndrome, and the systemic inflammatory response syndrome (SIRS) Gulliver in Laputa // JAMA. 1995. No. 73. Р. 155–156. doi: 10.1001/jama.1995.03520260077036
Chmielewski M., Cohen G., Wiecek A., JesúsCarrero J. The peptidic middle molecules: is molecular weight doing the trick? // SeminNephrol. 2014. No. 34. Р. 118–34. doi: 10.1016/j.semnephrol.2014.02.005
Giamarellos-Bourboulis E. J., Adamis.T, Laoutaris G., Sabracos L., Koussoulas V., Mouktaroudi M., Perrea D., Karayannacos P. E., Giamarellou H. Immunomodulatory clarithromycin treatment of experimental sepsis and acute pyelonephritis caused by multidrug-resistant Pseudomonas aeruginosa // Antimicrob. Agents Chemother. 2004. No. 48. Р. 93–99. doi: 10.1128/AAC. 48.1.93-99.2004
Kondratyuk M. O., Sorokopud O. O., Strіl’chuk L. M., Zhakun І. B., Slaba O. R., Besh O. M., Radchenko O. M., Leshchuk Y. L. Chronic heart failure course prognosis depending on body weight and endogenous intoxication syndrome // Wiad Lek. 2019. No. 72(4). Р. 527–531.
Nlandu Y., Padden M., Seidowsky A., Hamaz S., Vilaine É., Cheddani L., Essig M., Massy Z. A. Middlemolecule uremic toxins: A renewed interest // Nephrol. Ther. 2019. No. 15(2). Р. 82–90. doi: 10.1016/j.nephro.2018.09.003
Pianta T. J., Succar L., Davidson T., Buckley N. A., Endre Z. H. Monitoring treatment of acute kidney injury with damage biomarkers // Toxicol. Lett. 2017. No. 268. Р. 63–70. doi: 10.1016/j.toxlet.2017.01.001
References in English
Akimenko M. A., Todorov S. S., Kolmakova T. S. Dinamika morfologicheskikh adaptatsionno-kompensatornykh izmenenii v tkani pochki pri obstruktsii mochetochnikov v eksperimente [Dynamics of morphological adaptation-compensatory changes
in the tissues of the kidney during ureter obstruction in the experiment]. Nefrologiya [Nephrology]. 2017. No. 5. Р. 71–75.
Akimenko M. A., Todorov S. S., Kolmakova T. S. Dinamika morfologicheskikh adaptatsionno-kompensatornykh izmenenii v tkani kontrlateral’noi pochki pri obstruktsii mochetochnikov v eksperimente [Dynamics of morphological adaptation-compensatory changes in the contralateral kidney tissue during ureteral obstruction in the experiment]. Nefrologiya[Nephrology]. 2017. No. 5. Р. 80–84.
Alekseev A. V., Gilmanov A. J., Gatiyatullina R. S., Rakipov I. G. Sovremennye biomarkery ostrogo povrezhdeniya pochek [Modern biomarkers of acute kidney injury]. Prakticheskaya meditsina [Practical Medicine]. 2014. No. 3. Р. 22–27.
Antonov A. G., Godin M. K. Vozmozhnosti ispol’zovaniya markerov vospaleniya pri mochekamennoi bolezni, oslozhnennoi pielonefritom [Renal tissue damage markers in urolithiasis complicated by pyelonephritis]. Dal’nevostochnyi meditsinskii zhurn. [Far East Medical J.]. 2017. No. 2. Р. 93–98.
Gabrielyan N. I., Dmitriev A. A., Kulakov G. P., Mekikyan A. M., Shcherbaneva O. I. Diagnosticheskaya tsennost’ opredeleniya srednikh molekul v plazme krovi pri nefrologicheskikh zabolevaniyakh [Diagnostic value of middle molecules determination in blood plasma in renal diseases]. Klinicheskaya meditsina [Clinical Medicine]. 1981. No. 9. Р. 38–42.
Gabrielyan N. I., Lipatova V. I. Opyt ispol’zovaniya pokazatelya srednikh molekul v krovi dlya diagnostiki nefrologicheskikh zabolevanii u detei [Experience of using the index of middle molecules in the blood for the diagnosis of nephrological diseases in children]. Lab. delo [Lab. Science]. 1984. No. 3. Р. 138–140.
Ikromov T. Sh., Ibodov Kh. I., Ibodov N. S. Izuchenie endogennoi intoksikatsii i ee korrektsiya u detei s mochekamennoi bolezn’yu [Study of endogenous intoxication
and its correction in children with urolithiasis]. Detskaya khirurgiya [Pediatric Surgery]. 2014. No. 6. Р. 32–34.
Karyakina E. V., Belova S. V. Molekuly srednei massy kak integral’nyi pokazatel’ metabolicheskikh narushenii (obzor literatury) [Medium mass molecules as an integral indicator of metabolic disorders (a literature review)]. Klinich. lab. diagnostika [Clinical Lab. Diagnostics]. 2004. No. 3. Р. 3–8.
Karyakina E. V., Belova S. V. Osobennosti patogeneticheskikh
mekhanizmov endogennoi intoksikatsii u bol’nykh revmatoidnym artritom [Features of pathogenetic mechanisms of endogenous intoxication in patients with rheumatoid arthritis]. Nauchno-prakticheskaya revmatologiya [Scientific and Practical Rheumatology]. 2001. No. 1. Р. 5–10.
Nikolaichik V. V., Moin V. M., Kirkovskii V. V., Mazur L. I., Lobacheva G. A. Sposob opredeleniya “srednikh molekul” [A method for determining the “middle molecules”]. Lab. delo [Lab. Science]. 1991. No. 10. Р. 13–18.
Obukhova L. M., Vedunova M. V., Kontorshchikova K. N., Dobrotina N. A. Morfofiziologicheskii analiz plazmy krovi pri endogennoi intoksikatsii [Morphophysiological plasma analysis with endogenous intoxication]. Vestnik Nizhegorodskogo univ. im. N. I. Lobachevskogo [Bull. Lobachevsky State Univ. Nizhny Novgorod]. 2007. No. 6. Р. 104–107.
Oksenyuk O. S., Kalmykova Y. A., Smirnova O. B., Pasechnik D. G. Rol’ okislitel’nogo stressa v razvitii khronicheskoi bolezni pochek i sposoby ego otsenki [The role of oxidative stress in the development of chronic kidney disease and methods of its evaluation]. Zhurn. fund. meditsiny i biol. [J. Fund. Medicine and Biol.]. 2016. No. 1. Р. 15–24.
Shmoilov D. K., Karimov I. Z., Odinets T. N. Patogeneticheskaya
rol’ endogennoi intoksikatsii [Pathogenetic role of endogenous intoxication]. Lab. diagnostika [Lab. Diagnostics]. 2012. No. 2. Р. 65–69.
Sigitova O. N. Khronicheskaya bolezn’ pochek i khronicheskaya pochechnaya nedostatochnost’: sovremennye podkhody k terminologii, klassifikatsii i diagnostike [Chronic kidney disease and chronic kidney failure: modern approaches to terminology, classification, and diagnosis]. Vestnik sovr. klinich. meditsiny [Bull. Modern Clinical Medicine]. 2008. No. 1. Р. 83–87.
Stal’naya I. D., Garishvili T. G. Metod opredeleniya malonovogo dial’degida s pomoshch’yu tiobarbiturovoi kisloty [Method for determination of malonic dialdehyde using thiobarbituric acid]. Sovr. metody v biokhimii [Modern Methods in Biochem.]. 1977. P. 66–68.
Topchii K. I., Kirienko A. N., Shchenyavskaya E. N., Lesovaya A. V., Nessen, A. A., Gridasova L. N. Protsessy perepisnogo okisleniya lipidov u bol’nykh khronicheskoi bolezn’yu pochek v dinamike lecheniya ingibitorami APF i blokatorami ARA [Processes of lipid peroxidation in patients with chronic kidney disease in the dynamics of treatment with ACE inhibitors and ARA blockers. Scientific reports]. Nauchnye vedomosti. Ser. Meditsina. Farmatsiya [Scientific Bull. Medicine. Pharmacy]. 2012. No. 10. Р. 24–28.
Urologiya. Natsional’noe rukovodstvo [Urology: State guidelines]. Ed. N. A. Lopatkin. Moscow, 2009. P. 370.
Yurieva E. A., Sukhorukov V. S., Vozdvizhenskaya E. S., Novikova N. N., Dlin V. V. Endogennaya intoksikatsiya v patogeneze nefropatii [Endogenous intoxication in the pathogenesis of nephropathy]. Klinich. lab. diagnostika [Clinical Lab. Diagnostics]. 2015. No. 60. Р. 22–25.
Alberti C. Congenital ureteropelvic junction obstruction:
physiopathology, decoupling of tout court pelvic dilatation-obstruction semantic connection, biomarkers to predict renal damage evolution. Eur. Rev. Med. Pharmacol. Sci. 2012. No. 16(2). Р. 213–219.
Bone R. S. Sepsis, sepsis syndrome, and the systemic inflammatory response syndrome (SIRS) Gulliver in Laputa. JAMA. 1995. No. 73. Р. 155–156. doi: 10.1001/jama.1995.03520260077036
Chmielewski M., Cohen G., Wiecek A., JesúsCarrero J. The peptidic middle molecules: is molecular weight doing the trick? Semin. Nephrol. 2014. No. 34. Р. 118–34. doi: 10.1016/j.semnephrol.2014.02.005
Giamarellos-Bourboulis E. J., Adamis.T, Laoutaris G., Sabracos L., Koussoulas V., Mouktaroudi M., Perrea D., Karayannacos P. E., Giamarellou H. Immunomodulatory clarithromycin treatment of experimental sepsis and acute pyelonephritis caused by multidrug-resistant Pseudomonas aeruginosa. Antimicrob. Agents Chemother. 2004. No. 48. Р. 93–99. doi: 10.1128/AAC.48.1.93-99.2004
Kondratyuk M. O., Sorokopud O. O., Strіl’chuk L. M., Zhakun І. B., Slaba O. R., Besh O. M., Radchenko O. M., Leshchuk Y. L. Chronic heart failure course prognosis depending on body weight and endogenous intoxication syndrome. Wiad Lek. 2019. No. 72(4). Р. 527–531.
Nlandu Y., Padden M., Seidowsky A., Hamaz S., Vilaine É., Cheddani L., Essig M., Massy Z. A. Middle-molecule uremic toxins: A renewed interest. Nephrol. Ther. 2019. No. 15(2). Р. 82–90. doi: 10.1016/j.nephro.2018.09.003
Pianta T. J., Succar L., Davidson T., Buckley N. A., Endre Z. H. Monitoring treatment of acute kidney injury with damage biomarkers. Toxicol. Lett. 2017. No. 268. Р. 63–70. doi: 10.1016/j.toxlet.2017.01.001
- На текущий момент ссылки отсутствуют.
Читайте также:


